La estrategia antitrombótica más adecuada tras el reemplazo percutáneo de válvula aórtica (RPVA) es incierta, de manera que actualmente se recomienda de manera empírica el tratamiento antiagregante plaquetario doble (TAPD). El objetivo del presente metanálisis es valorar la seguridad y la efectividad del TAPD en pacientes sometidos a RPVA.
MétodosSe incluyeron estudios que compararon diferentes estrategias antitrombóticas tras el RPVA. La variable de resultado primaria fue mortalidad total a los 30 días.
ResultadosSe incluyeron 9 estudios, 5 de ellos compararon el TAPD con el ácido acetilsalicílico como único antiagregante y 4, el TAPD con un tratamiento antiagregante plaquetario único (TAPU) junto con anticoagulación oral. De un total de 7.991 pacientes, el 72% estaba en TAPD. La mediana de seguimiento fue de 3,5 meses. Se observó menos mortalidad entre los pacientes en TAPD (el 12,2 frente al 14,4%; OR = 0,81; IC95%, 0,70-0,93; p = 0,003; phet = 0,93), con beneficio cuando se comparó con ácido acetilsalicílico en monoterapia (OR = 0,80; IC95%, 0,69-0,93; p = 0,004; phet = 0,60) y sin beneficio estadísticamente significativo cuando se comparó con la estrategia combinada de TAPU junto con anticoagulación oral (OR = 0,86; IC95%, 0,55-1,35; p = 0,51; phet = 0,97). Una tendencia similar se observó respecto al ictus (OR = 0,83; IC95%, 0,63-1,10; p = 0,20; phet = 0,67), sin incremento de la tasa de hemorragias mayores (OR = 1,69; IC95%, 0,86-3,31; p = 0,13; phet < 0,0001). Mediante el método de análisis de comparación indirecta, no se documentó beneficio en las tasas de supervivencia total, ictus y hemorragias mayores con la adición de anticoagulación oral.
ConclusionesLos resultados de este metanálisis muestran una reducción de la mortalidad y un beneficio discreto en la tasa de ictus, sin un aumento de la de hemorragias mayores, con el TAPD respecto al tratamiento con un único antiagregante tras el RPVA. La adición de anticoagulación oral al ácido acetilsalicílico no obtuvo mayor beneficio respecto al TAPD o al TAPU.
Palabras clave
El reemplazo percutáneo de la válvula aórtica (RPVA) se está convirtiendo en la opción principal para el tratamiento de los pacientes con estenosis valvular aórtica grave, en especial los de los subgrupos con mayor riesgo, a los que no se puede tratar con una sustitución valvular quirúrgica1,2.
Sin embargo, a pesar de los avances técnicos, el riesgo de complicaciones periintervención o a largo plazo sigue siendo relevante, incluida la aparición de eventos hemorrágicos en hasta el 41% de las intervenciones de implante percutáneo de válvula aórtica (TAVI)3, principalmente por hemorragias en el lugar de acceso, mientras que alrededor de un 6% de los pacientes presentan ictus4.
Por este motivo, las guías actuales recomiendan un tratamiento antiagregante plaquetario doble (TAPD) con ácido acetilsalicílico (AAS) a dosis bajas y una tienopiridina inmediatamente después del TAVI y durante un periodo de hasta 6 meses5. De todos modos, la evidencia que respalda estas indicaciones sigue siendo débil, y en metanálisis recientes se ha observado un aumento del riesgo de complicaciones hemorrágicas con las estrategias antiagregantes plaquetarias más potentes6,7.
El equilibrio entre los riesgos hemorrágico y trombótico resulta difícil de alcanzar en los pacientes ancianos y frágiles, que generalmente son los candidatos a un RPVA. Además, se ha propuesto un posible efecto beneficioso de la anticoagulación de corta duración, con objeto de mejorar la prevención del ictus, según la estrategia aplicada para el reemplazo quirúrgico de la vávula aórtica, y principalmente en pacientes con fibrilación auricular concomitante8.
En ensayos aleatorizados actualmente en marcha, se intenta identificar la estrategia antitrombótica ideal después de las intervenciones de TAVI. Sin embargo, mientras no se disponga de nuevos datos, la información terapéutica sobre la seguridad y la efectividad del TAPD o la anticoagulación solo puede obtenerse de metanálisis de los estudios existentes, y este es el objetivo del presente estudio.
MÉTODOSElegibilidad para el estudio y estrategia de búsquedaSe examinó la bibliografía existente mediante búsquedas bibliográficas formales en bases de datos electrónicas (MEDLINE, Cochrane y EMBASE) para identificar los estudios clínicos, así como en resúmenes de congresos científicos, a través de las páginas web de Transcatheter Cardiovascular Therapeutics, EuroPCR, el American College of Cardiology, la American Heart Association y la Sociedad Europea de Cardiología, para identificar presentaciones orales y presentaciones de expertos entre enero de 1990 y diciembre de 2015.
Se incluyeron los estudios que comparaban una estrategia de TAPD con un tratamiento antiagregante plaquetario único (TAPU), con o sin anticoagulación oral (AO) después del TAVI.
Se utilizaron las siguientes palabras clave: «antiplatelet», «dual antiplatelet therapy»; «anticoagulation», «transcatheter aortic valve implantation»; «TAVI».
No se aplicaron restricciones de idioma. Los criterios de inclusión fueron los siguientes: a) pacientes tratados con TAVI; b) disponibilidad de datos clínicos completos, y c) asignación de tratamientos antitrombóticos diferentes. Los criterios de exclusión fueron: a) datos de seguimiento de menos del 90% de los pacientes; b) estudios en marcha o con datos no recavables, y c) uso de tratamiento antitrombótico combinado triple (TAPD+AO).
Extracción de los datos y evaluación de la validezExtrajeron los datos 2 investigadores (M. Verdoia y L. Barbieri) de manera independiente. Si los datos estaban incompletos o eran poco claros, se contactó con los autores. Las discrepancias se resolvieron por consenso. Los datos se evaluaron según el principio de intención de tratar.
Parámetros de valoraciónEl objetivo principal fue la mortalidad total con TAPD frente a TAPU±AO. El objetivo secundario fue la aparición de ictus. El objetivo de seguridad se definió como la aparición de complicaciones hemorrágicas de carácter mayor (según la definición del protocolo) con TAPD frente a otras estrategias. Se realizó una comparación indirecta ajustada del TAPU+AO frente al TAPU solo, y luego se llevó a cabo para los 3 objetivos del estudio.
Análisis de los datosEl análisis estadístico se realizó con el paquete informático gratuito Review Manager 5.3. Como estadísticas de resumen se utilizaron las odds ratio (OR) y sus intervalos de confianza del 95% (IC95%). Se calculó el valor combinado de la OR con un modelo de efectos fijos o aleatorios (modelo de efectos aleatorios de DerSimonian y Laird, si había una heterogeneidad significativa entre los estudios). Se utilizó la prueba de Breslow-Day para examinar la evidencia estadística de heterogeneidad entre los estudios (p <0,1).
Evaluaron la calidad de los estudios los mismos 2 investigadores mediante una puntuación que, según lo descrito anteriormente9, se expresó en una escala ordinal, asignando 1 punto por la presencia de cada una de las siguientes características: a) explicitación de los objetivos; b) criterios de inclusión y exclusión explícitos; c) descripción de la intervención; d) métodos objetivos de seguimiento; e) descripción de los eventos adversos; f) análisis de la potencia estadística; g) descripción de los métodos estadísticos; h) diseño multicéntrico; i) comentario de los abandonos, y j) diseño aleatorizado.
Se realizó un análisis de metarregresión para evaluar la relación entre los beneficios en cuanto a la mortalidad con TAPD frente a TAPU y el perfil de riesgo de los pacientes (como logaritmo de la OR para la mortalidad en el grupo de control) o la diferencia en las complicaciones hemorrágicas mayores.
Se llevó a cabo una comparación indirecta de las estimaciones conjuntas según el método de Biondi-Zoccai et al.9. Concretamente, a partir de una OR de efectos fijos al comparar el TAPU o el TAPU+AO frente al TAPD, se generó una OR de interacción para el TAPU frente al TAPU+AO, con sus correspondientes IC95% y z-scores para pruebas de las hipótesis bilaterales (diferencias significativas si p <0,05).
El estudio se realizó cumpliendo las directrices PRISMA10.
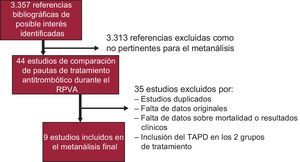
RESULTADOSEstudios incluiblesSe identificó un total de 11 estudios11–21. Se excluyeron 2 de ellos20,21 porque incluían a pacientes tratados con TAPD+AO en el grupo control.
Finalmente se incluyeron 9 estudios, de los cuales 515–19 comparaban el TAPD con el AAS en monoterapia y 4 comparaban el TAPD con el TAPU+AO11–14. En la figura 1 se muestra el diagrama de flujo de la selección de los estudios.
De una población total de 7.991 pacientes incluidos, se trató con TAPD a 5.752 (72%). A un 5% de los pacientes tratados con un único fármaco antiagregante plaquetario, se les añadió un AO, principalmente por indicaciones clínicas (trastornos preexistentes como prótesis valvular mecánica, antecedente de un evento trombótico/tromboembólico o fibrilación auricular). Las características de los estudios incluidos se indican en la tabla 1, mientras que en la tabla 2 se muestran las principales características clínicas de las poblaciones en estudio.
Características de los estudios incluidos
| Estudio | Año de publicación | Tipo | Tratamiento antitrombótico | Inclusión | Exclusión | Puntuación de calidad | |||
|---|---|---|---|---|---|---|---|---|---|
| TAPD | Duración | TAPU | Duración | ||||||
| Salinas et al.11 | 2012 | Un solo centro, prospectivo | AAS+clopidogrel | 3-6 meses | AVK solo o con AAS/clopidogrel | 3-6 meses | Pacientes consecutivos tratados con TAVI | — | 6 |
| Zeymer et al.12 | 2011 | Multicéntrico, prospectivo | AAS+clopidogrel | > 30 d | AO+AAS o clopidogrel | > 30 días | Pacientes consecutivos tratados con TAVI incluidos en el registro alemán de TAVI | — | 7 |
| Vavuranakis et al.13 | 2015 | Un solo centro, retrospectivo | AAS+clopidogrel | 3 meses | AVK+clopidogrel | 3 meses | Pacientes consecutivos tratados con TAVI | — | 6 |
| Figini et al.14 | 2013 | Un solo centro | AAS+clopidogrel | 3-6 meses | AO+AAS o clopidogrel | 3-6 meses | Cohorte retrospectiva de pacientes tratados con TAVI que tenían indicaciones para el tratamiento anticoagulante, y controles | — | 7 |
| Stabile et al.15 | 2014 | ECA, de un solo centro | AAS+clopidogrel | 6 meses | AAS | Indefinida | 1. EA grave: AVA < 0,8cm2 (o índice de AVA < 0,5cm2/m2) y GMA medio> 40mmHg o velocidad de chorro máxima> 4,0 m/s 2. Síntomas cardiacos: Clase funcional de la NYHA ≥ II 3. Riesgo quirúrgico elevado: Riesgo esperado de mortalidad operatoria ≥ 15% (determinado por el cirujano del centro) 4. Consentimiento informado (y cardiólogo) o puntuación de STS ≥ 10 | 1. Diámetro de anillo aórtico < 18mm o> 25 mm 2. Disección aórtica o dimensiones iliofemorales o enfermedad que impida la introducción segura de la vaina 3. EC no tratada que requiere revascularización 4. IA o IM grave (> 3+) o válvula protésica (cualquier localización) 5. IM agudo en 1 mes previo 6. Hemorragia gastrointestinal alta en los 3 meses previos 7. Ictus o AIT en 6 meses previos 8. Cualquier intervención cardiaca, aparte de la valvuloplastia con balón aórtico, en 1 mes previo o en 6 meses para los SFA 9. Indicación de tratamiento de anticoagulación oral (es decir, fibrilación auricular) 10. Intolerancia/alergia al AAS 11. Intolerancia/alergia a las tienopiridinas | 8 |
| Ussia et al.16 | 2011 | ECA, de un solo centro | AAS+clopidogrel | 3 meses | AAS | 3 meses | 1. EA sintomática grave con AVA <1cm2 2. Rechazado para un reemplazo estándar de la VA | 1. Enfermedad vascular que impide el acceso vascular 2. Deformación torácica grave 3. Trombo intracardiaco 4. Enfermedad de PI no protegida no tratable con ICP 5. IM en los 7 d previos 6. Válvula cardiaca protésica 7. Infección activa 8. Leucopenia 9. Coagulopatía 10. Hemorragia activa 11. Anemia aguda (hemoglobina <9 mg/dl) 12. La aorta no podía dilatarse por completo con un balón de valvuloplastia aórtica de 23 mm 13. Tamaño de anillo aórtico <19mm o> 24 mm 14. Cirrosis hepática 15. Embolia pulmonar recurrente 16. Aorta de porcelana 17. Insuficiencia respiratoria 18. Antecedentes de radioterapia en el mediastino 19. Enfermedad del tejido conjuntivo grave 20. Antecedentes de ICP previa o de IM que requiere TAPD 21. Necesidad de anticoagulación oral 22. Alergia o intolerancia a los fármacos en estudio | 9 |
| Durand et al.17 | 2014 | Multicéntrico, prospectivo | AAS+clopidogrel | 1-6 meses | AAS | 1-6 meses | 1. EA grave sintomática en pacientes no aptos para cirugía con enfermedades coexistentes 2. AVA <0,8cm2, GMA> 40mmHg o una velocidad máxima del chorro aórtico de 4,0 m/s 3. Clase funcional II, III o IV de la NYHA | — | 7 |
| Poliacikova et al.18 | 2013 | Un solo centro, prospectivo | AAS+clopidogrel | 6 meses | AAS | 6 meses | Todos los pacientes tratados con TAVI | — | 6 |
| Sherwood et al.19 | 2015 | Multicéntrico, prospectivo | AAS+clopidogrel | — | AAS o clopidogrel | — | Pacientes tratados con TAVI en los centros participantes | Fibrilación auricular preoperatoria | 8 |
AAS: ácido acetilsalicílico; AIT: accidente isquémico transitorio; AO: anticoagulación oral; AVA: área de la válvula aórtica; AVK: antagonista de la vitamina K; EA: estenosis aórtica; EC: enfermedad coronaria; ECA: ensayo controlado aleatorizado; GMA: gradiente medio aórtico; IA: insuficiencia aórtica; ICP: intervención coronaria percutánea; IM: infarto de miocardio; NYHA: clase funcional de la New York Heart Association; PI: principal izquierda; RM: regurgitación mitral; SFA: stent farmacoactivo; STS: Society of Thoracic Surgery; TAPD: tratamiento antiagregante plaquetario doble; TAPU: tratamiento antiagregante plaquetario único; TAVI: implante percutáneo de válvula aórtica.
Características clínicas de los pacientes de los estudios incluidos
| Estudio | TAPD (n) | TAPU (n) | Dispositivo | Acceso | Criterio principal de valoración | Definición de hemorragia | Seguimiento máximo | Media de edad TAPD (años) | Media de edad TAPU (años) | Mujeres TAPD (%) | TAPU en mujeres (%) | TAPD en EC (%) | TAPU en EC (%) | TAPD en FA pre-TAVI (%) | TAPU en FA pre-TAVI (%) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Salinas et al.11 | 21 | 13 | Edwards-Sapien | Transfemoral, transapical | Muerte, infarto de miocardio, ictus, MACE | — | Durante la hospitalización | 81,30 | 83,90 | 64,70 | 58,80 | 35,30 | 58,80 | 100,00 | 0,00 |
| Zeymer et al.12 | 993 | 171 | — | — | Muerte | — | 30 días | — | — | — | — | — | — | — | — |
| Vavuranakis et al.13 | 20 | 20 | CoreValve | Transfemoral, transubclavia | Muerte cardiaca, infarto de miocardio, cualquier revascularización coronaria e ictus en el seguimiento | BARC | Media 23,4 meses | 80,20 | 80,60 | 60,00 | 60,00 | 35,00 | 60,00 | 100,00 | 0,00 |
| Figini et al.14 | 300 | 43 | Edwards-Sapien o CoreValve | Transfemoral, transapical | Muerte | — | 11-12 meses | 80,00 | 79,00 | 51,00 | 48,00 | 26,00 | 46,00 | 100,00 | 0,00 |
| Stabile et al.15 | 60 | 60 | Edwards-Sapien | Transfemoral | Muerte | VARC | 6 meses | 80,20 | 81,10 | 66,70 | 60,00 | 21,30 | 23,30 | 15,60 | |
| Ussia et al.16 | 40 | 39 | CoreValve | Transfemoral, transapical | Muerte por cualquier causa, IM, ictus grave, conversión a cirugía de urgencia o urgencia inmediata, y hemorragia con peligro para la vida | — | 6 meses | 80,00 | 81,00 | 50,00 | 59,00 | — | — | 0,00 | 0,00 |
| Durand et al.17 | 128 | 164 | Edwards-Sapien o CoreValve | Transfemoral. Transubclavia, transapical o transaórtico | Mortalidad, ictus grave, hemorragia con peligro para la vida, IM y complicaciones vasculares mayores | — | 30 días | 84,60 | 82,70 | 60,90 | 45,10 | 30,50 | 50,00 | 10,00 | 15,00 |
| Poliacikova et al.18 | 58 | 91 | Edwards-Sapien o CoreValve o Lotus | Transfemoral. Transubclavia, transapical o transaórtico | Mortalidad por cualquier causa, evento coronario agudo, ictus o hemorragia mayor | VARC | 30 días | 81,60 | 82,00 | 44,60 | 46,20 | — | — | 35,20 | 23,00 |
| Sherwood et al.19 | 4.132 | 1.638 | — | — | Muerte | — | 12 meses | 84,00 | 84,00 | 51,60 | 53,10 | 67,10 | 55,70 | 27,60 | 11,00 |
BARC: Bleeding Academic Research Consortium; EC: enfermedad coronaria; FA: fibrilación auricular; IM: infarto de miocardio; MACE: eventos cardiovasculares agudos mayores; TAPD: tratamiento antiagregante plaquetario doble; TAPU: tratamiento antiagregante plaquetario único; TAVI: implante percutáneo de válvula aórtica; VARC: Valve Academic Research Consortium.
El RPVA se realizó principalmente con un abordaje transfemoral, pero en 5 estudios se permitió también el abordaje transapical11,14,16–18 y en 2, el transaórtico17,18, mientras que en 3 se aceptó el abordaje transubclavio13,17,18.
La duración del TAPD fue de entre 1 y 6 meses en 2 estudios12,18, de entre 3 y 6 meses en otros 211,14 y se programó para un periodo exacto de 3 meses en 2 estudios13,16 y de 6 meses en otros 215,18. El TAPU consistió en AAS en la mayoría de los pacientes, mientras que en 4 estudios se permitió el uso de clopidogrel solo, y combinado con AO en otro registro11–14,19.
La mediana de seguimiento fue de 3,5 meses. En 1 estudio, solo se obtuvieron datos durante la hospitalización11, mientras que en 3 se presentaron resultados a los 30 días12,17,18 y en 2, a los 6 meses15,16. En 3 estudios el seguimiento fue de 1 año o más13,14,19.
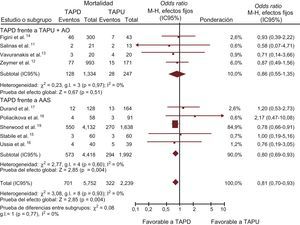
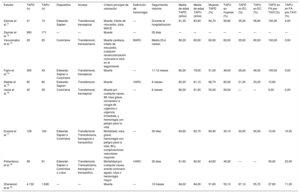
Resultados clínicosObjetivo principalSe dispuso de datos sobre la mortalidad total entre 7.991 (100%) pacientes. Fallecieron 1.023 (12,8%) pacientes. La mortalidad fue significativamente inferior en el grupo de TAPD que en el de TAPU (OR = 0,81; IC95%, 0,70-0,93; p = 0,003; phet = 0,93), tal como se muestra en la tabla 3 y la figura 2. Se observó un efecto beneficioso similar con AAS en monoterapia (OR = 0,80; IC95%, 0,69-0,93; p = 0,004; phet = 0,60), aunque sin alcanzar significación estadística en comparación con el TAPU+AO (OR = 0,86; IC95%, 0,55-1,35; p = 0,51; phet = 0,97).
Número total y porcentaje de eventos de los objetivos principal y secundarios del estudio en el grupo de implante percutáneo de válvula aórtica y el grupo control
| Variable | Eventos TAVI (n) | Total TAVI (n) | Eventos TAVI (%) | Eventos control (n) | Total control (n) | Eventos control (%) |
|---|---|---|---|---|---|---|
| Muerte | ||||||
| Total | 701 | 5.752 | 12,2 | 322 | 2.239 | 14,4 |
| TAPD frente a AAS+AO | 128 | 1.334 | 9,6 | 28 | 247 | 11,4 |
| TAPD frente a TAPU | 573 | 4.418 | 12,9 | 294 | 1.992 | 14,8 |
| Ictus | ||||||
| Total | 175 | 5.752 | 3,1 | 78 | 2.239 | 3,5 |
| TAPD frente a AAS+AO | 28 | 1.334 | 2,1 | 3 | 247 | 1,2 |
| TAPD frente a TAPU | 147 | 4.418 | 3,3 | 75 | 1.992 | 3,8 |
| Hemorragia | ||||||
| Total | 796 | 5.752 | 13,8 | 358 | 2.239 | 16 |
| TAPD frente a AAS+AO | 110 | 1.334 | 8,3 | 15 | 247 | 5,9 |
| TAPD frente a TAPU | 686 | 4.418 | 15,5 | 343 | 1.992 | 17,2 |
AAS: ácido aceilsalicílico; AO: anticoagulación oral; TAPD: tratamiento antiagregante plaquetario doble; TAPU: tratamiento antiagregante plaquetario único; TAVI: implante percutáneo de válvula aórtica.
TAPD en comparación con TAPU con o sin AO en cuanto a la mortalidad total, expresada en OR (IC95%). El tamaño de los símbolos de los datos (cuadrados) correspondientes al AAS es aproximadamente proporcional a la ponderación estadística de cada ensayo. AAS: ácido acetilsalicílico; AO: anticoagulación oral; IC95%: intervalo de confianza del 95%; M-H: Mantel-Haenszel; OR: odds ratio; TAPD: tratamento antiagregante plaquetario doble; TAPU: tratamiento antiagregante plaquetario único.
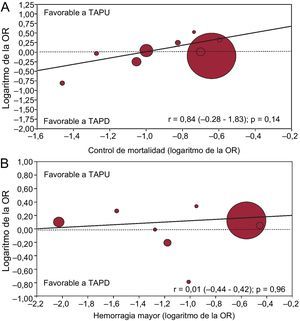
El análisis de metarregresión no mostró asociación alguna entre el beneficio de supervivencia obtenido con el TAPD (expresado como logaritmo de OR para la mortalidad) y el perfil de riesgo de los pacientes (definido como el logaritmo de OR para la mortalidad en el grupo control; r = 0,84; IC95%, –0,28 a 1,83; p = 0,14) y el riesgo de hemorragias mayores con el TAPD en comparación con TAPU (expresado como logaritmo de OR para las hemorragias mayores; r = 0,01; IC95%, –0,44 a 0,42; p = 0,96), como se muestra en la figura 3.
Análisis de metarregresión de efectos aleatorios para el riesgo (OR) de mortalidad del TAPD en comparación con el TAPU, según el perfil de riesgo de los pacientes (A) o la diferencia de riesgo hemorrágico en los 2 grupos (B). El tamaño del círculo corresponde a la ponderación estadística de cada estudio. OR: odds ratio; TAPD: tratamiento antiagregante plaquetario doble; TAPU: tratamiento antiagregante plaquetario único.
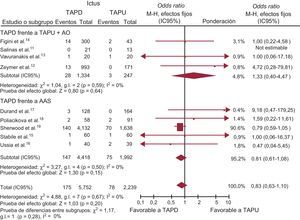
Ictus. Se dispuso de datos relativos al ictus en el 100% de la población en estudio (7.991 pacientes). Presentaron ictus 253 pacientes (3,2%), con una tasa ligeramente inferior, sin alcanzar significación estadística, en los pacientes tratados con TAPD (OR = 0,83; IC95%, 0,63-1,10; p = 0,20; phet = 0,67) (tabla 3 y figura 4). No se observaron diferencias significativas en el ictus entre el TAPD y TAPU (OR = 0,81; IC95%, 0,61-1,08; p = 0,15; phet = 0,50) y el TAPU+AO (OR = 1,33; IC95%, 0,40-4,47; p = 0,64; phet = 0,59).
TAPD en comparación con TAPU con o sin AO en cuanto al ictus, expresada con OR (IC95%). El tamaño de los símbolos de los datos (cuadrados) es aproximadamente proporcional a la ponderación estadística de cada ensayo. AAS: ácido acetilsalicílico; AO: anticoagulación oral; IC95%: intervalo de confianza del 95%; M-H: Mantel-Haenszel; OR: odds ratio; TAPD: tratamiento antiagregante plaquetario doble; TAPU: tratamiento antiagregante plaquetario único.
Un análisis de metarregresión no mostró asociación entre la reducción de la tasa de ictus con el TAPD (expresado como logaritmo de la OR para el ictus) y el perfil de riesgo de los pacientes (definido como el logaritmo de OR para el ictus en el grupo control; r = –2,22; IC95%, –5,8 a 1,29; p = 0,21).
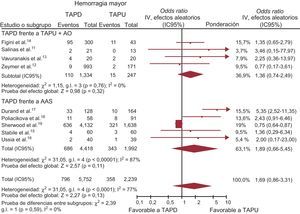
Hemorragia mayor. De los 7.991 pacientes con datos disponibles, en el 14,4% (1.154) se produjo una complicación de hemorragia mayor, según la definición establecida en el protocolo.
El uso de un TAPD más agresivo no se asoció con un aumento del riesgo de hemorragias mayores (OR = 1,69; IC95%, 0,86-3,31; p = 0,13; phet <0,0001), como se muestra en la tabla 3 y la figura 5. Se obtuvieron resultados similares en la comparación del TAPD con el TAPU (el 15,5% [686/4.418] frente al 17,2% [343/1.992]; OR = 1,89; IC95%, 0,66-5,45; p = 0,11; phet <0,00001) y el TAPU+AO (OR = 1,36; IC95%, 0,74-2,49; p = 0,32; phet = 0,76).
TAPD en comparación con TAPU con o sin AO en cuanto a las hemorragias mayores, expresada con OR (IC95%). El tamaño de los símbolos de los datos (cuadrados) es aproximadamente proporcional a la ponderación estadística de cada ensayo. AAS: ácido acetilsalicílico; AO: anticoagulación oral; IC95%: intervalo de confianza del 95%; OR: odds ratio; TAPD: tratamiento antiagregante plaquetario doble; TAPU: tratamiento antiagregante plaquetario único.
Un análisis de metarregresión no mostró ninguna asociación entre la reducción de la tasa de hemorragias mayores con el TAPD (expresada con el logaritmo de la OR) y el perfil de riesgo de los pacientes (definido como logaritmo de OR para las hemorragias graves en el grupo control; r = –0,21; IC95%, –1,59 a 1,16; p = 0,76).
Comparación indirecta ajustada. La comparación directa del TAPU+AO frente al TAPU solo no mostró ninguna diferencia en cuanto a la mortalidad (OR = 0,93; IC95%, 0,58-1,51; z = 0,27; p = 0,78); el ictus (OR = 0,51; IC95%, 0,15-1,72; z = 1,08; p = 0,28) o la hemorragia mayor (OR = 0,61; IC95%, 0,31-1,14; z = 1,54; p = 0,12) con las 2 estrategias antitrombóticas.
DISCUSIÓNEl presente metanálisis es el estudio más completo que haya abordado la repercusión de las estrategias antitrombóticas en los resultados clínicos en pacientes tratados con un RPVA. El resultado principal fue una reducción significativa de la mortalidad, sin ninguna repercusión en las hemorragias mayores con el uso del TAPD en comparación con el TAPU, aun añadiendo anticoagulación al único fármaco antiagregante plaquetario, lo cual respalda la estrategia propuesta actualmente por las guías y el principal consenso de expertos.
El RPVA es una estrategia innovadora para el tratamiento de los pacientes con estenosis grave de la válvula aórtica a los que no se considera aptos para reemplazo quirúrgico de la válvula22. Las mejoras tecnológicas realizadas han permitido alcanzar unos resultados comparables a los del reemplazo quirúrgico tradicional y una reducción de la tasa de complicaciones graves de la intervención, fundamentalmente gracias a la reducción de la tasa de fugas paravalvulares y de la invasividad del acceso vascular23,24.
Sin embargo, las complicaciones tanto isquémicas como hemorrágicas no son irrelevantes, sobre todo en un subgrupo de pacientes frágiles y con notable comorbilidad, como los tratados con RPVA, lo que indica el papel clave de los tratamientos antitrombóticos25.
No obstante, persiste la incertidumbre respecto a cuál es la estrategia antitrombótica más apropiada tras el implante valvular. Aunque cabe prever que la AO de corta duración fuera la mejor opción, según lo indicado para el reemplazo quirúrgico de la válvula aórtica, el TAPD desde el principio ha sido el enfoque preferido, a semejanza de la estrategia aplicada en el implante percutáneo de stents coronarios sin TAVI26.
La guía de 2014 de la American Heart Association y el American College of Cardiology recomienda actualmente el TAPD con clopidogrel y AAS durante un periodo de 6 meses5. Asimismo, la Canadian Cardiovascular Society recomienda el uso de AAS indefinidamente y una combinación con clopidogrel durante 1 a 3 meses, y se hacen recomendaciones similares en la guía de la Sociedad Europea de Cardiología1,26. No obstante, estas recomendaciones se basan en los resultados del primer ensayo de TAVI, el PARTNER, en el que los pacientes aleatorizados al RPVA recibieron tratamiento con TAPD2, aunque hasta el momento son pocos los estudios que han comparado terapias antitrombóticas diferentes tras el RPVA.
Hasta el momento se han realizado 2 pequeños ensayos aleatorizados en los que se ha comparado el TAPD con el AAS en monoterapia15,16; no se ha observado diferencia alguna de resultados clínicos entre las 2 estrategias, si bien la adición de clopidogrel se asoció con un pequeño aumento de la tasa de hemorragias. Estos resultados se confirmaron posteriormente con otros similares de 2 estudios retrospectivos17,18 y metanálisis posteriores7,27, lo cual indica que, en comparación con el TAPD, un tratamiento con AAS podría estar justificado, puesto que aporta un beneficio de supervivencia similar con un riesgo hemorrágico inferior.
No obstante, debe recomendarse la tendencia contraria, con un aumento del tratamiento antitrombótico, si se tiene en cuenta el riesgo de isquemia cerebrovascular después del TAVI. De hecho, aunque más del 50% de estos episodios se producen en la fase periintervención, debido a una embolización de calcio valvular o la manipulación de los catéteres en una aorta ateromatosa, el aumento del riesgo de ictus persiste hasta 2 meses después de la intervención; se ha descrito que dicho riesgo se debe a las tromboembolias28. Los mecanismos propuestos incluyen un estado protrombótico de las valvas valvulares antes de la endotelización completa en los primeros 3 meses, así como la fibrilación auricular25,29. De hecho, esta última se ha observado en hasta un 40% de los pacientes con TAVI, y tiene una repercusión importante en la mortalidad y un posible efecto superior en la función de las estrategias antitrombóticas a largo plazo11,30. Se ha observado que el cese de la anticoagulación reduce la supervivencia de los pacientes con fibrilación auricular31; en cambio, no se ha apreciado un beneficio claro al añadir AO a los antiagregantes plaquetarios32. Además, las ventajas aportadas por la combinación de antiagregantes plaquetarios con AO deben compararse con el aumento del riesgo hemorrágico33,34, y hasta el momento no se ha presentado ningún dato sobre la combinación óptima de inhibidores plaquetarios para los pacientes que necesitan anticoagulación después de un RPVA35.
Además, el registro TVT de STS/ACC de Estados Unidos19 ha puesto claramente de manifiesto en una población enorme de pacientes con RPVA que el TAPD puede mejorar la supervivencia e incluso se asocia con una tasa inferior de complicaciones hemorrágicas.
En un contexto de incertidumbre y a falta de estudios específicos de esta cuestión, el objetivo del presente metanálisis es aportar datos sobre la seguridad y la efectividad del TAPD en comparación con el TAPU, con o sin anticoagulación, en pacientes tratados con un RPVA.
Se incluyó a una población amplia, de alrededor de 8.000 pacientes, tanto de ensayos aleatorizados como de registros. Se incluyó a más de 5.000 pacientes tratados con TAPD, que presentaron una mortalidad inferior y una pequeña reducción de los eventos cerebrovasculares en comparación con el TAPU. Además, los efectos beneficiosos del TAPD no se vieron afectados por las complicaciones hemorrágicas.
La combinación de AO y TAPU no solo fue inferior al TAPD en cuanto a la reducción de la mortalidad, sino que tampoco aportó ninguna ventaja significativa en comparación con el TAPU solo. Sin embargo, el diseño no aleatorizado de la mayoría de los estudios podría haber llevado a la inclusión en el grupo de TAPU de pacientes más frágiles y en un estado crítico, cuyo riesgo de hemorragia es superior y el riesgo de mortalidad, también. Además, no se pudo evaluar la prevalencia de otras comorbilidades y en especial el porcentaje de pacientes con enfermedad coronaria concomitante tratados con implante de stents, que son los que habrían tenido un máximo efecto beneficioso del TAPD.
En el presente estudio, los pacientes tratados con AO constituían solo una pequeña parte de la población total, si bien pueden presentar un riesgo isquémico y hemorrágico diferente del de los pacientes tratados con antiagregantes plaquetarios. No obstante, el análisis de subgrupos en el que se comparó el TAPD con TAPU+AO aportó unos resultados análogos para el subgrupo de TAPD en comparación con el de TAPU solo. No se pudo estratificar a estos pacientes según la indicación para la AO, por lo que podría haber pacientes con fibrilación auricular, ictus o alto riesgo trombótico y pacientes tratados en centros en los que la AO se emplea con frecuencia tras el TAVI, lo que podría explicar que los resultados fueran comparables. De hecho, los mejores resultados observados con el TAPD fueron uniformes en toda la población en estudio y no se vieron influidos por el perfil de riesgo de los pacientes.
Por consiguiente, los resultados presentados respaldan las recomendaciones actuales de utilizar el TAPD como mejor estrategia antitrombótica para los pacientes sometidos a RPVA, mientras que la combinación de AO y terapia antiagregante plaquetaria debe basarse en un equilibrio cuidadoso y se limita a los pacientes con indicaciones estrictas para la AO antes de la intervención, como son la presencia de prótesis valvulares mecánicas o la fibrilación auricular crónica, puesto que no aporta ventaja alguna en comparación con el TAPD.
No obstante, los ensayos aleatorizados más amplios en curso36–38 aportarán ciertamente evidencia más clara sobre esta cuestión, así como datos objetivos respecto a la duración óptima del TAPD después de un RPVA.
LimitacionesEl presente estudio tiene ciertas limitaciones que es preciso abordar. La más importante es la síntesis de datos de ensayos clínicos diferentes. Concretamente, la inclusión de estudios no aleatorizados motivó cierta desproporción entre el grupo en tratamiento con TAPD y los pacientes que recibieron TAPU, y en especial para los que requirieron el añadido de AO, que solo constituyen una minoría de la población del estudio. Sin embargo, los resultados positivos obtenidos para el TAPD respaldan nuevamente la estrategia utilizada en la actualidad para la mayoría de los pacientes en la práctica clínica real.
La mayor parte de los estudios tenían la limitación de un tamaño muestral pequeño, con lo que los resultados del metanálisis derivan principalmente del enorme registro TVT de STS/ACC de Estados Unidos19. Además, la definición de la mortalidad en cada estudio fue distinta (mortalidad total, mortalidad cardiovascular, mortalidad hospitalaria). Sin embargo, no se observó una heterogeneidad significativa por lo que respecta al objetivo principal y, dada la escasez de datos disponibles, se prefirió incluir todos los estudios disponibles con objeto de evitar un posible sesgo de selección.
Otra limitación fue la diferente duración del TAPD o del periodo de seguimiento, con un número escaso de datos correspondientes a periodos largos. No obstante, cabe prever que las máximas diferencias en las hemorragias y en la prevención de los eventos tromboembólicos se observaran durante el periodo de tratamiento periintervención. Además, la disponibilidad de datos en un seguimiento a largo plazo habría permitido identificar mejor los efectos favorables de los tratamientos antitrombóticos en la prevención de los eventos cardiovasculares. Sin embargo, se prefirió no excluir los estudios que presentaban solo datos hospitalarios, puesto que habría imlpicado la exclusión de los pacientes en un estado más crítico, en los que se dio una mortalidad temprana.
Por último, la mayoría de estos estudios se realizaron con las primeras generaciones de las prótesis valvulares, y cabría prever que los resultados fueran diferentes tras la introducción de los nuevos dispositivos que han reducido drásticamente la tasa de complicaciones hemorrágicas en la zona del acceso vascular y la tasa de eventos isquémicos cerebrovasculares.
CONCLUSIONESEl presente metanálisis aporta evidencia que respalda las recomendaciones actuales de uso del TAPD como estrategia antitrombótica preferida para los pacientes sometidos a RPVA. De hecho, el TAPD produjo una reducción significativa de la mortalidad y aportó un ligero beneficio en cuanto al ictus, sin que aumentaran las hemorragias mayores en comparación con el TAPU. La estrategia basada en el empleo de AAS y anticoagulación no aportó ningún beneficio significativo en comparación con el TAPU o el TAPD.
CONFLICTO DE INTERESESNo se declara ninguno.
- –
El tratamiento antitrombótico para los pacientes sometidos a RPVA continúa en controversia, y hay pocos datos basados en ensayos clínicos.
- –
El TAPD se recomienda actualmente de manera empírica, mientras que no está claro el posible papel de la anticoagulación adyuvante.
- –
Se llevó a cabo un metanálisis de 9 ensayos clínicos en los que se comparó el TAPD con el AAS en monoterapia con o sin AO.
- –
El TAPD para los pacientes sometidos a RPVA redujo la mortalidad y aportó un ligero beneficio en cuanto al ictus, sin que aumentaran las hemorragias mayores.
- –
La anticoagulación adyuvante no aportó ningún efecto beneficioso significativo.