Palabras clave
La ablación por radiofrecuencia (ARF) tiene una eficacia elevada en el tratamiento de la mayoría de los sustratos arrítmicos, que está en torno al 90%1. Sin embargo, su eficacia disminuye significativamente en algunas taquiarritmias, como la fibrilación auricular, algunos tipos de aleteo auricular no común y la taquicardia ventricular (TV) en la cardiopatía estructural, en los que la tasa de éxito suele ser menor del 80%1. Esta menor eficacia se debe, fundamentalmente, a que el sustrato arrítmico de estos trastornos no está tan definido como en las otras taquicardias, lo que dificulta la localización del circuito de reentrada y, especialmente, de su zona de conducción lenta. Para tratar de solventar esta dificultad, se han desarrollado en los últimos años diversas técnicas de visualización tridimensional no fluoroscópica del catéter de ARF y que facilitan la cartografía de los sustratos arritmogénicos complejos2-5. Una de estas técnicas es el sistema LocaLisa, que es una de las de menor coste, que ocupa menos tiempo del procedimiento en su implementación y desarrollo, y que ya ha demostrado su utilidad en la ARF de diversas taquiarritmias6-9. Sin embargo, hasta ahora no se ha descrito en la literatura científica la utilización de este sistema en la ARF de TV.
El objetivo de este trabajo es describir la utilidad y los resultados de la ARF de TV en la cardiopatía estructural guiada mediante el sistema LocaLisa.
MÉTODO
Pacientes y diseño del estudio
El presente estudio, de carácter predominantemente descriptivo, incluyó a 32 pacientes consecutivos con TV monomórfica sostenida documentada y cardiopatía estructural que fueron sometidos a un estudio electrofisiológico y a una ARF de dicho sustrato arritmogénico en nuestro centro. En 10 pacientes se utilizó, asociado al método fluoroscópico convencional, el sistema de navegación no fluoroscópico, tridimensional y en tiempo real LocaLisa, como medio de visualización de los catéteres durante el procedimiento. Los resultados de este grupo se compararon con los de un grupo control de 22 pacientes en quienes sólo se empleó la fluoroscopia durante el procedimiento. De los pacientes incluidos en el grupo LocaLisa, los últimos 6 pacientes lo fueron de forma prospectiva y consecutiva (8 procedimientos). Se incluyó, además, a 4 pacientes (4 procedimientos) de forma retrospectiva. En estos 4 pacientes la decisión de utilizar el sistema LocaLisa en lugar de la simple fluoroscopia dependió de la decisión del especialista, generalmente basada en la situación clínica y la complejidad del paciente concreto, de las limitaciones logísticas del momento y de la participación en el procedimiento de personal con suficiente experiencia y conocimientos del uso del sistema.
El objetivo principal del empleo del sistema LocaLisa no se dirigió a la reducción del tiempo de fluoroscopia, sino a una localización y definición precisas del sustrato arrítmico.
Estudio electrofisiológico
Se sometió a los pacientes al procedimiento en ayunas y previa obtención del consentimiento informado. En todos se suspendió la medicación antiarrítmica al menos 5 vidas medias antes. Mediante acceso percutáneo venoso femoral se introdujeron al menos 2 catéteres tetrapolares de 5 Fr (Bard Electrophysiology Division, MA, Estados Unidos), que se emplazaron inicialmente en la aurícula derecha y la región hisiana y, posteriormente, en el ápex y en el tracto de salida del ventrículo derecho. Además, en el grupo LocaLisa se colocó un catéter bipolar de 6 Fr de fijación activa en el ápex del ventrículo derecho, utilizado como referencia del sistema, y en los últimos 7 pacientes de este grupo, un catéter decapolar de 6 Fr (Bard Electrophysiology Division, MA, Estados Unidos) en el seno coronario, como referencia anatómica para la localización del anillo auriculoventricular y de la base del ventrículo izquierdo. En ambos grupos, la cartografía ventricular izquierda y la ARF se realizaron mediante catéteres tetrapolares deflectables de 7 Fr con electrodo distal de 4 mm, 8 mm o de punta irrigada (Marinr, Conductr o Sprinkl, respectivamente, Medtronic, Minneapolis, MN, Estados Unidos), introducidos por vía transaórtica retrógrada.
A todos los pacientes se les administró 50 U/kg de heparina por vía intravenosa en bolo y 1.000 U cada hora que el electrodo permaneciera en el ventrículo izquierdo.
Se consideró mala tolerancia hemodinámica de la TV el registro de una presión arterial sistólica durante la TV menor de 90 mmHg en presencia de síntomas de bajo gasto cardíaco.
Cartografía del circuito
La identificación de la zona de conducción lenta del circuito se realizó mediante las técnicas cartográficas convencionales. Inicialmente en los pacientes sin TV incesante, se efectuó cartografía de activación, en ritmo sinusal o durante la estimulación desde el ápex del ventrículo derecho, buscando potenciales fragmentados, de baja amplitud y cuya aparición coincidiera con las porciones más tardías del complejo QRS10. Se buscó también mediante topoestimulación un intervalo S-QRS mayor de 60 ms durante ritmo sinusal con reproducción de la morfología de la TV en al menos 11 de 12 derivaciones electrocardiográficas. Posteriormente, se trató de inducir la TV clínica y se buscó la zona de conducción lenta del circuito de la taquicardia mediante los siguientes criterios: registro de potenciales presistólicos y mediodiastólicos, demostración de encarrilamiento con fusión oculta, ciclo de retorno trasencarrilamiento de hasta 30 ms mayor que la longitud de ciclo de la TV e intervalo electrograma-QRS durante la TV igual al intervalo espícula-QRS durante encarrilamiento11-13.
Navegación no fluoroscópica con el sistema LocaLisa
Los detalles técnicos y del funcionamiento del sistema LocaLisa se han descrito previamente4,14,15. El sistema representa en 3 dimensiones, en tiempo real, las posiciones de los electrodos de diferentes catéteres convencionales, y permite identificar y almacenar en la memoria puntos anatómicos correspondientes a cada una de las posiciones en las que se va situando el electrodo a lo largo del procedimiento, con un error de precisión, respecto a la posición real del catéter, de sólo 1-2 mm4,15.
En el proceso de cartografía del circuito reentrante de la TV, en primer lugar se emplazó el catéter de ARF, guiado mediante el sistema LocaLisa, en el ápex del ventrículo izquierdo. En esa posición anatómica se marcó un punto en el sistema, para lograr una fácil referencia entre el ápex del ventrículo y su base. Esta última se estableció mediante los electrodos del catéter emplazado en el seno coronario. Posteriormente, durante el ritmo sinusal se marcaron los puntos correspondientes a la cicatriz o a sus límites con miocardio viable. Se consideró cicatriz todo punto con una amplitud del voltaje del electrograma local ≤ 0,1 mV16,17. La extensión y la localización de las cicatrices fueron fácilmente visualizadas en el sistema LocaLisa en todas las proyecciones espaciales mediante la rotación de imágenes. Tras situar la localización más probable del circuito, se trató de inducir la TV y de trabajar en un modelo bidimensional de este circuito, buscando una proyección del sistema LocaLisa que permitiese su mejor visualización. Al mismo tiempo, se utilizó la fluoroscopia en una proyección ortogonal a la del sistema LocaLisa para controlar el desplazamiento del catéter explorador en la otra dimensión no cubierta por la proyección seleccionada del sistema. Posteriormente, durante la cartografía de estimulación y encarrilamiento, se marcó con puntos de distintos colores la pertenencia o no al circuito reentrante de las distintas áreas exploradas. De esta forma, se trató de localizar y marcar en el sistema la entrada y la salida de la zona de conducción lenta.
Ablación por radiofrecuencia
Para la ablación se utilizó un generador programable de radiofrecuencia, con monitorización continua de la impedancia, el voltaje y la temperatura (ATAKR 2, Medtronic, Minneapolis, MN, Estados Unidos). Se realizaron aplicaciones de radiofrecuencia durante la TV monomórfica reproducible y tolerada hemodinámicamente, en las posiciones en las que se cumplían al menos 2 de los criterios cartográficos previamente mencionados. Ocasionalmente, en los pacientes con mala tolerancia de la TV inducida, se realizaron aplicaciones guiadas mediante un abordaje no convencional, buscando electrogramas tardíos durante el ritmo sinusal o la estimulación desde el ápex del ventrículo derecho16.
Se etiquetaron en el sistema LocaLisa todos los puntos en donde se aplicó radiofrecuencia, diferenciando las aplicaciones ineficaces de las exitosas. Se consideró ARF exitosa cuando se produjo la terminación de la TV clínica y la imposibilidad de su reinducción posterior o sólo la segunda condición cuando la ARF se completó fuera de TV por intolerancia.
Análisis estadístico
Los datos se expresan como media ± desviación estándar. La comparación de las variables cuantitativas entre ambos grupos se realizó mediante la prueba de la t de Student. La comparación de las variables cualitativas entre ambos grupos se realizó mediante las pruebas de la χ² y de Fisher. Se consideró estadísticamente significativo un valor de p < 0,05.
RESULTADOS
Características clínicas
En el grupo de pacientes en los que la ARF se realizó guiada con el sistema LocaLisa, 9 tenían infarto de miocardio previo, mientras que el restante tenía una displasia arritmogénica del ventrículo derecho. El grupo control incluyó a 22 pacientes, todos ellos con el antecedente de un infarto agudo de miocardio. Las características clínicas de estos pacientes se reflejan en la tabla 1. No se apreciaron diferencias significativas entre los 2 grupos, tanto en sus características clínicas como en las principales variables de ARF analizadas (tablas 1 y 2).
Cartografía y ablación
El número de procedimientos realizados en el grupo LocaLisa fue de 12, de los cuales 9 (75%) fueron eficaces. Este porcentaje de éxito fue levemente superior al obtenido en el grupo control (68%), aunque esta diferencia no alcanzó significación estadística (tabla 2). Dos pacientes del grupo LocaLisa y 3 del grupo control requirieron de un segundo procedimiento para la ARF del sustrato arritmogénico. Por esta razón, finalmente el 70% de los pacientes (7/10) del grupo LocaLisa fueron tratados con éxito mediante ARF, mientras que lo fue el 63% de los pacientes del grupo control (14/22). En 8 pacientes (8 procedimientos) la taquicardia clínica era similar a la taquicardia cartografiada durante el procedimiento. Como se aprecia en la tabla 2, no hubo diferencias significativas en el número de TV inducidas, en la longitud media de ciclo de las TV, en la duración media del procedimiento, de la ARF o de la fluoroscopia, así como tampoco en el número de aplicaciones de radiofrecuencia entre los 2 grupos. Por otro lado, mientras que en el grupo control el 76% de las TV cartografiadas presentaban una adecuada tolerancia hemodinámica, en el grupo LocaLisa la mostraban el 58% de las TV, aunque estas diferencias no fueron significativas. Un procedimiento del grupo control (4%) requirió cartografía del sustrato arrítmico en ritmo sinusal debido a la intolerancia de la TV, mientras que fueron 4 (33%) procedimientos en el grupo LocaLisa (p = 0,03).
En 1 paciente la aplicación eficaz de radiofrecuencia se realizó sobre la región que se encontraba entre la salida y la entrada de la zona de conducción lenta del circuito, guiada de forma prácticamente exclusiva por la localización de estos puntos en el sistema LocaLisa, dado que no se registraba actividad eléctrica mediodiastólica en esta zona (fig. 1). Finalmente, en ninguno de los pacientes del grupo LocaLisa se interrumpió o hubo que reiniciar la representación tridimensional de los puntos obtenidos mediante el sistema LocaLisa a causa de un desplazamiento del catéter de referencia.
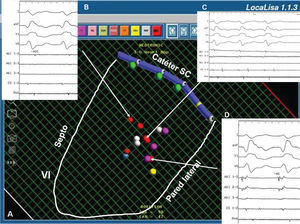
Fig. 1. Ablación de una taquicardia ventricular postinfarto de miocardio guiada por el sistema LocaLisa. A: imagen del sistema LocaLisa en la proyección oblicua anterior izquierda craneal. Se representa un catéter decapolar en la posición aproximada del seno coronario y mediante una línea blanca continua se ha dibujado el contorno aproximado del ventrículo izquierdo. Los puntos grises representan cicatrices, mientras que los de color violeta y rojo, las posiciones de interés cartográfico o de ablación, respectivamente. B y D: los electrogramas registrados en el canal de ablación representan los dos extremos de la zona de conducción lenta del circuito de la taquicardia. La flecha superior señala el punto en donde la cartografía de activación registra un intervalo electrograma-QRS de 400 ms (entrada), mientras que la flecha inferior señala un punto que registra un intervalo de 40 ms (salida). C: trazado que muestra el momento preciso de la terminación de la taquicardia ventricular durante la aplicación de radiofrecuencia, en ausencia de potenciales mediodiastólicos en los electrogramas del canal de ablación. La flecha media señala el punto exacto en donde se consiguió el éxito de la ablación. VI: ventrículo izquierdo.
Seguimiento a largo plazo
En el grupo LocaLisa el seguimiento medio fue de 10 ± 8 meses (rango, 3-24 meses). De 7 pacientes, 3 (42%) cuya ARF fue eficaz inicialmente presentaron recurrencia de la TV clínica. En 2 de ellos la recurrencia fue temprana (dentro de las 48 h) y se realizó un segundo procedimiento con resultado eficaz. El restante presentó recurrencia a los 2 meses de seguimiento, por lo que se optimizó la medicación antiarrítmica. Por otro lado, no se objetivaron recurrencias en los pacientes en que la ARF fue ineficaz. En este grupo, 3 pacientes tenían un desfibrilador automático implantable (DAI) colocado antes del estudio y todos ellos se mantuvieron libres de eventos; 2 pacientes requirieron el implante de un DAI tras el procedimiento, debido a la inducción de TV rápidas. Ninguno de ellos ha presentado recurrencias.
En el grupo control, el seguimiento medio fue de 19 ± 8 meses (rango, 4-31 meses). Cuatro pacientes tenían un implante previo de DAI, mientras que en 7 se implantó tras el procedimiento. Tras una ARF exitosa, 5 (35%) de 14 pacientes presentaron recurrencia de TV en los 6 meses siguientes al procedimiento. En 3 de ellos, se realizó la ablación eficaz de las TV en un segundo procedimiento, mientras que los otros 2 pacientes presentaron episodios de TV correctamente tratados por el DAI mediante terapias de estimulación antitaquicárdica. En ambos grupos no se produjeron fallecimientos durante el seguimiento.
DISCUSIÓN
Principales hallazgos
La eficacia del procedimiento fue ligeramente superior en el grupo LocaLisa, aunque esta diferencia no fue estadísticamente significativa. No obstante, la tendencia observada de una mayor frecuencia de TV con peor tolerancia en el grupo LocaLisa, junto a una mayor frecuencia de utilización de cartografía en ritmo sinusal en el mismo grupo, sugiere que en éste se incluyó a pacientes de mayor complejidad. Sin embargo, a pesar de todo, en este estudio con un número limitado de pacientes no se puede excluir que el sistema no tenga un efecto sustancial en el resultado del procedimiento.
Por otro lado, puede parecer sorprendente que no se haya encontrado una reducción en el tiempo de fluoroscopia en el grupo LocaLisa frente al control, a diferencia de lo publicado con este sistema en las series de ARF en otros sustratos arrítmicos. Sin embargo, y como ya se ha comentado, la utilización del sistema en este trabajo no se dirigió a reducir este tiempo, sino a definir y localizar mejor el circuito arrítmico. Por otro lado, las características especiales del sustrato arrítmico de las TV, en las que la cartografía se realiza en un volumen sobre un circuito tridimensional, son diferentes de las de otros sustratos, como el del aleteo auricular, en los que la cartografía se realiza en una superficie sobre un circuito de representación bidimensional. Este hecho puede haber influido también en los resultados, dado que, como en otros sistemas, no se visualizan el recorrido ni las curvas del catéter explorador, datos fundamentales para desplazarlos a puntos distantes dentro de una cavidad cardíaca.
La nueva versión de software incluye la posibilidad de visualizar simultáneamente 2 planos diferentes, lo que podría ayudar a reducir el tiempo de la radioscopia y del procedimiento.
Utilidad del sistema LocaLisa
El presente estudio demuestra la experiencia clínica inicial en la ARF de TV en presencia de cardiopatía estructural con la guía del sistema de navegación tridimensional no fluoroscópica LocaLisa. Este sistema ya ha demostrado su utilidad en la ARF de determinados sustratos arritmogénicos auriculares. Kirchhof et al9 encontraron una reducción de un 35% del tiempo de fluoroscopia tras una corta fase de entrenamiento en la ablación de taquicardias supraventriculares, así como Schneider et al6 en la ARF del aleteo auricular común. También se ha objetivado su utilidad tanto en el aislamiento de las venas pulmonares como en la ARF de taquicardias auriculares incisionales7,8. El sistema permite la navegación tridimensional del catéter sin visualización de la actividad eléctrica endocavitaria y puede ser suficiente para la ARF de sustratos bien definidos, susceptibles de un abordaje puramente anatómico. En sustratos complejos, su utilidad podría ser mayor para la ARF de dicho sustrato en ritmo sinusal que para la definición del circuito durante la taquicardia, dado que para ello es necesaria una minuciosa cartografía de activación endocárdica combinada con maniobras de estimulación para la localización del área crítica causante del mantenimiento de la reentrada18-22. Sin embargo, esta hipótesis no puede ser respondida por este estudio que no fue diseñado para ello. Por otro lado, frente a estos sistemas tiene la ventaja de no requerir un catéter adicional o uno especial de navegación, lo que repercute en el coste de los procedimientos y, también, al ser de implementación sencilla, no penaliza significativamente la duración del procedimiento, además de que facilita la recolocación del catéter de ARF en sitios específicos. La representación del catéter puede hacerse promediando su posición durante el ciclo cardíaco y respiratorio o reflejando fielmente sus movimientos a lo largo de ambos ciclos, a diferencia, y como ventaja, de otros sistemas. Por último, encontramos de gran utilidad en estos pacientes, especialmente aquellos con una cicatriz inferior, la posibilidad de navegación del catéter utilizando una proyección craneal. Esta proyección, imposible con fluoroscopia, permite trabajar en un modelo de 2 dimensiones en pacientes con un sustrato arrítmico de localización inferior (fig. 2).
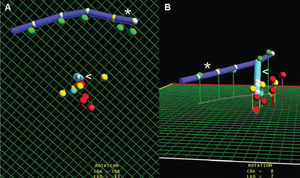
Fig. 2. Ablación de una taquicardia ventricular postinfarto de localización inferior. A: imagen en proyección oblicua anterior izquierda craneal en la que se aprecian diferentes puntos de interés cartográfico. Los puntos amarillos representan posiciones cartográficas relacionadas con la entrada, salida y zona de conducción lenta del circuito. Los puntos rojos representan sitios de aplicación de radiofrecuencia. B: imagen que muestra los puntos anteriores en proyección anteroposterior. *: catéter emplazado en el seno coronario; <: catéter de ablación.
Limitaciones del sistema LocaLisa
Aunque inicialmente la cartografía y la ARF de las TV se realizaban sólo bajo control fluoroscópico, recientemente se han desarrollado varios métodos sofisticados de visualización tridimensional2-5. Existe, actualmente, una importante experiencia en la ARF de TV guiadas mediante diferentes sistemas de navegación, como el sistema CARTO y el EnSite23-27. Estos métodos, a diferencia del sistema LocaLisa, aportan información tanto eléctrica como anatómica y ayudan a definir las características del istmo protegido (entrada, zona de conducción lenta y salida), combinando el análisis del voltaje de los electrogramas y de la secuencia de activación; algunos de ellos incluso permiten la ablación del circuito de TV cuya cartografía convencional es difícil o imposible, y ésta es, quizá, la principal desventaja del sistema LocaLisa23-28.
Esta limitación del sistema no permite fácilmente lograr hacerse una idea espacial de la posición de los puntos y del catéter explorador. En este sentido, en nuestro trabajo encontramos especialmente útil el emplazamiento de un catéter multipolar en el seno coronario como referencia anatómica, ya que facilitó la cartografía en los pacientes en quienes se emplazó, con relación a los primeros de la serie en los que éste no se utilizó. Al mismo tiempo, en general no es necesario tener una representación anatómica que delimite precisamente la extensión de las cicatrices ni la activación de todo el ventrículo izquierdo, sino de la relación de las cicatrices con la zona de conducción lenta, representaciones que se pueden realizar sencillamente con el sistema LocaLisa. Otra limitación, al igual que otros sistemas de navegación tridimensional, es el desplazamiento del electrodo de referencia, que provoca un desplazamiento en la misma dirección de la representación de puntos del sistema con respecto a su localización anatómica real. Esta potencial limitación, que hemos observado con la utilización del sistema para otros sustratos arrítmicos, no se presentó en ninguno de nuestros pacientes con TV.
LIMITACIONES
Este estudio describe la experiencia inicial de esta tecnología en el sustrato de las TV, por ello es predominantemente descriptivo, mientras que los resultados están condicionados por el limitado número de pacientes, una escasa potencia estadística, así como por la curva de aprendizaje del sistema LocaLisa en este sustrato específico. Una ventaja potencial que ofrece el sistema LocaLisa es la reducción del tiempo de fluoroscopia. En nuestro estudio, la reducción del tiempo de escopia no fue un objetivo específico, lo que constituye una limitación de este estudio para evaluar una de las ventajas potenciales más importantes de este sistema. Por otro lado, si bien los resultados del grupo en estudio son controlados, la inclusión de los pacientes fue inicialmente abierta y en los últimos pacientes correlativa no aleatorizada.
CONCLUSIONES
En este estudio predominantemente descriptivo, el sistema LocaLisa ha permitido, con un bajo coste y sin requerir un catéter adicional, delinear el circuito de reentrada y la reubicación precisa del catéter de ablación en puntos de interés previamente cartografiados, lo que podría representar, en esta población, una ventaja respecto a las técnicas convencionales.
Los autores M. Abello, J.L. Merino y R. Peinado declaran haber recibido ayudas por becas de formación, consultoría o participación en ensayos multicéntricos patrocinados por la compañía Medtronic.
Correspondencia: Dr. J.L. Merino.
Hospital La Paz. Unidad de Arritmias y Electrofisiología (1.a PRE).
P.o de la Castellana, 261. 28046 Madrid. España.
Correo electrónico: jlmerino@secardiologia.es