La infección por Trypanosoma cruzi induce una respuesta autoinmunitaria humoral contra diferentes antígenos del huésped. En especial, los anticuerpos que presentan reactividad cruzada con antígenos del miocardio tienen un papel importante en el desarrollo de las formas graves de la cardiopatía chagásica crónica. En este trabajo se analiza la asociación del estadio clínico de la enfermedad con la presencia de autoanticuerpos en pacientes con cardiopatía chagásica crónica.
MétodosEstudio transversal con pacientes con serología positiva para enfermedad de Chagas, categorizados en tres grupos según la clasificación de cardiopatía chagásica de Storino et al. Se realizó a todas las personas incluidas un examen clínico completo y se usaron las muestras de suero para cuantificar los autoanticuerpos.
ResultadosTodos los pacientes presentaron cantidades detectables de anti-p2β y anti B13; el anti-Na-K-ATPasa fue negativo en todos los casos. No se halló asociación significativa entre las alteraciones electrocardiográficas y los valores de autoanticuerpos. Los pacientes con cardiopatía chagásica en estadio III presentaron mayor concentración de anti-B13 y riesgo de mortalidad alto, lo que muestra una clara asociación entre el estadio de la enfermedad y la puntuación de mortalidad.
ConclusionesLa concentración del autoanticuerpo anti-B13 fue significativamente mayor en los pacientes con cardiopatía chagásica en estadio III, lo que indica que este anticuerpo puede estar involucrado en la progresión de la enfermedad y podría usarse como marcador de mal pronóstico respecto a la afección cardiaca. Los resultados revelan también una importante correlación entre el anti-B13 y la insuficiencia cardiaca sintomática y la cardiomiopatía dilatada.
Palabras clave
La enfermedad de Chagas, una infección parasitaria causada por el protozoo Trypanosoma cruzi, afecta a un mínimo de 8-10 millones de personas en América Central y del Sur. Se han descrito también casos esporádicos en Estados Unidos y Europa. Las principales complicaciones de esta enfermedad son los síndromes mega, que afectan al tracto gastrointestinal o al corazón. La cardiopatía chagásica crónica (CCC) es la manifestación más frecuente y afecta a aproximadamente un 30% de los individuos infectados por T. cruzi. Los trastornos cardiacos graves, como las anomalías del ritmo o de la conducción, la miocardiopatía dilatada específica o los episodios tromboembólicos, pueden causar aproximadamente 50.000 muertes anuales1,2.
Los mecanismos que subyacen a la patogenia de la enfermedad de Chagas son complejos y multifactoriales3,4; es probable que intervengan en ello las respuestas inmunitarias a los antígenos parasitarios5,6, los procesos autoinmunitarios7–9 y la respuesta inflamatoria que acompaña a estas reacciones10–15. Una respuesta autoinmunitaria humoral debida a la imitación molecular que muestran algunas proteínas de parásitos es uno de los mecanismos que intervienen en la patogenia de la enfermedad de Chagas. Entre los diversos autoanticuerpos descritos, se ha demostrado que el anti-p2β y el anti-B13 desempeñan un papel patógeno en la producción de las lesiones del tejido cardiaco, tanto en el ser humano como en modelos animales16. Los anticuerpos anti-p2β con reactividad cruzada con el receptor adrenérgico β1 se han observado en modelos murinos de alteraciones cardiacas, como las anomalías electrocardiográficas y la apoptosis miocitaria17–23. La reactividad cruzada se atribuye al epítopo ácido antigénico presente en el extremo carboxiterminal del p2β, denominado R13 (EEEDDDMGFGLFD), que muestra similitud con el motivo ácido AESDE situado en el segundo bucle extracelular del receptor adrenérgico β124. Una determinación de los anticuerpos anti-p2β en pacientes chagásicos de diversos estadios no aportó resultados concluyentes respecto a su relación con la CCC25,26. Se demostró que el antígeno B13 fomentaba una respuesta celular de autoanticuerpos contra la miosina cardiaca, debido a la homología de secuencia del epítopo de la proteína B13 (AAAGDK) del hexapéptido de cadena pesada de miosina cardiaca humana (AAALDK)16,27,28. En un estudio realizado en pacientes con CCC, se observó una prevalencia elevada de anticuerpos anti-B13 en pacientes con miocardiopatía dilatada25, pero no se exploró la correlación de la concentración con el grado de afección de la CCC.
Recientemente, los anticuerpos contra la ATPasa de la bomba de Na+/K+ se han asociado a una miocardiopatía dilatada idiopática y a alteraciones electrocardiográficas de la conducción29,30. Es interesante señalar que la expresión de la ATPasa de la bomba de Na+/K+ por T. cruzi se ha considerado un mecanismo de adaptación del ciclo extracelular al intracelular31. Dado que la ATPasa de la bomba de Na+/K+ tiene una secuencia de aminoácidos muy conservada en el ser humano y el parásito, los autoanticuerpos contra esta proteína pueden desempeñar un papel en la patogenia de la CCC, debido a un mecanismo de imitación molecular desencadenado por esta proteína.
Este estudio se diseñó para evaluar la presencia de las inmunoglobulinas anti-p2β y anti-B13 y el anticuerpo anti-ATPasa de bomba de Na+/K+, todavía inexplorado en pacientes con CCC. Se evaluó la posible asociación entre la concentración sérica de estos anticuerpos y el grado de afección cardiaca, y se determinó también la puntuación de riesgo de mortalidad.
MÉTODOSPoblación en estudio y evaluación de los participantesSe llevó a cabo un estudio transversal en 80 pacientes con una prueba serológica positiva para T. cruzi. El diagnóstico de enfermedad de Chagas se estableció según las recomendaciones de la Organización Mundial de la Salud con dos pruebas diferentes (ELISA y hemaglutinación indirecta o inmunofluorescencia indirecta) con resultados positivos32. Se dividió a los pacientes en tres grupos según la clasificación de la CCC de Storino et al33. Todos los participantes inscritos procedían del servicio clínico del Hospital Iturraspe (Santa Fe, Argentina). Se les practicó una exploración clínica completa, que incluía las siguientes pruebas: hemograma completo, glucosa, potasio, creatinina, nitrógeno de urea en sangre, electrocardiograma, radiografía de tórax y abdomen y ecocardiografía Doppler. Las ecocardiografías se realizaron según el método de Acquatella34. Los criterios de exclusión fueron: presencia de dos o más factores de riesgo de enfermedad coronaria o enfermedad establecida, antecedentes de otras enfermedades cardiacas, alteraciones renales, enfermedad tiroidea o cualquier otra afección sistémica, así como el tratamiento con compuestos anti-T. cruzi o fármacos inmunosupresores. El estudio contó con la aprobación ética del Consejo de Revisión Ética de la Universidad Nacional del Litoral. Se obtuvo el consentimiento informado de todos los pacientes.
Según la clasificación antes citada, se incluyó a: a) 30 pacientes con CCC en estadio I (es decir, con exploraciones radiológicas, electrocardiograma y ecocardiografía normales); b) 25 pacientes con CCC en estadio II (con alteraciones electrocardiográficas como bloqueo de división anterior izquierda, bloqueo de rama derecha del haz, bloqueo auriculoventricular completo, bloqueo de rama izquierda o derecha del haz de His, arritmias ventriculares complejas y bloqueo de la división anterosuperior de la rama izquierda), y c) 25 pacientes con CCC en estadio III (con insuficiencia cardiaca clínica o miocardiopatía dilatada en la ecocardiografía). La insuficiencia cardiaca clínica se definió según la guía de práctica clínica de la Sociedad Europea de Cardiología sobre diagnóstico y tratamiento de la insuficiencia cardiaca aguda y crónica 201235. Todos los pacientes de este grupo tenían diagnóstico de insuficiencia cardiaca, y en el momento de la inclusión en el estudio ninguno recibía un tratamiento específico para dicho trastorno.
Se incluyó también un grupo de control formado por 10 pacientes con miocardiopatía dilatada e insuficiencia cardiaca debida a hipertensión o enfermedad coronaria.
Expresión y purificación de proteínasSe cultivaron células de Escherichia coli BL21(DE3) portadoras de las construcciones plasmídicas PET-32a/p2β, PET-32a/B13 (durante una noche) en medio LB, con suplementos de 0,1mg×ml/1 ampicilina a 37°C, con agitación. Se indujo la expresión proteica en 1 mM de isopropil-β-D-tiogalactopiranósido y se purificó con una columna de Ni-ácido nitrilotriacético (GE), según lo descrito en otra publicación36. Se produjo una inducción de las células de E. coli BL21(DE3) portadoras de las construcciones plasmídicas pET28a/TcENA (como ATPasa de la bomba de Na+/K+) mediante la incubación de las células en 1 mM de isopropil-β-D-tiogalactopiranósido. Se lisaron las células bacterianas mediante sonicación y se precipitaron mediante centrifugación a 10.000×g durante 10 min a 4°C. El precipitado resultante se solubilizó con 8 mol UREA, se incubó con TALON Metal Affinity Resin (BD Biosciences; San Jose, California, Estados Unidos) y se dializó, según lo descrito por Iizumi et al31.
Determinaciones de anticuerposSe obtuvieron muestras de suero mediante punción venosa convencional y se determinaron los anticuerpos mediante inmunoanálisis (ELISA). Se recubrieron placas de microtitulación con 0,5 μg del antígeno específico en tampón de carbonato-bicarbonato 0,05 M, a pH 9,6, y se incubaron (durante una noche) a 4°C. Se bloquearon las placas con albúmina de suero bovino al 5% y se incubaron con una dilución de 1:100 de suero humano por duplicado. Las placas se leyeron a 450 nm en un lector de ELISA (BioRad). Todas las muestras de suero se evaluaron por duplicado y se tomó como resultado de la prueba la media del valor de densidad óptica de estas determinaciones simultáneas. En cada placa se analizaron simultáneamente 6 controles negativos (individuos sanos seronegativos para T. cruzi)36. Se calcularon valores de corte estándares con ELISA negativo tomando la media de la densidad óptica de las muestras de suero negativas más 2 desviaciones estándares. La cantidad de anticuerpos se expresó mediante un índice que indica la relación entre la densidad óptica de la muestra y la densidad óptica de los valores de corte estándares negativos. Se denomina a este índice IDON (índice de la densidad óptica de autoanticuerpos en relación con el control negativo). Un IDON ≤ 1 se consideró negativo36–38.
Puntuación de mortalidadSe aplicó a todos los pacientes la puntuación de riesgo para la predicción de muerte en cardiopatía chagásica39,40. Se incluyó a los pacientes en los grupos de riesgo bajo y alto porque no los hubo de riesgo intermedio.
Análisis estadísticoLos datos se analizaron con el programa MedCalc versión 12.2.1. La distribución normal de las variables continuas se evaluó con el método de Kolmogorov-Smirnov. Los datos se expresan en forma de media±desviación estándar o la mediana [intervalo intercuartílico]. Se compararon los grupos en lo relativo a edad, concentración de anticuerpos y estadio de la CCC. Se utilizó la prueba de la χ2 o la prueba exacta de Fisher para las variables discretas y un análisis de la varianza de una vía (prueba de Student-Newman-Keuls para todas las comparaciones por pares) para comparar las medias de valores de IDON y la edad de los grupos definidos según el estadio de la CCC. Se aplicaron modelos de regresión logística binaria múltiple para evaluar la influencia de las variables asociadas (p<0,05) a la insuficiencia cardiaca en la enfermedad de Chagas. Los factores de confusión y los factores de riesgo independientes se incluyeron en el modelo de regresión logística final. Se construyó una curva receiver operating characteristic para explorar si el IDON de anticuerpos era útil para diferenciar entre los pacientes con diferentes estadios de CCC. Se consideró estadísticamente significativo un valor de p<0,05.
RESULTADOSPoblación generalLa media de edad de los sujetos de la muestra era 55±12,4 años; el 56% eran mujeres. No hubo diferencias entre los grupos en cuanto a la distribución de edades o sexos. Los pacientes con una CCC en estadio III no tenían conciencia de haber contraído una infección por T. cruzi hasta que ingresaron en el hospital a causa de una insuficiencia cardiaca. Tan solo 12 pacientes con CCC en estadios I o II sabían que tenían enfermedad de Chagas. Los demás pacientes con CCC fueron diagnosticados mediante un examen de selección inicial debido a una epidemiología positiva en cuanto a la enfermedad de Chagas.
Tenían hipertensión y recibían tratamiento con enalapril 12 pacientes con CCC en estadio II y 6 con CCC en estadio III. Todos los pacientes del grupo control eran también hipertensos y recibían tratamiento con inhibidores de la enzima de conversión de la angiotensina y bloqueadores beta. La presión arterial sistólica fue significativamente inferior en los pacientes en estadio I en comparación con los de los demás grupos (prueba de Kruskall Wallis, p=0,0042).
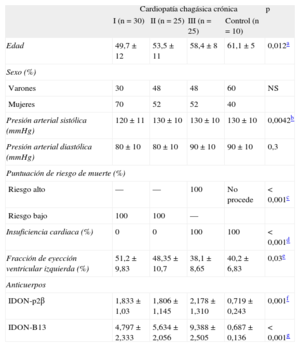
Las características de los pacientes de cada grupo y la distribución de los anticuerpos se resumen en la tabla 1.
Características de los pacientes con cardiopatía chagásica crónica de los diversos grupos
| Cardiopatía chagásica crónica | p | ||||
| I (n=30) | II (n=25) | III (n=25) | Control (n=10) | ||
| Edad | 49,7±12 | 53,5±11 | 58,4±8 | 61,1±5 | 0,012a |
| Sexo (%) | |||||
| Varones | 30 | 48 | 48 | 60 | NS |
| Mujeres | 70 | 52 | 52 | 40 | |
| Presión arterial sistólica (mmHg) | 120±11 | 130±10 | 130±10 | 130±10 | 0,0042b |
| Presión arterial diastólica (mmHg) | 80±10 | 80±10 | 90±10 | 90±10 | 0,3 |
| Puntuación de riesgo de muerte (%) | |||||
| Riesgo alto | — | — | 100 | No procede | <0,001c |
| Riesgo bajo | 100 | 100 | — | ||
| Insuficiencia cardiaca (%) | 0 | 0 | 100 | 100 | <0,001d |
| Fracción de eyección ventricular izquierda (%) | 51,2±9,83 | 48,35±10,7 | 38,1±8,65 | 40,2±6,83 | 0,03e |
| Anticuerpos | |||||
| IDON-p2β | 1,833±1,03 | 1,806±1,145 | 2,178±1,310 | 0,719±0,243 | 0,001f |
| IDON-B13 | 4,797±2,333 | 5,634±2,056 | 9,388±2,505 | 0,687±0,136 | <0,001g |
CCC: cardiopatía chagásica crónica; IDON: índice de la densidad óptica de autoanticuerpos en relación con el control negativo; NS: no significativo.
Las variables cuantitativas se expresan en forma de media±desviación estándar y las cualitativas, en forma de proporciones y porcentajes.
Las alteraciones electrocardiográficas más frecuentes en la CCC en estadios II y III fueron el bloqueo de división anterior izquierda con bloqueo de rama derecha del haz (n=12), el bloqueo de rama derecha del haz (n=7) y la fibrilación auricular asociada a bloqueo de rama derecha del haz (n=7). Se observó la presencia de bradicardia sinusal en 4 pacientes con CCC en estadio II, mientras que 2 pacientes con CCC en estadio III tenían un bloqueo auriculoventricular de tercer grado que requirió la implantación de un marcapasos. Las alteraciones observadas en el grupo control de pacientes con miocardiopatía dilatada fueron: fibrilación auricular (n=4), hipertrofia ventricular izquierda (n=3), fibrilación auricular y bloqueo de rama derecha del haz (n=2) y bloqueo de división anterior izquierda y bloqueo de rama derecha del haz (n=1). No se observó asociación alguna entre las alteraciones electrocardiográficas de la conducción y la hipertensión o los valores de IDON para los anticuerpos anti-p2β y anti-B13. No hubo diferencias estadísticamente significativas en cuanto a la frecuencia de registros electrocardiográficos patológicos entre los pacientes con CCC (estadios II y III) y el grupo control.
Signos ecocardiográficosDe los pacientes del grupo de CCC II, 4 presentaban hipocinesia septal apical sin alteración diastólica ni sistólica y 2 pacientes tenían hipertrofia ventricular concéntrica. De los 25 pacientes con CCC III, el 53% presentaba miocardiopatía dilatada general con reducción de la fracción de eyección, un 30% tenía crecimiento auricular izquierdo y una relajación ventricular izquierda anormal, con insuficiencia cardiaca diastólica, y el 17% presentaba hipertrofia ventricular concéntrica con alteración diastólica. En el grupo control, 7 pacientes presentaban hipocinesia de las paredes ventriculares izquierdas asociada a un crecimiento de las cavidades izquierdas y reducción de la fracción de eyección, 2 pacientes tenían miocardiopatía dilatada general y los demás presentaban hipocinesia septal apical asociada a una relajación ventricular izquierda anormal e insuficiencia cardiaca diastólica.
Tal como se esperaba, la hipertensión se asociaba a hipertrofia ventricular concéntrica (p=0,04).
AnticuerposTodos los pacientes con enfermedad de Chagas presentaban concentraciones detectables de autoanticuerpos anti-p2β (2.007 a 11.207) y anti-B13 (1.950 a 13.525), mientras que ninguno tenía anticuerpos anti-Na-K-ATPasa. Todos los pacientes del grupo control presentaron unos resultados negativos. La concentración de anticuerpos no se correlacionaba con la distribución por edad o sexo ni con otras variables adicionales, como la hipertensión o el tratamiento con enalapril.
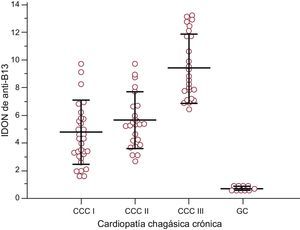
La comparación de los anticuerpos anti-p2β no reveló ninguna diferencia entre los grupos en los pacientes con CCC, mientras que los pacientes con CCC III fueron los que presentaban los valores más altos de IDON para los anticuerpos anti-B13 (cociente F=37,32; p<0,001) (fig. 1). Este grupo mostró una clara asociación con la insuficiencia cardiaca y un riesgo elevado de puntuación de mortalidad elevada (prueba exacta de Fisher, p<0,001).
Valores del índice de la densidad óptica de autoanticuerpos en relación con el control negativo de anti-B13 según el grado de cardiopatía chagásica crónica y en el grupo control. Las líneas corresponden a media±desviación estándar. Los valores del índice de la densidad óptica de autoanticuerpos en relación con el control negativo de anti-B13 en los pacientes en estadio III fueron significativamente diferentes de las de los demás grupos. Cociente F de análisis de la varianza=24,58 (p<0,001) (prueba de Student-Newman-Keuls para todas las comparaciones por pares, p<0,05). CCC: cardiopatía chagásica crónica; GC: grupo control; IDON: índice de la densidad óptica de autoanticuerpos en relación con el control negativo.
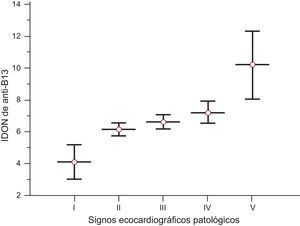
No hubo diferencias estadísticamente significativas entre el grado de miocardiopatía determinado mediante ecocardiografía y el IDON de autoanticuerpos. Al excluir del análisis a los pacientes hipertensos, observamos que los valores de IDON de anticuerpos anti-B13 aumentaban con la progresión de los signos ecocardiográficos patológicos (fig. 2). Además, los pacientes con miocardiopatía dilatada y fracción de eyección reducida presentaban un aumento del valor de IDON de anti-B13 en comparación con los pacientes sin esa alteración (p<0,001) en las poblaciones que eran serológicamente positivas para la enfermedad de Chagas. Los pacientes con una puntuación de mortalidad elevada presentaban valores de IDON anti-B13 superiores a los de los pacientes de bajo riesgo (p<0,001).
Valores del índice de la densidad óptica de autoanticuerpos en relación con el control negativo de anti-B13 según los signos ecocardiográficos patológicos. I: ecocardiografía normal; II: hipocinesia apical-septal; III: hipertrofia ventricular concéntrica; IV: crecimiento auricular izquierdo y relajación ventricular izquierda anormal, con insuficiencia cardiaca diastólica; V: miocardiopatía dilatada general con fracción de eyección reducida; IDON: índice de la densidad óptica de autoanticuerpos en relación con el control negativo. Las líneas corresponden a mediana ± desviación estándar. Los pacientes con miocardiopatía dilatada y fracción de eyección reducida presentaban un aumento significativo del valor del índice de la densidad óptica de autoanticuerpos en relación con el control negativo en comparación con los pacientes sin esa alteración. Cociente F de análisis de la varianza = 61,91 (p < 0,001) (prueba de Student-Newman-Keuls para todas las comparaciones por pares, p < 0,05).
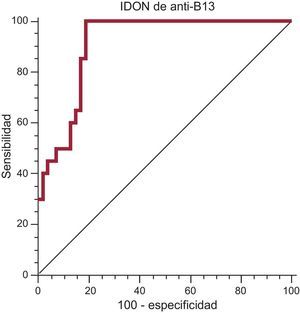
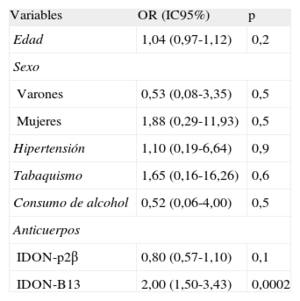
Se realizó una regresión logística binaria múltiple para predecir la insuficiencia cardiaca clínica empleando las variables discretas hipertensión, sexo, tabaquismo y consumo de alcohol, y las variables continuas edad, valor de IDON anti-p2β e IDON anti-B13. El criterio de Wald puso de manifiesto que tan solo el IDON anti-B13 contribuía de manera significativa a la predicción (odds ratio=2; intervalo de confianza del 95% [IC95%], 1,501-3,430; p=0,0002), que mostraba una relación lineal (tabla 2). Se calculó también la curva receiver operating characteristic del IDON anti-B13, que produjo un área bajo la curva del 0,87% (p<0,001) para un IDON anti-B13 de 6,655, con una sensibilidad del 99% (IC95%, 78,2-99,0) y una especificidad del 74,58% (IC95%, 61,6-85,0) (fig. 3).
Resumen de variables y odds ratio
| Variables | OR (IC95%) | p |
| Edad | 1,04 (0,97-1,12) | 0,2 |
| Sexo | ||
| Varones | 0,53 (0,08-3,35) | 0,5 |
| Mujeres | 1,88 (0,29-11,93) | 0,5 |
| Hipertensión | 1,10 (0,19-6,64) | 0,9 |
| Tabaquismo | 1,65 (0,16-16,26) | 0,6 |
| Consumo de alcohol | 0,52 (0,06-4,00) | 0,5 |
| Anticuerpos | ||
| IDON-p2β | 0,80 (0,57-1,10) | 0,1 |
| IDON-B13 | 2,00 (1,50-3,43) | 0,0002 |
IC95%: intervalo de confianza del 95%; IDON: índice de la densidad óptica de autoanticuerpos en relación con el control negativo; OR: odds ratio.
Curva receiver operating characteristic del índice de la densidad óptica de autoanticuerpos en relación con el control negativo anti-B13 como marcador serológico de la cardiopatía chagásica crónica en estadio III. Área bajo la curva, 0,87% (p<0,001) para el índice de la densidad óptica de autoanticuerpos en relación con el control negativo de anti-B13=6,655. Sensibilidad del 99% (intervalo de confianza del 95%, 78,2-99,0) y especificidad del 74,58% (intervalo de confianza del 95%, 61,6-85,0). IODN: índice de la densidad óptica de autoanticuerpos en relación con el control negativo.
La respuesta autoinmunitaria contra los antígenos miocárdicos puede desempeñar un papel en el desarrollo de las formas graves de CCC16. En el presente estudio, se evaluó la influencia de la imitación molecular en el fomento de la respuesta de anticuerpos autoinmunitarios en los pacientes con cardiopatía.
Como objetivo adicional relacionado con el análisis de autoanticuerpos, se evaluó si la ATPasa de la bomba de Na+/K+ de T. cruzi inducía una reacción autoinmunitaria. Estos anticuerpos no se han investigado anteriormente en pacientes con enfermedad de Chagas, pero se ha detectado su presencia en otros pacientes con miocardiopatía. Nuestra hipótesis fue que estos autoanticuerpos pueden ser inducidos por la infección parasitaria, teniendo en cuenta el análisis filogenético anteriormente presentado, que indica que las ATPasas de Na+/K+ e H+/K+ de tipo IIC de organismos de diferentes reinos tienen secuencias conservadas, excepto en las regiones aminoterminal y carboxiterminal, que son muy variables41. No se pudo identificar anticuerpos contra la proteína de la bomba de cationes del parásito en ninguno de los pacientes con enfermedad de Chagas. Aunque el parásito debe expresar esta bomba para poder sobrevivir en el interior de la célula huésped31, parece claro que la inmunogenicidad de este antígeno, la cantidad de antígeno o las vías de presentación antigénica no desencadenan una proliferación de clones de células B dirigidas contra este antígeno en la infección humana por T. cruzi. En consecuencia, es posible que este antígeno no intervenga en la producción de anticuerpos impulsada por la imitación molecular.
De entre los autoanticuerpos de aparición promovida por los antígenos del parásito, el anti-p2β y el anti-B13 son los mejor caracterizados. Estos anticuerpos se han detectado en los sueros de animales infectados experimentalmente y en los de pacientes con enfermedad de Chagas16,27,42. Algunos estudios indican que estos anticuerpos pueden inducir alteraciones funcionales y estructurales del tejido cardiaco durante la enfermedad de Chagas experimental9,17–24,43,44. Además, nuestros resultados indican que los pacientes con CCC tenían anticuerpos contra las secuencias peptídicas tanto del receptor adrenérgico como de la miosina cardiaca. El anti-p2β estaba presente en toda la población en estudio, y no había diferencias entre los grupos ni relación alguna con las manifestaciones clínicas. Estos resultados concuerdan con los de otros estudios. Talvani et al26 no observaron correlación alguna entre el anti-p2β y los diferentes estadios de la CCC, pero utilizaron un tamaño muestral pequeño. Brenière et al25 tampoco observaron ninguna asociación entre los valores de anti-p2β y las alteraciones del electrocardiograma, aunque en el estudio no se incluyó a pacientes con insuficiencia cardiaca. En el presente estudio, el grado de signos ecocardiográficos patológicos, alteraciones electrocardiográficas de la conducción e insuficiencia cardiaca no mostró relación alguna con las cifras de anticuerpos anti-p2β. Por lo que respecta al anti-B13, Cunha-Neto et al27 señalaron que los anticuerpos con reactividad cruzada entre miosina cardiaca y B13 estaban presentes en todos los pacientes con enfermedad de Chagas con insuficiencia cardiaca, pero solo en el 14% de los pacientes seropositivos para T. cruzi asintomáticos. Todos los pacientes serológicamente positivos para la enfermedad de Chagas incluidos en nuestro estudio presentaban anticuerpos anti-B13, tal como se ha descrito anteriormente45, y sus valores fueron significativamente mayores en los que tenían CCC en estadio III. Además, la comparación de la cantidad de anti-B13 en relación con los signos ecocardiográficos patológicos mostró que estos autoanticuerpos aumentaban a medida que progresaba la afección cardiaca estructural.
CONCLUSIONESNuestros resultados reflejan una importante correlación entre concentración de autoanticuerpos anti-B13 y la insuficiencia cardiaca sintomática y los signos patológicos en la ecocardiografía, lo que indica que estos anticuerpos pueden estar involucrados en la progresión de la enfermedad. Sin embargo, se necesitan estudios longitudinales para determinar si los autoanticuerpos anti-B13 pueden tener valor predictivo en la CCC.
CONFLICTO DE INTERESESNinguno.
Estudio financiado por CONICET (Consejo Nacional de Investigación Científica y Técnica) y por la Universidad Nacional del Litoral (Santa Fe, Argentina). MHV e IB son becarios de investigación de CONICET. ISM y OB son investigadores de carrera de CONICET.