La integración de la anatomía y la función del miocardio ventricular es fundamental para una completa comprensión de la fisiología cardiaca, lo que podría revelar conocimientos clave para futuros estudios experimentales y procedimientos clínicos. Se han propuesto varios modelos conceptuales de la organización de las fibras miocárdicas, pero la dificultad para automatizar y analizar objetivamente una estructura anatómica tan compleja ha impedido que se llegue a un acuerdo. El objetivo de nuestro estudio es analizar objetivamente la arquitectura de las fibras miocárdicas mediante métodos avanzados de procesamiento gráfico por computadora aplicados a imágenes de resonancia magnética por tensor de difusión.
MétodosSe han realizado reconstrucciones tractográficas automatizadas de datos de imágenes de resonancia magnética por tensor de difusión sin segmentar de corazones provenientes de la base de datos pública de la Johns Hopkins University. Las reconstrucciones a máxima resolución se han construido con 200 semillas y se componen de perfiles calculados sobre el volumen de vectores propios primarios obtenidos del tensor de difusión. También aportamos una nueva técnica de visualización multiescalar para obtener tractografías simplificadas. Esta metodología permite mantener las principales propiedades geométricas de las fibras y descifrar las principales propiedades de la organización arquitectónica del miocardio.
ResultadosEn el análisis de las tractografías de todo el espectro multiescalar, encontramos una correlación exacta en los detalles de bajo nivel, así como de la conceptualización abstracta de la disposición helicoidal continua de las fibras miocárdicas que conforman la arquitectura ventricular.
ConclusionesEl análisis objetivo de la arquitectura miocárdica mediante un método automatizado que incluye el miocardio completo y utiliza diferentes niveles de complejidad tridimensional revela una organización de las fibras en forma de estructura helicoidal continua que conforma ambos ventrículos. Estos datos concuerdan con el modelo de banda ventricular miocárdica descrita por F. Torrent-Guasp.
Palabras clave
Está ampliamente aceptado que la arquitectura de las fibras miocárdicas desempeña un papel crucial en muchos aspectos funcionales del corazón, como la propagación eléctrica1,2 o la contracción ventricular3,4. También está aceptado que el miocardio, al igual que sus fibras, puede sufrir alteraciones de su arquitectura en muchas enfermedades cardiacas5,6 que dé lugar a una función cardiaca ineficiente. Sin embargo, falta consenso respecto a la distribución exacta de las fibras miocárdicas y su disposición espacial que constituye la estructura miocárdica macroscópica (ventrículos izquierdo y derecho). Un conocimiento más preciso de la arquitectura cardiaca7 y su relación con la función ventricular8 sería beneficioso para actividades clínicas como la planificación de la cirugía de remodelado ventricular o la terapia de resincronización cardiaca9,10.
Se han propuesto hasta siete modelos conceptuales11 al intentar describir con detalle la arquitectura del corazón basándose en métodos de disección o histológicos. Dos de los enfoques más controvertidos son el modelo de malla cardiaca propuesto por Anderson et al12,13 y la banda miocárdica ventricular helicoidal (BMVH) propuesta por Torrent-Guasp14 y Torrent-Guasp et al15. El modelo de malla cardiaca propone que los miocitos están dispuestos de manera longitudinal y radial, con angulaciones que varían con la profundidad miocárdica, y relaciona esta distribución arquitectónica con su consecuencia funcional16. Por otro lado, el modelo BMVH afirma que el miocardio ventricular tiene una disposición anatómica helicoidal y continua de las fibras miocárdicas, arquitectura que se relaciona con la bien conocida mecánica de torsión ventricular17.
El problema en el estudio de los modelos ventriculares radica en que, a diferencia de lo que ocurre en el músculo esquelético, el tejido miocárdico forma un enmallado aparentemente discontinuo de miocitos con ramificaciones18. Esta estructura en malla es propensa a dificultar o incluso confundir la interpretación de los «tractos» que definen la disposición de las fibras miocárdicas. Algunos investigadores argumentan que la interpretación de estos «tractos» depende de la técnica de disección usada12.
En la última década, una nueva técnica de diagnóstico por la imagen, la resonancia magnética por tensor de difusión (DT-RM), ha permitido realizar una validación computacional de la estructura muscular del corazón. Esta técnica proporciona una medición discreta de la disposición tridimensional de los miocitos19 mediante la observación de la difusión anisotrópica local de las moléculas de agua en los tejidos biológicos20. La DT-RM se ha establecido como técnica de imagen de referencia para la medición de toda la arquitectura cardiaca, con una resolución aceptable (300×300×1.000μm) en comparación con el tamaño de los miocitos (50-100μm de longitud y 10-20μm de grosor). De hecho, la DT-RM proporciona una visión simplificada de la malla microscópica y resalta las vías de conexión preferentes de los miocitos, lo que da lugar al concepto de fibra miocárdica.
En este estudio se utilizaron técnicas avanzadas de gráficos de ordenador para obtener una descripción objetiva y detallada de la arquitectura de las fibras miocárdicas, tal como se ha descrito parcialmente en una comunicación previa21, y se presenta un abordaje tractográfico multirresolutivo para conseguir una descripción ajustada de la arquitectura miocárdica ventricular.
MÉTODOSLas series de datos utilizadas en este estudio proceden de la base de datos pública de la Johns Hopkins University22. Dichas series se obtuvieron de 4 corazones caninos normales. Cada corazón se colocó en un recipiente acrílico lleno de Fomblin, un perfluoropoliéter (Ausimon; Thorofare, New Jersey, Estados Unidos). Fomblin tiene un efecto dieléctrico bajo y una señal de RM mínima, con lo que aumenta el contraste y elimina los artefactos de susceptibilidad no deseados próximos a los límites del corazón. El eje largo del corazón se alineó con el eje z del escáner. La adquisición de las imágenes se realizó con una espiral en fase de rodilla, de cuatro elementos, en un escáner GE CV/I RM de 1,5 T (GE Medical System; Wausheka, Wisconsin, Estados Unidos) utilizando un sistema de gradiente intensificado, con 40mT/m de amplitud de gradiente máximo y 150 T/m/s de frecuencia de cambio de voltaje (slew rate). Los corazones se colocaron en el centro de la espiral y se utilizó una secuencia de espín-eco rápida tridimensional para la adquisición de las imágenes de difusión con un mínimo de 16 direcciones de gradiente no colineales y un valor b máximo de 1.500 s/mm2. El tamaño de cada vóxel fue de alrededor de 312,5×312,5×800μm. La resolución derivada del relleno de cero en el espacio de Fourier nos permitió adaptar el tamaño de imagen original de 192×192 a 256×256. El conjunto de datos final se dispuso en matrices de aproximadamente 256×256×108 (según el corazón examinado) y contiene dos tipos de datos: datos de geometría/escalares y datos de tensor de difusión. Para los datos del tensor de difusión, cada vóxel de la matriz consistió en tres valores propios (eigenvalores) y tres vectores propios (eigenvectores). El tamaño de cada vóxel fue de alrededor de 312,5×312,5×800μm.
Las tractografías a escala completa presentadas en este estudio se han construido con 200 semillas. Estas semillas se eligieron aleatoriamente en toda la anatomía, excluyendo tan sólo una gama muy pequeña de puntos relacionados con los valores propios (eigenvalores) mínimos que es probable que sean un mal punto de partida para la reconstrucción. La estrategia para la elección de las semillas en las reconstrucciones de menor resolución en el espacio a escala consistió en escalar estos valores en proporción a la magnitud del escalado de reducción.
Puntos clave para la reconstrucción de la tractografía ventricular- •
Completitud de los datos: es indiscutible que el anillo basal es crucial para comprender plenamente la anatomía y la función del corazón. Sin embargo, en algunas publicaciones23–25 el volumen del miocardio se corta justo por debajo de la válvula mitral para evitar una tractografía con «ruido» en las cavidades auriculares. Dado que este plano de corte descarta el anillo basal, las reconstrucciones son demasiado incompletas para poder realizar una interpretación fiable de la arquitectura cardiaca.
- •
Orientación de campo vectorial de la DT-RM: la tractografía es una técnica heredada del estudio de fluidos, en la que la orientación de los campos vectoriales corresponde a las direcciones de flujo de los fluidos y, por lo tanto, las reconstrucciones no presentan ambigüedad alguna. Sin embargo, en el caso de las estructuras anatómicas, la orientación de los campos vectoriales de DT-RM no se corresponde con ninguna propiedad fisiológica. Para una reconstrucción tractográfica satisfactoria, deben reorientarse los campos vectoriales de la DT-RM. Los pocos abordajes existentes se basan en las propiedades locales del flujo o en modelos paramétricos del corazón. Por su propia naturaleza local, los abordajes locales24 podrían introducir fibras subóptimas que no concuerdan con la estructura general. Aunque los modelos paramétricos de los ventrículos26,27 proporcionan buena solución para resolver la orientación de las fibras, dada su complejidad, suelen estar limitados al ventrículo izquierdo. Proponemos una organización geométrica coherente con la anatomía macroscópica del corazón.
- •
Visualización: la visualización completa de los tractos de fibras debe comportar una asignación correcta de colores que aporte información sobre la orientación de las fibras miocárdicas. Con frecuencia, los mapas de colores se definen empleando un sistema de coordenadas general, lo cual podría comportar una representación errónea de la estructura general. Para codificar adecuadamente la estructura anatómica, debe considerarse el uso de mapas de colores basados en la información local.
- •
Interpretación de la arquitectura del corazón: las reconstrucciones tractográficas plenamente detalladas se adaptan perfectamente a las descripciones de bajo nivel, pero podrían fallar a un nivel de análisis superior, como resultado de su complejidad. Para obtener descripciones más detalladas de la estructura miocárdica general, nosotros proponemos un abordaje de multirresolución aplicado a algoritmos tractográficos estándares. Esto puede ser útil para generar visualizaciones más sencillas, lo que a su vez puede facilitar un mejor conocimiento de la arquitectura miocárdica detallada.
La tractografía cardiaca se interpreta como una reconstrucción formada por varias líneas de flujo28 (también denominadas trayectos de fibras en este campo). La propiedad principal que define claramente una línea de flujo es que es una curva tangencial al campo vectorial en cualquier punto de esa curva.
En este estudio, las tractografías estarán formadas por líneas de flujo calculadas en el campo vectorial de los vectores propios (eigenvectores) primarios en los volúmenes de tensor de difusión. Estas líneas de flujo se calcularon con un método de integración de quinto orden de Runge-Kutta-Fehlbert29 que permite aportar resultados satisfactorios empleando pasos de integración variables basados en una estimación del error.
- •
Completitud de los datos: para obtener reconstrucciones completas de la anatomía miocárdica, se consideraron los volúmenes de DT-RM completos, incluidos los de las cavidades auriculares y el anillo basal. El «ruido» en la reconstrucción de líneas de flujo tiene origen principalmente en el tejido auricular delgado, que introduce en la visualización un desorden significativo. Para minimizar este artefacto, nuestro método de determinación de las líneas de flujo detiene la integración con un error de reconstrucción estimado de Runge-Kutta grande.
- •
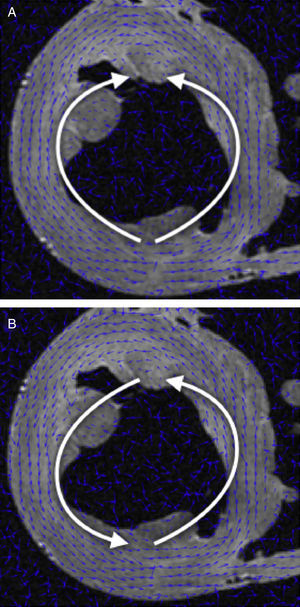
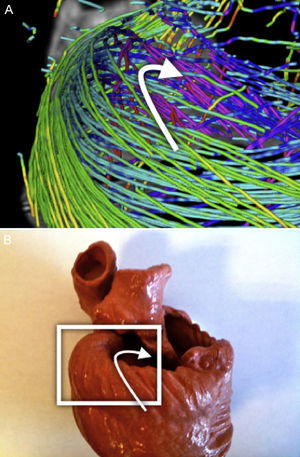
Orientación de campo vectorial de DT-RM: la tractografía es una representación gráfica derivada de la mecánica de fluidos, en la que tanto la dirección como la orientación de los campos vectoriales forman parte útil de la información representada. Sin embargo, en los datos de DT-RM los vectores pueden considerarse bidireccionales, ya que la difusión del agua representada por este vector propio (eigenvector) se produce en una dimensión pero lo hace en las dos orientaciones posibles al mismo tiempo. A veces la serie de datos tendrá una estructura casi organizada, pero también se puede obtener orientaciones opuestas (fig. 1A) en algunos puntos del campo vectorial que dificultan su reconstrucción.
- •
Se aplicó una reorganización geométrica del campo vectorial usando sistemas de coordenadas locales coherentes con la anatomía ventricular y la mecánica de fluidos. La anatomía ventricular puede describirse mediante un eje longitudinal y coordenadas angulares respecto a este eje en los cortes axiales. Para reorientar adecuadamente ambos ventrículos, nuestro eje longitudinal se situó a través del ventrículo izquierdo, cerca del tabique, lo cual garantizaba que no cruzara nunca una pared miocárdica. Para obtener un campo vectorial válido para las líneas de flujo, este eje debe definir un centro de rotación para cada corte axial. Así pues, en cada corte axial de la DT-RM reorganizamos las orientaciones de los vectores en forma de líneas de flujo (fig. 1B) alrededor del punto donde el eje de coordenadas tiene la intersección con el mismo corte axial. Esta aplicación permite una reorientación rápida, con lo que se evita toda suavización del campo vectorial.
- •
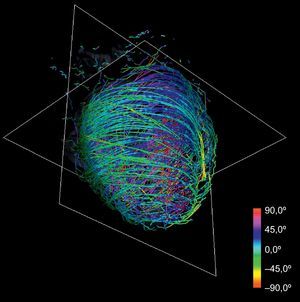
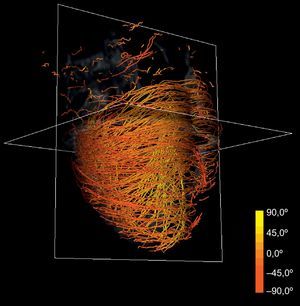
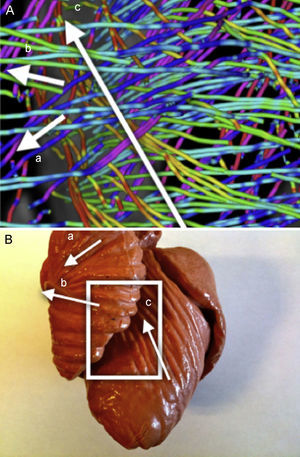
Asignación de colores a las fibras según la anatomía: la reorientación previa permite aplicar técnicas de asignación de colores basadas en las angulaciones axial y longitudinal de las fibras, lo que puede ser útil para la interpretación de los modelos tractográficos. Diferentes mapas de colores coherentes con esas direcciones permiten resaltar diferentes características de la arquitectura de las fibras, añadiendo una información útil acerca de las capas musculares existentes. Los mapas de colores ajustados según la angulación longitudinal aportan más información útil acerca de las capas musculares. En las figuras 2 y 3 se presentan dos imágenes diferentes del mapa de color longitudinal de las fibras reconstruidas.
La representación de una tractografía plenamente detallada ha sido la metodología moderna estándar utilizada para el examen del corazón. En este campo, los modelos tractográficos han alcanzado resultados interesantes, pero no han sido capaces de definir una descripción específica y ampliamente aceptada de la anatomía miocárdica.
Intuitivamente, cuando un observador intenta realizar un análisis macroscópico en el mundo real, puede apartarse unos metros del objeto del análisis y obtener una visión más contextualizada. Extrapolaremos esta conducta cotidiana para aplicarla a nuestro problema.
Para resolver esta cuestión en una representación gráfica de ordenador es habitual utilizar modelos multirresolución que intentan construir modelos diferentes de los mismos datos con diferentes niveles de detalle pero sin perder fidelidad. Esta técnica, que generalmente se aplica a los mapas de textura, se denomina mipmapping30, y se basa en la conocida representación de pirámide31. La técnica aplica un filtro gaussiano y luego una reducción exponencial a través de un submuestreo de la textura a escala completa. Las texturas reducidas son «resúmenes» de la textura original y se utilizan para representar esa textura a diferentes escalas. Estos «resúmenes» son estadísticamente completos, por lo que la suavización gaussiana mantiene la información contextual antes de aplicar la reducción de muestreo. El uso de estas imágenes desescaladas es frecuente también en otros campos como la visión por ordenador, en la que esta operación puede interpretarse como un cálculo en el espacio de escalas.
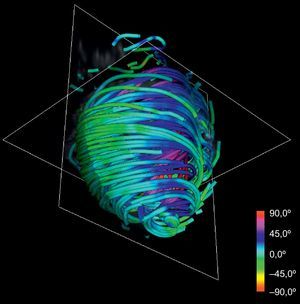
La técnica puede aplicarse al conjunto de datos de DT-RM para simplificar su complejidad. Con la reducción de escala en dos órdenes de magnitud respecto a la serie de datos original y aplicando nuestras líneas de flujo, se obtiene la tractografía simplificada que se muestra en la figura 4. En comparación con la tractografía a escala completa que se muestra en la figura 2, la simplificada mantiene las características geométricas de las fibras. En consecuencia, permite una identificación más fácil de las tendencias morfológicas generales.
RESULTADOSNuestro método de reconstrucción tractográfica simplificada (fig. 4) mantiene las principales características geométricas de las fibras, y ello permite una identificación más fácil de las tendencias generales. A su vez, esas tendencias muestran una estructura helicoidal continua manifiesta del miocardio ventricular. Intentamos comparar los resultados de la tractografía con la anatomía de BMVH descrita por Torrent-Guasp et al15.
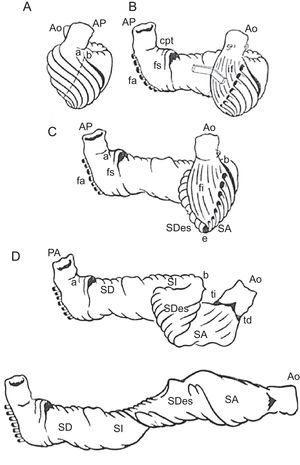
El modelo de BMVH describe una disposición longitudinal de las fibras miocárdicas ventriculares, formando una única banda muscular funcional (fig. 5) que empieza a la altura de la arteria pulmonar y termina a nivel de la aorta. Este músculo envuelve el ventrículo izquierdo y parte del ventrículo derecho (segmentos derecho e izquierdo), conectando con una estructura helicoidal que se inicia en el anillo basal y va hacia el interior del ventrículo izquierdo hacia el vértice cardiaco y regresa para conectar con la aorta (segmentos descendente y ascendente), envolviendo toda la anatomía del corazón.
Banda miocárdica ventricular. Presentación esquemática de la disección de la banda miocárdica ventricular. Ao: aorta; AP: arteria pulmonar; cpt: cuerda pulmonar-tricuspídea; fa: fibras aberrantes; fs: fibras septales derechas; fi: fibras intraseptales; SA: segmento ascendente; SD: segmento derecho; SDes: segmento descendente; SI: segmento izquierdo; td: trígono derecho; ti: trígono izquierdo.
Para comparar los resultados tractográficos con los del modelo de banda, se compararon paso a paso reconstrucciones tractográficas con los tractos de fibras miocárdicas mostrados en el modelo de caucho-silicona de Torrent-Guasp de la BMVH32 (figs. 6–9).
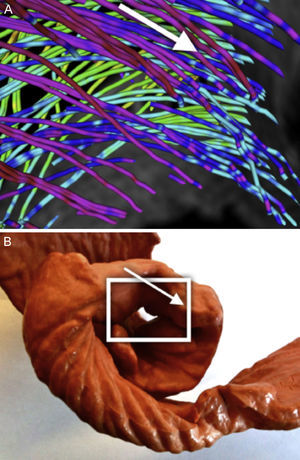
Se observa un patrón claro en el que los tractos reconstruidos en el epicardio están orientados hacia el anillo basal. Estos tractos forman un bucle en el anillo basal hacia el endocardio describiendo lo que parece un pliegue simple (fig. 6). Al seguir el trayecto por las líneas de flujo inferiores, estas líneas tienen una organización más horizontal, pero conservan una leve pendiente. Se puede observar que las líneas describen trayectorias envolventes alrededor del ventrículo izquierdo y que conectan con nuevos pliegues en el anillo basal (fig. 7).
Segmento izquierdoEl patrón previo se reproduce a lo largo del segmento izquierdo. Al final de este segmento, se observa que el pliegue mencionado termina en el punto donde las líneas de flujo entran en el endocardio (fig. 7).
Segmento descendenteEn la proyección anterior (fig. 8) podemos distinguir claramente una organización espiral descendente de la población de líneas de flujo del endocardio a través del tabique. Esta estructura continúa hacia el vértice cardiaco y la mayor parte de estas líneas de flujo continúan en el segmento derecho. Detrás de esta estructura endocárdica, se observa una estructura ascendente que se analiza en el apartado siguiente desde otro ángulo.
Segmento ascendenteEl análisis de este segmento es más complejo debido a la imagen agrupada de varios cruces de poblaciones de miocitos. Con un número de líneas de flujo inferior al de las capturas previas, en la figura 9 se muestran tres poblaciones en las que en esta zona las líneas de flujo procedentes del vértice cardiaco inician un ascenso apreciable (con una coloración de las líneas de flujo que va del verde al rojo [ver colores en la versión electrónica], lo cual indica aumento de la pendiente) debajo de las otras dos poblaciones que son el inicio del segmento derecho en su conexión con la arteria pulmonar.
Tractografía simplificadaAunque nuestros modelos simplificados aportan una interpretación más fácil de las tendencias generales, continúan siendo demasiado complejos para resumir estructuras complejas como la BMVH de Torrent-Guasp.
Para simplificar la estructura básica de la orientación espacial de las fibras miocárdicas, se exploró la geometría del corazón mediante el examen de los trayectos largos que pueden corresponder a regiones conectadas en la tractografía de DT-RM. El objetivo de este proceso es proporcionar una reconstrucción completa que permita la interpretación a primera vista por cualquier posible observador.
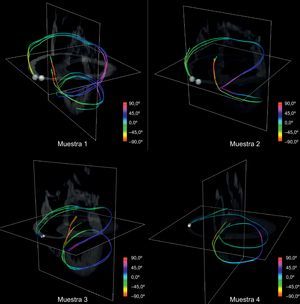
Tomando manualmente semillas a nivel basal, obtuvimos trayectos continuos que conectan ambos ventrículos y envuelven todo el miocardio. En la figura 10, se muestran cuatro tractos de modelos simplificados reconstruidos a partir de semillas tomadas manualmente situadas basales y cerca de la arteria pulmonar. Se observa que los tractos definen una estructura helicoidal coherente para el conjunto de la muestra y cada muestra canina.
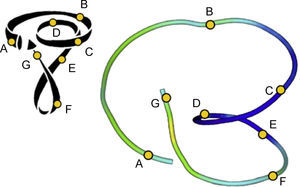
El uso de visualizaciones con tractos únicos modifica la forma en que se puede visualizar esta estructura. Se compararon estos tractos con la BMVH propuesta (fig. 11). Hay una clara semejanza entre el modelo esquemático de BMVH (fig. 11, izquierda) y los trayectos reconstruidos (fig. 11, derecha). En ambos modelos, los segmentos principales (indicados con las letras A–G) de la arquitectura helicoidal se identifican claramente.
Comparación entre el esquema de banda miocárdica ventricular helicoidal y una tractografía ventricular simplificada. El modelo de banda miocárdica ventricular helicoidal de Torrent-Guasp (izquierda) en comparación con un tracto reconstruido (derecha) a partir de una sola semilla obtenida manualmente en el volumen de las imágenes de resonancia magnética por tensor de difusión con los puntos clave de referencia para la comparación con el modelo.
Se presenta una interpretación objetiva de la arquitectura miocárdica a partir de las descripciones automatizadas de la DT-RM. Los resultados muestran la existencia de una conectividad inequívoca entre las fibras ventriculares, dispuestas de manera continua en una doble helicoide que conforma ambos ventrículos, arquitectura que reafirma la BMVH descrita por Torrent-Guasp en sus disecciones anatómicas. La representación gráfica de los resultados muestra unos tractos independientes, generados de forma automática, que conectan las fibras miocárdicas de manera continua a lo largo de toda la malla, con inicio en la arteria pulmonar y final en la aorta.
La técnica de DT-RM proporciona una información fiel y detallada del tejido miocárdico. Sin embargo, la interpretación de estos datos para validar la arquitectura cardiaca es indirecta. Las técnicas existentes reconstruyen la anatomía miocárdica ventricular completa utilizando puntos de referencia visuales. Desde que se propuso y se utilizó por primera vez la tractografía para el estudio de la estructura cardiaca23,33, esta técnica ha sido la más comúnmente utilizada para obtener información de la DT-RM. Se han explorado también otras técnicas, como las descritas por Frindel et al25, basadas en la optimización de modelos gráficos, que es prometedora para futuros desarrollos.
Hay muchos factores que se debe tener en cuenta para obtener reconstrucciones e interpretaciones ampliamente aceptables. En consecuencia, la mayoría de los enfoques existentes23–26,34,35 no aportan evidencia suficiente y ampliamente aceptada por toda la comunidad científica para respaldar o refutar determinado modelo de arquitectura. En lo único que hay acuerdo es en la existencia de una estructura en capas del miocardio a través de representaciones tractográficas y mejoras de la visualización mediante codificación con colores. De entre estos trabajos, resaltamos el de Helm et al26, puesto que, dado su nivel de detalle, se ha comentado ampliamente en la literatura, con interpretaciones opuestas. Este desacuerdo es consecuencia directa de una reconstrucción parcial de la anatomía de las fibras cardiacas.
Para resolver tales discrepancias, se utilizaron todos los datos de DT-RM sin segmentación, para evitar la instrumentalización del estudio, y demostramos que es posible reconstruir todo el miocardio, incluidas algunas estructuras complejas como el bucle basal, que lamentablemente queda oculto o se malinterpreta en otros estudios. También fue necesario definir un método que garantizara un uso correcto de las técnicas de líneas de flujo a las peculiaridades de los campos vectoriales de la DT-RM.
La validación de la corrección de las estructuras locales no basta para ampliar la interpretación a una vista general. Para abordar interpretaciones de nivel superior de la organización arquitectónica del corazón, se buscaron también representaciones de nivel más alto que facilitaran su interpretación y su validación. Hemos desarrollado un método de multirresolución para la tractografía que usa reducción del muestreo de los volúmenes de DT-RM para mostrar las características generales de la estructura del corazón. Este trabajo incluye también técnicas para colorear aplicadas a nuestra solución para facilitar la interpretación de los modelos tractográficos tridimensionales.
Para los estudios que requieren un análisis Q-ball, es imprescindible el uso de no menos de 60 direcciones por vóxel. Sin embargo, los tensores de las técnicas de imagen de tensor de difusión (DTI) solo aportan una descripción del promedio de la difusión del agua, por lo que un número elevado de direcciones de difusión no mejora de manera significativa su calidad. En consecuencia, los estudios cardiacos de DTI existentes (como los datos de la Johns Hopkins University ampliamente utilizados36) para el análisis de DTI suelen limitar los valores entre 12 y 32 direcciones37 para alcanzar un compromiso adecuado entre tiempo de adquisición y calidad. Además, un estudio reciente ha indicado que el vector propio (eigenvector) primario de la DTI se mantiene sin variar dentro de una gran diversidad de parámetros del dispositivo de adquisición y, en particular, para un número bajo de direcciones de difusión38. Nuestra propia investigación indica que la preparación del corazón y la resolución espacial del volumen, en realidad, son de los factores con mayor influencia en la calidad de la DTI. El campo de visión de adquisición debe ajustarse cuidadosamente para que encaje exactamente en el volumen miocárdico, que debe estar en suspensión dentro de un recipiente para evitar distorsiones de la difusión cerca de los límites del miocardio.
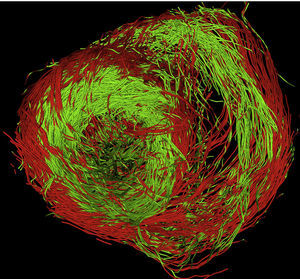
Actualmente estamos adquiriendo nuestro propio conjunto de datos en corazones de cerdo mediante un equipo de RM Philips de 3 T con 32 gradientes, con una resolución de volumen de 1,38×1,38×1,5μm (144×144×60vóxeles) que abarca una región de interés de 70×70píxeles, correspondiente a una sección del eje corto ventricular. En la figura 12 (ver colores en la versión electrónica) se muestra una reconstrucción tractográfica con resolución completa de las fibras musculares, obtenida con nuestro programa informático. Los colores indican el signo de componente z de las fibras (rojo para positivo y verde para negativo) y, por lo tanto, su orientación. El bucle de fibras de transición del epicardio al endocardio se observa claramente en el segmento lateral izquierdo de la base del ventrículo izquierdo. La calidad de los resultados obtenidos evidencia la elevada resolución de los estudios realizados mediante DT-RM.
CONCLUSIONESEl análisis objetivo de la arquitectura del miocardio con un método automático que incluye la totalidad del miocardio y usando varios niveles tridimensionales de complejidad revela una disposición helicoidal y continua de las fibras miocárdicas en ambos ventrículos, hecho que respalda las descripciones anatómicas de F. Torrent-Guasp.
FINANCIACIÓNEstudio parcialmente financiado por las ayudas TIN2009-13618 y TIN2012-33116.
CONFLICTO DE INTERESESNinguno.
Damos las gracias a los Dres. Patrick A. Helm y Raimond L. Winslow del Center for Cardiovascular Bioinformatics and Modeling y al Dr. Elliot McVeigh del National Institute of Health por proporcionarnos los conjuntos de datos de DT-RM.