Palabras clave
INTRODUCCIÓN
En los últimos años es creciente la evidencia científica que avala el papel de la inflamación en el desarrollo de la ateroesclerosis y en la patogenia de la trombosis coronaria1-4. Estudios recientes muestran que la elevación de ciertos marcadores inflamatorios se asocian con un mayor número de complicaciones cardiovasculares y muerte, tanto a corto como a largo plazo, en el contexto de un síndrome coronario agudo (SCA)5-10; sin embargo, la accesibilidad a la mayoría de estos marcadores no es universal, su coste es elevado y su obtención no suele ser inmediata. Por ello, su utilidad en la práctica clínica habitual es limitada.
Diversas publicaciones muestran que un recuento recuento leucocitario (RL) elevado se asocia con una mayor incidencia de enfermedades cardiovasculares y mortalidad global en la población general11-17. Trabajos recientes avalan el valor pronóstico del RL como predictor de desarrollo de insuficiencia cardíaca y mortalidad a corto y largo plazo tras un SCA18-27, y particularmente tras un infarto agudo de miocardio (IAM)18-25,27. Sin embargo, los datos disponibles en la bibliografía científica al respecto en población no seleccionada, con un seguimiento a largo plazo y utilizando la nueva definición de IAM son mucho más limitados28.
El objetivo de este trabajo fue determinar el grado de asociación entre el RL determinado en el momento del ingreso y la mortalidad global a largo plazo en pacientes con IAM sin elevación del segmento ST (IAMSEST) y con elevación del segmento ST (IAMEST).
PACIENTES Y MÉTODO
Grupo de estudio y protocolo de actuación
Se analizó de forma prospectiva a 1.118 pacientes que fueron ingresados consecutivamente del 1 de noviembre de 2000 al 28 de febrero de 2003 en nuestro centro hospitalario con el diagnóstico de IAM. Los pacientes fueron estratificados de acuerdo con los cambios documentados en el segmento ST del electrocardiograma presentes en el momento del ingreso: 569 pacientes con IAMSEST y 549 pacientes con IAMEST. Sobre la base de esta estratificación se delinearon las pautas terapéuticas. Los criterios de inclusión fueron los del Colegio Americano de Cardiología y la Asociación Americana del Corazón29. Para el IAMEST, como criterio enzimático indicador de necrosis se aceptó una elevación de los marcadores de necrosis miocárdica (troponina I > 1 ng/ml); los criterios electrocardiográficos fueron definidos como nueva elevación del segmento ST en el punto J de por lo menos 0,2 mV en V1, V2 y V3 y 0,1 mV en el resto de las derivaciones y en, al menos, 2 derivaciones contiguas ocurridas durante las primeras 24 h del inicio de los síntomas. También se incluyó a los pacientes con nueva elevación del segmento ST en el electrocardiograma de presentación asociada con un episodio reciente de dolor torácico y en los que, debido a una muerte precoz, no fue posible obtener determinaciones de marcadores de necrosis miocárdica o, si fueron obtenidos, no alcanzaron los valores indicativos de necrosis miocárdica30. Se definió el IAMSEST cuando se producía una elevación de marcadores de necrosis miocárdica (ya descritos para el IAMEST) y una de las siguientes circunstancias: síntomas isquémicos o alteraciones del segmento ST (excepto el ascenso persistente del segmento ST). La estrategia de tratamiento para cada tipo de IAM fue acorde con lo establecido por las guías de actuación nacionales e internacionales en cada momento29,31. La indicación de estudio invasivo y revascularización se dejó en manos del cardiólogo responsable. Cabe destacar que ninguno de estos pacientes había sido trasladado de otros centros por su mala evolución clínica. Se excluyó del trabajo a todos los pacientes con enfermedad infecciosa, inflamatoria sistémica o hematológica evidente en el momento del ingreso.
Variables incluidas en el estudio
Las variables analizadas en ambos tipos de IAM se obtuvieron en el momento del ingreso y durante las primeras 24 h del ingreso hospitalario.
Se registraron las variables edad, sexo, hipertensión arterial, tabaquismo, dislipemia, diabetes mellitus, antecedentes familiares y personales de cardiopatía isquémica, revascularización percutánea y quirúrgica; presión arterial sistólica y grado Killip en el momento del ingreso; desviación del segmento ST (> 1 mm en al menos 2 derivaciones contiguas) y número de derivaciones implicadas; creatinina sérica (mg/dl) y RL (10 x 103 células/ml). En el IAMSEST se determinó la concentración máxima de troponina I (ng/ml) y en el IAMEST, además, la frecuencia cardíaca, el bloqueo de rama izquierda de nueva aparición, los episodios de taquicardia ventricular sostenida/fibrilación ventricular las primeras 24 h, localización del IAM, trombólisis y criterios electrocardiográficos de reperfusión (descenso del segmento ST al menos un 50% a los 90 min tras la trombólisis).
Definición de eventos y seguimiento
Se definió como evento la aparición de muerte de cualquier origen durante la evolución con un seguimiento máximo de 2 años en la población superviviente (mediana en la población total de 10 ± 2 meses). El seguimiento se realizó en las consultas externas de nuestro centro hospitalario o mediante contacto telefónico por el personal médico de la institución.
Análisis estadístico
El RL obtenido en el momento del ingreso del paciente fue categorizado en las siguientes 3 categorías (10 x 103 células/ml): RL1 < 10, RL2 = 10-14,9 y RL3 > 15. Los puntos de corte fueron escogidos según trabajos previos18-20,25.
Las variables cuantitativas se expresaron como media ± desviación estándar (DE) y se compararon entre las 3 categorías del RL mediante ANOVA; en ausencia de distribución gaussiana, las variables cuantitativas se expresaron como mediana (rango intercuartílico) y para su comparación se utilizó el procedimiento de Kruskal-Wallis. Las variables cualitativas se expresaron como porcentajes y se compararon mediante el test de la χ². La mortalidad acumulada en cada categoría del RL se presentó mediante las curvas de Kaplan-Meier y sus diferencias se contrastaron mediante el test Peto-Peto-Prentice. El modelo de regresión de riesgos proporcionales de Cox fue utilizado para los análisis multivariables. Los modelos multivariables fueron construidos con variables obtenidas de manera sistemática en todos los pacientes durante las primeras 24 h de ingreso, e independientemente para cada tipo de infarto. Se incluyeron las variables de reconocido valor pronóstico en la bibliografía médica y con independencia de su significación estadística; las variables que no fueron consideradas según el criterio anterior se incluyeron sólo si, en el análisis bivariable, esa variable hubiese presentado una p < 0,20. Una vez establecidos los modelos iniciales se procedió a su simplificación mediante la estrategia de exclusión secuencial stepdown. El supuesto de proporcionalidad del riesgo fue evaluado mediante el análisis de los «residuos de Schoenfeld» y la forma funcional de las variables cuantitativas (relación log-lineal) fue determinada mediante «polinomiales fraccionados»32. El poder discriminativo de los modelos ajustados fue evaluado mediante el índice C de Harrell para datos censurados. Los coeficientes estimados fueron expresados como hazard ratio (HR), con sus respectivos intervalos de confianza del 95% (IC del 95%). En todos los casos se consideraron significativos los valores de p < 0,05. Para el análisis estadístico se utilizó el paquete estadístico STATA 8.2.
RESULTADOS
Características basales del grupo de estudio
EL RL en nuestra población tuvo un rango desde 3,1 x 103 a 35 x 103 células/ml. La mediana en toda la población fue de 9.800 células/ml, con un rango intercuartílico de 7,8-12,5 x 103 células/ml. Las características clínicas y demográficas basales se estratificaron en función de las categorías preestablecidas del RL y para cada tipo de IAM por separado (tablas 1 y 2).
IAMSEST
La distribución de la población que se iba a estudiar entre las categorías contempladas del RL fueron: RL1 = 358 (62,9%), RL2 = 176 (30,9%) y RL3 = 35 (6,2%). La edad media de estos pacientes fue 70 ± 12,1 años y el 65% fueron varones. La proporción de diabetes mellitus, grado Killip > 2 y troponina I > 1 ng/ml aumentó monotónicamente desde la categoría inferior hasta la superior del RL, mientras que la relación fue inversamente proporcional en el porcentaje de varones. No se observaron otras diferencias significativas en otras variables de estudio (tabla 1).
IAMEST
La distribución entre las categorías contempladas del RL fue RL1 = 228 (41,5%), RL2 = 239 (43,5%), RL3 = 82 (14,9%) para este tipo de IAM. La edad media de estos pacientes fue de 65 ± 13 años y el 72,9% fueron varones. En este tipo de IAM, la proporción de fumadores activos, el grado Killip > 2 en el momento del ingreso, la frecuencia cardíaca > 100 lat/min, la presión arterial sistólica < 100 mmHg, la presencia de algún episodio de taquicardia ventricular sostenida/fibrilación ventricular durante las primeras 24 h, el número de derivaciones con elevación del segmento ST y la aparición de nuevas ondas Q aumentaron de manera proporcional desde la categoría RL1 a la RL3, mientras que esta relación fue inversamente proporcional en los > 65 años, los que tenían antecedentes de cardiopatía isquémica y en los sujetos con criterios electrocardiográficos de reperfusión (tabla 2).
Recuento leucocitario y mortalidad global
Durante el seguimiento se registraron 214 fallecimientos (19,1%): 105 (18,5%) en pacientes con IAMSEST y 109 (19,9%) en pacientes con IAMEST.
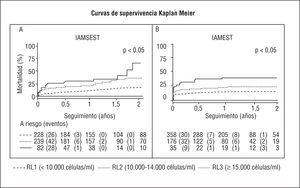
En el análisis bivariable se observa que la mortalidad a corto (tablas 1 y 2) y a largo plazo aumenta proporcionalmente en las categorías preestablecidas del RL para ambos tipos de IAM (tabla 3 y 4). En las curvas de Kaplan-Meier se puede identificar que las curvas de mortalidad para las categorías contempladas del RL se separan desde los primeros momentos, especialmente en los pacientes con IAMEST (fig. 1B), y que estas diferencias persisten o incluso se incrementan durante la evolución (fig. 1 A y B) para ambos tipos de IAM.
Fig. 1. Diferencias significativas en las proporciones de mortalidad global entre las categorías del recuento leucocitario por el método de Kaplan-Meier, para el IAMSEST (A) y para el IAMEST (B). RL: recuento leucocitario; IAMEST: infarto agudo de miocardio sin elevación del segmento ST; IAMSEST: infarto agudo con elevación del segmento ST.
IAMSEST
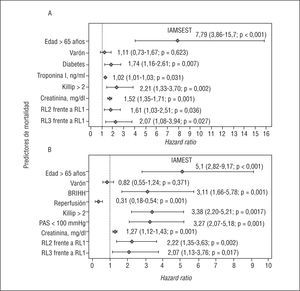
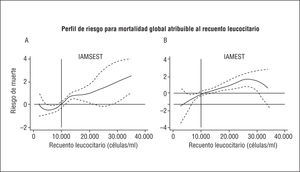
En el análisis multivariable final sobre los pacientes con este tipo de IAM, tras incluir en el estudio únicamente covariables obtenidas en las primeras 24 h del inicio de los síntomas (fig. 2A), se observa que los pacientes incluidos en la categoría RL2 y RL3 tienen un riesgo de mortalidad a largo plazo 1,61 (1,03-2,51; p = 0,036) y 2,07 (1,08-3,94; p = 0,027) veces superior, respectivamente, al de los pacientes con un RL1, como se detalla en la figura 2A. En el análisis de la forma funcional de la variable (polinomiales fraccionados) destaca que el riesgo de mortalidad atribuible al RL empieza a partir de 10 x 103 células/ml y se incrementa de manera lineal a partir de esta cifra (fig. 3A). El índice C del modelo multivariable para este tipo de IAM fue de 0,80.
Fig. 2. Predictores de mortalidad global. Análisis multivariable para el IAMSEST (A) para el IAMEST (B). RL1: recuento leucocitario < 10 x 103 células/ml; RL2: recuento leucocitario 10-14,9 x 103 células/ml; RL3: recuento leucocitario > 15 x 103 células/ml; IAMEST: infarto agudo de miocardio sin elevación del segmento ST; IAMSEST: infarto agudo con elevación del segmento ST.
IAMEST
En el modelo multivariable final sobre la totalidad de la muestra destaca que los individuos incluidos en las categorías RL2 y RL3 tuvieron un riesgo de mortalidad ajustado 2,22 (1,35-3,63; p = 0,002) y 2,07 (1,13-3,76; p = 0,017) veces superior que los pacientes en la categoría RL1 (fig. 2A). En el análisis de la forma funcional de la variable observamos que el riesgo de mortalidad atribuible al RL empieza a partir de una cifra ligeramente > 10 x 103 células/ml; sin embargo, en el examen visual de la figura 3B se observa que esta pendiente de riesgo presenta un discreto aplanamiento a partir de esta cifra. El índice C del modelo en estos casos fue de 0,85.
Fig. 3. Perfil de riesgo de mortalidad global a largo plazo atribuible al recuento leucocitario en el IAMSEST (A) y en el IAMEST (B). Perfil de riesgo ajustado por edad, sexo, diabetes mellitus, concentraciones máximas de troponina I, clase Killip > 2 y creatinina sérica para el IAMSEST. Perfil de riesgo ajustado por edad, sexo, bloqueo de rama izquierda del haz de His complicado, criterios electrocardiográficos de reperfusión, clase Killip > 2, presión arterial sistólica < 100 mmHg y creatinina sérica para el IAMEST. IAMEST: infarto agudo de miocardio sin elevación del segmento ST; IAMSEST: infarto agudo con elevación del segmento ST.
DISCUSIÓN
Desde una perspectiva encuadrada en una estratificación temprana de riesgo, este trabajo muestra cómo el RL determinado en las primeras horas de un IAM es un predictor independiente de otras variables de reconocido valor pronóstico para predecir mortalidad a largo plazo en ambos tipos de IAM.
En la bibliografía se dispone de creciente información que avala el poder pronóstico de los marcadores inflamatorios en el amplio espectro clínico de la enfermedad aterosclerótica: desde su papel en la patogenia de la placa hasta su importancia como cuantificadores de la respuesta inflamatoria en el seno de un IAM1-10.
El RL basal se asocia con aumento en la incidencia de cardiopatía isquémica y mortalidad en la población general en amplios estudios epidemiológicos11-17, y el potencial poder pronóstico atribuible al RL determinado en fase aguda de un IAM para predecir complicaciones posteriores a éste es un tema de interés científico actual. En este sentido, en trabaj os recientes se respalda la asociación entre un RL elevado y un mayor número de complicaciones tras un IAM, particularmente una mayor incidencia de desarrollo de insuficiencia cardíaca y mortalidad a corto y largo plazo18-28.
Se han propuesto numerosos mecanismos en un intento de explicar esta asociación: resistencia a la terapia trombolítica por alteración en la microcirculación33, estado hipercoagulable34, no reflujo mediado por leucocitos35, cardiotoxicidad indirecta mediada por citocinas proinflamatorias36, promotores de la lesión por isquemia/reperfusión37 y mayor extensión del IAM. Con respecto a este último punto hay que destacar que la respuesta leucocitaria que ocurre tras un IAM es un componente central de la respuesta inflamatoria-reparativa que se pone en marcha para reemplazar el tejido necrótico por tejido cicatrizal. Esto llevaría a especular que a mayor grado de necrosis mayor respuesta leucocitaria. Esta aseveración se basa en estudios experimentales que muestran una relación directa entre la extensión de la necrosis y el grado de leucocitosis, tanto sistémica como local38,39. Además, la depleción de neutrófilos en modelos animales a los que se les realiza una oclusión coronaria ha resultado en disminuciones significativas en el tamaño del infarto y en la magnitud de la lesión por reperfusión40,41. En el ámbito clínico, la extensión del IAM es de alguna manera estimada mediante parámetros indirectos, de esta manera son diversas las publicaciones que relacionan el valor del RL con variables asociadas con el tamaño del IAM: como el desarrollo de insuficiencia cardíaca18,20,23,26,27, correlaciones significativas con el pico de isoenzima MB de la creatincinasa (CK-MB)18-19 o con la fracción de eyección del ventrículo izquierdo21. En nuestra muestra se observó un incremento monotónico entre las categorías del RL y la variable Killip > 2 y PAS < 100 mmHg en ambos tipos de IAM, de manera particular en el IAMEST, hecho que de manera indirecta respalda la asociación entre el RL y la extensión del IAM. En el análisis de la forma funcional del RL dentro de cada modelo multivariable destacan: a) el nivel del RL donde empieza incrementarse el riesgo se centra en los 2 tipos de IAM en una cifra cercana a 10 x 103 células/ml, lo que sugiere que es un punto al menos contemplable para la categorización, y b) la pendiente de riesgo en el IAMEST es menor que en el IAMSEST (fig. 3), lo que podría explicarse por el mayor impacto pronóstico de variables de perfil hemodinámico en el IAMEST (clase Killip y PAS) en comparación con el IAMSEST, como se puede apreciar en los análisis multivariables para cada tipo de IAM (tablas 3 y 4). Este hecho sugiere la presencia de cierto grado de colinealidad entre el RL y las variables relacionadas con la extensión del infarto, sobre todo en el IAMEST. Esta asociación es menor en el IAMSEST, lo que sugiere que el RL en estos pacientes podría estar relacionado con el RL basal y, así, ser un indicador válido del «grado de inflamación sistémica».
No obstante, en nuestra muestra, a pesar de ajustar por las covariables relacionadas con el tamaño del IAM, el RL se muestra como una variable predictora independiente de mortalidad a largo plazo, hecho que sugiere cierta evidencia indirecta del papel independiente que desempeña el RL en la patogenia de las complicaciones post-IAM.
Entendemos que, a la vista de nuestros resultados, el RL es una herramienta bioquímica de gran interés en la estratificación de riesgo en los pacientes con ambos tipos de IAM, destacando a su favor las siguientes características logísticas:
1. Su determinación en el IAM es sistemática: los protocolos de actuación y las guías de actuación clínica vigentes recomiendan la realización de un hemograma básico ante un dolor torácico de perfil coronario.
2. Se encuentra ampliamente disponible.
3. Se obtiene de manera precoz: la determinación del RL en un paciente con IAM se produce las primeras horas y en cualquier área de urgencias, a diferencia de otros marcadores inflamatorios que necesitan de reactivos no usualmente disponibles en un laboratorio de urgencias.
4. Su coste económico es reducido y, dado que es una determinación sistemática, no supone un coste añadido a los procedimientos actuales.
Limitaciones
Limitaciones inherentes al diseño del estudio fueron: a) las propias de todo estudio observacional debido a la dificultad para incluir variables de valor pronóstico desconocidas o no recogidas en nuestro registro; b) en ausencia del recuento diferencial de los leucocitos en el momento del ingreso, no se puede determinar si el valor pronóstico del RL depende de alguno de sus componentes (como los neutrófilos), y c) la inclusión de variables accesibles en las primeras 24 horas de la hospitalización del paciente impide el ajuste por otras variables de reconocido valor pronóstico que usualmente se obtienen durante el curso de la hospitalización, como la fracción de eyección del ventrículo izquierdo.
CONCLUSIONES
El RL determinado en el momento del ingreso en pacientes con IAMSEST e IAMEST demostró estar asociado con la mortalidad a largo plazo, de forma independiente de otras variables de reconocido valor pronóstico; por ello, consideramos que es una herramienta biológica útil y ampliamente disponible para discriminar a los pacientes con mayor riesgo de mortalidad.
Véase editorial en págs. 615-7
Este trabajo ha sido financiado mediante una beca RECAVA-FIS.
Correspondencia: Dr. J. Núñez Villota.
Servei de Cardiologia. Hospital Clínic Universitari.
Avda. Blasco Ibáñez, 17. 46010 Valencia. España.
Correo electrónico: yulnunez@gmail.com