Se ha sugerido que las concentraciones urinarias de la porción aminoterminal del pro-péptido natriurético tipo B (NT-proBNP) pueden tener valor pronóstico en pacientes con insuficiencia cardiaca estable, pero hasta ahora no se ha realizado una comparación directa con las concentraciones plasmáticas de este marcador en pacientes con una insuficiencia cardiaca aguda descompensada (ICAD). El objetivo de este estudio fue comparar el valor pronóstico de la concentración plasmática de NT-proBNP con el de la concentración urinaria de este marcador en la estratificación del riesgo de los pacientes con ICAD.
MétodosSe estudió prospectivamente a pacientes consecutivos hospitalizados con ICAD. A la llegada al hospital, se obtuvieron simultáneamente muestras de sangre y orina, para determinar las concentraciones de NT-proBNP. Se realizó un seguimiento clínico, y se registraron la mortalidad y la hospitalización por insuficiencia cardiaca.
ResultadosSe incluyó un total de 138 pacientes (mediana de edad, 74 años [rango intercuartiles, 67-80]; 54 varones). Durante una mediana de seguimiento de 387 días [rango intercuartiles, 161-559], 65 pacientes (47%) presentaron eventos clínicos adversos. La concentración plasmática de NT-proBNP fue más alta en los pacientes que presentaron eventos clínicos adversos (4.561 pg/ml [2.191-8.631] frente a 2.906 pg/ml [1.643-5.823]; p=0,03), mientras que la concentración urinaria de NT-proBNP fue similar en ambos grupos (p=0,62). En los análisis de regresión de Cox multivariable, la concentración plasmática de NT-proBNP se asoció a un mayor riesgo de eventos clínicos adversos, tanto como variable continua (por 100 pg/ml; razón de riesgos [HR]=1,004; intervalo de confianza [IC] del 95%, 1,001-1,007; p=0,003) o categórica (≥3.345 pg/ml; HR; IC del 95%, 1,41-3,93; p=0,001). En cambio, la concentración urinaria de NT-proBNP no se asoció a una evolución clínica adversa.
ConclusionesLa concentración plasmática de NT-proBNP es superior a la concentración urinaria de este marcador en la predicción de los resultados clínicos adversos en pacientes con ICAD.
Palabras clave
Una posible estrategia para mejorar el tratamiento de los pacientes con una insuficiencia cardiaca aguda descompensada (ICAD) es la que se basa en el empleo de biomarcadores para mejorar la valoración diagnóstica y pronóstica de estos pacientes, y que en conjunto puede ayudar en la toma de decisiones terapéuticas por parte del clínico. De entre los biomarcadores cardiacos, la determinación plasmática del péptido natriurético tipo B y del fragmento aminoterminal de la proteína precursora (NT-proBNP) en el plasma han mostrado ser especialmente útiles para establecer el diagnóstico de ICAD, y son capaces de aportar una información pronóstica valiosa en los pacientes que acuden a servicios de urgencias hospitalarios por disnea aguda. Además, el uso de estos péptidos puede ser útil para la selección de los pacientes según su gravedad y para la asistencia intrahospitalaria de los pacientes con ICAD1, 2, 3, 4, 5, 6.
Estudios recientes han mostrado que la determinación de la concentración de péptidos natriuréticos en orina puede ser útil en la predicción de eventos clínicos adversos en pacientes con insuficiencia cardiaca (IC)7, 8. Sin embargo, estos estudios han examinado predominantemente a pacientes ambulatorios con IC crónica y hasta el momento no se han realizado comparaciones con determinaciones plasmáticas en pacientes con ICAD. En consecuencia, la aplicabilidad de la utilidad pronóstica de las concentraciones urinarias de NT-proBNP a pacientes con ICAD continúa sin estar clara. Por consiguiente, en el presente estudio hemos evaluado el valor pronóstico de las determinaciones de NT-proBNP en orina, y lo hemos comparado con el de las concentraciones plasmáticas de NT-proBNP en la estratificación del riesgo de una población hospitalizada por ICAD.
MétodosPoblación de estudio y protocoloLa población de estudio la formaron pacientes con ICAD de un estudio prospectivo anteriormente publicado9. Entre septiembre de 2006 y febrero de 2008 incluimos prospectivamente en el estudio a 138 pacientes ingresados de forma consecutiva con un diagnóstico inicial de ICAD (diagnosticada clínicamente aplicando las guías actuales10) en el Servicio de Cardiología del Hospital Universitario Virgen de la Arrixaca (Murcia, España). Se obtuvieron simultáneamente muestras de sangre y orina de todos los pacientes, a su llegada al servicio de urgencias.
Se registraron prospectivamente las características clínicas basales y los eventos clínicos aparecidos en el hospital. Se realizó también una ecocardiografía en todos los pacientes antes del alta hospitalaria. Se determinó la fracción de eyección ventricular izquierda (FEVI) utilizando el método biplanar de Simpson. Todos los pacientes recibieron un tratamiento estándar según lo recomendado por las guías existentes en ese momento10. Durante todo el periodo de hospitalización, las decisiones de tratamiento clínico de cada paciente fueron tomadas por el cardiólogo encargado, que no conocía las concentraciones de NT-proBNP del paciente.
Análisis bioquímicoSe obtuvieron simultáneamente muestras de sangre y orina de todos los pacientes a su llegada al servicio de urgencias. Tras la centrifugación a 1.300 rpm y 4°C durante 10 min, se separaron las muestras de orina y plasma y se conservaron en criotubos a –80°C hasta el momento de realizar las determinaciones. Antes del análisis, las muestras de orina se centrifugaron a 13.200 rpm a 4°C durante 30 min, para evitar posibles interferencias en la determinación del NT-proBNP producidas por la precipitación de sales en la orina. Las concentraciones plasmáticas y urinarias de NT-proBNP se determinaron con un inmunoensayo de electroquimioluminiscencia a través del analizador Modular Analytics E170 (Roche Diagnostics GmbH, Mannheim, Alemania). El coeficiente de variación intraensayo para el NT-proBNP fue del 1,8% para 221 pg/ml y del 3,1% para 4.250 pg/ml. Con objeto de tener en cuenta posibles diferencias en las concentraciones urinarias de NT-proBNP, introdujimos también una corrección según las concentraciones urinarias de creatinina (nanogramos por miligramo de creatinina urinaria). Se calculó la filtración glomerular estimada (FGe) con la versión abreviada de la fórmula Modification of Diet in Renal Disease (ml/min/1,73 m2, 186,3×[creatinina plasmática] – 1,154×[edad] – 0,203) (el factor de corrección para las mujeres fue×0,742)11.
Seguimiento y variable de valoración clínicaSe realizó un seguimiento clínico de los pacientes durante una mediana de 387 días [rango intercuartiles (RIC), 161-559], y se tomó una fecha final común para todos los casos como criterio para la finalización del estudio. Es importante señalar que, al final del seguimiento, se registró en todos los pacientes la aparición de eventos clínicos adversos. Los eventos del estudio se definieron como la combinación de la mortalidad y/o los reingresos por IC. Las muertes se determinaron a partir de las historias clínicas disponibles y los certificados de defunción. Si la historia clínica hospitalaria era ambigua o no se disponía de ella, se consultaron los registros de defunciones nacionales. En los pacientes que requirieron hospitalización, se revisaron cuidadosamente las historias clínicas para caracterizar mejor la causa de la hospitalización. El estudio fue aprobado por el comité ético local y se obtuvo el consentimiento informado de cada paciente en el momento de la inclusión en el estudio.
Análisis estadísticoSe evaluó la distribución normal de las variables continuas con la prueba de Kolmogorov-Smirnov. Los datos con una distribución normal se presentan mediante la media±desviación estándar y los datos de distribución no normal en forma de mediana [RIC]. Las variables categóricas se expresan mediante porcentajes. Los análisis categorizados se llevaron a cabo comparando a los pacientes que presentaron eventos clínicos adversos con los que no los sufrieron durante el periodo de seguimiento. Las diferencias de las características basales se compararon con la prueba de t de Student o la prueba de la U de Mann-Whitney por lo que respecta a las variables continuas y mediante la prueba de χ2 para las variables categóricas. La relación entre cada biomarcador y otros parámetros se evaluó con la correlación de rango de Spearman. Se realizaron análisis de regresión lineal múltiple para evaluar el efecto independiente que tenían las variables clínicas sobre las concentraciones urinarias de NT-proBNP. Los modelos multivariables se ajustaron a través de un algoritmo de selección escalonada con el empleo de las siguientes variables: edad, índice de masa corporal, presión arterial sistólica, clase funcional III-IV de la New York Heart Association, FEVI, fibrilación/flutter auricular, tratamiento actual con antagonistas de aldosterona al ingreso en el hospital, antecedentes previos de infarto agudo de miocardio con elevación del ST, FGe, albúmina, troponina T, proteína C reactiva y NT-proBNP plasmático. Dado que las concentraciones urinarias y plasmáticas de NT-proBNP no tenían una distribución normal, para los análisis de regresión lineal se utilizaron transformaciones con logaritmos naturales; y no se detectó multicolinealidad en ninguno de los modelos utilizados. El valor pronóstico de la concentración plasmática de NT-proBNP y el de la concentración urinaria se evaluaron como variables continuas y categóricas (por encima y por debajo de la mediana de concentraciones). Calculamos las razones de riesgos (HR) derivadas del análisis de regresión de Cox para identificar los factores que predecían la aparición de eventos clínicos adversos durante el seguimiento. El efecto independiente que tenían las variables sobre el pronóstico se calculó con un análisis de regresión multivariable de Cox, en el que se incorporaron las covariables con valores de p<0,1 en el análisis univariable. Se evaluó el supuesto de linealidad con el empleo de los residuos de Martingale. Se utilizaron gráficos de riesgos log-acumulativos, covariables dependientes del tiempo y residuos de Schoenfeld para evaluar la adherencia a los supuestos de riesgos proporcionales del modelo de Cox. La capacidad predictiva del modelo final se cuantificó con el índice C. Se evaluó la capacidad predictiva añadida por el NT-proBNP urinario al NT-proBNP plasmático con el cálculo de la mejora de discriminación integrada (IDI por integrated discrimination improvement), según lo descrito por Pencina et al.12. El índice C y la IDI se validaron internamente con un bootstrapping de 1.000 veces utilizando un muestreo aleatorio del 100% mediante sustitución. La incidencia acumulativa de eventos clínicos adversos se estimó con el método de Kaplan-Meier, y se utilizó el parámetro estadístico de log-rank para las comparaciones. Se aceptaron como estadísticamente significativos todos los valores de p<0,05. El análisis estadístico se realizó con el programa SPSS versión 15.0 para Windows (SPSS, Inc., Chicago, Illinois, Estados Unidos).
ResultadosPoblación en estudioLas características clínicas de los pacientes del estudio se indican en la Tabla 1, en la que se describe una población de pacientes con ICAD relativamente común. La mediana de edad de los pacientes del estudio fue de 74 años, y más de la mitad eran varones (54%). La mayoría de los pacientes tenía historia previa de hipertensión arterial y aproximadamente dos terceras partes presentaron IC de novo. La mediana de FEVI fue del 50% y un 54% de los pacientes presentó FEVI preservada (FEVI>45%). Tal como era de esperar en pacientes con ICAD, la mediana de la concentración plasmática de NT-proBNP fue superior a la de la concentración urinaria de NT-proBNP (3.345 [1.900-7.205] pg/ml frente a 73 [41-213] pg/ml; p<0,001). Los pacientes con una FEVI reducida presentaron concentraciones plasmáticas de NT-proBNP más altas que las de los pacientes con una FEVI preservada (4.298 [2.238-10.963] pg/ml frente a 2.933 [1.628-5.242]; p=0,018), mientras que las concentraciones urinarias de NT-proBNP fueron similares en los pacientes con una FEVI reducida o preservada (92 [44-225] pg/ml frente a 71 [40-195] pg/ml; p=0,77). Además, los pacientes con disfunción renal moderada-grave (FGe<60ml/min/1,73 m2) presentaron unas concentraciones plasmáticas y urinarias de NT-proBNP superiores a las de los pacientes con función renal normal o casi normal (FGe=60ml/min/1,73 m2): NT-proBNP en plasma, 5.897 [2.986-12.088] pg/ml frente a 2.252 [1.408-4.227] pg/ml (p<0,001) y NT-proBNP en orina, 155 [57-587] pg/ml frente a 56 [37-97] pg/ml (p<0,001).
Tabla 1. Características clínicas y bioquímicas basales de toda la cohorte
| Variables | Pacientes (n=138) |
| Edad (años) | 74 [67-80] |
| Varones | 74 (54) |
| Índice de masa corporal | 28 [26-31] |
| Presión arterial sistólica (mmHg) | 151±36 |
| Frecuencia cardiaca (lat/min) | 105±31 |
| Fracción de eyección ventricular izquierda | 50 [35-60] |
| Clase funcional de la NYHA III o IV previa | 44 (32) |
| Insuficiencia cardiaca crónica | 86 (62) |
| Insuficiencia cardiaca coronaria | 48 (35) |
| Diabetes mellitus | 70 (51) |
| Hipertensión | 114 (83) |
| Fibrilación/flutter auricular | 86 (63) |
| IMEST previo | 36 (26) |
| Ictus previo | 22 (16) |
| Anemia | 64 (46) |
| Uso de fármacos inotrópicos en el hospital | 2 (1,4) |
| Hemoglobina (g/dl) | 12,5±2,1 |
| Creatinina (mg/dl) | 1,2 [0,9-1,5] |
| FG estimada (ml/min/1,73 m2) | 63±25 |
| Nitrógeno ureico en sangre (mg/dl) | 51 [39-72] |
| Albúmina (g/dl) | 4,0±0,5 |
| Sodio (mEq/l) | 139±5,6 |
| Ácido úrico (mg/dl) | 7,7±2,7 |
| Proteína C reactiva (mg/dl) | 1,2 [0,5-3] |
| Troponina T (ng/ml) | 0,01 [0,01-0,06] |
| NT-proBNP en plasma (pg/ml) | 3.345 [1.900-7.205] |
| NT-proBNP en orina (pg/ml) | 73 [41-213] |
| NT-proBNP en orina/creatinina en orina (pg/mg Cr) | 2,7 [1,66-6,49] |
| Tratamiento utilizado al ingreso | |
| Bloqueador beta | 74 (54) |
| Inhibidor de la ECA/ARA-II | 72 (55) |
| AA | 47 (34) |
| Diurético de asa | 122 (88) |
AA: antagonista de aldosterona; ECA: enzima de conversión de la angiotensina; ARA-II: antagonista de los receptores de angiotensina; FG: filtración glomerular; NT-proBNP: porción N-terminal del pro-péptido natriurético tipo B; NYHA: New York Heart Association; IMEST: infarto de miocardio con elevación del segmento ST.
Los datos se expresan en forma de mediana [rango intercuartiles], en forma de media±desviación estándar, o como número (porcentaje).
Los pacientes tratados con antagonistas de aldosterona presentaron, en el momento del ingreso, una concentración urinaria inferior de NT-proBNP (43 pg/ml [26-109] frente a 72 pg/ml [44-227]; p=0,02), sin embargo no se observaron otras diferencias significativas de la concentración urinaria de NT-proBNP en relación con factores clínicos o con la medicación utilizada en el momento del ingreso en el hospital (p>0,05 en todos los casos). Tal como se muestra en la Tabla 2, la concentración plasmática de NT-proBNP fue el principal factor predictivo independiente de los niveles urinarios de este marcador. El valor ajustado de R2 del modelo que incluía estas variables fue de 0,55 (p<0,001) para el valor log10 de la concentración urinaria de NT-proBNP.
Tabla 2. Análisis de correlación y factores determinantes independientes del log10 de la concentración urinaria de la porción N-terminal de pro-péptido natriurético tipo B mediante un análisis de regresión múltiple
| Univariable | Multivariable | |||
| Variables | r | p | β | p |
| Log10 NT-proBNP plasmático | 0,61 | <0,001 | 0,52 | <0,001 |
| Fracción de eyección ventricular izquierda | –0,09 | 0,282 | 0,17 | 0,016 |
| Albúmina | –0,44 | <0,001 | –0,24 | <0,001 |
| Proteína C reactiva | 0,25 | 0,003 | 0,17 | 0,009 |
| En tratamiento con AA al ingresar en el hospital | — | 0,02 * | –0,15 | 0,024 |
| Fibrilación/flutter auricular | — | 0,083 * | –0,16 | 0,009 |
| IMEST previo | — | 0,092 * | 0,14 | 0,034 |
| Clase funcional de la NYHA III o IV previa | — | 0,308 * | — | 0,4 |
| Edad | 0,22 | 0,011 | — | 0,95 |
| Índice de masa corporal | –0,06 | 0,505 | — | 0,67 |
| Presión arterial sistólica | –0,06 | 0,639 | — | 0,31 |
| Troponina T | 0,42 | <0,001 | — | 0,25 |
| FG estimada | –0,37 | <0,001 | — | 0,13 |
AA: antagonista de aldosterona; FG: filtración glomerular; NT-proBNP: porción N-terminal del pro-péptido natriurético tipo B; NYHA: New York Heart Association; IMEST: infarto de miocardio con elevación del segmento ST.
* Valor de p para la prueba de U de Mann-Whitney.
A lo largo del periodo de estudio, un total de 65 pacientes (47%) presentaron eventos clínicos adversos: 33 pacientes fallecieron y 44 pacientes fueron ingresados de nuevo en el hospital a causa de una descompensación de la IC. La distribución de las características y los parámetros de laboratorio en función de la aparición de eventos clínicos adversos se muestra en la Tabla 3. Los pacientes que presentaron eventos clínicos adversos eran de mayor edad, tenían una prevalencia más alta de anemia e insuficiencia cardiaca crónica, y necesitaron apoyo inotrópico más frecuente durante la hospitalización.
Tabla 3. Características clínicas y de laboratorio basales de la población en estudio según la mortalidad y/o reingreso por insuficiencia cardiaca
| Sin eventos (n=73) | Eventos (n=65) | p | |
| Edad (años) | 73 [62-79] | 76 [69-82] | 0,037 |
| Varones | 41 (56%) | 33 (51%) | 0,53 |
| Índice de masa corporal | 29 [26-32] | 28 [26-32] | 0,9 |
| Presión arterial sistólica (mmHg) | 156±34 | 148±36 | 0,21 |
| Frecuencia cardiaca (lati/min) | 100±34 | 99±29 | 0,98 |
| Fracción de eyección ventricular izquierda | 52 [38-60] | 49 [30-60] | 0,43 |
| Clase funcional de la NYHA III o IV previa | 12 (16%) | 32 (49%) | <0,001 |
| Insuficiencia cardiaca crónica | 38 (52%) | 48 (74%) | 0,008 |
| Insuficiencia cardiaca coronaria | 22 (30%) | 26 (40%) | 0,23 |
| Diabetes mellitus | 32 (44%) | 38 (59%) | 0,09 |
| Hipertensión | 62 (86%) | 52 (80%) | 0,34 |
| Fibrilación/flutter auricular | 42 (59%) | 44 (68%) | 0,3 |
| IMEST previo | 14 (19%) | 22 (34%) | 0,05 |
| Ictus previo | 10 (14%) | 12 (19%) | 0,45 |
| Anemia | 27 (27%) | 37 (57%) | 0,019 |
| Uso de fármacos inotrópicos en el hospital | 6 (8%) | 13 (20%) | 0,045 |
| Hemoglobina (g/dl) | 13±2 | 12±2 | 0,01 |
| Creatinina (mg/dl) | 1 [0,8-1,3] | 1,2 [1-1,7] | 0,01 |
| FG estimada (ml/min/1,73 m2) | 69±24 | 56±25 | 0,003 |
| Nitrógeno ureico en sangre (mg/dl) | 47 [36-59] | 58 [47-99] | <0,001 |
| Albúmina (g/dl) | 4,1±0,4 | 4±0,5 | 0,18 |
| Sodio (mEq/l) | 138±6 | 138±5 | 0,64 |
| Ácido úrico (mg/dl) | 7,5±2,4 | 8±2,9 | 0,24 |
| Proteína C reactiva (mg/dl) | 1 [0,6-3] | 1,3 [0,4-3,4] | 0,93 |
| Troponina T (ng/ml) | 0,01 [0,01-0,04] | 0,02-[0,01-0,06] | 0,029 |
| Tratamiento al alta | |||
| Bloqueadores beta | 44 (60%) | 30 (53%) | 0,383 |
| Inhibidores de la ECA/ARA-II | 64 (88%) | 48 (84%) | 0,571 |
| AA | 31 (43%) | 16 (28%) | 0,09 |
| Diuréticos de asa | 69 (95%) | 53 (93%) | 0,729 |
AA: antagonista de aldosterona; ARA-II: antagonista de los receptores de angiotensina II; ECA: enzima de conversión de la angiotensina; FG: filtración glomerular; NYHA: New York Heart Association; IMEST: infarto de miocardio con elevación del segmento ST.
Los datos se expresan en forma de mediana [rango intercuartiles], en forma de media±DE, o como número (%).
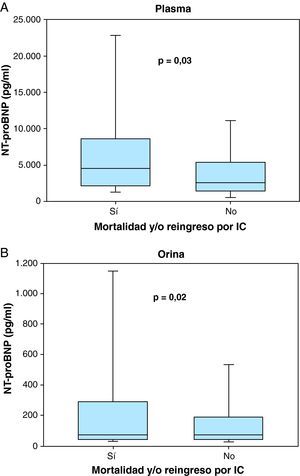
Los pacientes que presentaron eventos clínicos tenían una concentración plasmática superior de NT-proBNP (4.561 pg/ml [2.191-8.631] frente a 2.906 pg/ml [1.643-5.823]; p=0,03) (Figura 1A) pero su concentración urinaria de NT-proBNP fue similar (78 pg/ml [42-294] frente a 71 pg/ml [41-189]; p=0,62) (Figura 1B) en comparación con las de los pacientes que no sufrieron eventos clínicos. Las concentraciones séricas de creatinina, nitrógeno ureico en sangre y troponina T fueron también más altas en los pacientes que presentaron eventos clínicos adversos; mientras que los valores de hemoglobina y de FGe fueron menores en estos pacientes.
Figura 1. Gráfico box plot de las concentraciones plasmáticas (A) y urinarias de porción N-terminal de pro-péptido natriurético tipo B (B) en pacientes que presentaron mortalidad y/o reingreso por insuficiencia cardiaca y en pacientes que no sufrieron estos eventos. IC: insuficiencia cardiaca; NT-proBNP: porción N-terminal del pro-péptido natriurético tipo B.
En el análisis de regresión de Cox univariable, para cada 100 pg/ml de aumento de la concentración plasmática de NT-proBNP se observó un mayor riesgo de eventos clínicos adversos, y esta asociación no se modificó tras introducir un ajuste multivariable (por 100 pg/ml; HR=1,001; IC del 95%, 1,004-1,007; p=0,003) (Tabla 4). El índice C en el modelo final fue de 0,75 (IC del 95%, 0,67-0,83) y el método bootstrap mostró validaciones internas buenas (índice C, 0,75±0,039). Por el contrario, un cambio de 10 pg/ml en la concentración urinaria de NT-proBNP no se asoció a la aparición de eventos clínicos adversos en el análisis univariable (por 10 pg/ml; HR=1; IC del 95%, 0,998-1,001; p=0,55) (Tabla 4). Al analizar la mortalidad y los reingresos por IC como variables de valoración separadas, los resultados fueron muy similares: el NT-proBNP plasmático fue un factor predictivo significativo para cada una de estas variables (HR por 100 pg/ml de aumento del NT-proBNP en plasma=1,006; IC del 95%, 1,003-1,009; p<0,001 para la mortalidad, y HR=1,003; IC del 95%, 1,002-1,004; p=0,014 para el reingreso por IC), mientras que el NT-proBNP urinario no tuvo valor predictivo (p>0,3 en ambos casos).
Tabla 4. Análisis de riesgo de regresión de Cox para los factores predictivos de la mortalidad por todas las causas y/o el reingreso por insuficiencia cardiaca a
| Univariable | Multivariable b | |||
| HR | p | HR | p | |
| Edad | 1,03 (1,01-1,06) | 0,008 | — | 0,235 |
| Clase funcional de la NYHA III o IV previa | 3,34 (2,03-5,49) | <0,001 | 3,58 (2,16-5,93) | <0,001 |
| IMEST previo | 1,81 (1,08-3,04) | 0,024 | 1,69 (1,01-2,85) | 0,047 |
| Insuficiencia cardiaca crónica | 1,82 (1,05-3,17) | 0,034 | — | 0,23 |
| Diabetes mellitus | 1,65 (1,01-2,71) | 0,049 | — | 0,08 |
| Anemia | 1,75 (1,07-2,87) | 0,026 | — | 0,24 |
| Uso de fármacos inotrópicos en el hospital | 2,17 (1,18-3,99) | 0,012 | — | 0,27 |
| Troponina T | 2,61 (1,5-4,55) | 0,001 | 2,5 (1,36-4,61) | 0,003 |
| Nitrógeno ureico en sangre | 1,007 (1,002-1,012) | 0,006 | — | 0,09 |
| FG estimada | 2,2 (1,33-3,65) | 0,002 | — | 0,09 |
| NT-proBNP en plasma por 100 pg/ml | 1,003 (1,001-1,006) | 0,01 | 1,004 (1,001-1,007) | 0,003 |
| NT-proBNP en plasma>3.345 pg/ml | 1,86 (1,13-3,06) | 0,014 | 2,35 (1,41-3,93) | 0,001 |
| NT-proBNP en orina por 10 pg/ml | 1,15 (0,79-1,68) | 0,55 | ||
| NT-proBNP en orina>73 pg/ml | 1,2 (0,79-1,96) | 0,46 | ||
FG: filtración glomerular; HR: razón de riesgos; NT-proBNP: porción N-terminal del pro-péptido natriurético tipo B; NYHA: New York Heart Association; IMEST: infarto de miocardio con elevación del segmento ST.
a Todas las variables con un valor de p < 0,10 en el análisis univariable se indican en la tabla y se incluyeron en el modelo multivariable.
b La concentración plasmática de NT-proBNP se analizó por separado como variable cuantitativa y categórica. Se indica la HR multivariable y el valor de p para otras variables calculado a partir del modelo cuantitativo.
Determinamos también el valor pronóstico de las concentraciones plasmáticas y urinarias de NT-proBNP situadas por encima y por debajo de la mediana. En los análisis de regresión de Cox univariables y multivariables, la concentración plasmática de NT-proBNP por encima de la mediana (3.345 pg/ml) se asoció a un mayor riesgo de eventos clínicos adversos (HR=2,35; IC del 95%, 1,41-3,93; p=0,001) (Tabla 4). Sin embargo, la concentración urinaria de NT-proBNP por encima de la mediana (73 pg/ml) no alcanzó significación estadística como factor predictivo del pronóstico de eventos en el análisis univariable (HR=1,2; IC del 95%, 0,79-1,96; p=0,46) (Tabla 4). Además, al analizar la capacidad predictiva adicional del NT-proBNP urinario al añadirlo al NT-proBNP plasmático mediante el cálculo de la IDI, observamos que el NT-proBNP urinario no proporcionaba una información pronóstica adicional respecto a la de su concentración plasmática (IDI=0,00786; p=0,308, con el método bootstrap).
La normalización de la concentración urinaria de NT-proBNP respecto a los valores de creatinina urinaria (pg/mg creatinina urinaria) no mejoró los resultados obtenidos con el NT-proBNP urinario. En consecuencia, el área bajo la curva para la concentración de NT-proBNP en orina normalizada fue inferior, de 0,54 (IC del 95%, 0,45-0,63; p=0,049). Los análisis de regresión de Cox univariables mostraron también que la concentración urinaria de NT-proBNP normalizada no se asociaba al riesgo de eventos clínicos adversos al considerarla una variable continua (por pg/mg; HR=0,997; IC del 95%, 0,991-1,004; p=0,46) ni al considerarla una variable categórica (>2,7 pg/mg; HR=1,106; IC del 95%, 0,68-1,799; p=0,68).
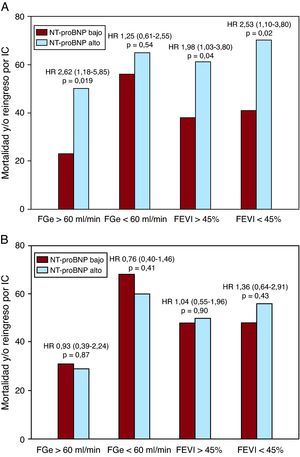
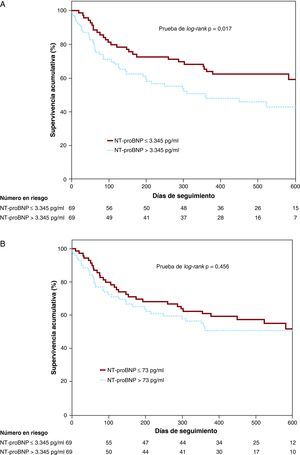
En los análisis estratificados según la función renal o la FEVI, la concentración plasmática elevada de NT-proBNP se asoció también a un mayor riesgo de mortalidad y/u hospitalización por IC en todos los subgrupos, excepto en los pacientes con una disfunción renal moderada-grave. En cambio, el NT-proBNP urinario no predecía los eventos clínicos adversos en ninguno de los subgrupos de pacientes (Figura 2A y B). Los análisis de supervivencia de Kaplan-Meier mostraron que una concentración plasmática de NT-proBNP superior a la mediana se asociaba a un incremento de la tasa de mortalidad y/o reingreso por IC (Figura 3A; prueba de log-rank, p=0,017), mientras que la concentración urinaria de NT-proBNP por encima de la mediana no mostraba esa asociación (Figura 3B; prueba de log-rank, p=0,465).
Figura 2. Asociación de las concentraciones plasmáticas (A) y urinarias (B) de porción N-terminal del pro-péptido natriurético tipo B con la mortalidad y/o el reingreso por insuficiencia cardiaca en pacientes con insuficiencia cardiaca aguda descompensada, estratificados mediante la filtración glomerular estimada y la fracción de eyección ventricular izquierda. En la figura se muestra el riesgo de mortalidad y/o reingreso por insuficiencia cardiaca en los participantes con concentraciones plasmáticas y urinarias de NT-proBNP por encima (alta) o por debajo (baja) de la mediana de 3.345 pg/ml y 73 pg/ml respectivamente. Las razones de riesgos comparan las concentraciones de NT-proBNP alta y baja en los distintos subgrupos de participantes con una FGe ≥60ml/min/1,73 m2 o<60ml/min/1,73 m2, así como en los que tenían una FEVI ≥45% o <45%. IC: insuficiencia cardiaca; FEVI: fracción de eyección ventricular izquierda; FGe: filtración glomerular estimada; HR: razones de riesgos; NT-proBNP: porción N-terminal del pro-péptido natriurético tipo B.
Figura 3. Curvas de supervivencia de Kaplan-Meier para la mortalidad y/o el reingreso por insuficiencia cardiaca según las concentraciones plasmáticas (A) o urinarias (B) de NT-proBNP. NT-proBNP: porción N-terminal del pro-péptido natriurético tipo B.
DiscusiónEn este estudio se explora el valor pronóstico de la concentración urinaria de NT-proBNP en pacientes con ICAD y se compara con la concentración plasmática de NT-proBNP en este importante escenario clínico. En consonancia con lo indicado por estudios previos1, 2, 3, 4, observamos que, en nuestra población de pacientes hospitalizados con ICAD, la concentración plasmática elevada de NT-proBNP se asoció con un riesgo mayor de eventos clínicos adversos, mientras que la concentración urinaria de NT-proBNP no mostró utilidad pronóstica.
Se ha observado que la determinación en plasma de la concentración de péptidos natriuréticos es útil como adyuvante en la evaluación clínica estándar para el diagnóstico y la estratificación del pronóstico en los pacientes con ICAD1, 2, 3, 4, 5, 6. Como tal, la utilidad de las determinaciones plasmáticas de los péptidos natriuréticos ha sido reconocida e incorporada en documentos y guías de consenso para el diagnóstico y el tratamiento de los pacientes con ICAD10.
En cambio, es poco lo que se sabe hoy día acerca de la utilidad clínica de la concentración de NT-proBNP en orina. Un reducido número de estudios previos han mostrado que la determinación de péptidos natriuréticos en orina podría ser útil para la detección de la disfunción sistólica ventricular izquierda y la predicción de eventos clínicos adversos en los pacientes con IC7, 8, 13, 14. Sin embargo, no todos los estudios han presentado resultados concordantes. Por ejemplo, Michielsen et al.15 han indicado recientemente que las concentraciones urinarias de NT-proBNP presentan una gran variabilidad en un mismo individuo y entre distintos individuos, y que tienen una sensibilidad y un valor predictivo negativo relativamente bajos para la detección de la disfunción sistólica ventricular izquierda en pacientes con ICAD, lo cual sugiere que las concentraciones urinarias de NT-proBNP deben interpretarse con precaución en este contexto.
En este mismo sentido, en el presente estudio hemos observado que la concentración urinaria de NT-proBNP no predijo la aparición de eventos clínicos adversos en pacientes hospitalizados por ICAD, y estos resultados se mantuvieron inalterados tras introducir una estratificación de la población según la FEVI o la función renal. Es de destacar que nuestros resultados contrastan con los de estudios previos en los que se ha indicado un aumento del riesgo de eventos cardiovasculares adversos en los pacientes con concentraciones elevadas de péptidos natriuréticos en orina, aunque estos estudios se realizaron habitualmente en pacientes con IC ambulatorios, más estables,7, 8 a diferencia de nuestro estudio llevado a cabo en pacientes con una situación clínica inestable; cuando menos en el contexto de la ICAD, nuestros resultados parecen sugerir que la determinación de péptidos natriuréticos en orina tiene menor utilidad pronóstica.
Dado que el NT-proBNP es una proteína de bajo peso molecular (8,5 kDa) que es filtrada libremente a través del glomérulo, observamos —tal como se esperaba— que el NT-proBNP en orina aumentaba con el incremento de la concentración plasmática de NT-proBNP. De hecho, observamos que el NT-proBNP plasmático fue el principal factor predictivo independiente de la concentración urinaria de NT-proBNP. Sin embargo, en contra de lo esperado, observamos que las concentraciones urinarias de NT-proBNP en nuestra cohorte global eran inferiores a las que tal vez podría predecir la concentración plasmática elevada de NT-proBNP observada en nuestros pacientes con ICAD. De hecho, observamos que el cociente de concentraciones en plasma/orina de nuestros pacientes (cociente=46) era al menos 3 veces superior al de los pacientes ambulatorios con IC, que tenían unos valores urinarios de NT-proBNP relativamente comparables, pero unas cifras plasmáticas considerablemente inferiores7, 16. Nuestros resultados contrastan con el hecho de que se haya propuesto que un aumento de la carga de NT-proBNP en la luz tubular secundaria a una concentración plasmática superior satura los mecanismos de reabsorción del péptico, con el consiguiente aumento de las concentraciones urinarias de NT-proBNP. El potencial papel de la degradación del NT-proBNP en la orina es muy improbable, puesto que las concentraciones de NT-proBNP de nuestros pacientes fueron comparables a las de otros estudios; además, se sabe que el NT-proBNP es excepcionalmente estable en la orina, lo cual hace que esta posibilidad sea remota.
Las limitaciones de nuestro estudio son similares a las de cualquier estudio observacional de un solo centro. El pequeño tamaño muestral y el número relativamente bajo de pacientes incluidos en cada grupo dificultan también poder extraer conclusiones sólidas. La validez de nuestros resultados en otras poblaciones está por establecer. Concretamente, será preciso examinar la utilidad de las concentraciones urinarias de NT-proBNP en grupos de pacientes con IC aguda más amplios. Además, no se incluyeron pacientes trasplantados cardiacos, por lo que nuestros resultados podrían no ser extrapolables a esa población específica. Dado que utilizamos la primera muestra de orina obtenida al ingresar en el hospital para la determinación del NT-proBNP urinario, no pudimos evaluar ni la cantidad total de excreción urinaria de NT-proBNP en una muestra de orina de 24 h ni la excreción fraccional de NT-proBNP. Otra consideración a tener en cuenta es la falta de métodos estandarizados para la determinación del NT-proBNP urinario, que incluiría un uso del mismo preparado peptídico, y de las mismas unidades, valores de referencia y valores de corte17.
ConclusionesNuestros resultados sugieren que, en una población con ICAD no seleccionada, debe usarse preferentemente el NT-proBNP en plasma, en vez de la determinación urinaria, con fines pronósticos. La fisiología renal de la excreción de péptidos natriuréticos es evidentemente compleja, y deberá ser investigada con mayor detalle.
Conflicto de interesesEl Dr. Januzzi declara recibir subvenciones de Roche Diagnostics, Siemens y Critical Diagnostics. El Dr. Pascual-Figal declara recibir subvenciones de Roche Diagnostics. Por lo demás, no hay otros posibles conflictos de intereses.
Recibido 27 Mayo 2010
Aceptado 3 Octubre 2010
Autor para correspondencia: Departamento de Cardiología, Hospital Universitario Virgen de la Arrixaca, Ctra. Madrid-Cartagena s/n, 30120 Murcia, España. sergiosmf13@hotmail.com