La fibrilación auricular (FA) es una afección médica compleja con mecanismos poco conocidos1,2. En algunos casos, causa insuficiencia cardiaca (IC), por lo que aumenta la mortalidad. La FA también puede causar IC sin problemas cardiacos subyacentes, lo que se conoce como miocardiopatía inducida por arritmia (MCiA)3. Esta forma de IC se puede mejorar con el control de la frecuencia o el ritmo4. Diagnosticar MCiA es actualmente imposible sin documentar el seguimiento de la fracción de eyección del ventrículo izquierdo (FEVI).
Recientemente, el estudio ANTWOORD5 ha introducido un nuevo modelo de predicción, la escala de Amberes, para identificar a los pacientes con IC sistólica causada por FA cuya FEVI mejoró después del control del ritmo mediante ablación con catéter. El objetivo es validar la escala de Amberes en un análisis retrospectivo de una cohorte prospectiva (SWISS-AF-PVI, NCT03718364) de pacientes con FA sometidos a aislamiento de las venas pulmonares6.
La capacidad predictiva de la escala de Amberes se valoró mediante curvas de eficacia diagnóstica y gráficos de calibración. Las variables continuas se compararon con la prueba de la U de Mann-Whitney o la prueba de la t de Student. Los porcentajes bajos (volumen de la aurícula izquierda indexado [VAIi] del 7,2%) de los valores ausentes se dedujeron estadísticamente. Todos los análisis estadísticos se realizaron con R versión 4.2.1.
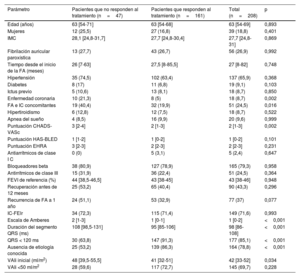
Entre mayo de 2010 y enero de 2022, se sometió a ablación de FA mediante catéter a 1.665 pacientes. De estos, se excluyó a 1.447 (87%) a causa de una FEVI inicial ≥ 50% y 10 (0,6%) se perdieron en el seguimiento, con lo que finalmente quedaron 208 pacientes (media de edad, 63 [54-69] años; el 19% mujeres) para el análisis final; la FEVI fue del 40 al 50% en el 72% y < 40% en el 28% (FEVI media, 43% [38-46]) (tabla 1). En esta cohorte, 161 pacientes (77%) respondieron al tratamiento y 47 (23%) no. La duración media del seguimiento fue 30 [20-34] meses. La enfermedad coronaria fue mucho menos frecuente en los pacientes que respondieron al tratamiento que en los que no (el 5 frente al 23%; p=0,002) al igual que el diagnóstico concomitante de FA e IC (el 20 frente al 40%; p=0,016). Los pacientes que respondieron al tratamiento también presentaron una duración del segmento QRS considerablemente más corta que los que no respondieron (95 [85-106] frente a 108 [99-131]; p<0,001), aquellos con un VAIi más pequeño (41 [32-51] frente a 48 [39,5-55,5]; p=0,03) y presentaban con mayor frecuencia IC de etiología desconocida (el 86 frente al 53%; p<0,001). El tipo de FA fue comparable entre quienes respondieron al tratamiento y los que no (FA paroxística, el 27 frente al 28%; p=0,99). El médico responsable manifestó sospechas clínicas de MCiA en 34 pacientes (el 17% de los que respondieron frente al 13% de lo que no; p=0,61). La mediana de tiempo hasta la recuperación de la FEVI en los que respondieron al tratamiento fue de 8 [3-22] meses. De estos, 20 pacientes mostraron recuperación de la FEVI tras más de 1 año pese a que no hubo recurrencia de la FA: el 75% presentaba cardiopatía hipertensiva; el 15%, apnea obstructiva del sueño y el 10%, diabetes.
Características clínicas basales
| Parámetro | Pacientes que no responden al tratamiento (n=47) | Pacientes que responden al tratamiento (n=161) | Total (n=208) | p |
|---|---|---|---|---|
| Edad (años) | 63 [54-71] | 63 [54-68] | 63 [54-69] | 0,893 |
| Mujeres | 12 (25,5) | 27 (16,8) | 39 (18,8) | 0,401 |
| IMC | 28,1 [24,8-31,7] | 27,7 [24,8-30,4] | 27,7 [24,8-31] | 0,869 |
| Fibrilación auricular paroxística | 13 (27,7) | 43 (26,7) | 56 (26,9) | 0,992 |
| Tiempo desde el inicio de la FA (meses) | 26 [7-63] | 27,5 [8-85,5] | 27 [8-82] | 0,748 |
| Hipertensión | 35 (74,5) | 102 (63,4) | 137 (65,9) | 0,368 |
| Diabetes | 8 (17) | 11 (6,8) | 19 (9,1) | 0,103 |
| Ictus previo | 5 (10,6) | 13 (8,1) | 18 (8,7) | 0,850 |
| Enfermedad coronaria | 10 (21,3) | 8 (5) | 18 (8,7) | 0,002 |
| FA e IC concomitantes | 19 (40,4) | 32 (19,9) | 51 (24,5) | 0,016 |
| Hipertiroidismo | 6 (12,8) | 12 (7,5) | 18 (8,7) | 0,522 |
| Apnea del sueño | 4 (8,5) | 16 (9,9) | 20 (9,6) | 0,999 |
| Puntuación CHADS-VASc | 3 [2-4] | 2 [1-3] | 2 [1-3] | 0,002 |
| Puntuación HAS-BLED | 1 [1-2] | 1 [0-2] | 1 [0-2] | 0,101 |
| Puntuación EHRA | 3 [2-3] | 2 [2-3] | 2 [2-3] | 0,231 |
| Antiarrítmicos de clase I C | 0 (0) | 5 (3,1) | 5 (2,4) | 0,647 |
| Bloqueadores beta | 38 (80,9) | 127 (78,9) | 165 (79,3) | 0,958 |
| Antirrítmicos de clase III | 15 (31,9) | 36 (22,4) | 51 (24,5) | 0,364 |
| FEVI de referencia (%) | 44 [38,5-46,5] | 43 [38-45] | 43 [38-46] | 0,948 |
| Recuperación antes de 12 meses | 25 (53,2) | 65 (40,4) | 90 (43,3) | 0,296 |
| Recurrencia de FA a 1 año | 24 (51,1) | 53 (32,9) | 77 (37) | 0,077 |
| IC-FElr | 34 (72,3) | 115 (71,4) | 149 (71,6) | 0,993 |
| Escala de Amberes | 2 [1-3] | 1 [0-1] | 1 [0-2] | <0,001 |
| Duración del segmento QRS (ms) | 108 [98,5-131] | 95 [85-106] | 98 [86-108] | <0,001 |
| QRS < 120 ms | 30 (63,8) | 147 (91,3) | 177 (85,1) | <0,001 |
| Ausencia de etiología conocida | 25 (53,2) | 139 (86,3) | 164 (78,8) | <0,001 |
| VAIi inicial (ml/m2) | 48 [39,5-55,5] | 41 [32-51] | 42 [33-52] | 0,034 |
| VAIi <50 ml/m2 | 28 (59,6) | 117 (72,7) | 145 (69,7) | 0,228 |
EHRA: European Heart Rhythm Association; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; IC-FElr: insuficiencia cardiaca con fracción de eyección ligeramente reducida; IMC: índice de masa corporal; VAIi: volumen de la aurícula izquierda indexado.
Los valores expresan mediana [intervalo intercuartílico] o n (%).
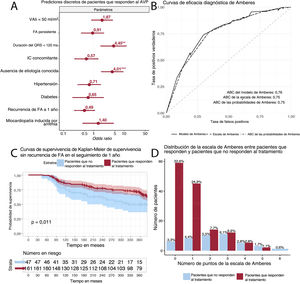
En el análisis univariable, los factores asociados significativamente con la falta de recuperación de la FEVI después del aislamiento de las venas pulmonares fueron la duración del QRS como variable continua (p< 0,001), VAIi (p=0,005), FA e IC concomitantes (p=0,003) y etiología de la IC desconocida (p< 0,001). Estas conclusiones se reprodujeron al utilizar las versiones binarias de las variables excepto el VAIi <50ml/m2 (p=0,08). En el análisis multivariable, después del ajuste de las diferencias en los parámetros iniciales entre las cohortes, solo la duración del QRS < 120ms (odds ratio [OR] = 4,41; intervalo de confianza del 95% [IC95%], 1,68-11,88; p=0,002) y la etiología de la IC desconocida (OR = 4,10; IC95%, 1,80-9,42; p<0,001) se mantuvieron asociadas significativamente con la falta de recuperación de la FEVI (figura 1).
A: gráfico de bosque que muestra las odds ratio de diversos parámetros distintos en la predicción de la recuperación de la FEVI después del aislamiento de las venas pulmonares. B: curvas de eficacia diagnóstica del modelo de predicción de Amberes (línea continua gruesa), escala de Amberes (puntos que van del 0 al 6, línea discontinua) y probabilidades proporcionadas en el estudio Antwoord (línea de puntos). C: supervivencia sin recurrencia de fibrilación auricular de pacientes que responden al tratamiento frente a pacientes que no responden. D: distribución de puntos de Amberes entre pacientes que responden al tratamiento y pacientes que no responden. ABC: área bajo la curva; AVP: aislamiento de las venas pulmonares; FA: fibrilación auricular; IC: insuficiencia cardiaca; VAIi: volumen de la aurícula izquierda indexado.
Con el análisis mediante curvas de eficacia diagnóstica, la escala de Amberes como modelo de predicción presentó un área bajo la curva (AUC) de 0,76 (0,68-0,84), mientras que la escala en sí (entre 0 y 6, dependiendo del número de criterios positivos de cada paciente) tuvo un AUC de 0,75 (IC95%, 0,67-0,83) y las probabilidades proporcionadas en el estudio ANTWOORD presentaron un AUC de 0,75 (IC95%, 0,67-0,83). Los gráficos de calibración mostraron pendientes entre 0,39 y 0,69. Se obtuvo un AUC similar (0,76) cuando se evaluó un conjunto de datos no imputados. La escala tuvo un comportamiento similar en pacientes sin recurrencia de la FA a los 12 meses (AUC = 0,79). El cociente de verosimilitudes del modelo que contiene un QRS < 120ms y la ausencia de etiología conocida tuvieron un comportamiento similar al del modelo de Amberes completo (χ2, p =0,77).
Este análisis secundario de un gran estudio prospectivo multicéntrico se realizó para la validación externa de la escala de Amberes y analizar su potencial generalización clínica. Anteriormente se halló que la escala de Amberes predice con precisión la recuperación de la FEVI tras la ablación de la FA, y en esta cohorte de validación, ligeramente más sana, se demostró una discreta potencia predictiva de la recuperación de la FEVI. La duración del QRS y la ausencia de etiología conocida de la IC se confirmaron como excelentes predictores de la recuperación de la FEVI. La escala tuvo un comportamiento mejor en la predicción de la respuesta en pacientes con una baja probabilidad de recuperación de la FEVI (5 o 6 puntos), mientras que su comportamiento en pacientes con una alta probabilidad de recuperación de la FEVI (0, 1 o 2 puntos) fue peor. Solo el 17% de los pacientes que respondieron al tratamiento contaban con un diagnóstico clínico previo de MCiA, que no fue un factor significativo para determinar la recuperación después de la ablación mediante catéter, lo que indica la escasa posibilidad de un diagnóstico de esta entidad antes del tratamiento. Es posible que se requieran intervenciones consecutivas de repetición o tratamiento con fármacos antiarrítmicos adyuvantes durante el seguimiento para garantizar la recuperación de la FEVI. Esta podría recuperarse en algunos pacientes tras más de 1 año si hay cardiopatía subyacente o comorbilidades incluso sin recurrencia de la FA. Una escala como la de Amberes5 es una necesidad y se precisan más estudios para identificar otros parámetros predictivos3.
Cabe señalar varias diferencias entre las cohortes de derivación y de validación que podrían haber afectado al comportamiento de la escala de Amberes: la proporción de pacientes respondedores fue diferente en los 2 estudios (el 54 frente al 77%), al igual que la distribución de varios parámetros basales entre los pacientes respondedores y los no respondedores (sexo, diabetes, ictus previo). La cohorte de validación mostró una mediana general de FEVI más alta, una mediana de duración del QRS más corta, menos pacientes con etiología de la IC conocida y mejor supervivencia sin recurrencia en los pacientes respondedores.
Este estudio presenta varias limitaciones: su diseño retrospectivo, el pequeño porcentaje de mujeres (19%) y de pacientes no respondedores (22,6%), la falta de imágenes de resonancia magnética cardiaca disponibles, la falta de cuantificación de la carga de FA durante el seguimiento, la estimación no estandarizada de la FEVI (el 66% en biplano, el 33% visual y el 1% otro) y la deducción de VAIi en un pequeño número de pacientes.
En resumen, en esta cohorte externa, la escala de Amberes tuvo un comportamiento moderado respecto a la identificación de pacientes con recuperación de la FEVI tras la ablación por catéter. La duración del QRS y la ausencia de una etiología conocida de la IC se confirmaron como excelentes predictores de la MCiA. El estudio se ajusta a las normas éticas y fue aprobado por el comité de ética de nuestro centro. Todos los pacientes firmaron el consentimiento informado.
FINANCIACIÓNNo se recibieron fondos para este estudio.
CONTRIBUCIÓN DE LOS AUTOREST. Serban: recopilación y depuración de datos, análisis estadístico, redacción y revisión del original. J. du Fay du Lavallaz: corrección del original, revisión de análisis estadísticos. D.C. Barker: recopilación de datos. C. Sticherling: revisión del original. M. Kühne y P. Badertscher: supervisión del proyecto, revisión del original; ambos contribuyeron por igual y se los debe considerar últimos coautores.
CONFLICTO DE INTERESESNo se han notificado conflictos de intereses en el presente estudio. T. Serban: financiación de la investigación por la Swiss Academy of Medical Sciences y la Fundación Gottfried & Julia Bangerter-Rhyner. P. Badertscher: financiación de la investigación por la Universidad de Basilea, la Stiftung für Herzschrittmacher und Elektrophysiologie, la Freiwillige Academice Gesellschaft Basel y Johnson&Johnson, todo ello al margen del trabajo presentado; notifica honorarios personales de Abbott. C. Sticherling: miembro de Medtronic Advisory Board Europe y Boston Scientitic Advisory Board Europe, recibió becas de formación de Biosense Webster y Biotronik, una beca de investigación del programa FP7 de la Unión Europea y Biosense Webster y honorarios por conferencias y asesoría de Abbott, Medtronic, Biosense Webster, Boston Scientific, Microport y Biotronik, todo ello al margen del trabajo presentado. M. Kühne: honorarios personales de Bayer, Böhringer Ingelheim, Pfizer BMS, Daiichi Sankyo, Medtronic, Biotronik, Boston Scientific, Johnson&Johnson y Roche; ayudas de Bayer, Pfizer, Boston Scientific, BMS, Biotronik, Daiichi Sankyo, todo ello al margen del trabajo presentado. J. du Fay du Lavallaz: financiación de la investigación por la Universidad de Basilea y la Swiss Heart Foundation. Los demás autores no tienen nada que declarar.