Palabras clave
INTRODUCCIÓN
La insuficiencia cardiaca es uno de los problemas de salud pública más importantes, la tercera causa de muerte por enfermedad cardiovascular en los países desarrollados, además de ser una causa significativa de morbilidad y carga hospitalaria1,2. La terapia de resincronización cardiaca (TRC) se ha probado como opción terapéutica para los pacientes con insuficiencia cardiaca, con una disminución de la morbilidad y la mortalidad total y por insuficiencia cardiaca3-8. Desde el año 2005, las guías europeas y americanas de práctica clínica aceptan la estimulación biventricular como una indicación de clase I con nivel de evidencia A en pacientes con insuficiencia cardiaca en grado funcional III-IV de la New York Heart Association en presencia de disfunción ventricular izquierda y prolongación del QRS9,10.
Sin embargo, los beneficios de esta terapia dependen no sólo de una cuidadosa selección del paciente, sino también de la posición de los electrodos, particularmente del encargado de la estimulación del ventrículo izquierdo (VI)11-13. Así, de acuerdo con los datos existentes, la localización ideal de este electrodo es la región lateral, ya que es la que presenta el mayor retraso contráctil en presencia de bloqueo de rama izquierda14,15.
La experiencia de los grandes ensayos clínicos indica que el implante del electrodo de VI vía transvenosa se realiza con éxito en aproximadamente el 90% de los intentos, con posicionamiento del electrodo en un lugar óptimo en el 64-79% de los casos4,6,7,16. Desafortunadamente, hasta en un 20% el implante de un electrodo en una vena coronaria puede ser dificultoso debido a factores anatómicos desfavorables17-19. Por ello, es fundamental un conocimiento detallado de la anatomía venosa coronaria del paciente al objeto de seleccionar la vena adecuada y poder reconocer los rasgos anatómicos que pudieran dificultar el procedimiento.
En este trabajo analizamos la utilidad de la senovenografía de retorno venoso con hiperemia para el conocimiento de la anatomía venosa coronaria, comparándola con la senovenografía oclusiva retrógrada, al ser ésta la técnica utilizada en la mayoría de los centros en la actualidad20. Esta técnica permitiría aprovechar la realización de la coronariografía, indicada frecuentemente durante la valoración de los pacientes candidatos a TRC, para la planificación del implante sin coste adicional significativo en términos económicos y de morbilidad.
MÉTODOS
De una serie de 221 pacientes a quienes se implantó un dispositivo de TRC en el Hospital Universitario de Gran Canaria Dr. Negrín, en 200 en los que estaba indicada una coronariografía previa al implante, se estudió la anatomía venosa coronaria mediante angiografía de retorno venoso durante hiperemia y senovenografía retrógrada oclusiva21. Todos los pacientes, tras ser informados, consintieron a la realización de ambos procedimientos. En la tabla 1 se resumen las características de los pacientes incluidos.
Se analizó el segmento comprendido entre el ostium del seno coronario (OSC) y la vena interventricular anterior (VIA), clasificándose la visibilidad de las venas coronarias utilizando una escala de 0,3 puntos, según la descrita por Muhlenbruch et al22 (tabla 2).
La angiografía del sistema venoso coronario se realizó con contraste yodado, no iónico y de baja osmolaridad y las proyecciones utilizadas fueron oblicua anterior izquierda a 30°, anteroposterior y oblicua anterior derecha a 30°. Todos los hallazgos fueron registrados en formato digital y analizados por dos observadores médicos experimentados de forma independiente.
Senovenografía de retorno con hiperemia
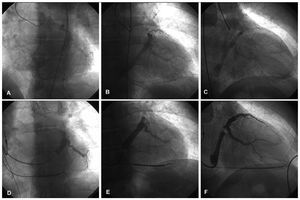
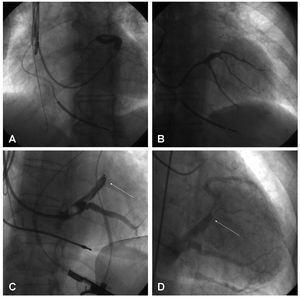
Se cateterizó la arteria coronaria izquierda con un catéter Judkins® 6F (Cordis Corp., Miami, Florida) y se administraron 200 mg de nitroglicerina intracoronaria (opcionalmente 60 mg de adenosina) al objeto de potenciar el flujo coronario y consiguientemente el retorno venoso. Posteriormente, se inyectaron 6-10 ml de contraste y se prolongó la filmación 5-10 s para visualizar la fase venosa del árbol coronario (fig. 1A-C).
Fig. 1. Angiografía de retorno venoso coronario con hiperemia (A: OAI 30°. B: AP. C: OAD 30°) y senovenografía retrógrada oclusiva (D: OAI 30°. E: AP. F: OAD 30°) realizadas en un mismo paciente.
Senovenografía oclusiva retrógrada
Tras acceder al seno coronario (SC) con el catéter guía, se introdujo por él un catéter balón, que se posicionó a mitad de trayecto entre las venas interventricular posterior y anterior. Tras inflarlo y comprobar que era oclusivo, se inyectaron 5 ml de contraste y se obtuvo la opacificación de la porción distal del sistema venoso coronario y a través de las conexiones intervenosas, en caso de estar presentes, de su porción proximal21 (fig. 1D-F). En caso de que no las hubiera, se realizó además una angiografía con el balón inflado a nivel del OSC. En las ocasiones en que no se opacificó la VIA y sus tributarias, se realizó una inyección adicional con el catéter balón en una posición más avanzada.
Terminología
Se utilizó la terminología aceptada para el SC y sus tributarias, según descrita por von Lüdinghausen23:
- Vena interventricular anterior (VIA): recorre el surco interventricular anterior hasta alcanzar el surco auriculoventricular.
- Gran vena cardiaca (GVC): se origina como una continuación de la VIA y discurre con un trayecto paralelo a la arteria circunfleja para drenar, normalmente a la altura del borde obtuso cardiaco, en el SC.
- Seno coronario (SC): inicia como una continuación de la GVC y en su origen recibe la desembocadura de la vena oblicua de Marshall. Al final de su trayecto desemboca en la aurícula derecha, por medio del llamado OSC.
- Vena cardiaca media (VCM): también denominada vena interventricular posterior, ya que recorre el surco con dicho nombre, desembocando habitualmente cerca del OSC.
- Venas posteriores y laterales: se encargan del drenaje venoso de la pared libre del VI y desembocan en el SC y la GVC, respectivamente.
Análisis estadístico
Las variables cuantitativas se describen mediante media aritmética y desviación típica. Las variables cualitativas nominales, se trataron analizando la frecuencia absoluta de la aparición de cada una de las categorías así como las frecuencias relativas y las ordinales, mediante la mediana y los percentiles 25 y 75.
La asociación de la opacificación con la oclusión del balón y la existencia de conexiones intervenosas se contrastó con la prueba de la c2. El test de Wilcoxon para muestras apareadas se utilizó en la comparación de la visualización entre ambas técnicas, y las diferencias en la información anatómica suministrada por las mismas se evaluaron mediante el test de McNemar.
RESULTADOS
Se valoró la variabilidad entre observadores e intraobservador, y la concordancia fue del 93 y el 98%, respectivamente.
Del total, fue posible obtener una información anatómica adecuada en el 99,5% de los individuos, y se visualizó el SC y la GVC en todos los pacientes. La opacificación de la VCM y VIA se consiguió de manera apropiada en el 96 y el 92,5%, respectivamente. La vena lateral se visualizó de manera óptima en la totalidad de los casos. No fue necesaria la exclusión de ningún paciente debido a opacificación subóptima de la anatomía venosa coronaria.
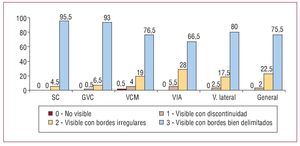
Para la visualización del sistema venoso en los individuos estudiados mediante angiografía de retorno venoso con hiperemia, se inyectaron un total de 17,8 ± 1 (mediana, 18; intervalo, 12-18) ml de contraste en tres proyecciones, que delinearon la anatomía de forma apropiada para su análisis en el 98% de los casos. El SC y la GVC se opacificaron en el 100 y el 99,5% de los casos respectivamente (fig. 2). La VCM y la VIA se visualizaron de forma óptima en el 96 y el 94,5%, respectivamente. Finalmente, las venas de la región lateral del VI se observaron de forma adecuada en el 97,5% de los casos y de manera discontinua en el 2,5% restante. No hubo complicaciones en relación con esta técnica.
Fig. 2. Calidad de la visibilidad de cada vaso mediante angiografía de retorno venoso con hiperemia (en porcentajes).
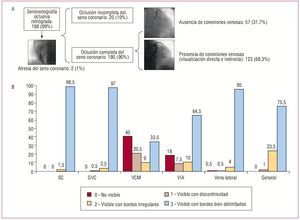
La canulación del SC para la realización de la senovenografía oclusiva retrógrada fue posible en 198 (99%) pacientes, y se fracasó en 2 por atresia del OSC. La oclusión con balón del SC fue completa en 180 (90%). En 123 (61,5%), la presencia de comunicaciones intervenosas permitió una opacificación completa del sistema venoso coronario (de forma directa como indirecta), mientras que en el 38,5% restante fue necesario realizar inyecciones adicionales con el balón inflado cerca del OSC para la delimitación de la anatomía de dicha región (fig. 3A). De esta manera, mediante la venografía retrógrada con balón se consiguió visualizar el SC y la GVC en el 100 y el 99,5% de los casos con precisión respectivamente (fig. 3B). La VCM sólo pudo ser vista de forma indirecta a través de conexiones intervenosas (42%). En los pacientes en los que el balón no fue completamente oclusivo, la opacificación de la VCM fue peor (p = 0,025), así como en los que no había conexiones intervenosas que aportasen flujo de contraste a las regiones proximales a la oclusión del balón (p < 0,001). En los pacientes en que se dieron las dos circunstancias (oclusión completa con balón y presencia de colaterales), se obtuvo una mejor opacificación de dicho vaso que en el resto de los grupos (p < 0,001). La VIA se visualizó de forma adecuada en el 75% de los casos y no fue posible en el 25%, a pesar de la oclusión completa del SC/GVC con el balón. Al igual que en el caso de la VCM, la oclusión incompleta del SC se relacionó de forma estadísticamente significativa con una opacificación inadecuada de la VIA (p < 0,001). Finalmente, la vena lateral se observó de forma adecuada en el 99% de los casos. El contraste total suministrado para el análisis de la anatomía venosa coronaria mediante esta técnica fue 18,26 ± 4,1 (mediana, 18; intervalo, 8-32) ml, en un total de 3,7 ± 0,9 (mediana, 3; intervalo, 2-6) inyecciones. En 93 (46,5%) pacientes fue necesario aplicar inyecciones adicionales con el balón en una posición más distal y/o proximal para la correcta visualización de la totalidad del sistema venoso coronario. En 4 (2%) pacientes se observó disección de la GVC y aparición de tatuaje durante la inyección de contraste, que en ningún caso impidió el implante de electrodo venoso, y se comprobó la ausencia de derrame pericárdico mediante ecocardiografía al final del procedimiento.
Fig. 3. A: representación esquemática de los pacientes estudiados con senovenografía retrógrada. B: calidad de la visibilidad de cada vaso mediante senovenografía retrógrada oclusiva (en porcentajes). SC: seno coronario; GVC: gran vena cardiaca; VCM: vena cardiaca media; VIA: vena interventricular anterior.
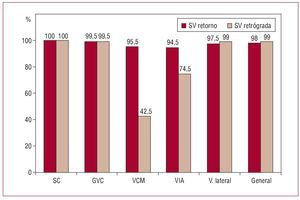
A pesar de que en general no hubo diferencias significativas en la opacificación de la anatomía del sistema venoso coronario, las puntuaciones de visibilidad fueron ligeramente superiores en el grupo estudiado mediante senovenografía oclusiva retrógrada que con la fase de retorno venoso para el SC, y las venas de la región lateral de VI (p = 0,034 y p < 0,001, respectivamente), aunque la información anatómica proporcionada por la senovenografía de retorno fue adecuada (puntuaciones 2 o 3 de la escala de Muhlenbruch) en el 100 y el 97,5%, respectivamente, sin diferencias significativas entre las dos técnicas (fig. 4). Por el contrario, la VCM y la VIA se visualizaron con mayor detalle mediante la senovenografía de retorno con hiperemia (p < 0,001 en ambos casos), aunque el inflado del balón en una posición más distal permitió una opacificación adecuada de la VIA.
Fig. 4. Comparación de la opacificación adecuada de la anatomía venosa coronaria (puntuación 2 y 3 de la escala de Muhlenbruch) mediante angiografía de retorno venoso y la senovenografía retrógrada (en porcentajes).
El electrodo ventricular izquierdo fue implantado con éxito en un 98%, y fracasó en 2 pacientes por atresia del OSC que impidió su canulación y por implante en la VIA en otros 2 pacientes. De los 196 con posicionamiento adecuado del electrodo venoso, en el 84% fue en una vena de la región lateral, en el 15% en una vena anterolateral y en el 1% en una vena posterior con trayecto paralelo a la MCV.
DISCUSIÓN
De acuerdo con la evidencia, la estimulación en la región lateral del VI es lo que produce mayor beneficio en la TRC11-13. La descripción de maniobras para superar obstáculos anatómicos y el desarrollo de la tecnología utilizada en el implante han permitido pasar de tasas de éxito del 80% a las actuales, en torno al 95%19,24. Sin embargo, la tasa de implantes en Europa y España presenta una distribución muy heterogénea25, lo cual se justifica en parte por la complejidad de la colocación del electrodo de VI, en ocas iones haciendo tedioso el implante de estos dispositivos.
Conocer el sistema venoso coronario es de gran utilidad para valorar la dificultad del implante del electrodo ventricular izquierdo, ya que los problemas encontrados durante el implante se pueden explicar por las variaciones anatómicas a nivel del OSC, la válvula de Tebesio y otras estructuras del sistema venoso coronario17.
La angiografía con catéter balón oclusivo continúa siendo la técnica más utilizada para el estudio de sistema venoso coronario. Descrita inicialmente por Tori26 en 1952 y posteriormente mejorada por Gensini et al27, consiste en el inflado de un balón a nivel del SC27,28 para que, mediante la inyección de contraste, se opacifique «contracorriente» la anatomía venosa del VI. En presencia de anastomosis venosas, es posible visualizar la totalidad del drenaje venoso coronario. Sin embargo, esta técnica presenta varios inconvenientes. En primer lugar, en caso de ausencia de anastomosis venosas, se pueden pasar por alto venas con origen posterior (fig. 5A y B). En otras ocasiones, el balón no llega a ser totalmente oclusivo y se precisan dos inyecciones, distal y proximal, para ilustrar la anatomía con la precisión requerida. Por otra parte, para la opacificación de la VIA puede ser necesaria una inyección con el balón inflado más distalmente en la GVC ya que, al inyectar en contra del flujo normal y en presencia de conexiones intervenosas, el contraste se distribuye preferentemente por ellas, y no se opacifican las venas de la región anterior y lateral alta. Asimismo, la presencia de una válvula de Vieussens limita la calidad de la visualización de los territorios mencionados28,30 (fig. 5C y D).
Fig. 5. Inconvenientes de la senovenografía oclusiva retrógrada. A: omisión de la vena por desembocadura próxima al OSC y ausencia de conexiones intervenosas. B: la inyección manual de contraste en la vecindad del OSC permitió su identificación. C: ausencia de opacificación de la región anterior y lateral del VI por válvula de Vieussens restrictiva. D: la senovenografía de retorno con hiperemia permitió la visualización de dicho territorio.
En concordancia con nuestros hallazgos, Meisel et al28 refieren una tasa de éxito en la canulación del SC del 96%, pero obteniendo una información anatómica óptima únicamente en el 67%, bien por oclusión incompleta del SC con el balón, bien por una resolución angiográfica pobre. Por ello, los autores concluyen que la visión global del sistema venoso coronario para la selección de la vena adecuada es limitada por la frecuencia de fracaso con la técnica.
Un hallazgo novedoso de este trabajo es la documentación de la utilidad de la fase venosa de una angiografía coronaria como un método sencillo de visualización del sistema venoso coronario. En la gran mayoría de los pacientes en los que está indicada la TRC, el estudio del árbol coronario es de gran utilidad independientemente del estado clínico, pues permite identificar si hay enfermedad coronaria y su extensión, así como los candidatos potenciales a revascularización percutánea o quirúrgica. En estos pacientes, la utilización de la información que da el retorno venoso coronario es de gran interés y no implica ninguna morbilidad29,31 ni costo alguno. De esta manera, esta técnica nos permite definir con precisión la anatomía del OSC, del SC y la GVC y de las venas de la región lateral del VI.
En los pacientes con enfermedad coronaria severa y/o sometidos a cirugía de revascularización coronaria, la calidad de la imagen en la fase venosa de la coronariografía puede verse reducida debido a un menor flujo del medio de contraste, tal y como ha sido descrito previamente32. Sin embargo, la inducción de hiperemia con nitroglicerina o adenosina intracoronaria permite contrarrestar este efecto y una visualización adecuada de la anatomía venosa. A diferencia de otros trabajos publicados31-33, en nuestra serie se consiguió una visualización óptima de la anatomía venosa coronaria con la angiografía de retorno, con índices de visualización similares mediante las dos técnicas analizadas. Esto es debido, con toda probabilidad, al aumento del flujo de retorno venoso mediante hiperemia causada por la administración de nitroglicerina y/o adenosina intracoronaria.
Vaseghi et al34, debido a imposibilidad de cateterización del SC, realizaron una coronariografía izquierda durante el implante en 7 (9%) de 77 pacientes a los que implantaron un dispositivo de TRC, que permitió visualizar la posición y las características y su canulación con éxito en 6 de ellos. Por ello, los autores recomiendan la visualización del OSC mediante la fase venosa de una coronariografía como una estrategia excepcional en pacientes en los que se fracasa en la canulación retrógrada del SC34. Sin embargo, si tenemos en cuenta los hallazgos de nuestro estudio y de acuerdo con lo sugerido por otros autores31,32, parece razonable considerar la senovenografía de retorno con hiperemia como una técnica útil para la visualización del sistema venoso coronario y la planificación del implante. En los pacientes sometidos previamente a una coronariografía, permitiría obviar la angiografía con balón durante el implante del electrodo venoso, reduciendo los tiempos de exploración, cantidad de contraste administrado y complicaciones asociadas a la senovenografía oclusiva, tales como la disección del SC o el taponamiento cardiaco28,35.
Adicionalmente, si se tienen en cuenta los hallazgos de Ansalone et al36, en que la mejoría de los pacientes sometidos a TRC es mayor en los pacientes estimulados desde la región del VI con activación más tardía, una planificación cuidadosa previa al implante podría facilitar el posicionamiento del electrodo en la región de interés y, por lo tanto, potenciar el beneficio clínico de la TRC.
Los datos presentados indican además la posibilidad de practicar sistemáticamente la filmación prolongada de la fase venosa de los pacientes sometidos por otra razón a una coronariografía. Dada la ausencia de modificación de la anatomía venosa coronaria a lo largo de la vida, esta información podría ser utilizada para el implante de un dispositivo de resincronización cardiaca en el caso de que la evolución de la enfermedad así lo requiriese. Las imágenes adquiridas y almacenadas digitalmente proporcionan una hoja de ruta óptima para el avance de guías coronarias y electrodos en la vena diana. Así, esta técnica permite delinear el lugar y el modo de acceso al SC y muestra todas las dianas venosas posibles, haciendo innecesaria la realización de una senovenografía oclusiva retrógrada durante el implante y simplificando el procedimiento.
Como alternativa, en pacientes en que no esté indicada una coronariografía durante la fase de valoración de TRC, podría recurrirse a técnicas como la tomografía computarizada (TC) multicorte22,37 previa al procedimiento. Aún está por definir el impacto que tienen la angiografía rotacional del SC38 o la resonancia magnética en la definición de la anatomía venosa coronaria y el implante de dispositivos de TRC.
CONCLUSIONES
El estudio del sistema venoso coronario es posible mediante la angiografía de retorno venoso y la senovenografía oclusiva retrógrada, que permiten una opacificación óptima del sistema venoso coronario de manera equiparable. La angiografía coronaria de retorno durante hiperemia, a diferencia de la senovenografía oclusiva retrógrada, además define con precisión la anatomía y la posición del OSC y el SC proximal y, al realizarse antes del implante, permite anticipar el nivel de dificultad de acceso a la vena diana con el electrodo venoso.
ABREVIATURAS
GVC: gran vena cardiaca.
OSC: ostium del seno coronario.
TRC: terapia de resincronización cardiaca. VCM: vena cardiaca media.
VI: ventrículo izquierdo.
VIA: vena interventricular anterior.
Full English text available from: www.revespcardiol.org
VÉASE EDITORIAL EN PÁGS. 914-6
Correspondencia: Dra. E. Arbelo Lainez.
Ctra. General del Centro, 239. 35017 Las Palmas de Gran Canaria. Las Palmas. España.
Correo electrónico: elenaarbelo@secardiologia.es
Recibido el 11 de marzo de 2008.
Aceptado para su publicación el 6 de mayo de 2008.