La detección del rechazo agudo en pacientes trasplantados cardiacos mediante métodos no invasivos representa un reto. La disponibilidad de un nuevo método de alta sensibilidad para la determinación de troponina T podría ayudar a su detección.
MétodosEstudio case-crossover, en el que cada paciente sirvió como control de sí mismo, mediante la selección de muestras obtenidas en episodios de rechazo agudo tratados (29 casos) y muestras sin rechazo obtenidas inmediatamente antes y/o después (38 controles). La determinación de alta sensibilidad de troponina T se realizó mediante un nuevo test precomercial (Elecsys Troponina T HS).
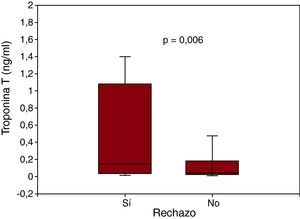
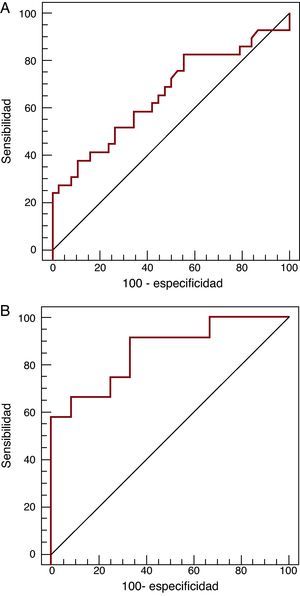
ResultadosLa troponina T fue detectable en todas las muestras: mediana, 0,068 [intervalo intercuartílico, 0,030-0,300] ng/l. Sus concentraciones se correlacionaron con la presión auricular derecha (r=0,37; p=0,002), la fracción aminoterminal del propéptido natriurético cerebral (r=0,67; p<0,001) y el tiempo transcurrido desde el trasplante (r=–0,81; p<0,001). Las concentraciones de troponina T fueron mayores en presencia de rechazo (0,155 frente a 0,047 ng/l; p=0,006). En el análisis operador-receptor, el área bajo la curva fue 0,67 (intervalo de confianza del 95%, 0,53-0,77) y el mejor punto de corte, 0,035 ng/l, que se asoció con mayor riesgo de rechazo (odds ratio=3,7; intervalo de confianza del 95%, 1,2-11,9; p=0,02). Durante los primeros 2 meses, el área bajo la curva aumentó hasta 0,86 (intervalo de confianza del 95%, 0,66-0,97), con un punto de corte óptimo de 1,1 ng/l (sensibilidad, 58% [28-85%]; especificidad, 100% [74-100%]).
ConclusionesEl análisis de alta sensibilidad detectó troponina T en todas las muestras tras el trasplante, en mayor concentración en caso de rechazo agudo, si bien su utilidad en la monitorización se limitaría a servir como apoyo ante la sospecha clínica o histológica, especialmente en los primeros meses.
Palabras clave
A pesar de los avances en la terapia inmunosupresora, un 20-30% de los pacientes sometidos a trasplante cardiaco precisan un incremento del grado de inmunosupresión por rechazo agudo, celular o humoral1, 2. La mortalidad asociada es del 6% en el primer mes y alcanza el 12% al final del primer año3. Actualmente, la biopsia endomiocárdica (BEM) es la herramienta estándar para el diagnóstico de rechazo agudo, a pesar de su carácter invasivo y su baja sensibilidad debida a la importante variabilidad del muestreo y de la interpretación intraobservador e interobservador.
La detección en sangre de troponinas cardiacas es una herramienta habitual en la detección precoz de daño isquémico en los síndromes coronarios agudos. El rechazo agudo también se asocia a necrosis de cardiomiocitos y, por lo tanto, a liberación de troponinas cardiacas4, 5. Sin embargo, la baja sensibilidad de los métodos convencionales para determinar las troponinas cardiacas limita su aplicabilidad clínica en este grupo de pacientes, en los que la liberación inicial es de muy escasa magnitud6. En los últimos años se han desarrollado métodos de determinación con alta sensibilidad7 que permiten reducir significativamente los límites de detección y podrían permitir su aplicación como una herramienta clínica en la monitorización del rechazo agudo del injerto.
El objetivo de este estudio es evaluar, por primera vez, un nuevo método de alta sensibilidad para la detección de troponina T (hsTnT) en el diagnóstico del rechazo agudo en pacientes con trasplante cardiaco.
MÉTODOSPoblación y diseño del estudioSe diseñó un estudio case-crossover, en el que cada paciente sirvió como control de sí mismo, mediante la selección de muestras obtenidas en episodios de rechazo (caso) e inmediatamente antes o después de dicho episodio (control). Entre los años 2000 y 2008, se realizaron 72 trasplantes cardiacos, a los que se practicaron BEM como parte del protocolo habitual de monitorización o por sospecha clínica de rechazo. Las muestras de sangre se obtuvieron inmediatamente antes de cada BEM, dentro del protocolo de la Red de grupos de investigación «Inmunología del trasplante» (Expediente G03/114; Instituto de Salud Carlos III), de las que se obtuvo suero que fue procesado y congelado a −80°C. De dicha población, un total de 29 pacientes (40%) (media de edad, 53±13 años; el 75% varones) presentaron un primer episodio de rechazo agudo durante el primer año, definido como el tratado con metilprednisolona en bolo intravenoso y a dosis ≥ 250mg, según criterios clínicos y/o histológicos de rechazo. Se seleccionaron las muestras obtenidas en el episodio de rechazo (n=29 casos, grupo con rechazo) y las obtenidas en la biopsia sin rechazo realizada inmediatamente antes (n=17) y/o después (n=21) (n=38 controles, grupo sin rechazo). El grado de rechazo histológico fue clasificado en cada biopsia de acuerdo con los criterios de la Sociedad Internacional de Trasplante Cardiaco y Pulmonar8. Las características clínicas y de laboratorio en el momento de la biopsia se registraron de manera prospectiva en la historia clínica del paciente, de acuerdo con la práctica clínica habitual para estos pacientes, y se recogió a posteriori para su análisis.
Medidas de laboratorioLas muestras sufrieron un único ciclo de descongelación para la determinación de troponina T con un inmunoanálisis de electroquimioluminiscencia de alta sensibilidad (Elecsys Troponina T HS), en un analizador Elecsys 2010 (Roche Diagnostics GmbH, Mannheim, Alemania). Dicho test tiene una gama analítica de 0,003-10 ng/ml, un límite de detección de 0,003 ng/ml y un valor de 0,013 ng/ml para el percentil 99 de la población normal (coeficiente de variación para dicho valor, 9%). Este test comercial ha sido validado recientemente y cumple con los requisitos y las recomendaciones de consenso para su uso en el diagnóstico de necrosis miocárdica9. La concentración de la fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP) también se midió a través de un inmunoanálisis de electroquimioluminiscencia, utilizando el analizador Elecsys 2010 mencionado anteriormente, cuya imprecisión total es < 3%.
Análisis estadísticoPara objetivar diferencias entre grupos con rechazo y sin rechazo, se empleó el test de la t de Student en el caso de variables de distribución normal o la prueba no paramétrica de la U de Mann-Whitney para las variables sin distribución normal. El test de la χ2 se empleó para la comparación de variables cualitativas. Para estudiar las posibles influencias en los valores obtenidos por hsTnT, se realizó un análisis de regresión lineal múltiple introduciendo las variables que se correlacionaban significativamente. La utilidad diagnóstica de la hsTnT en la predicción de rechazo celular agudo se evaluó a través del análisis COR (Características Operativas del Receptor), calculando el área bajo la cuva y sus intervalos de confianza (IC) con el método de DeLong10. El mejor punto de corte para el diagnóstico fue aquel que presentó el producto de especificidad por sensibilidad más elevado. La asociación de riesgo con el rechazo se estudió mediante un análisis de regresión logística en el que se realizó un ajuste por otras variables significativas. Todos los valores de p<0,05 fueron considerados estadísticamente significativos. El análisis estadístico se llevó a cabo mediante el software estadístico MedCalc 11.3.0 (MedCalc Software, Mariakerke, Bélgica) para el análisis COR y PASW 18.0 (SPSS Inc., Chicago, Illinois, Estados Unidos) para los demás análisis.
RESULTADOSLas características clínicas y bioquímicas se muestran en la Tabla 1, según la presencia o ausencia de rechazo. Para la población total, la troponina T fue detectable en todas las muestras (100%), con una mediana de 0,068 (0,030-0,300) ng/ml, y se encontraron concentraciones significativamente mayores en los pacientes con rechazo (Figura 1). Al estratificar a la población en función de terciles de troponina T, también se observó una asociación con mayor prevalencia de rechazo (p=0,02): 23% (< 0,035ng/ml), 48% (0,035-0,176 ng/ml) y 59% (> 0,176 ng/ml). La Tabla 2 muestra las variables clínicas que se correlacionaron con los valores de troponina T; tras el ajuste de regresión lineal múltiple, el tiempo transcurrido desde el trasplante, la presión auricular derecha y la concentración de NT-proBNP fueron sus principales determinantes. No se encontró correlación entre las concentraciones de troponina T y el grado histológico de rechazo (p > 0,5).
Tabla 1. Características basales de las biopsias endomiocárdicas según haya o no asociación con rechazo agudo
| Rechazo (n=29) | Sin rechazo (n=38) | p | |
| Tiempo desde trasplante (meses) | 2,6 [1,1-6,7] | 3,6 [1,5-8,8] | 0,152 |
| Ciclosporina (ng/ml) a | 270±221 | 237±102 | 0,516 |
| Tacrolimus (ng/ml) b | 10,9±3,7 | 14,3±9,5 | 0,418 |
| Ácido micofenólico (μg/ml) | 2,7±2,2 | 2,6±1,5 | 0,734 |
| FEVI (%) | 60 [56-64,5] | 60 [59-62,7] | 0,396 |
| Presión auricular derecha (mmHg) | 10 [5-15] | 8 [4-11] | 0,559 |
| Presión sistólica del VD (mmHg) | 37 [29-43] | 36 [30-41] | 0,556 |
| Creatinina (mg/dl) | 1,3±0,6 | 1,3±0,5 | 0,8 |
| Nitrógeno ureico (mg/dl) | 62±37 | 57±33 | 0,605 |
| Ácido úrico (mg/dl) | 7,1±2,6 | 6,6±2 | 0,453 |
| Albúmina (g/dl) | 3,6±0,8 | 3,86±0,42 | 0,152 |
| Proteína C reactiva (mg/dl) | 1,1 [0,3-3,7] | 0,5 [0,1-1,4] | 0,065 |
| Hemoglobina (g/dl) | 11±1,5 | 11,8±1,5 | 0,038 |
| NT-proBNP (ng/l) | 3.684 [916-12.005] | 1.587 [778-4.864] | 0,047 |
| Troponina T (ng/ml) | 0,155 [0,040-1,080] | 0,047 [0,026-0,187] | 0,006 |
Valores expresados como media±desviación estándar o mediana [intervalo intercuartílico].
FEVI: fracción de eyección del ventrículo izquierdo; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; VD: ventrículo derecho.
a n=18 para ciclosporina.
b n=11 para tacrolimus.
Figura 1. Concentración de troponina T en biopsias endomiocárdicas con y sin rechazo.
Tabla 2. Variables relacionadas con la concentración de troponina T en el análisis de regresión lineal
| Univariable | Múltiple | |||
| r | p | β | p | |
| Tiempo desde el trasplante | −0,810 | < 0,001 | −0,600 | < 0,001 |
| Presión auricular derecha | 0,370 | 0,002 | 0,241 | 0,021 |
| NT-proBNP | 0,666 | < 0,001 | 0,220 | 0,046 |
| Proteína C reactiva | 0,384 | 0,002 | −0,042 | 0,649 |
| Hemoglobina | −0,356 | 0,003 | −0,131 | 0,136 |
NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral.
El análisis COR mostró un área bajo la curva de 0,67 (IC del 95%, 0,53-0,77) (Figura 2A) para la presencia de rechazo; el punto óptimo de corte fue 0,035 ng/ml, con sensibilidad del 83% (IC del 95%, 64-94%), especificidad del 45% (IC del 95%, 29-62%), valor predictivo positivo del 56% y valor predictivo negativo del 77%. En un modelo multivariable, se asoció a un mayor riesgo de rechazo (p=0,02; odds ratio [OR]=3,7; IC del 95%, 1,2-11,9) tras el ajuste por el tiempo de evolución, las presiones derechas y el NT-proBNP. Cuando el análisis COR se restringió a los primeros 2 meses (12 muestras con rechazo y 12 controles sin rechazo), se observó un incremento del área bajo la curva hasta 0,86 (IC del 95%, 0,66-0,97) (Figura 2B), y el punto de corte óptimo se elevó a 1,10 ng/mL, con sensibilidad del 58% (IC del 95%, 28-85%), especificidad del 100% (IC del 95%, 74-100%), valor predictivo positivo del 100% y negativo del 66%.
Figura 2. Curvas COR de la prueba de troponina T de alta sensibilidad para la detección de rechazo en la población total (A: n=67) y en los primeros 2 meses postrasplante (B: n=24).
DISCUSIÓNDadas las limitaciones de la BEM, se han estudiado múltiples alternativas no invasivas para la detección del rechazo agudo cardiaco5, 8, 11, 12, 13, 14. Entre ellas, la determinación de troponinas cardiacas con pruebas convencionales también se ha evaluado, con hallazgos discordantes. Así, en algunas series de biopsias, sus concentraciones han mostrado correlación con el grado histológico de rechazo5, 6, mientras que otros trabajos no han encontrado esta asociación11, 12, 15, 16. Sin embargo, todos esos trabajos coinciden en mostrar escasa sensibilidad y bajo valor predictivo positivo.
El trabajo aquí presentado muestra, en primer lugar, que con el uso de un análisis de alta sensibilidad la troponina T fue detectable en todas las muestras con y sin rechazo. Con tests convencionales, un 54% de los pacientes presentan concentraciones persistentemente detectables. Este hallazgo concuerda con la elevada sensibilidad que estos nuevos tests han mostrado en pacientes con sospecha de enfermedad coronaria17, 18. Además, las concentraciones fueron significativamente mayores en los casos de rechazo que precisaron tratamiento con esteroides intravenosos, con base en hallazgos biópsicos o clínicos. Sin embargo, el área bajo la curva fue relativamente baja, lo que podría explicarse por la importante influencia del tiempo tras el trasplante (r=−0,8). Por otro lado, sólo la sensibilidad y el valor predictivo negativo elevados pueden permitir que se evite la necesidad de biopsia en la monitorización del rechazo cardiaco, y en este sentido, los valores mostrados por la hsTnT fueron relativamente bajos. Por lo tanto, la monitorización mediante hsTnT no evita la necesidad de BEM, si bien la asociación positiva con el rechazo que encontramos en este estudio indica su uso en apoyo de la sospecha clínica o biópsica. En este sentido, su capacidad diagnóstica mejoró en el periodo precoz, en el que valores elevados de troponina se asociaron con un elevado valor predictivo positivo (100%), por lo que la ausencia de descenso o la elevación de su concentración postrasplante por encima de 1,10 ng/mL podría ayudar a sospechar la presencia de rechazo agudo durante los primeros meses de evolución.
Un aspecto de interés es que en nuestra población, no encontramos una asociación con la gradación histológica, como ya se había descrito en otros estudios con pruebas convencionales11, 12, 15, 16. Este hecho pone de manifiesto la imperfección de usar la histología de las biopsias endomiocardicas como única herramienta patrón. De hecho, los cambios moleculares de rechazo se correlacionan mejor con los hallazgos clínicos que con las lesiones histológicas, tal y como han mostrado Mengel et al19 recientemente. En nuestro análisis, la correlación de la hsTnT con las presiones de llenado y el NT-proBNP indica también una correlación clínica con variables hemodinámicas que se afectan por la presencia de rechazo con repercusión clínica20, 21.
Este estudio está limitado por su carácter observacional y el pequeño número de muestras obtenidas en diferentes periodos de tiempo; sin embargo, esto se debe a que el trasplante es un procedimiento infrecuente y los episodios de rechazo son un evento imprevisible en la evolución de estos pacientes. La principal fortaleza de este estudio es que evalúa por primera vez la detección de troponinas con un test de alta sensibilidad y puede servir para aumentar el conocimiento en esta área y ayudar al diseño de nuevos estudios centrados en la búsqueda de marcadores no invasivos de rechazo. En cualquier caso, nuevos estudios con diseño prospectivo se hacen necesarios para definir mejor el papel de la hsTnT con o sin otros marcadores biológicos en la monitorización del rechazo tras el trasplante cardiaco.
CONCLUSIONESLos hallazgos muestran que, usando un test de alta sensibilidad, la troponina T es medible en todos los pacientes tras el trasplante y se encuentra en mayores concentraciones en presencia de rechazo agudo. Además, indica que la persistencia de valores elevados en el periodo precoz se asocia a un mayor riesgo de rechazo, si bien su uso en la monitorización continua debe ser individualizado y siempre como parámetro de apoyo de la sospecha clínica y/o histológica.
CONFLICTO DE INTERESESEl Dr. Domingo Pascual-Figal ha recibido becas de investigación de Roche Diagnostics.
Agradecimientos
Los reactivos para la determinación mediante hsTnT fueron donados por Roche Diagnostics.
Recibido 29 Marzo 2011
Aceptado 19 Junio 2011
Autor para correspondencia: Servicio de Cardiología, Hospital Universitario Virgen de la Arrixaca, Ctra. Madrid-Cartagena s/n, 30120 Murcia, España. dapascual@servicam.com