La miocardiopatía hipertrófica (MCH) es una enfermedad miocárdica primaria que se transmite habitualmente de manera autosómica dominante. La MCH se caracteriza por una amplia heterogeneidad en su expresión clínica. Aunque se han descrito trastornos de la conducción en la MCH1, la aparición de un bloqueo auriculoventricular de alto grado es inusual en los niños e implica un reto para la toma de decisiones clínicas. Se presenta el caso de una niña de 12 años con una MCH y portadora de un desfibrilador automático implantable subcutáneo (DAI-s) tras una parada cardiaca recuperada, que después sufrió síncopes secundarios a bloqueo auriculoventricular paroxístico.
Inicialmente se remitió a la paciente a nuestro centro a la edad de 8 años, tras un episodio de fibrilación ventricular que se desfibriló con éxito. Anteriormente en otro centro se le había diagnosticado de MCH sin compactación del ventrículo izquierdo y fisiología restrictiva. Había una hipertrofia leve de la pared miocárdica septal y la función sistólica era normal; no se apreciaba obstrucción del tracto de salida del ventrículo izquierdo y ambas aurículas estaban muy dilatadas. El cateterismo cardiaco mostró un aumento de la presión de llenado del ventrículo izquierdo. Se implantó un DAI-s y, tras un seguimiento de 4 años, la paciente no ha tenido ninguna terapia apropiada ni recibe tratamiento médico.
No había antecedentes familiares de MCH ni de muerte súbita cardiaca. Los padres, de Marruecos, eran primos hermanos. Un estudio genético mediante secuenciación de nueva generación identificó la variante patogénica homocigota Asp778Glu en el gen MHY7 de la probando.
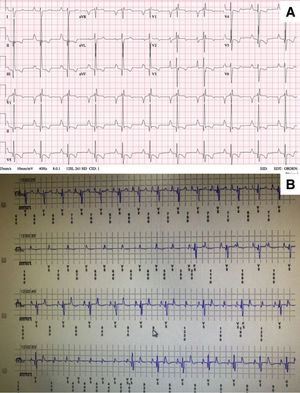
A la edad de 12 años, la paciente tuvo episodios de síncope inexplicados, sin que se registrara ninguna arritmia en el desfibrilador. El electrocardiograma en reposo se mantuvo inalterado (figura 1A), por lo que se implantó un dispositivo subcutáneo de monitorización prolongada, que demostró un bloqueo auriculoventricular de alto grado intermitente, que coincidía con la pérdida de conocimiento (figura 1B). Se decidió implantar un marcapasos transvenoso de doble cámara definitivo; a través de la vena axilar, se utilizó un electrodo sin luz de calibre 4 Fr (Select-Secure modelo 383069cm, Medtronic Inc., Estados Unidos) (figura 2A,B) a través de una vaina preformada fija (C315 HIS, Medtronic Inc., Estados Unidos) conectada al sistema de registro digital (Electrophysiology Lab System, Estados Unidos) con una configuración unipolar para el registro de la señal intracavitaria. Tras localizar el electrograma de His, se avanzó la vaina 1-2cm en dirección apical; una vez ahí, cuando se obtuvo mediante estimulación un QRS con morfología en W en la derivación V1, se avanzó el electrodo en el tabique interventricular mediante 5-6 giros en el sentido de las agujas del reloj, hasta que la muesca del QRS migró hacia el final del complejo y se consiguió estrechar el QRS. No se inyectó contraste a través de la vaina. Se obtuvieron unos parámetros de estimulación excelentes (amplitud de onda R de 12mV con un umbral de captura de 0,5 V a 0,4ms de anchura); a continuación se implantó un electrodo de 52cm en la orejuela auricular derecha (figura 2A,B). El tiempo total de fluoroscopia fue de 8min. Por último, se programó el marcapasos en modo AAI-DDD. Dado el complejo QRS estrecho con una semejanza extrema con el electrocardiograma en reposo de la paciente (figura 2C), la consulta intraoperatoria del electrocardiograma del DAI-s no mostró ningún fallo en la identificación del QRS estimulado (pasó los 3 vectores), y ello se confirmó 24h después. La niña se mantenía en buen estado a los 6 meses de seguimiento, sin recidivas de síncopes, en clase funcional II de la New York Heart Association, sin otras arritmias ventriculares malignas y con parámetros de marcapasos óptimos (amplitud de onda R, 15mV con un umbral de captura de 0,75 V a 0,4ms). El porcentaje de estimulación ventricular fue del 7%.
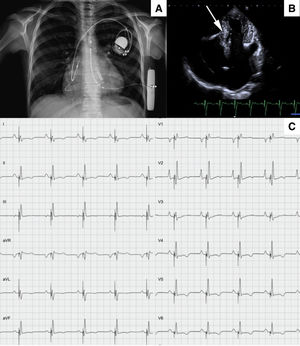
A: radiografía de tórax en la que se observan tanto el desfibrilador automático implantable subcutáneo como el marcapasos con estimulación en la rama izquierda. B: proyección ecocardiográfica de 4 cámaras en la que se observa el electrodo de la rama izquierda (flecha). C: QRS producido por estimulación con una anchura de 108ms.
Nuestro caso describe a una niña con una forma agresiva de MCH con fisiología restrictiva a causa de una mutación homocigota en el gen MHY7. La principal novedad que se presenta es la coexistencia de un DAI-s junto con un marcapasos transvenoso con estimulación de rama izquierda para resolver una situación clínica compleja. Para nuestra paciente, cuando se decidió implantar el DAI para prevención secundaria de muerte súbita cardiaca, no se preveía necesidad de estimulación antibradicárdica ni una terapia antitaquicárdica; en consecuencia, para evitar los riesgos de complicaciones intravasculares del electrodo en una paciente joven en etapa de crecimiento, se optó por un DAI-s. No obstante, cuando la presencia de un bloqueo auriculoventricular sintomático hizo inevitable el uso de un marcapasos, la opción de un dispositivo con estimulación en la rama izquierda parecía ofrecer varios posibles beneficios respecto a la de un sistema de DAI transvenoso único: en primer lugar, es bien conocida la elevada frecuencia de eventos adversos al emplear un generador y electrodos del DAI endovasculares, sobre todo en pacientes jóvenes2; además, la estimulación en la rama izquierda es una técnica emergente para aplicar un patrón de estimulación ventricular más fisiológico, que genera un complejo QRS estrecho y fomenta las sincronías auriculoventricular e intraventricular, con lo que se evitan las consecuencias adversas de una estimulación ventricular derecha en la función del ventrículo izquierdo, y con umbrales inferiores y una detección de la onda R superior en comparación con la estimulación del haz de His3. Por último, un QRS obtenido por estimulación similar al QRS en reposo permite un funcionamiento correcto del DAI-s, se evita un fallo en el cribado electrocardiográfico y, por lo tanto, se reduce la posibilidad de terapias inadecuadas.
Cuando se agote la batería del DAI-s, se producirá un reto en la toma de decisiones. Una opción sería retirar el sistema de DAI-s e introducir un electrodo de desfibrilación transvenoso con resincronización, siempre que el tamaño corporal de la niña esté ya próximo al de la edad adulta. Esto permitiría tener 1 solo generador colocado y con ello mejorar el resultado estético a la vez que se dispone de una terapia de estimulación antitaquicárdica. Sin embargo, esto implicaría un elemento más de interferencia en la válvula tricúspide en una paciente joven.
En resumen, el uso combinado de un DAI-s con un marcapasos de estimulación en la rama izquierda puede ser la opción óptima en ciertas situaciones, especialmente en los niños, en quienes los efectos nocivos de la estimulación crónica y los eventos adversos relacionados con los electrodos de un desfibrilador endovenoso son extremadamente indeseables.
CONFLICTO DE INTERESESM. Álvarez declara pagos personales de Boston Scientific y de Medtronic, sin relación con el trabajo presentado. Los demás autores no tienen nada que declarar.