La insuficiencia tricuspídea es una enfermedad prevalente, pero aún está infratratada. En ausencia de otra valvulopatía concomitante, son pocos los pacientes a los que se indica una intervención quirúrgica para reparar solamente la válvula tricúspide. Además, esta intervención se asocia con mal pronóstico, especialmente en pacientes con antecedentes de cirugía cardiaca. A pesar del impacto de la insuficiencia tricuspídea en la supervivencia, se considera que la mayoría de los pacientes son tributarios únicamente de tratamiento médico. Los tratamientos percutáneos de la válvula tricúspide suponen una prometedora alternativa para los pacientes con alto riesgo quirúrgico. En los últimos años se han desarrollado e implantado con éxito varios dispositivos percutáneos. Las técnicas de imagen tienen un papel indispensable en la selección de pacientes, como guía del procedimiento y en el seguimiento posterior. Los diferentes dispositivos disponibles se pueden dividir en 3 tipos: dispositivos que mejoran la coaptación valvular, implante transcatéter de válvulas en la vena cava y dispositivos de anuloplastia percutánea. Para los pacientes con una bioprótesis o anillo tricuspídeo disfuncionante, el implante transcatéter de válvulas aórticas o pulmonares es una alternativa a la reintervención quirúrgica. Esta revisión analiza en detalle los nuevos dispositivos percutáneos y los aspectos más relevantes de la anatomía y la evaluación de la válvula tricúspide.
Palabras clave
Históricamente, se ha pasado por alto la enfermedad de la válvula tricúspide (VT) y a menudo se ha tenido en cuenta sus consecuencias demasiado tarde. Un dato que respalda esta afirmación es que son pocos los pacientes a los que se indica una intervención quirúrgica para reparar solamente la VT1. A la mayoría de los pacientes con insuficiencia tricuspídea (IT) significativa se los trata médicamente, y solo en un 0,5% de los casos se realiza una reparación de la VT o una sustitución valvular2. Algunos estudios observacionales han indicado que la IT grave se asocia de manera independiente con un aumento de la mortalidad3,4, pero en ausencia de otra valvulopatía concomitante con indicación quirúrgica, la IT se suele tratar médicamente. Incluso en algunas intervenciones quirúrgicas sobre la válvula aórtica o mitral, en presencia de una IT grave concomitante, en ocasiones esta no se repara debido al clásico error de concepto de que la IT mejora siempre tras la cirugía valvular mitral o aórtica. De hecho, el 48% de los pacientes presenta un aumento de la gravedad de la IT de al menos 2 grados en el seguimiento de una cirugía mitral5. Basándose en esta evidencia, la Sociedad Europea de Cardiología recomienda realizar una reparación tricuspídea en caso de IT moderada o grave a los pacientes con valvulopatía mitral o aórtica con indicación quirúrgica6. Además, incluso en ausencia de una IT significativa, la reparación de la VT está indicada para los pacientes a los que se practica una cirugía valvular izquierda si ya presentan una dilatación del anillo tricuspídeo. La finalidad de esta recomendación es prevenir tanto la progresión de la IT cuando el anillo ya está dilatado como la necesidad de una intervención quirúrgica posterior5. La cirugía solo de la VT se asocia con altas tasas de mortalidad hospitalaria, que puede llegar a un 10% de los pacientes con antecedentes de cirugía valvular izquierda7. En el caso concreto de una reintervención sobre la válvula tricúspide tras una primera reparación valvular, la tasa de mortalidad hospitalaria puede alcanzar un 35%8. Una de las principales razones de esta alta tasa de mortalidad hospitalaria es las intervenciones quirúrgicas tardías, realizadas cuando el ventrículo derecho (VD) presenta ya una dilatación y una disfunción irreversibles. Como consecuencia, se necesitan tratamientos percutáneos de la VT, dado el gran número de pacientes que reciben solo tratamiento médico a causa del alto riesgo quirúrgico.
El desarrollo de las técnicas percutáneas en cardiopatía estructural, como el reemplazo percutáneo de la válvula aórtica o la reparación percutánea mitral de borde a borde, ha permitido tratar a pacientes con alto riesgo quirúrgico y constituye uno de los hitos más importantes de la cardiología moderna. No obstante, entre los factores predictivos de mortalidad tras una reparación percutánea mitral borde a borde, la IT grave antes del procedimiento es uno de los más importantes9,10. Además, en los pacientes a los que se practica una sustitución percutánea de la válvula aórtica, la presencia de una IT moderada o grave se asocia con un aumento de la mortalidad a 1 año11. Estos resultados subrayan la necesidad de dispositivos percutáneos para tratar la afección de la VT, sobre todo en el contexto de un uso creciente de los tratamientos percutáneos de las valvulopatías del ventrículo izquierdo. Tras el éxito de las intervenciones percutáneas para las valvulopatías aórtica, pulmonar o mitral, en los últimos años hemos asistido al desarrollo de numerosas técnicas percutáneas para la VT. En esta revisión se presentan el estado actual y las perspectivas futuras de los tratamientos percutáneos para la valvulopatía tricuspídea, así como los aspectos más importantes de la anatomía de la VT y la evaluación de la IT.
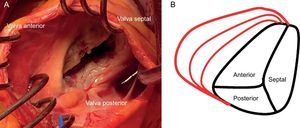
ANATOMÍA DE LA VÁLVULA TRICÚSPIDELa VT normal es la válvula auriculoventricular del corazón derecho, y se encuentra en una posición anteroinferior en el corazón, la más apical de las 4 válvulas cardiacas. El aparato valvular de la VT está formado por un anillo fibroso que rodea 3 valvas triangulares, que están sostenidas por cuerdas tendinosas y los respectivos músculos papilares del VD. Las 3 valvas se designan según su posición relativa en el corazón: septal, anterior y posterior12 (figura 1). La VT es la mayor de las 4 válvulas cardiacas y presenta diferencias respecto a la válvula correspondiente del ventrículo izquierdo, la válvula mitral, puesto que el área del orificio anular es aproximadamente un 20% mayor que el área del anillo mitral. El anillo tricuspídeo es complejo, con una forma oval en silla de montar y un cambio dinámico durante el ciclo cardiaco13,14.
Dado que el VD es una cámara de baja presión conectada a una circulación pulmonar de baja resistencia, muestra mayor sensibilidad que el ventrículo izquierdo al aumento de la poscarga15. Como consecuencia de esta anatomía, la integridad de la VT está estrechamente ligada al tamaño y la función del VD, y la sobrecarga de volumen o presión del VD puede causar un deterioro de la función de la VT16. El anillo tricuspídeo es una estructura dinámica que cambia su morfología cuando se modifican las condiciones de carga y durante las diferentes fases del ciclo cardiaco. La dilatación inicial del VD conduce a una dilatación del anillo tricuspídeo que es el mecanismo dominante de la IT funcional. Cuando se produce una dilatación funcional, no todas las valvas desempeñan el mismo papel en la IT: el anillo se dilata en dirección lateral, se conserva la porción septal y se extiende el punto de coaptación (figura 1B). La morfología del anillo cambia de elíptica a circular y se hace más plana, con una falta de coaptación valvular que crea chorros (jets) regurgitantes14. La valva anterior es la más grande y está anclada en un único músculo papilar fijado a la pared libre del VD, por lo que se ve más afectada por la dilatación del anillo17. Por lo tanto, es importante comprender las complejas relaciones entre el VD, la VT y el anillo tricuspídeo, que explican que la IT funcional no sea simplemente una valvulopatía, sino más bien el resultado de una serie de procesos que alteran el tamaño del anillo tricuspídeo, a la vez que producen anomalías del tamaño y la función del VD, lo que causa una alteración en el modo de coaptación y produce un tethering o fijación de la VT17.
TÉCNICAS DE IMAGEN PARA LA EVALUACIÓN DE LA INSUFICIENCIA TRICUSPÍDEALa técnica de imagen más utilizada en la práctica clínica para la evaluación de la VT es la ecocardiografía. La integración de la compleja relación entre el VD y el aparato valvular tricuspídeo requiere la utilización de múltiples ventanas ecográficas, la mayor parte de las veces mediante ecocardiografía transtorácica y en ocasiones ecocardiografía transesofágica (ETE), con exploraciones tanto bidimensionales como tridimensionales (3D)18,19.
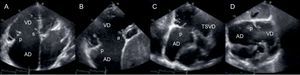
Ecocardiografía transtorácicaLas proyecciones recomendadas para llevar a cabo una evaluación completa del VD y el aparato valvular tricuspídeo se han descrito en la guía de la American Society of Echocardiography20,21 (figura 2). La mayoría de los parámetros empleados para establecer el grado de la IT son cualitativos o semicuantitativos22,23. Varios estudios han validado la evaluación cuantitativa del volumen de regurgitación tricuspídea con el método del área de isovelocidad proximal, por lo que un área del orificio de regurgitación efectiva ≥ 40 mm2 y un volumen regurgitante ≥ 45 ml son característicos de IT grave24,25.
Imágenes transtorácicas para la evaluación de la válvula tricúspide. A: proyección axial de 4 cámaras. B: proyección paraesternal de eje corto. C: proyección axial bicameral con el VD en el vértice del sector. D: proyección subcostal. a: valva anterior; AD: aurícula derecha; p: valva posterior; s: valva septal; TSVD: tracto de salida del ventrículo derecho; VD: ventrículo derecho.
La evaluación actual de la IT funcional debe de tener en cuenta también el tamaño del anillo tricuspídeo y el modo de coaptación de las valvas, que están influidos por el agrandamiento y la disfunción del VD, en vez de basarse únicamente en la gravedad de la regurgitación valvular17. Las guías de práctica clínica europea y estadounidense proponen emplear la dimensión septolateral telediastólica determinada en la proyección apical de 4 cámaras para evaluar el tamaño del anillo tricuspídeo, de tal manera que una dimensión diastólica ≥ 40 mm (o > 21 mm/m2) se considera indicativa de una dilatación grave del anillo tricuspídeo6,26. Debe analizarse también cuidadosamente la coaptación de las valvas. El tethering de las valvas se considera significativo cuando la distancia de tethering es > 8 mm o el área > 1,6 cm227.
Los parámetros más comúnmente utilizados para evaluar la IT se resumen en la tabla 128.
Evaluación ecocardiográfica de la gravedad de la insuficiencia tricuspídea
| Parámetro | Leve | Moderada | Grave |
|---|---|---|---|
| Cualitativo | |||
| Morfología de la VT | Valvas normales o levemente anormales | Valvas generalmente anormales | Lesiones valvulares graves |
| Movimiento septal interventricular | Normal | Habitualmente normal | Patrón paradójico/de sobrecarga de volumen |
| Chorro de regurgitación en Doppler color | Penetración pequeña en AD o no holosistólica | Penetración en AD moderada o penetración grande y sistólica tardía | Penetración en AD profunda y jet holosistólico o jet excéntrico |
| Zona de convergencia del flujo | No visible, transitoria o pequeña | De tamaño y duración intermedias | Grande en toda la sístole |
| Densidad/contorno del jet de regurgitación en DC | Débil/parabólica o contorno parcial | Densa, contorno variable | Densa, contorno triangular con un pico temprano |
| Tamaño de la VCI | Generalmente normal | Generalmente normal o dilatación leve | Generalmente dilatado con una variabilidad respirofásica reducida |
| Tamaño de VD y AD | Generalmente normal | Generalmente normal o dilatación leve | Generalmente dilatado |
| Semicuantitativo | |||
| Anillo tricuspídeo | < 40 mm o 21 mm/m2 | Puede ser > 40 mm o 21 mm/m2 | > 40 mm o 21 mm/m2 |
| Área del jet de flujo color (cm2) | No definido | No definido pero < 10 | > 10 |
| Vena contracta (cm) | No definido | No definido pero < 0,7 | ≥ 0,7 |
| Radio de PISA (cm) | ≤ 0,5 | 0,6-0,9 | > 0,9 |
| Flujo en las venas hepáticas | Predominio sistólico | Amortiguación sistólica | Inversión del flujo sistólico |
| Flujo transtricuspídeo | Onda A predominante, onda E < 1 m/s | Variable | Onda E dominante y ≥ 1,0 m/s |
| Cuantitativo | |||
| AEOR (mm2) | < 20 | 20-39 | ≥ 40 |
| Volumen de regurgitación (ml) | < 30 | 30-45 | ≥ 45 |
AD: aurícula derecha; AEOR: área efectiva del orificio regurgitante; DC: Doppler continuo; IT: insuficiencia tricuspídea; PISA: área de superficie de isovelocidad proximal; VCI: vena cava inferior; VD: ventrículo derecho; VT: válvula tricúspide.
Extraído con permiso de Rodés-Cabau et al.28.
La ETE permite evaluar la VT con una mejor resolución espacial y con más ventanas para la evaluación detallada de las imágenes bidimensionales y 3D29. La presencia de estructuras adyacentes dentro del mismo volumen en la exploración 3D puede ser útil para identificar la anatomía de las valvas (figura 3). Las imágenes estandarizadas obtenidas en la ETE son de especial importancia para facilitar la tarea de los cardiólogos intervencionistas durante las intervenciones percutáneas.
Tomografía computarizada y cardiorresonancia magnéticaAunque la ecocardiografía es la técnica de referencia para la evaluación de la IT, tanto la tomografía computarizada como la cardiorresonancia magnética pueden aportar información adicional.
Dada su alta resolución espacial, la cardiorresonancia magnética puede aportar datos que se suman a los de la ecocardiografía 3D para el análisis tanto anatómico como funcional del anillo de la VT y las cámaras cardiacas derechas30.
La tomografía computarizada es útil para medir el anillo tricuspídeo y puede aportar imágenes de la morfología del VD. Por lo que respecta al ámbito específico del tratamiento percutáneo, la tomografía computarizada proporciona información sobre las estructuras circundantes y su relación con la zona diana del dispositivo. Además, dado que la arteria coronaria derecha (ACD) transcurre por el surco auriculoventricular derecho, tiene especial importancia determinar su distancia respecto al anillo de la VT para evitar daños en la ACD durante las intervenciones percutáneas de anuloplastia31.
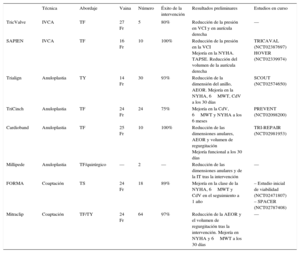
TRATAMIENTOS PERCUTÁNEOS PARA LA INSUFICIENCIA TRICUSPÍDEAEn los últimos años, se han desarrollado varias opciones percutáneas específicas para el tratamiento de la IT funcional. A diferencia de lo que ocurre con la valvulopatía aórtica o mitral, hasta la fecha no se dispone de una válvula cardiaca percutánea (VCP) específica y solo se han descrito algunas experiencias preclínicas. Se han identificado varias dificultades que será preciso superar para continuar el desarrollo de dispositivos tricuspídeos percutáneos, como el gran tamaño del anillo tricuspídeo (> 40 mm) y su forma elíptica y no plana. Además, algunas de las características del VD añaden dificultades adicionales, como el flujo lento, la estructura trabeculada con una pared ventricular fina, así como la proximidad a otras estructuras como la ACD, el seno coronario, la vena cava o el nódulo auriculoventricular28. Algunos dispositivos diseñados para la enfermedad mitral o aórtica, como el MitraClip (Abbott Vascular; Santa Clara, California, Estados Unidos) o la válvula Edwards SAPIEN (Edwards Lifesciences; Irvine, California, Estados Unidos), se han adaptado con éxito para el tratamiento de la IT o sus consecuencias, mientras que otros dispositivos se han desarrollado exclusivamente para la VT. Se puede identificar 3 dianas diferentes para los actuales tratamientos percutáneos tricuspídeos de la IT: implantes de una VCP en la vena cava para reducir el flujo retrógrado, dispositivos de anuloplastia percutánea que reducen las dimensiones del anillo, y dispositivos que mejoran la coaptación de las valvas y reducen el orificio de regurgitación. Se han publicado las primeras experiencias con estos dispositivos en el ser humano, y en los estudios actualmente en marcha y en otros futuros se evaluará la viabilidad, la seguridad y la eficacia de estas nuevas opciones terapéuticas percutáneas (tabla 2). Se ha descrito el implante de una VCP aórtica o pulmonar en pacientes con una reparación o sustitución tricuspídea previa y degeneración de la bioprótesis o incompetencia del anillo de anuloplastia, lo que representa actualmente una prometedora alternativa a la reintervención quirúrgica.
Tratamientos percutáneos para la enfermedad de la válvula tricúspide nativa
| Técnica | Abordaje | Vaina | Número | Éxito de la intervención | Resultados preliminares | Estudios en curso | |
|---|---|---|---|---|---|---|---|
| TricValve | IVCA | TF | 27 Fr | 5 | 80% | Reducción de la presión en VCI y en aurícula derecha | — |
| SAPIEN | IVCA | TF | 16 Fr | 10 | 100% | Reducción de la presión en la VCI Mejoría en la NYHA. TAPSE. Reducción del volumen de la aurícula derecha | TRICAVAL (NCT02387697) HOVER (NCT02339974) |
| Trialign | Anuloplastia | TY | 14 Fr | 30 | 93% | Reducción de la dimensión del anillo, AEOR. Mejoría en la NYHA, 6MWT, CdV a los 30 días | SCOUT (NCT02574650) |
| TriCinch | Anuloplastia | TF | 24 Fr | 24 | 75% | Mejoría en la CdV, 6MWT y NYHA a los 6 meses | PREVENT (NCT02098200) |
| Cardioband | Anuloplastia | TF | 25 Fr | 10 | 100% | Reducción de las dimensiones anulares, AEOR y volumen de regurgitación Mejoría funcional a los 30 días | TRI-REPAIR (NCT02981953) |
| Millipede | Anuloplastia | TF/quirúrgico | — | 2 | — | Reducción de las dimensiones anulares y de la IT tras la intervención | — |
| FORMA | Coaptación | TS | 24 Fr | 18 | 89% | Mejoría en la clase de la NYHA, 6MWT y CdV en el seguimiento a 1 año | – Estudio inicial de viabilidad (NCT02471807) – SPACER (NCT02787408) |
| Mitraclip | Coaptación | TF/TY | 24 Fr | 64 | 97% | Reducción de la AEOR y el volumen de regurgitación tras la intervención. Mejoría en NYHA y 6MWT a los 30 días | — |
6MWT: prueba de marcha de 6 min; AEOR: área efectiva del orificio regurgitante; CdV: cuestionarios de calidad de vida; IT: insuficiencia tricuspídea; IVCA: implante de válvula en vena cava; NYHA: clase funcional de la New York Heart Association; TAPSE: desplazamiento sistólico del anillo tricuspídeo; TF: transfemoral; TS: transubclavio; TY: transyugular; VCI: vena cava inferior.
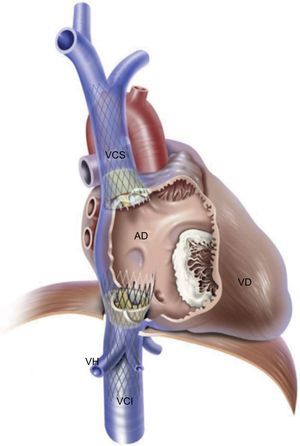
El objetivo de esta intervención consiste en reducir el volumen y la presión de regurgitación hacia la vena cava de los pacientes con una IT grave, que causa congestión hepática, abdominal y periférica, de tal manera que se mejoren los síntomas de insuficiencia cardiaca derecha. El implante de válvula en la vena cava se ha realizado con dispositivos específicamente diseñados para ello, como la válvula autoexpandible TricValve (P+F Products + Features Vertriebs GmbH; Viena, Austria) y también con la válvula aórtica percutánea SAPIEN con balón expandible. La TricValve es una válvula de tejido pericárdico montada sobre un stent de nitinol que se puede implantar en la vena cava inferior sola o en combinación con una TricValve específica para la vena cava superior (figura 4)32. Lauten et al.28,32,33 describieron una mejoría hemodinámica y clínica de los pacientes a los que se implantó el TricValve en la unión cavoauricular. Para el implante percutáneo, es necesario un introductor de 27 Fr33. Es imprescindible determinar preoperatoriamente el tamaño de la vena cava inferior y superior, que puede ser un criterio de exclusión para el uso de esta técnica si existe un posible riesgo de embolización valvular. El tamaño máximo de este dispositivo es 43 mm para la vena cava inferior y 38 mm para la vena cava superior. Empleando el mismo concepto, Laule et al.34 han descrito el implante de válvulas SAPIEN XT o SAPIEN 3 de 29 mm en la vena cava inferior. Antes del implante final de la válvula, se despliega un stent periférico para crear una zona de anclaje. El principal inconveniente del implante de válvula en la vena cava es que este concepto terapéutico no reduce la IT, sino solo sus consecuencias. No se dispone de datos a largo plazo sobre la seguridad de la ventricularización de la aurícula derecha y la sobrecarga de la aurícula derecha y el VD persistente debida a una IT grave persistente. Se recomienda anticoagulación, ya que el flujo lento en la vena cava podría favorecer la trombosis valvular. Hay 3 dificultades que es preciso tener en cuenta en la intervención para el implante de válvula en la vena cava: la proximidad de las venas hepáticas, la distensibilidad y el grado de dilatación de las venas cavas, y la importante variabilidad anatómica que muestra la vena cava superior, que hace que el doble implante en las venas cavas sea una intervención técnicamente más exigente35. Se ha descrito un alto porcentaje de éxito del procedimiento con los 2 sistemas valvulares, pero los resultados a 1 año muestran una tasa de mortalidad alta en estas series iniciales de pacientes con un riesgo quirúrgico prohibitivo incluidos en un programa de uso compasivo28. Los datos existentes sobre los resultados a largo plazo tras el implante de estos dispositivos son insuficientes. Actualmente se está investigando la seguridad y la eficacia del implante de la válvula SAPIEN en la vena cava inferior en los ensayos TRICAVAL (NCT02387697) y HOVER (NCT02339974).
Implante heterotópico de válvula en la vena cava. Doble implante valvular con un dispositivo TricValve autoexpandible en la vena cava inferior y otro en la superior. AD: aurícula derecha; VCI: vena cava inferior; VCS: vena cava superior; VD: ventrículo derecho; VH: venas hepáticas. Reproducido con permiso de Lauten et al.32.
La fisiopatología de la IT funcional implica la dilatación del anillo tricuspídeo. La dilatación progresiva del anillo tricuspídeo se produce en el plano anteroposterior, y conduce a una falta de coaptación de las valvas. La anuloplastia de la VT es el tratamiento quirúrgico de referencia de la IT funcional13 y en los últimos años se han desarrollado varios dispositivos de anuloplastia percutánea. Estos dispositivos tienen la ventaja de basarse en una técnica quirúrgica demostrada, con buenos resultados a largo plazo. Además, estas técnicas preservan la anatomía de la VT, lo que permite futuras opciones de tratamiento, como la VCP o la reparación percutánea borde a borde, si es necesario.
TrialignEste dispositivo se basa en la intervención quirúrgica de bicuspidización de Kay (conversión de una VT incompetente en una válvula bicúspide competente)36. El dispositivo Trialign (Mitralign Inc.; Tewksbury, Massachusetts, Estados Unidos) permite realizar la reparación percutánea de la VT por vía transyugular. La primera anuloplastia tricuspídea realizada en el ser humano se describió en 2015 y utilizó la plataforma mitral de este dispositivo (Mitralign)37 antes de que se desarrollara un sistema de implante específico para la VT.
Se implantan 2 introductores de calibre 14 Fr en la vena yugular derecha y se introduce a través de la VT un catéter articulado, que se posiciona al nivel de la comisura valvular anteroposterior, guiándose por ETE 3D. Se introduce una guía de radiofrecuencia a través del anillo tricuspídeo hacia la aurícula derecha y se externaliza para introducir un catéter de aplicación de las suturas (pequeños parches o pledgets)28,37. Se anclan 2 pledgets de poliéster en el anillo de la VT en posición posteroanterior y posteroseptal respectivamente. En los pacientes con un anillo muy grande, pueden implantarse múltiples pledgets. A continuación, se aproximan los pledgets para obliterar la valva posterior y se utiliza un sistema de cierre específicamente diseñado para ello en el lado auricular. De este modo se reducen las dimensiones del anillo y disminuye la IT (figura 5)37.
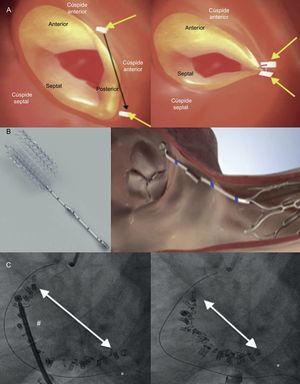
Dispositivos de anuloplastia percutánea. A: Trialign; parches (pledgets) o suturas (flechas amarillas) anclados al anillo de la VT (izquierda); reducción de la dimensión del anillo tricuspídeo tras la plicatura de la valva posterior (derecha) (reproducido con permiso de Schofer et al.37). B: dispositivo TriCinch (izquierda); implante del TriCinch (derecha) (reproducido con permiso de Rodés-Cabau et al.28). C: Cardioband; imágenes fluoroscópicas tras el implante del dispositivo, antes (izquierda) y después (derecha) de tensar los anclajes, con una reducción significativa del diámetro del anillo tricuspídeo (reproducido con permiso de Schueler et al.45). *Guía coronaria en la arteria coronaria derecha. #Catéter para el tensado del Cardioband. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Hasta la fecha, se ha tratado con este dispositivo a más de 30 pacientes en todo el mundo. Se ha descrito una reducción anular media de un 37% tras la intervención y una reducción del área del orificio de regurgitación de un 59%. En el estudio inicial de viabilidad en Estados Unidos, SCOUT I38, se incluyó a 15 pacientes, con éxito de la intervención en todos ellos y éxito técnico a los 30 días en 12 (3 casos de dehiscencia de 1 solo pledget). En el seguimiento realizado a los 30 días se observó una reducción significativa del diámetro del anillo tricuspídeo y del área del orificio de regurgitación, así como una mejoría de los síntomas de los pacientes (estado funcional, prueba de marcha de 6 min y cuestionarios de calidad de vida)38. Estos resultados preliminares se evaluarán en una cohorte de pacientes más amplia en el estudio para obtener la marca CE de la Unión Europea.
TriCinchEl TriCinch (4Tech Cardio; Galway, Irlanda) es un dispositivo percutáneo diseñado para reducir la IT funcional reduciendo las dimensiones del anillo y restableciendo la coaptación de las valvas39. Consiste en una estructura de anclaje en forma de sacacorchos, con una banda de dacrón y un stent de nitinol autoexpandible, disponible en 4 tamaños, de entre 27 y 43 mm40 (figura 5B)28. La intervención se lleva a cabo generalmente con anestesia general y guiada por fluoroscopia, ETE y ecocardiografía intracardiaca. No obstante, recientemente se ha descrito la realización con éxito de esta intervención con anestesia local y sedación, guiada por fluoroscopia y ecocardiografía intracardiaca41. Durante el implante del TriCinch, se coloca una guía en la ACD debido al riesgo de lesión de la arteria coronaria. Se inserta un introductor de calibre 24 Fr en la vena femoral derecha, y se avanza un catéter de 18 Fr hacia el anillo tricuspídeo. Se ancla la estructura de acero inoxidable en forma de sacacorchos al anillo de la VT cerca de la comisura anteroposterior. El sistema de implante del stent se conecta junto con el sistema de anclaje por medio de la banda de dacrón y se aplica tensión al dispositivo traccionando el sistema hacia la vena cava inferior para reducir el diámetro septolateral del anillo tricuspídeo y la intensidad de la IT. Por último, se despliega el stent en la vena cava inferior para mantener la tensión aplicada28,39,40. La proximidad de la ACD al anillo de la VT y la falta de suficiente tejido perianular son posibles limitaciones de esta técnica, por lo que se requiere un cuidadoso análisis previo a la intervención. La tomografía computarizada preoperatoria es imprescindible para evaluar la calidad del tejido y el riesgo de desprendimiento o dehiscencia o de lesión de la ACD42.
El PREVENT (NCT02098200), un ensayo multicéntrico para la marca CE actualmente en marcha, evalúa la seguridad y los resultados del sistema TriCinch para la reparación de la IT funcional. Hasta la fecha, se ha incluido en el estudio a 24 pacientes y se han realizado con éxito 18 implantes (75%). Se registraron 2 casos de hemopericardio y 4 de desprendimiento posoperatorio del sistema de anclaje. Se obtuvo una reducción de la IT en el 94% de los pacientes con éxito del implante. En el seguimiento realizado a los 6 meses, se registraron mejoras en los tests de calidad de vida y un 75% de los pacientes estaban en clase funcional I o II43. Esta experiencia inicial confirma que la reducción del anillo tricuspídeo con el sistema TriCinch es viable y seguro en pacientes seleccionados. Además, el TriCinch conserva la anatomía nativa y permite aplicar futuras opciones de tratamiento. La segunda generación del dispositivo TriCinch cuenta con un nuevo sistema de anclaje, de forma hemiespiral, que se despliega en el espacio pericárdico. La principal ventaja de este sistema de anclaje es la independencia de la ubicación de la ACD y de la calidad del tejido perianular42.
CardiobandEl sistema Cardioband para el tratamiento de la VT (Valtech Cardio; Or-Yehuda, Israel)44 es un anillo de anuloplastia percutánea basado en el dispositivo Cardioband autorizado por la CE para la insuficiencia mitral. Esta banda de dacrón ajustable se fija en una posición supraanular, de manera similar a la anuloplastia quirúrgica, y permite una adaptabilidad bidireccional (con lo que se evita apretar demasiado la fijación y el riesgo de gradientes transvalvulares posintervención) con un tamaño del anillo quirúrgico de hasta 28 mm (figura 5C)45. El sistema de implante del Cardioband para la IT requiere un introductor transfemoral de 25 Fr. Por razones de orientación y de seguridad durante el procedimiento, se coloca una guía en la ACD45. La intervención se realiza con fluoroscopia y guiado por ETE 3D. El dispositivo Cardioband se fija al anillo mediante 17 anclajes de acero inoxidable de 6 mm de longitud, que se implantan de la parte anterior a la parte posterior del anillo tricuspídeo. Una vez establecidos los anclajes, el dispositivo se tensa y se reducen de manera significativa las dimensiones del anillo tricuspídeo. Entre las ventajas importantes de esta técnica se encuentran su reversibilidad y su capacidad de adaptarse a la geometría del anillo tricuspídeo46, con una distribución de la reducción anular por todo el anillo, con lo que se reduce la tensión en los lugares de anclaje. Recientemente se han descrito los resultados preliminares del estudio TRI-REPAIR (NCT02981953) en 10 pacientes, con una reducción significativa del diámetro del anillo y del volumen de regurgitación tricuspídea, junto con una mejora del estado funcional a los 30 días47. El estudio TRI-REPAIR evaluará la seguridad y la aplicabilidad del sistema Cardioband para el tratamiento de la IT funcional sintomática en 30 pacientes. En futuros estudios se esclarecerán la durabilidad y los resultados clínicos a largo plazo de este dispositivo de anuloplastia percutánea.
MillipedeEl dispositivo de anuloplastia Millipede (Millipede Inc.; Santa Rosa, California, Estados Unidos) consiste en un anillo completo, ajustable y semirrígido que puede implantarse quirúrgicamente o por vía percutánea transfemoral. Tiene la ventaja de ser reposicionable y recuperable antes del despliegue y proporciona una reducción anular estable48. Presenta una interrupción para la zona del nódulo auriculoventricular, al objeto de reducir el riesgo de aparición de un bloqueo auriculoventricular39. Este dispositivo se ha implantado en posición mitral en 9 pacientes, en 2 de ellos se implantó un Millipede en las válvulas mitral y tricúspide. La reducción del diámetro del anillo tricuspídeo en estos 2 pacientes alcanzó el 42 y el 45% respectivamente, y el grado de IT tras la intervención fue 049.
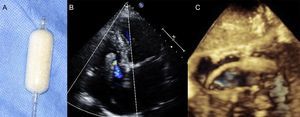
Dispositivos de coaptaciónFORMAEl dispositivo FORMA (Edwards Lifesciences) se ha diseñado para reducir la IT funcional al ocupar el orificio de regurgitación y aportar una plataforma para la coaptación de las valvas nativas50. Consta de un espaciador y un raíl. El raíl guía el espaciador hacia su posición y se ancla distalmente en el ápex del VD, perpendicular al plano del anillo tricuspídeo. El espaciador es un balón relleno de espuma que se coloca en el orificio regurgitante guiado por fluoroscopia y ETE 3D (figura 6). El espaciador está disponible en 2 tamaños: 12 y 15 mm, y requiere un introductor de 20 y 24 Fr respectivamente, implantado en la vena axilar o la subclavia izquierdas. El tamaño final del espaciador se obtiene mediante expansión pasiva a través de 8 pequeños orificios28. Una vez colocado el espaciador en la posición óptima para reducir la IT, el dispositivo se fija proximalmente y el exceso de longitud del raíl se coloca en una bolsa subcutánea, utilizando una técnica similar a la del implante de un marcapasos estándar. Este dispositivo se ha implantado en 18 pacientes en un programa de uso compasivo, con 2 fallos del implante a causa de 1 pérdida de anclaje y 1 perforación del VD. En el seguimiento a 1 año, hubo 1 rehospitalización por insuficiencia cardiaca y no se registró ninguna muerte. Los pacientes a los que se ha implantado el dispositivo FORMA han mostrado una mejoría de la clase funcional de la New York Heart Association, la distancia recorrida en la prueba de marcha y los cuestionarios de calidad de vida51. Se ha descrito cierto grado de reducción de la IT en todos los pacientes, pero la evaluación ecocardiográfica de la gravedad de la IT residual tras la intervención resulta especialmente difícil debido a la presencia de múltiples chorros pequeños. No se ha descrito ningún caso de estenosis tricuspídea iatrogénica, con un gradiente medio transtricuspídeo de 1,2 mmHg50. Los pacientes con defectos de coaptación muy grandes podrían ser una posible limitación para el uso de este dispositivo, ya que el espaciador actual de 15 mm podría ser insuficiente para alcanzar una reducción significativa de la IT. La presencia de electrodos de marcapasos en el VD no es una contraindicación para el dispositivo FORMA, pero esta población suele presentar un orificio de regurgitación asimétrico, por lo que la reducción de la IT puede resultar menos efectiva. Los ensayos clínicos US Early Feasibility Study (NCT02471807) y EU/Canada SPACER trial (NCT02787408) evaluarán la seguridad y la eficacia del dispositivo FORMA en 30 y 75 pacientes respectivamente.
MitraClip en la válvula tricúspideLa reparación percutánea borde a borde con el sistema MitraClip (Abbott Vascular) puede utilizarse para pacientes con una IT grave52,53. El MitraClip en la posición tricuspídea imita la técnica quirúrgica de aproximación borde a borde (técnica clover), que está validada para el tratamiento de la IT compleja, con resultados satisfactorios en el seguimiento a largo plazo54. El dispositivo MitraClip consiste en un implante de cobalto-cromo de 4 mm de ancho, cubierto de poliéster, que cuenta con 2 brazos que pueden abrirse y cerrarse para su sujeción a las valvas16. La reparación tricuspídea borde a borde puede realizarse a través de un abordaje transyugular o transfemoral. En un reciente estudio multicéntrico, se implantó un MitraClip a 64 pacientes consecutivos, con éxito del procedimiento en el 97% de los casos. En el 42% de los pacientes se necesitaron 2 o más clips. Se observaron reducciones significativas del área del orificio de regurgitación efectivo y del volumen de regurgitación. En el seguimiento realizado a los 30 días, se observó una mejoría significativa de la clase funcional de la New York Heart Association y de la prueba de marcha de 6 min55. A pesar de la amplia experiencia con este dispositivo en la válvula mitral, la reparación tricuspídea borde a borde sigue siendo una intervención compleja. Las principales dificultades específicas que plantea se deben a la mayor variabilidad anatómica y a los grandes defectos de coaptación, con mayor dificultad para la fijación del dispositivo a las valvas, que hace que a menudo se necesiten múltiples clips. Otros retos que plantea son la dificultad de dirigir el sistema MitraClip en el interior de la aurícula derecha perpendicularmente al plano de la VT, y el riesgo de atrapamiento del clip en el aparato subvalvular. La intervención se realiza con guía por ETE pero, a diferencia de la válvula mitral, la visualización de las valvas de la VT puede ser subóptima en algunos pacientes53. Será necesario disponer de una nueva versión del dispositivo, con unos brazos más largos (MitraClip XT), así como un sistema de implante específico para la VT, para mejorar la viabilidad y los resultados de esta técnica en los próximos años56.
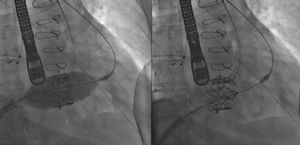
TRATAMIENTOS PERCUTÁNEOS DE LA TRICUSPÍDE TRAS EL FALLO DE LA REPARACIÓN O EL REEMPLAZO DE LA VÁLVULA TRICÚSPIDEValve-in-valve y valve-in-ring en la válvula tricúspideLos pacientes con reparación o reemplazo de la VT previos que requieren una reintervención tricuspídea tienen un riesgo quirúrgico prohibitivo, con una mortalidad hospitalaria que alcanza el 35%8. Hasta un 17% de los pacientes sometidos a anuloplastia tricuspídea presentan una IT grave a los 5 años de seguimiento57. Se ha descrito el uso de una VCP para el tratamiento de la degeneración de las bioprótesis tricuspídeas o el fallo de los anillos de anuloplastia. Se han implantado con éxito válvulas mediante abordajes percutáneos transauricular, transyugular o transfemoral48,58. Los pacientes con una disfunción de la prótesis quirúrgica y alto riesgo operatorio, además de los pacientes con cardiopatías congénitas y antecedentes de múltiples intervenciones tricuspídeas, son candidatos adecuados para el implante de una VCP59. Se han implantado con éxito 2 VCP diferentes en las intervenciones tricuspídeas de válvula intravalvular (valve-in-valve) y de válvula intraanular (valve-in-ring): la válvula aórtica percutánea SAPIEN y la válvula Melody (Medtronic; Minneapolis, Minnesota, Estados Unidos). En el caso de las intervenciones de valve-in-ring, los anillos semirrígidos o flexibles parecen ser más favorables que los anillos rígidos y abiertos, puesto que resulta más fácil convertir en circular su forma oval durante el despliegue de la VCP, con lo cual se reduce el riesgo de insuficiencia paravalvular48 (figura 7)60. La experiencia con la valve-in-ring tricuspídea es escasa y el registro multicéntrico más amplio solo incluye 20 procedimientos valve-in-ring, con una alta tasa de insuficiencia paravalvular61.
Valve-in-ring (válvula intraanular) en la válvula tricúspide con una válvula SAPIEN XT en un paciente con insuficiencia tricuspídea grave y antecedentes de reparación de la válvula tricúspide con un anillo de anuloplastia de 32 mm Carpentier-Edwards (Edwards Lifesciences; Irvine, California, Estados Unidos). Reproducido con permiso de Cabasa et al.60.
En un amplio registro multinacional de valve-in valve tricuspídeo, se incluyó a 152 pacientes, con una tasa de éxito de la intervención del 98,7%62. Es necesaria una estimulación ventricular rápida por medio de marcapasos para el despliegue de la válvula, pero no puede colocarse un electrodo de marcapasos transitorio en el VD para evitar enjaular el electrodo. Se han descrito 2 alternativas para el marcapasos ventricular: un electrodo transitorio en el seno coronario o el marcapasos directo utilizando la guía como electrodo en el ápex del VD48. En los pacientes con un marcapasos previo, la VCP puede implantarse sin retirar el electrodo del marcapasos. Debe considerarse la posibilidad de realizar un valve-in-valve tricuspídeo en los pacientes con degeneración de la bioprótesis de VT y riesgo quirúrgico alto. Serán necesarios nuevos estudios para determinar la durabilidad a largo plazo de las válvulas SAPIEN y Melody en la posición tricuspídea48,62.
FUTUROS DISPOSITIVOS Y PERSPECTIVASActualmente hay varios dispositivos en fase de desarrollo preclínico, como el TRAIPTA (Transatrial Intra-pericardial Tricuspid Annuloplasty), que se ha implantado ya en un modelo animal63. Después de introducirse en el espacio pericárdico, se coloca el dispositivo alrededor de los ventrículos y se tensa, con lo que se consigue una reducción de la dimensión del anillo tricuspídeo como consecuencia de la compresión externa. El lugar de acceso intrapericárdico se cierra con un oclusor septal auricular (atrial septal occluder) al final de la intervención.
Boudjemine et al.64 describieron la primera experiencia con un implante percutáneo de VT, hace más de 10 años, en 8 ovejas con una VT normal. No obstante, dados el gran tamaño del anillo tricuspídeo, su forma oval y la falta de una zona rígida de anclaje, además de otras consideraciones anatómicas, no se ha realizado todavía ningún implante percutáneo de VT en un ser humano. Actualmente hay 2 prometedores sistemas transcatéter de VT en fase de desarrollo: la válvula TriCares (TriCares GmbH; Aschheim, Alemania) y la NaviGate (NaviGate Cardiac Structures Inc.; Lake Forest, California, Estados Unidos).
Las técnicas de imagen desempeñan un papel clave en la selección de los pacientes y la planificación de la intervención, y permiten identificar posibles riesgos del procedimiento en cada paciente. El desarrollo de las técnicas percutáneas deberá acompañarse de nuevos avances en las técnicas de imagen para adaptarse a las necesidades específicas de los diferentes dispositivos percutáneos. Se necesitan operadores con experiencia en el uso de la ETE 3D para guiar las intervenciones tricuspídeas percutáneas, lo que tiene una repercusión directa en el éxito del procedimiento. El uso de la ecocardiografía intracardiaca aumentará probablemente en los próximos años, y permitirá realizar la reparación o sustitución percutáneas de la VT sin anestesia general.
Los dispositivos percutáneos actuales y futuros deberán demostrar su seguridad y viabilidad, así como unos resultados uniformes y duraderos. Serán necesarios estudios aleatorizados para demostrar su superioridad respecto al tratamiento médico estándar en pacientes con alto riesgo quirúrgico. En los próximos años, probablemente tengan lugar las primeras intervenciones en el ser humano con algunos nuevos dispositivos e incluso VT percutáneas, lo que aportará alternativas adicionales para el tratamiento de la IT. Tal como ya ha sucedido con el tratamiento de la valvulopatía mitral, podrían combinarse también algunos de los dispositivos percutáneos tricuspídeos, como los dispositivos de anuloplastia y de coaptación. Los futuros estudios deberán esclarecer cuál es la opción percutánea más apropiada en función de las características específicas de cada paciente, como la disfunción del VD grave o la dilatación anular grave.
CONCLUSIONESLa IT funcional grave continúa siendo una valvulopatía infratratada a pesar de su repercusión en la supervivencia a largo plazo. La anuloplastia quirúrgica es la técnica de referencia para la valvulopatía tricuspídea, pero el número de pacientes a los que se practica solo reparación tricuspídea es muy pequeño. A la mayoría de los pacientes no se les indica una intervención quirúrgica tricuspídea y reciben solo tratamiento médico debido al riesgo quirúrgico prohibitivo. Además, hoy cada vez son más los pacientes que pasan por intervenciones percutáneas para la enfermedad mitral o aórtica, pero la concomitancia de una IT no tratada empeora los resultados de estas intervenciones a largo plazo. En consecuencia, se necesitan nuevos dispositivos que permitan el tratamiento percutáneo de la enfermedad de la VT. En los últimos años, han aparecido varios dispositivos tricuspídeos percutáneos que se están evaluando en diferentes ensayos clínicos. Además, en un futuro próximo aparecerán nuevos dispositivos y probablemente se dispondrá también de VT percutáneas. Teniendo en cuenta las diferentes opciones de tratamiento actualmente en desarrollo y el interés renovado por la enfermedad de la VT, se puede afirmar que esta dejará de ser la válvula «olvidada».
CONFLICTO DE INTERESESNinguno.