Las complicaciones mecánicas posteriores a un infarto agudo de miocardio no son comunes, pero tienen consecuencias dramáticas y potencialmente letales. El ventrículo izquierdo se ve afectado con mayor frecuencia y las complicaciones se clasifican, según su inicio después del evento primario, en tempranas (de días a semanas después) y tardías (de semanas hasta años). A pesar de que la incidencia de estas complicaciones se ha reducido en la era de la angioplastia primaria —allá donde está disponible—, la mortalidad sigue siendo significativa y, aunque estas complicaciones se consideran poco frecuentes, suponen una emergencia y son una importante causa de mortalidad a corto plazo. Los dispositivos de asistencia circulatoria mecánica, en especial implantados de forma mínimamente invasiva y sin necesidad de toracotomía, han mejorado el pronóstico de estos pacientes al facilitar su estabilidad hasta que se pueda aplicar el tratamiento definitivo. Por otro lado, la creciente experiencia en intervenciones percutáneas para el tratamiento de la rotura del septo interauricular y la insuficiencia mitral aguda se ha asociado con una aparente mejora en sus resultados que aún precisa de la obtención de evidencia prospectiva.
Palabras clave
Durante las últimas décadas, los avances en la reperfusión farmacológica, percutánea y quirúrgica han mejorado los desenlaces y el pronóstico para los pacientes que sufren un infarto agudo de miocardio (IAM). Sin embargo, los pacientes con grandes IAM o que no reciben una reperfusión a tiempo se encuentran en riesgo de sufrir complicaciones mecánicas del IAM1. Muchos factores pueden influir en su incidencia, como ha demostrado el reciente repunte de este tipo de complicaciones durante la pandemia por el SARS-CoV-2, fundamentalmente a expensas de un retraso en el primer contacto médico2.
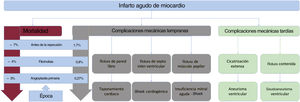
Las complicaciones mecánicas posteriores a un IAM no son comunes, pero tienen consecuencias dramáticas y potencialmente letales. El ventrículo izquierdo se ve afectado con mayor frecuencia y las complicaciones se clasifican según su inicio tras el evento primario en tempranas (de días a semanas después) y tardías (de semanas hasta años)3.
La rotura del septo ventricular (RSV), la insuficiencia mitral (IM) aguda y la rotura de la pared libre del ventrículo izquierdo (RPLVI) conforman el espectro de complicaciones mecánicas tempranas posteriores al IAM, mientras que la formación de seudoaneurismas o aneurismas verdaderos se halla entre las complicaciones tardías. El mecanismo común subyacente se debe a una necrosis miocárdica transmural excesiva que se sigue de la rotura de alguna estructura cardiaca (en las complicaciones tempranas) o una extensa cicatrización del tejido afectado (en las complicaciones tardías). En el IAM se producen una pérdida de miocardio ventricular funcionante y, a medida que ese miocardio sano disminuye, una progresiva reducción de la fracción de eyección del ventrículo izquierdo que puede llegar al shock cardiogénico3,4.
A pesar de que la incidencia de estas complicaciones se ha reducido en la era de la reperfusión mediante intervención coronaria percutánea, la mortalidad sigue siendo significativa y, aunque estas complicaciones se consideran poco frecuentes, suponen una emergencia y son una importante causa de mortalidad a corto plazo5 (figura 1).
INCIDENCIALa incidencia real de las 3 complicaciones tempranas puede diferir entre las distintas series de casos publicadas debido a subestimación o variación entre las poblaciones estudiadas. En general, se ha estimado que estas ocurren con una tasa de 3/100 pacientes que se presentan con un IAM y la mayoría ocurre en el contexto de los síndromes coronarios agudos con elevación del segmento ST (SCACEST). Entre los pacientes con SCACEST, la rotura del septo ventricular (RSV) es la más común de las 3 y la menos común es la RPLVI6,7.
Es difícil precisar la incidencia real, pero en 2019 Elbadawi et al.8 analizaron en Estados Unidos 9 millones de hospitalizaciones por IAM entre 2003 y 2015, y obtuvieron los siguientes datos: se produjo RSV en el 0,21% de los pacientes con SCACEST y el 0,04% de los pacientes con síndrome coronario agudo sin elevación del segmento ST (SCASEST); se produjo rotura del musculo papilar (RMP) en el 0,05% de los pacientes con SCACEST y el 0,01% de los pacientes con SCASEST, mientras que la RPLVI ocurrió en el 0,01% de los pacientes tanto con SCACEST como con SCASEST8.
CONSIDERACIONES GENERALESAunque la incidencia de estas complicaciones mecánicas permanece baja, la mortalidad asociada es muy alta (10-> 50%) (tabla 1). Además, las opciones de tratamiento quirúrgicas y percutáneas la mayoría de las veces son procedimientos complejos que requieren la experiencia de un equipo multidisciplinario compuesto por cardiólogos, cardiólogos intervencionistas, cirujanos cardiacos, intensivistas, especialistas en insuficiencia cardiaca y trasplante cardiaco, enfermería y especialistas en cuidados paliativos. La presentación aguda y la letalidad de estas complicaciones resaltan la necesidad de un diagnóstico temprano y un tratamiento inmediato para mitigar el shock cardiogénico y evitar la potencial muerte9.
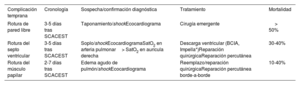
Resumen de las principales complicaciones mecánicas tempranas
| Complicación temprana | Cronología | Sospecha/confirmación diagnóstica | Tratamiento | Mortalidad |
|---|---|---|---|---|
| Rotura de pared libre | 3-5 días tras SCACEST | Taponamiento/shockEcocardiograma | Cirugía emergente | > 50% |
| Rotura del septo ventricular | 3-5 días tras SCACEST | Soplo/shockEcocardiogramaSatO2 en arteria pulmonar> SatO2 en aurícula derecha | Descarga ventricular (BCIA, Impella*)Reparación quirúrgicaReparación percutánea | 30-40% |
| Rotura del músculo papilar | 2-7 días tras SCACEST | Edema agudo de pulmón/shockEcocardiograma | Reemplazo/reparación quirúrgicaReparación percutánea borde-a-borde | 10-40% |
BCIA: balón de contrapulsación intraaórtico; SCACEST: síndrome coronario agudo con elevación del segmento ST.
En las últimas 2 décadas la adopción sistemática de la revascularización percutánea temprana para los pacientes con IAM ha tenido un impacto favorable en la incidencia global de estas complicaciones mecánicas. Sin embargo, a pesar de estas mejoras, los estudios han mostrado resultados contradictorios10. Diversos estudios han demostrado desenlaces favorables, mientras que la mayoría de los estudios comunican que la tasa de mortalidad asociada con dichas complicaciones ha permanecido sin cambios a pesar de un aumento notorio en el uso de tratamientos percutáneos y dispositivos de asistencia ventricular y las mejoras en las técnicas quirúrgicas9,10.
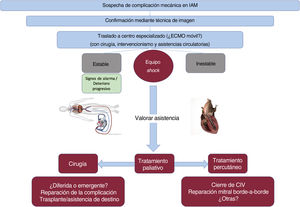
USO DE DISPOSITIVOS DE ASISTENCIA VENTRICULAR Y TRASPLANTELos pacientes con complicaciones mecánicas secundarias a IAM se presentan con cuadros de insuficiencia cardiaca rápidamente progresiva que puede terminar en shock cardiogénico. Por lo tanto, estos pacientes deben ser tratados en centros que tengan la capacidad de utilizar dispositivos de asistencia ventricular y que cuenten con servicio de cirugía cardiaca11 (figura 2). Para los pacientes con inestabilidad hemodinámica o shock cardiogénico, se debe considerar la inserción de un balón de contrapulsación intraaórtico y, en los casos de colapso hemodinámico refractario, será necesaria la asistencia hemodinámica con oxigenador extracorpóreo de membrana para la estabilización del paciente hasta lograr el tratamiento definitivo11,12. El uso de asistencias tipo Impella (Abiomed, Estados Unidos) es más controvertido, pero existen series tanto de RSV como de RMP que han podido tener asistencia hemodinámica exitosa con Impella antes de la intervención13.
Figura central. Adaptación del algoritmo de tratamiento propuesto por la American Heart Association para pacientes con sospecha de complicaciones mecánicas posteriores al IAM. CIV: comunicación interventricular; ECMO: oxigenador extracorpóreo de membrana; IAM: infarto agudo de miocardio.
En aquellos que nos sean candidatos a tratamiento quirúrgico o percutáneo, como quienes tengan fallo biventricular y deterioro multiorgánico, se deberá evaluar la indicación de trasplante cardiaco ortotópico o asistencia ventricular de destino. Aunque aún es alta la mortalidad operatoria de los pacientes sometidos a trasplante cardiaco en asistencia con oxigenador extracorpóreo de membrana implantado de forma percutánea para minimizar el número de toracotomías, este puede ser un tratamiento puente exitoso en ciertos pacientes sin otra alternativa.
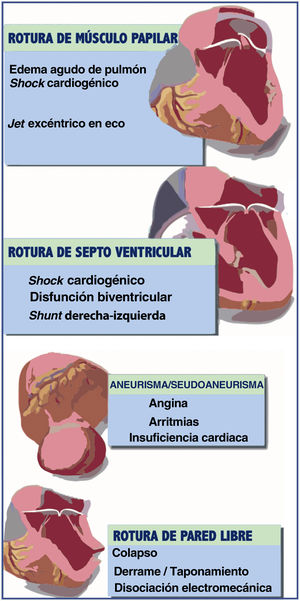
COMPLICACIONES MECÁNICAS TEMPRANASLos hallazgos más frecuentes de las distintas complicaciones mecánicas se resumen en la figura 3. El algoritmo actual de tratamiento de estos pacientes se muestra en la figura 2.
Rotura del septo ventricularLa RSV es un desgarro del septo interventricular que ocasiona un cortocircuito agudo de izquierda a derecha, sobrecarga de la circulación pulmonar y disfunción biventricular. La rotura septal suele ocurrir entre el margen del tejido miocárdico necrótico y el no necrótico; este suele ser único y puede variar en tamaño y trayecto a través del septo interventricular, que puede ser directo o irregular y serpiginoso14. El tamaño del defecto determina la magnitud del cortocircuito de izquierda a derecha, lo que a su vez está directamente relacionado con el pronóstico y la supervivencia de estos pacientes15,16.
En la práctica contemporánea, la incidencia de las RSV tras un IAM es de aproximadamente el 0,3%. Entre los factores de riesgo se incluyen las poblaciones mayores, el sexo femenino y el IAM no reperfundido. Típicamente ocurre de 3 a 5 días tras el IAM y la presentación clínica puede ir desde la disnea de esfuerzo hasta el shock cardiogénico. La exploración física se suele caracterizar por un soplo cardiaco holosistólico de nueva aparición y de alta intensidad, comúnmente en el borde paraesternal izquierdo bajo, acompañado de signos de congestión venosa y datos relacionados con shock cardiogénico y bajo gasto cardiaco (hipotensión, taquicardia, extremidades frías y oliguria)14. El diagnóstico inicial se basa en el soplo cardiaco, pero el ecocardiograma transtorácico confirma el diagnóstico. En los pacientes remitidos a la sala de hemodinámica para angiografía coronaria, la ventriculografía izquierda confirmará dicho diagnóstico objetivando el paso de medio de contraste del ventrículo izquierdo al derecho a través de dicho defecto15.
Aunque muy ocasionalmente pequeños defectos pueden cursar asintomáticos, la mayoría de estos pacientes típicamente se encuentran en un estado de salud crítico. El tratamiento médico se dirige a disminuir tanto las presiones de llenado del ventrículo izquierdo como la poscarga, para lo que se debe considerar el uso de inotrópicos, diuréticos y, en muchas ocasiones, dispositivos de asistencia ventricular. Asimismo estos pacientes deben ser evaluados de manera integral por un equipo multidisciplinario y ser referidos para cirugía urgente como primera opción17.
Aunque la cirugía aumenta la supervivencia, el momento adecuado para llevarla a cabo es controvertido. Muchos estudios han demostrado menores tasas de mortalidad operatoria en los pacientes sometidos tardíamente a cirugía, unas semanas después del IAM, que en los de cirugía temprana15. Sin embargo, estos resultados deben ser tomados con precaución, ya que en esto puede haber un sesgo en la selección de pacientes, dado que muchos de los pacientes que sobreviven pueden someterse a cirugía tardía gracias a un estado menos crítico, hemodinámicamente más estable y, probablemente, con defectos de menor tamaño, lo que disminuye el riesgo quirúrgico real. Esto indica que la cirugía no debería retrasarse con la idea de permitir una mayor fibrosis del septo, ya que muchos pacientes no sobreviven a esos retrasos por el cuadro de shock cardiogénico progresivo, las infecciones y el fallo multiorgánico. Como tratamiento puente a cirugía para los pacientes en shock cardiogénico, la estabilización hemodinámica deberá llevarse a cabo mediante inotrópicos, vasopresores y, en algunos casos, dispositivos de asistencia ventricular18. Es importante mencionar que antes del procedimiento quirúrgico es indispensable conocer la anatomía coronaria mediante coronariografía, ya que, en caso de que se confirme enfermedad coronaria significativa, será necesaria una cirugía de revascularización coronaria concomitante15–17.
Opciones de tratamiento percutáneoLa cirugía de reparación de la RSV se asocia con una tasa de mortalidad muy alta y los resultados subóptimos por cortocircuito residual posoperatorio se presentan hasta en un 20% de los casos. Debido a eso, se han desarrollado opciones de cierre percutáneo de la RSV19.
Para los pacientes que no son candidatos a tratamiento quirúrgico de la RSV por el riesgo excesivo, se puede considerar el cierre percutáneo como una opción. Una serie de estudios han demostrado la factibilidad y la eficacia del cierre percutáneo con dispositivos de oclusión septal. Aunque el éxito de dicho procedimiento puede ser cercano al 90% en centros con experiencia, la mortalidad hospitalaria es elevada y las complicaciones relacionadas con el procedimiento son comunes; entre ellas, destacan la embolización o migración del dispositivo de cierre, la hemolisis y el cierre parcial o incompleto del defecto20. En relación con este último punto, aunque en algunas instancias se ha comunicado el cierre completo de roturas pequeñas y medianas, en muchos de los casos solo se puede lograr el cierre parcial de dicho defecto. Sin embargo, esto también se considera de utilidad, ya que, al disminuir el tamaño del defecto, se disminuye el grado del cortocircuito y pueden mejorar las condiciones hemodinámicas del paciente hasta que la cicatrización del tejido miocárdico sea adecuada y permita un cierre quirúrgico definitivo19,20. La estrategia de abordaje percutáneo es variable, pero series más recientes apuntan a que el abordaje transyugular podría ofrecer mejores opciones de éxito debido a una orientación de la vaina más favorable4 (vídeo 1 del material adicional). El apoyo en técnicas de imagen multimodal y la realización del implante a través de una guía externalizada para proveer soporte y una orientación adecuada de la vaina han sido clave para mejorar la tasa de éxito de esta técnica en épocas más recientes; dado el número escaso de procedimientos con esta complicación, la guía de práctica clínica indica que el tratamiento percutáneo es una alternativa a la cirugía en centros con un grado de experiencia apropiado (sin matizar exactamente qué es «apropiado»), pero en cualquier caso la decisión siempre debe ser multidisciplinaria.
Para los pacientes en shock cardiogénico refractario con disfunción biventricular que contraindique el cierre quirúrgico o percutáneo, deben utilizarse dispositivos de asistencia ventricular para estabilizar al paciente y mejorar las condiciones hemodinámicas a la espera de un trasplante cardiaco si por lo demás el paciente resulta buen candidato17–19.
Insuficiencia mitral aguda secundaria a rotura de músculo papilarSon 2 los mecanismos principales por los cuales aparece la IM aguda en el IAM: la RMP y la disfunción del músculo papilar secundaria a isquemia. Es mucho más común la IM aguda debida a disfunción del músculo papilar que la originada por RMP21.
La válvula mitral está compuesta por 2 músculos papilares: el anterolateral y el posteromedial. El primero tiene una doble irrigación por la arteria descendente anterior y la circunfleja, mientras que el segundo tiene una irrigación única por la descendente posterior que puede originarse de la circunfleja o de la coronaria derecha (dependiendo de la dominancia coronaria). Por lo tanto, la RMP anterolateral es extremadamente infrecuente, mientras que la posteromedial ocurre con mayor frecuencia y típicamente se asocia con IAM inferiores o laterales; sin embargo, también se puede observar en los SCASEST22.
La incidencia de IM aguda secundaria a RMP, como las otras complicaciones mecánicas del IAM, ha disminuido en la era de la reperfusión, pero las tasas de mortalidad continúan siendo elevadas, entre un 10 y un 40%21.
Los factores de riesgo incluyen las edades mayores, el sexo femenino, la mala circulación colateral al músculo papilar afectado, la enfermedad de un solo vaso, un primer IAM, el IAM no reperfundido y una gran extensión del IAM.
Suele producirse de 2 a 7 días después del IAM y la rotura del músculo puede ser parcial o completa. Cerca de la mitad de estos pacientes se presentan en edema agudo de pulmón que puede progresar rápidamente a shock cardiogénico23. En la exploración física es característico el soplo holosistólico de nueva aparición, que se escucha con más intensidad en el ápex, con un componente diastólico e irradiación a la axila, aunque en algunos casos este puede estar ausente debido a la rápida ecualización de las presiones entre la aurícula y el ventrículo izquierdos, por lo que el diagnóstico inicial se basa principalmente en el ecocardiograma transtorácico, pero en muchos casos se requiere un ecocardiograma transesofágico debido a que este ofrece una mayor precisión diagnóstica24.
El tratamiento inicial precisa de las medidas habituales en situación de edema agudo de pulmón, con ventilación no invasiva o intubación orotraqueal. El uso de vasodilatadores y reducción de la poscarga ayudan a reducir la IM y aumentan el flujo anterógrado. En los casos en que la presentación clínica sea el shock cardiogénico, será necesario prescribir vasopresores e inotrópicos, y también pueden precisarse dispositivos de asistencia ventricular23. La tasa de mortalidad con tratamiento médico solo es cercana al 50%, por lo que se recomienda el abordaje quirúrgico temprano24.
La cirugía urgente es el tratamiento de elección para estos pacientes. A diferencia de la cirugía de la RSV, la cirugía de la RMP no suele involucrar manipulación de miocardio necrótico, por lo que la mortalidad relacionada con el propio procedimiento es menor; aunque presenta una elevada variabilidad, la supervivencia de los pacientes en tratamiento solo médico es muy baja23. Existe cierta controversia acerca del abordaje quirúrgico óptimo, ya que idealmente se debería realizar reparación de la válvula mitral en lugar de recambio, pero esto solo se recomienda en centros experimentados en dicho procedimiento. Por ello, en general, se realiza con mayor frecuencia el recambio de la válvula mitral con conservación del músculo papilar, dado que es un procedimiento con una durabilidad establecida. Además, la revascularización coronaria deberá llevarse a cabo en el mismo procedimiento si el paciente lo precisa23,24.
Opciones de tratamiento percutáneoAunque el tratamiento quirúrgico continúa siendo el tratamiento de elección para los pacientes con IM grave secundaria a RMP, el riesgo quirúrgico puede ser prohibitivo para algunos. En la IM crónica, la reparación percutánea borde a borde se ha convertido en el tratamiento de elección para los pacientes con riesgo quirúrgico prohibitivo. Para algunos pacientes con IM aguda grave por RMP en shock cardiogénico y con riesgo quirúrgico prohibitivo, la reparación percutánea borde a borde puede ser una opción terapéutica25. Se han presentado algunas comunicaciones de casos en los que se ha utilizado con éxito el MitraClip (Abbott, Estados Unidos) para el tratamiento de estos pacientes; sin embargo, esta información debe ser analizada con precaución puesto que es posible que exista un sesgo de publicación; cada caso debe ser individualizado y analizado por equipos multidisciplinarios para su mejor tratamiento26.
Otras opciones de tratamiento para pacientes con riesgos quirúrgicos prohibitivos incluyen el tratamiento médico junto con dispositivos de asistencia ventricular como terapia puente para estabilizar y mejorar las condiciones clínicas del paciente y hacerlo candidato a reparación mitral quirúrgica o a trasplante cardiaco24.
Las prótesis ortotópicas aún no se han ensayado en este contexto, pero ofrecen una nueva y prometedora opción en estas situaciones cuando la alternativa borde a borde no sea factible.
Rotura de la pared libre del ventrículo izquierdoLa rotura miocárdica suele afectar más al ventrículo izquierdo que al derecho, motivo por el cual en la literatura se hace más referencia a esta como RPLVI y se define como la necrosis transmural y la consecuente rotura de la pared ventricular isquémica, con sangrado hacia el espacio pericárdico, lo que eventualmente ocasiona taponamiento cardiaco. Se considera que la arteria descendente anterior y la circunfleja suelen ser las culpables en la mayoría de los casos27.
Se desconoce la incidencia real de la RPLVI, ya que en muchas ocasiones su presentación es en forma de muerte súbita extrahospitalaria. Sin embargo, esta deberá sospecharse cuando el paciente se presente con inestabilidad hemodinámica o shock cardiogénico después de un IAM, especialmente en el contexto de IAM no reperfundido o terapias de reperfusión farmacológicas inefectivas28.
Se han comunicado factores de riesgo en diversos estudios observacionales en la era de la reperfusión; entre ellos, se ha observado que ocurre con una frecuencia cerca de 10 veces mayor en los pacientes que cuentan con las siguientes características: sin antecedentes de angina o de IAM, IAM no reperfundido o tratamiento de reperfusión farmacológico inefectivo y concentraciones elevadas de la fracción MB de la creatincinasa (> 150 U/l)27.
La presentación clínica es variable y depende de si la RPLVI es completa o incompleta; en la primera la presentación clínica será con taponamiento cardiaco y muerte súbita, mientras que en la segunda, como la rotura suele contenerse y sellarse con trombo organizado y el pericardio, la presentación suele ser menos dramática, con dolor torácico de características anginosas o pericárdicas27. La RPLVI se puede presentar en de los primeros 5 días después del IAM, pero hasta el 90% de los casos se presentan 2 semanas tras el IAM. A la exploración física se encuentran clásicamente distensión yugular venosa, ruidos cardiacos abolidos o disminuidos, pulso paradójico o una evidente disociación electromecánica28.
El diagnóstico se basa en los signos clínicos y ecocardiográficos de taponamiento cardiaco. El ecocardiograma típicamente objetivará derrame pericárdico con fisiología de taponamiento cardiaco y evidencia de colapso de las cavidades cardiacas; en algunos casos se puede observar la rotura28.
La supervivencia de estos pacientes depende del reconocimiento temprano de la rotura y el rápido establecimiento del tratamiento. Para los pacientes en quienes se sospecha una RPLVI, el tratamiento médico inicial se dirige a la estabilización hemodinámica con fluidos, vasopresores y soporte inotrópico. La periocardiocentesis urgente está indicada como terapia de rescate28. Si el paciente se estabiliza y el sangrado se detiene, podría justificarse en algunos casos el tratamiento conservador, pero la cirugía de urgencia debe considerarse como primordial. La mayoría de los pacientes no sobreviven a esta fase aguda, ya que sufren un shock cardiogénico que lleva a la parada cardiorrespiratoria típicamente con actividad eléctrica sin pulso29.
En cuanto a la técnica quirúrgica, como las suturas pueden desgarrar fácilmente el tejido necrótico que se encuentre extremadamente lábil, deben evitarse técnicas de cierre directo. Las 2 técnicas más frecuentemente utilizadas son la infarterectomía con reconstrucción con parche de la pared del ventrículo y la cobertura total de la región afectada con un parche sobredimensionado de pericardio reforzado con pegamento30.
La RPLVI tiene el peor pronóstico de todas las complicaciones mecánicas tras el IAM. Según los datos comunicados en el SHOCK Trial Registry, su mortalidad hospitalaria es cercana al 70%24.
No existen alternativas percutáneas para el tratamiento definitivo de esta complicación, aunque sí se han comunicado casos anecdóticos de cierre mediante dispositivos del tipo Amplatzer (Abbott, Estados Unidos), pero generalmente en casos de presentación tardía sobre seudoaneurisma31.
COMPLICACIONES MECÁNICAS TARDÍASAneurisma verdadero del ventrículo izquierdoEl aneurisma verdadero del ventrículo izquierdo (AVVI) se define como una protrusión anormal de la pared vascular conteniendo todas las capas de la estructura original. Se caracteriza por ser una pared definida, delgada, cicatrizada o fibrótica y que carece de tejido muscular o contiene músculo necrótico como resultado de un IAM transmural curado. Dicho segmento típicamente es acinético o discinético. Aproximadamente el 85% de los AVVI se localizan en el ápex o la pared anterior debido a la oclusión total de la arteria descendente anterior y la ausencia de circulación colateral. Únicamente del 10 al 15% de los AVVI afectan a la pared inferior por la oclusión total de la coronaria derecha, mientras que los AVVI de la pared lateral por la oclusión total de la circunfleja son extremadamente infrecuentes32.
En cuanto a su incidencia, previamente se presentaban hasta en el 35% de los IAM, pero con el advenimiento de la reperfusión farmacológica y percutánea ha disminuido a un 10-15% de los casos33.
Puede producirse una serie de complicaciones serias como consecuencia de los AVVI, entre las que destacan la insuficiencia cardiaca, las arritmias ventriculares y los fenómenos embólicos32. El resultado final de una sobrecarga de volumen a largo plazo con isquemia prolongada es un ventrículo izquierdo dilatado e insuficiente. Las arritmias ventriculares pueden resultar por 2 mecanismos. El primero es una isquemia del tejido miocárdico que ocasiona aumento del automatismo y el segundo es que la zona del aneurisma esté compuesta por una mezcla de tejido fibroso, necrótico y células inflamatorias, lo que puede crear focos ectópicos arritmogénicos. De cualquier manera, estas arritmias ventriculares pueden ocasionar muerte súbita. Tanto la estasis sanguínea en el aneurisma como el contacto de la sangre con tejido fibroso procoagulante del aneurisma condicionan la formación de trombos, los cuales están presentes hasta en el 50% de los pacientes con AVVI. Debido a esto pueden ocurrir eventos de embolia sistémica, entre los que destaca la embolia cerebral, por lo que la anticoagulación es parte del tratamiento de estos pacientes32,33.
Para los aneurismas pequeños o medianos, el tratamiento puede ser solo médico, con tasas de supervivencia> 90% a los 5 años según distintas publicaciones. Dicho tratamiento consiste en fármacos que reduzcan la poscarga, como los inhibidores de la enzima de conversión de la angiotensina, los fármacos antianginosos y los anticoagulantes orales si hay evidencia de un trombo en el aneurisma o el ventrículo izquierdo33.
Por otro lado, en cuanto a los aneurismas grandes, tanto las guías estadounidenses como la europea recomiendan como opción razonable una aneurismectomía acompañada de cirugía de revascularización coronaria para los pacientes que tengan arritmias ventriculares intratables, angina refractaria a tratamiento médico, insuficiencia cardiaca refractaria a tratamiento médico o eventos embólicos a pesar de anticoagulación óptima. En esas situaciones, la reparación quirúrgica es altamente efectiva y resulta en mejoras significativas en la supervivencia, los síntomas y la clase funcional de los pacientes respecto al tratamiento solo médico34.
Seudoaneurismas del ventrículo izquierdoLos seudoneurismas del ventrículo izquierdo o falsos aneurismas se forman cuando la rotura cardiaca se contiene por adherencias de pericardio o por tejido cicatricial. A diferencia de los AVVI, no contienen endocardio ni miocardio y también, en comparación con los verdaderos, los seudoaneurismas afectan con más frecuencia a la pared inferior o lateral, probablemente como resultado del desarrollo de adherencias pericárdicas en un paciente recostado y convaleciente tras un IAM35.
Antes se consideraba que estos pacientes podrían presentar una serie de signos y síntomas poco específicos e incluso algunos podrían encontrarse asintomáticos; sin embargo, estudios recientes han demostrado que la mayoría de los pacientes presentan, en algún momento de su evolución, síntomas de insuficiencia cardiaca, angina, arritmias ventriculares y embolia sistémica, como suele ocurrir con los AVVI36.
El ecocardiograma suele ser el estudio de diagnóstico inicial, pero la precisión diagnóstica es baja. El método más certero para realizar el diagnóstico es la angiografía, en la cual se objetivará un orificio estrecho que conduce a un aneurisma sacular. Tanto la tomografía computarizada como la resonancia magnética son alternativas a la angiografía y ambas son de gran utilidad para distinguir un AVVI de un seudoneurisma del ventrículo izquierdo35.
Los seudoneurismas del ventrículo izquierdo no tratados tienen hasta un 45% de riesgo de rotura, por lo que la recomendación es referir al paciente a cirugía de urgencia en cuanto se alcance el diagnóstico36. La cirugía se considera la opción de tratamiento preferida, ya que con las técnicas actuales la mortalidad perioperatoria es menor del 10%32. En cuanto a la técnica quirúrgica, se suele realizar la misma que para los aneurismas verdaderos34.
Opciones de tratamiento percutáneoEl cierre percutáneo de los seudoneurismas del ventrículo izquierdo debe considerarse como una alternativa a la cirugía tradicional para pacientes con alto riesgo quirúrgico y particularmente en los casos en que no se precise cirugía de revascularización coronaria concomitante37. La factibilidad y la eficacia del cierre percutáneo de seudoneurismas del ventrículo izquierdo con dispositivos de oclusión septal se ha demostrado en diversas publicaciones38. En dichos casos, se requieren técnicas de imagen como la tomografía computarizada y la resonancia magnética para conocer de manera precisa la anatomía y planear el procedimiento37,38.
RETOS EN EL TRATAMIENTO PERCUTÁNEO DE LAS COMPLICACIONES MECÁNICAS DEL IAMAunque en la actualidad se producen complicaciones mecánicas en menos del 1% de los pacientes que ingresan con un IAM, es necesario centralizar los casos en centros con la experiencia necesaria para su tratamiento exitoso y que dispongan de todos los medios técnicos que puedan requerir.
Esta centralización sería clave para la inclusión sistemática de estos pacientes en ensayos clínicos de carácter pragmático que permitan desarrollar vías asistenciales exitosas y reduzcan la enorme variabilidad asistencial existente en la actualidad. La escasa evidencia en lo referente a opciones terapéuticas proviene fundamentalmente de series de casos, de modo que está afectada por un sesgo de publicación. Para ello, una iniciativa global, quizá amparada en el contexto del grupo de expertos que ha elaborado el reciente documento sobre shock cardiogénico39, podría ser útil para registrar y mejorar la asistencia de las complicaciones mecánicas y adquirir la destreza necesaria de los equipos quirúrgicos e intervencionistas. Asimismo la investigación futura debe abordar la indicación y el tipo de dispositivos de asistencia circulatoria y el momento más adecuado de la intervención apoyado en la nueva y más extensa disponibilidad de dichas asistencias.
CONCLUSIONESLa revascularización temprana es el tratamiento de elección para los pacientes con IAM. Gracias a la extensión de la angioplastia primaria, la incidencia de las complicaciones mecánicas en nuestro entorno es menor del 0,1%. Sin embargo, cuando estas ocurren, la presentación clínica es dramática, con inestabilidad hemodinámica aguda y una alta tasa de mortalidad asociada, por lo que precisan de un reconocimiento inmediato y tratamiento urgente. Se requiere un abordaje y un tratamiento multidisciplinarios para conseguir el mejor tratamiento, percutáneo o quirúrgico, así como su aplicación en el momento idóneo. La menor invasividad y la mayor rapidez del implante percutáneo de sistemas de asistencia circulatoria abren asimismo la posibilidad de mantener estables a los pacientes hasta que se les pueda ofrecer la mejor alternativa terapéutica definitiva. Esta estrategia puede ayudar a que la experiencia en técnicas percutáneas crezca y favorecer así resultados más reproducibles e investigaciones prospectivas adecuadas.
FINANCIACIÓNNinguna.
CONTRIBUCIÓN DE LOS AUTORESAmbos autores participaron en el diseño del artículo y aprobaron la versión final.
CONFLICTO DE INTERESESNinguno relacionado con este trabajo.