Palabras clave
INTRODUCCIÓN
La tomografía de coherencia óptica (OCT) ha surgido en los últimos años como uno de los instrumentos de diagnóstico intracoronario más prometedores1,2. Esta técnica de imagen óptica, basada en la luz, permite generar imágenes de la arteria coronaria con un nivel de resolución (10 mm) que no se había alcanzado nunca antes in vivo. Ello ha proporcionado nuevas perspectivas respecto a la alteración anatomopatológica existente en la placa aterosclerótica, así como respecto a la respuesta aguda y a largo plazo de la pared del vaso a la implantación del stent3-8.
Hasta el momento, la principal dificultad para una aplicación clínica generalizada de la OCT intracoronaria ha sido la complejidad del procedimiento de obtención de las imágenes. La sangre causa una dispersión múltiple de la luz y una considerable atenuación de la señal, por lo que es preciso retirarla temporalmente del vaso sanguíneo durante la captación de la imagen de OCT. La primera generación de sistemas de OCT de dominio de tiempo (OCT-DT) que se comercializaron utilizaba una oclusión proximal del vaso mediante un balón de baja presión (0,5 atm), similar al de la angioscopia, y una aplicación distal simultánea de infusión durante la retirada de la sonda de obtención de imagen de OCT9. Este protocolo limitaba el segmento coronario del que se podía obtener imágenes, y comportaba de forma intrínseca la creación de una isquemia miocárdica durante dicha obtención, lo cual limitaba el uso de la OCT a cohortes de pacientes seleccionadas10-13.
La nueva generación de sistemas de OCT (otros nombres utilizados para la misma tecnología son OCT de dominio de Fourier [OCT-DF], imagen de dominio de frecuencia óptica [IDFO], imagen de dominio espectral u OCT de fuente de barrido) se desarrolló para superar esta limitación. El aspecto más destacado de estos sistemas de OCT de segunda generación es que no requieren una oclusión transitoria mediante un balón. La capacidad sin precedentes que proporcionan para la captación de datos y las velocidades de retirada (20 mm/s) permiten la visualización de segmentos coronarios largos en pocos segundos, mientras se desplaza temporalmente la sangre mediante la inyección de una infusión a través del catéter guía14.
Aunque este concepto es atractivo, no se ha realizado ninguna investigación sistemática para evaluar las repercusiones que tienen estas altas velocidades de retirada en la reproducibilidad de los datos obtenidos en el contexto clínico. Desde un punto de vista teórico, la obtención rápida reduce los artefactos de movimiento durante el ciclo cardiaco y, por consiguiente, las posibles fuentes de error, mientras que el aumento de la distancia entre imágenes transversales consecutivas podría introducir otras nuevas. La frecuencia de fotogramas de la OCT-DF es habitualmente de 100 fps, que a una velocidad de retirada de 20 mm/s corresponden a 5 fotogramas/mm, es decir, una distancia entre fotogramas de 200 mm. La frecuencia de fotogramas habitual en la OCT-DT es de 20 fps, que a una velocidad de retirada de 3 mm/s da lugar a 7 fotogramas/mm, es decir, una distancia entre fotogramas de 142 mm. El objetivo del presente estudio es evaluar la reproducibilidad de la nueva generación de sistemas de OCT-DF intracoronaria en la evaluación de la placa y del stent in vivo. Investigamos, pues, la reproducibilidad de las características morfológicas de las que anteriormente se ha descrito que pueden tener relevancia clínica en los pacientes a los que se practica una intervención coronaria percutánea (ICP).
MÉTODOS
Población del estudio
Entre mayo y diciembre de 2008 se incluyó en el estudio a pacientes no consecutivos para los que se había programado una ICP electiva. El protocolo del estudio fue aprobado por el Comité Ético del Erasmus Medical Center. Todos los pacientes dieron su consentimiento informado por escrito. Los criterios de exclusión para la exploración de imagen con OCT-DF fueron los siguientes: a) flujo TIMI 0 en la localización de la lesión diana, y b) lesión situada después de curvas agudas o en una localización de la anatomía coronaria que el catéter no puede superar.
Principios técnicos de la tomografía de coherencia óptica de nueva generación
La OCT utiliza la luz reflejada para crear imágenes transversales de alta resolución del vaso sanguíneo. Un interferómetro divide la fuente de luz en dos «ramas» (una rama de referencia y otra de muestra, que se dirige al interior del tejido). Las imágenes se crean a partir de la comparación de la intensidad óptica reflejada procedente de las dos ramas (señal de interferencia).
Los primeros sistemas de OCT que se utilizaron en el ámbito clínico utilizaban la tecnología DT, mientras que los sistemas de nueva generación se basan en la tecnología DF.
Tanto la OCT-DT como la OCT-DF utilizan una luz próxima al infrarrojo de baja coherencia. Se elige una longitud de onda de aproximadamente 1.300 nm, ya que con ello se reduce al mínimo la absorción de energía producida en el haz de luz por las proteínas, el agua, la hemoglobina y los lípidos. La OCT-DT utiliza una fuente de luz de banda ancha y la rama de referencia contiene un espejo móvil que permite el examen de cada posición de profundidad en la imagen píxel a píxel. Este proceso de examen mecánico limita la rapidez con la que se obtienen las imágenes. La OCT-DF utiliza como fuente de luz un láser de barrido de longitud de onda, y el espejo de la rama de referencia es fijo. Este cambio en la tecnología da lugar a una mejor relación señal/ruido15 y a unos barridos más rápidos, con lo que permite una frecuencia de líneas A extraordinariamente superior y, por lo tanto, una captación de imágenes más rápida y una velocidad de retirada mayor que la de OCT-DT16,17.
Sistemas de tomografía de coherencia óptica de dominio de Fourier
Se utilizaron dos prototipos diferentes de OCT-DF (LightLab Imaging, Inc., Westford, Massachusetts, y Wellman Center for Photomedicine, MGH, Boston, Massachusetts). Todos los sistemas emplean un láser de barrido de longitud de onda como fuente de luz. En la tabla 1 se resumen las especificaciones de los sistemas de segunda generación en comparación con la OCT-DT (LightLab Imaging, Inc.). Todos los catéteres de obtención de imagen de la OCT-DF tenían un diseño de monorraíl corto, con perfiles del catéter que oscilaban entre 2,4 y 3,2 Fr, pero todos ellos eran compatibles con los catéteres guía de calibre 6 Fr. Los catéteres de obtención de imagen de OCT-DF contenían un núcleo de imagen de fibra óptica cubierto por una vaina translúcida y retraído en ella. El núcleo de imagen óptica tenía una rotación a aproximadamente 100 revoluciones/s y la velocidad de retirada oscilaba entre 5 y 20 mm/s con el empleo de un dispositivo de retirada dedicado. Los datos se procesaron en tiempo real y se almacenaron digitalmente.
Obtención de datos de tomografía de coherencia óptica
Utilizamos una vía de abordaje femoral estándar en todos los pacientes. Se administró heparina no fraccionada, con dosis ajustadas según el peso, para mantener un tiempo de coagulación activada > 300 s. Tras la colocación del catéter de guía (6 Fr) en el ostium coronario, se introducía una guía de ICP estándar en la arteria coronaria de la forma convencional. La obtención de imágenes de OCT-DF se realizó antes de la implantación del stent (cohorte A) y después de la implantación (cohorte B). Tras la administración de nitratos (0,2 mg de NTG i.c.), se introducía el catéter de imagen de OCT-DF en la arteria coronaria con una técnica de intercambio rápido.
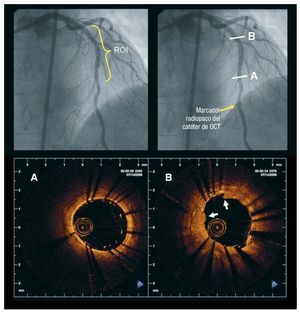
Los marcadores radiopacos situados en el extremo distal del catéter y en el número de obtención de imagen permitían la colocación de la sonda óptica distalmente a la región de interés (fig. 1). Tras la colocación del catéter de OCT-DF, se retiraba la sangre mediante la inyección de un contraste isoosmolar (Iodixanol 370, Visipaque®, GE Health Care, Irlanda) a 37 °C, mediante una bomba de inyección (Mark-V ProVis, Medrad, Inc., Indianola, Pennsylvania, Estados Unidos) a velocidad de flujo de 3 ml/s, a través del catéter guía. La retirada de la OCT-DF se iniciaba en cuanto se había eliminado la sangre de la arteria y se detenía cuando el núcleo de obtención de imagen alcanzaba el catéter guía.
Fig. 1. Procedimiento de obtención de imágenes en la tomografía de coherencia óptica-dominio de Fourier (OCT-DF). La angiografía (superior izquierda) muestra una ADA tratada mediante implantación repetida de stents a causa de la reestenosis en ellos. La región de interés (ROI) para la exploración de OCT fue el área de implantación de stents. La imagen superior derecha muestra el marcador radiopaco del catéter de OCT colocado distalmente a la ROI (flecha). Los dos paneles inferiores muestran dos imágenes de OCT-DF obtenidas en esa área (sistema Lightlab Imaging, Inc.). A: parte distal de un stent recién implantado, en el que se aprecia la mala aposición del stent. B: corte transversal en la región de la reestenosis después de la nueva implantación del stent. Se observan dos capas de struts, y el tejido neointimal aparece alterado y protruye al interior de la luz (flechas blancas). ADA: arteria descendente anterior; OCT: tomografía de coherencia óptica.
Evaluación de la reproducibilidad entre estudios y entre observadores
Las retiradas en las coronarias nativas, así como tras la implantación del stent, se analizaron de la siguiente forma. Para evaluar la reproducibilidad entre estudios, se repitió la retirada de OCT-DF a través de la región de interés utilizando el mismo catéter en dos ocasiones y en idénticas condiciones de velocidad de retirada, frecuencia de fotogramas y velocidad de infusión. No se retiró el catéter de la arteria entre las dos adquisiciones. Estas dos retiradas se analizaron de manera independiente. Para evaluar la variabilidad entre observadores, dos analistas de OCT experimentados revisaron las primeras retiradas de OCT-DF de manera independiente. Para evaluar la variabilidad en un observador, un mismo observador repitió el análisis de la misma retirada al cabo de 1 semana.
Evaluación del stent
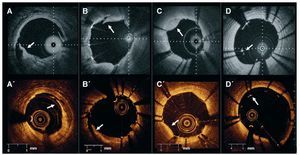
Tras la implantación del stent, se evaluó la coincidencia de estudio y observador para los siguientes parámetros, utilizando las definiciones indicadas18: a) disección del borde: alteración de la superficie vascular intraluminal en los bordes del stent (5 mm proximal y distal); b) prolapso tisular: protrusión de tejido entre los struts del stent sin pérdida de la continuidad de la superficie vascular intraluminal; c) disección en el stent: alteración de la superficie vascular intraluminal en el segmento del stent, y d) mala aposición: presencia de al menos un strut separado de la pared vascular (fig. 2). Se evaluó la incidencia de estos fenómenos por vaso examinado.
Fig. 2. Evaluación de la implantación del stent. Ejemplos clínicos de disección del borde (A, A'), disección en el stent (B, B'), prolapso tisular (C, C') y mala aposición (D, D'), obtenidos con diferentes sistemas de tomografía de coherencia óptica de dominio de Fourier en distintos pacientes (panel superior, Wellman Center for Photomedicine, MGH; panel inferior, Lightlab Imaging, Inc.)
Evaluación del tipo de placa
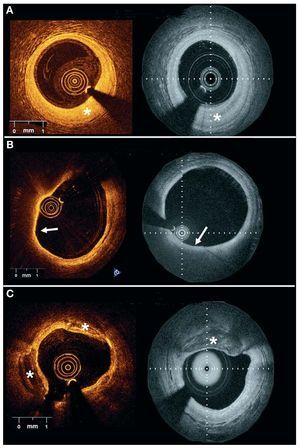
Se evaluaron segmentos coronarios nativos de la siguiente forma. Se seleccionaron sesenta placas ateroscleróticas correspondientes en las dos retiradas, con el empleo de puntos de referencia como las ramas laterales o los bordes del stent. Los dos observadores evaluaron las placas preseleccionadas utilizando las siguientes definiciones: a) placa fibrosa: regiones homogéneas con una alta reflectividad; b) placa fibrocalcificada: regiones de baja reflectividad con límites bien definidos, y c) placa rica en lípidos: regiones de baja reflectividad con límites difusos5 (fig. 3).
Fig. 3. Ejemplos de diferentes tipos de placa obtenidos con dos sistemas de tomografía de coherencia óptica-dominio de Fourier en distintos pacientes. A: las placas fibrosas (*) se visualizan en forma de regiones homogéneas de alta reflectividad. B: las placas ricas en lípidos se observan en forma de regiones de reflectividad baja, sin bordes delimitados y generalmente cubiertas por una cubierta fibrosa (flecha blanca). C: las placas fibrocalcificadas (*) aparecen en forma de regiones de baja reflectividad con bordes bien definidos (panel izquierdo, Lightlab Imaging, Inc.; panel derecho, Wellman Center for Photomedicine, MGH).
Análisis estadístico
Las variables continuas se expresan en forma de media ± desviación estándar y las variables discretas, en forma de porcentajes. Se utilizó el coeficiente kappa para valorar la coincidencia entre estudios, entre observadores y en un observador en cuanto a la caracterización de la placa y la evaluación del stent.
RESULTADOS
Características de los pacientes y éxito de la exploración de imagen con tomografía de coherencia óptica de dominio de Fourier
Se incluyó en el estudio a 45 pacientes (49 vasos). La media de edad era 63 ± 10 años y un 80% eran varones. La incidencia de factores de riesgo cardiovascular era la siguiente: 23/45 (51%) hipertensión, 12/45 (27%) diabetes mellitus, 29/45 (64%) dislipemia y 13/45 (30%) tabaquismo actual. Un total de 19 pacientes (42%) habían sufrido un infarto de miocardio previamente, a 7/45 (16%) ya se les había practicado una intervención de bypass arterial coronario y 22/45 (49%) ya habían sido tratados con una ICP. La indicación para la ICP electiva fue una angina estable en 31/45 (69%) pacientes, una angina inestable en 10/45 (22%) y un infarto agudo de miocardio en 4/45 (9%).
Se pudo colocar con éxito la sonda de obtención de imágenes en la arteria coronaria en todos los pacientes. En 97 retiradas se obtuvieron imágenes de excelente calidad. Se observaron artefactos que no permitieron una evaluación adecuada de la imagen en 12 retiradas y otras 2 no fueron evaluables a causa de una limpieza incompleta de la sangre. Las características del procedimiento de exploración se resumen en la tabla 2. El tipo de stent implantado quedó a criterio del operador. En 10 pacientes, la OCT-DF se realizó antes y después de la implantación del stent a criterio del operador. Después del tratamiento de la lesión causal, se seleccionó un segundo vaso para la evaluación de la placa en 2 pacientes (4,5%) y para el seguimiento de un stent implantado previamente en 9 pacientes (20%).
Durante la obtención de imágenes de OCT-DF, se observó un dolor torácico transitorio o la aparición de alteraciones del ECG en el 8 y el 10% de los pacientes respectivamente. Las alteraciones del ECG consistieron en depresión del ST o cambios de la onda T. No se observaron elevaciones del ST en ningún caso. No se produjo ninguna disección coronaria, perforación, espasmo, embolización, arritmia u otro acontecimiento adverso.
Reproducibilidad de la evaluación del stent
Se realizó un análisis de la OCT después de la implantación del stent en 27 pacientes (28 vasos). Se observó una disección del borde en 14 vasos (50%). En 25 casos (89%) se apreciaron signos de prolapso tisular, y en 26 (93%) hubo una disección en el stent. Se identificó una mala aposición de al menos un strut en 23 vasos (82%). La reproducibilidad entre estudios (17 vasos) en cuanto a la visualización de la disección del borde, el prolapso tisular, la disección en el stent y la mala aposición fue excelente (k = 1; p < 0,001). En la tabla 3 se indican los valores de kappa para la reproducibilidad entre observadores en un observador.
Reproducibilidad de la caracterización de la placa
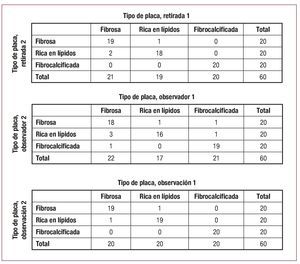
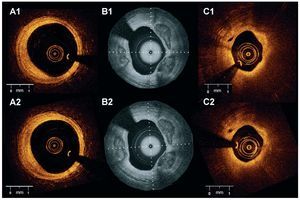
En total, se identificaron 60 placas en las dos retiradas. En la figura 4 se resumen los resultados de la clasificación. Hubo coincidencia entre las dos retiradas en cuanto a la clasificación de la placa en 57 de las 60 placas (k = 0,92; p < 0,001) (fig. 5). La variabilidad entre observadores mostró coincidencia para dos observadores en la clasificación de 53 de 60 placas (k = 0,82; p < 0,001). La variabilidad en un observador mostró coincidencia en la clasificación de 58 de las 60 placas (k = 0,95; p < 0,001).
Fig. 4. Reproducibilidad entre estudios, entre observadores y en un observador para la caracterización de la placa.
Fig. 5. Reproducibilidad entre estudios para la caracterización de la placa. La figura muestra las imágenes correspondientes de las mismas placas obtenidas en dos retiradas diferentes en la arteria. A1 y A2: placa fibrosa. B1 y B2: placa fibrocalcificada. C1 y C2: placa rica en lípidos (A y C, Lightlab Imaging, Inc.; B, Wellman Center for Photomedicine, MGH).
DISCUSIÓN
Éste es el primer estudio en que se evalúa la reproducibilidad entre estudios, entre observadores y en un observador de los sistemas de OCT-DF para la evaluación del stent y la caracterización de la placa in vivo.
La tecnología de OCT-DF de nueva generación con una retirada de alta velocidad tiene una excelente reproducibilidad entre estudios in vivo, permite una clasificación reproducible de la placa y una evaluación del traumatismo vascular periintervención asociado a la implantación del stent coronario, con baja variabilidad entre observadores, en el observador y entre estudios.
El presente estudio confirma también que los nuevos sistemas de OCT permiten visualizar segmentos coronarios más largos (media, 54,4 ± 12,5 mm) en menos tiempo (media, 3,5 ± 1,4 s) y con menor volumen de infusión que lo descrito anteriormente para la OCT-DT10. Esto concuerda con lo indicado por un estudio recientemente publicado de Takarada et al19, en el que se comparó la OCT-DT con la OCT-DF en pacientes tratados con stents.
La OCT ha evolucionado rápidamente hasta llegar a ser un instrumento de obtención de imágenes intracoronarias atractivo para los cardiólogos intervencionistas, puesto que ofrece la posibilidad de abordar cuestiones de trascendencia clínica para mejorar la implantación habitual de los stents y, en consecuencia, los resultados a largo plazo. Su elevada resolución in vivo permite realizar una evaluación exacta de la interacción mecánica entre el stent y la pared vascular, incluida la aposición de los struts y las disecciones periintervención3,18. En la actual era de los stents liberadores de fármacos, no se conocen bien las razones de los fallos, incluidas las reestenosis y la trombosis tardía del stent. En este escenario clínico concreto, una evaluación detallada de la microestructura vascular podría ser útil para prevenir los episodios que pueden poner en peligro la vida, como la trombosis del stent, puesto que ésta se ha relacionado con la cicatrización incompleta, el fallo mecánico del stent y la cobertura incompleta de lesiones ricas en lípidos o con núcleo necrótico3,4,20-23. La técnica de obtención de imágenes, relativamente compleja, dificultó el uso de los dispositivos de OCT de dominio temporal de primera generación en pacientes tratados con una ICP. En el presente estudio, hemos evaluado los nuevos sistemas de OCT-DF, que simplifican la técnica de obtención de imágenes y pueden contribuir a la difusión de la aplicación clínica de esta tecnología de diagnóstico por la imagen.
Los datos presentados en este artículo corresponden a los primeros casos de utilización en nuestro centro de los sistemas de OCT-DF y reflejan también la curva de aprendizaje de los operadores. La optimización de la técnica de adquisición puede reducir el número de casos de retirada incompleta de la sangre. Un reciente estudio ha indicado que la OCT-DF permite una visualización clara del 99,4% de los segmentos examinados para la obtención de imágenes (en comparación con el 80,8% observado con la OCT-DT)19.
Reproducibilidad de la evaluación del stent
La OCT ha resultado útil para la evaluación de los efectos agudos de la implantación del stent en la pared vascular18. En el presente estudio, una proporción elevada de los pacientes presentó signos de prolapso tisular entre los struts del stent o disecciones en el stent, y en la mitad de los casos se pudo apreciar también disecciones del borde. De manera aún más pronunciada, se observó una mala aposición de al menos uno de los struts en la mayoría de los casos. La reproducibilidad entre observadores y en un observador de la OCT-DT para la evaluación del stent tras la implantación fue examinada por Kubo et al24. Esos autores observaron una concordancia en el observador aceptable para la aposición inadecuada del stent (k = 0,9), la protrusión tisular (k = 0,92), la disección del borde del stent (k = 0,96) y la rotura de placa residual (k = 0,92). Se observó una concordancia entre observadores comparativamente inferior para la aposición inadecuada del stent (k = 0,75), la protrusión tisular (k = 0,86), la disección del borde del stent (k = 0,89) y la rotura de placa residual (k = 0,86). En nuestros datos, la reproducibilidad entre estudios para la identificación de la disección del borde, el prolapso tisular, la disección en el stent y la mala aposición fue excelente. La reproducibilidad entre observadores y en un observador mostró un cierto grado de variabilidad, sobre todo en cuanto a la evaluación de la mala aposición. En el presente estudio, la mala aposición se evaluó mediante examen visual. Este análisis cualitativo puede verse afectado por el artefacto de la sombra producida por los struts. Además, con los stents liberadores de fármacos es preciso tener en cuenta la presencia del polímero al evaluar la mala aposición, y debe aplicarse una corrección para el grosor del strut de cada tipo específico de stent. El uso de un método cuantitativo para definir la mala aposición podría ser útil para mejorar la reproducibilidad entre observadores y en un observador25,26.
La evaluación de la mala aposición del stent tiene trascendencia clínica, puesto que hay datos de ecografía intravascular que indican una posible relación entre este fenómeno y la trombosis del stent27. Estudios previos han señalado un aumento de la mala aposición en las áreas de solapamiento y en los diseños en celdas cerradas25. Esto podría ser un posible vínculo con la fractura del stent y la reestenosis.
En un estudio previo de OCT de nuestro grupo18 se observó que, tras la implantación del stent, se apreciaba un prolapso tisular en el 97,5% de los casos, una disección en el stent en el 86,3% y una disección del borde en el 25%. Además, el 63,8% de los pacientes presentaron al menos un strut con mala aposición. Este estudio puso de manifiesto también que estas observaciones no se asociaban a episodios clínicos durante la hospitalización. Sin embargo, no se conocen las implicaciones que esto tiene a largo plazo, y se debería investigarlo en futuros estudios. La OCT de segunda generación ha hecho que esta información sea mucho más asequible, gracias a la simplificación del procedimiento de captación de las imágenes. Esto facilita en gran manera los estudios destinados a valorar la trascendencia clínica de estas observaciones en poblaciones amplias de pacientes, sobre todo con métodos de evaluación cuantitativos para la mala aposición.
Reproducibilidad de la caracterización de la placa
El presente estudio muestra también una excelente reproducibilidad entre estudios en lo que se refiere a la caracterización de la placa. De las 60 placas, 57 se clasificaron de manera coincidente en las dos retiradas. Sólo hubo 3 casos de clasificación errónea entre las placas fibrosas y ricas en lípidos. La variabilidad entre observadores y en un observador en cuanto a la caracterización de la placa concuerda con lo descrito con los datos in vitro de la OCT-DT (k = 0,88 y k = 0,91 respectivamente)5. In vivo, Jang et al28 han descrito una aceptable concordancia en el observador para la placa rica en lípidos (k = 0,86) y la calcificación (k = 0,88), con mayor variabilidad entre observadores (placa rica en lípidos, k = 0,47; calcificación, k = 0,57). A diferencia de los datos presentados anteriormente, que han resaltado el riesgo de clasificación errónea entre los depósitos de lípidos y los de calcio29, en nuestra serie la discrepancia más frecuente entre los observadores fue en la clasificación de las placas fibrosas y las ricas en lípidos. Esto podría estar relacionado con la presencia de artefactos derivados de la posición del catéter o de su eficiencia óptica durante la rotación. Estos artefactos pueden crear regiones de falsa baja reflectividad, que pueden interpretarse erróneamente como placas ricas en lípidos. Los métodos de caracterización cuantitativa de la placa que se están desarrollando podrían ser útiles para superar las limitaciones de la evaluación visual dependiente del observador30. Se ha descrito la obtención de reconstrucciones tridimensionales de las arterias coronarias humanas tratadas con stents, con caracterización de la placa y detección de macrófagos, utilizando imágenes de dominio de frecuencia óptica14. Ello brinda nuevas oportunidades para la evaluación in vivo de la aterosclerosis coronaria y el efecto de la implantación de stents coronarios.
La evaluación de las características de la placa en el laboratorio de cateterismo puede ser útil como guía para la ICP (p. ej., para identificar la menor distensibilidad de las lesiones intensamente calcificadas) y puede tener utilidad para la detección de placas con elevado riesgo de rotura. En comparación con la histología, la OCT ha mostrado altas sensibilidad y especificidad en la detección de algunas de las características asociadas a las lesiones propensas a la rotura, como el núcleo necrótico, la presencia de macrófagos y la cubierta fibrosa fina5,6,8,31-34.
Limitaciones
El estudio presentado es de carácter observacional y tiene un tamaño muestral pequeño. Para evaluar la reproducibilidad entre estudios, se repitió la retirada dos veces en condiciones idénticas. Reconocemos que el cambio en las condiciones de adquisición podría afectar a la reproducibilidad entre estudios. A pesar de que intentamos incluir una amplia variedad de placas ateroscleróticas con diferentes morfología y composición, la preselección de las placas podría haber influido en la reproducibilidad. Reconocemos que algunas de las observaciones clasificadas como prolapso tisular pueden corresponder de hecho a trombos, puesto que la distinción entre estas dos entidades puede resultar difícil después de la implantación del stent.
CONCLUSIONES
La tecnología de OCT de segunda generación (OCT-DF) con una alta velocidad de obtención de datos muestra buena reproducibilidad entre estudios, entre observadores y en el observador para la caracterización de la placa y la evaluación de la implantación del stent en pacientes a los que se practica una ICP.
AGRADECIMIENTOS
Quisiéramos agradecer a Robert Beurskens su inestimable asistencia técnica con los sistemas de obtención de imagen.
ABREVIATURAS
DF: dominio de Fourier.
DT: dominio de tiempo.
ICP: intervención coronaria percutánea.
OCT: tomografía de coherencia óptica.
VÉASEEDITORIALENPÁGS. 885-7
Este estudio fue financiado en parte por Ligthlab Imaging, Inc., y el Wellman Center of Photomedicine.
Full English text available from: www.revespcardiol.org
Correspondencia: Dr. E. Regar.
Thoraxcenter, Bd 585.
's-Gravendijkwal 230. 3015-CE Rotterdam. Países Bajos.
Correo electrónico: e.regar@erasmusmc.nl
Recibido el 11 de diciembre de 2009.
Aceptado para su publicación el 19 de febrero de 2010.