Palabras clave
INTRODUCCIÓN
Aunque la implantación de stents en lesiones de bifurcaciones coronarias aporta un buen resultado angiográfico coronario, las reestenosis (incluso al utilizar stents farmacoactivos) se dan con más frecuencia que en las lesiones más simples. Se continúa considerando que la intervención en las lesiones de bifurcaciones es la situación en que se aplican los stents fuera de las indicaciones aprobadas, dado el posible riesgo de apresamiento de la rama lateral (RL) y de deformación y mala aposición del stent. Las observaciones anatomopatológicas han indicado una posible correlación entre la mala aposición de los struts de los stents y las trombosis de éstos1, lo cual puede explicar que la intervención coronaria percutánea (ICP) para lesiones de bifurcaciones sea un factor de riesgo independiente en cuanto a la trombosis del stent2. La incidencia y los factores predictivos de la trombosis del stent al utilizar diferentes estrategias de ICP para las lesiones de bifurcaciones son objeto de controversia. La mayoría de los estudios han apuntado a que las trombosis de stents son más comunes en las bifurcaciones tratadas con dos stents. En la presentación de la experiencia de los grupos de Milán y Rotterdam, Hoye et al3 indicaron una tasa de trombosis de stents del 4,3% tras la técnica de «aplastado» (crushing). Uno de los dos principales ensayos aleatorizados en los que se ha comparado una estrategia simple de implantación de stent únicamente en el vaso principal (VP) con una estrategia compleja de implantación de stent tanto en el VP como en la RL, el British Bifurcation Coronary Study: Old, New, and Evolving Strategies (BBC ONE), indicó una mayor frecuencia de trombosis de stents en el grupo en que se usó la estrategia de los dos vasos4. Sin embargo, en el estudio nórdico, la incidencia de trombosis de stent en 14 meses fue del 0,5% en el grupo de la estrategia de dos vasos frente al 2% en el grupo de implantación de stent provisional5.
Se prevé que las técnicas de dos vasos induzcan una mayor deformidad y mala aposición del stent6, pero no hay ninguna confirmación in vivo, puesto que la ecografía intravascular (IVUS) no permite detectar con precisión la mala aposición de los struts. La resolución de la tomografía de coherencia óptica (OCT) es unas 10 veces mayor que la de la IVUS, con un menor número de artefactos inducidos por los struts y aporta una evaluación precisa de la aposición de éstos en el contexto de la práctica clínica real7. La OCT ha resultado útil para valorar la aposición de los stents tras el tratamiento de bifurcaciones con el empleo de los nuevos stents de bifurcación8. Además, los resultados de ese estudio constituyen una parte de los del actual grupo de tratamiento complejo.
El objetivo de nuestro estudio fue cuantificar y comparar la aposición de los struts de los stents en las lesiones de bifurcaciones tratadas con una técnica simple (implantación de stent únicamente en el VP) o con una técnica compleja (implantación de stent tanto en el VP como en la RL utilizando la técnica de culotte)9.
MÉTODOS
Población del estudio
Se incluyó en el estudio a todos los pacientes consecutivos a quienes se realizó una exploración de OCT tras la implantación de stents en lesiones de bifurcaciones entre enero de 2006 y septiembre de 2008.
Intervención
La técnica de implantación de stent en VP provisional y la técnica compleja específica se han descrito con anterioridad5,10. En todos los casos se utilizaron catéteres guía de calibre de 6 Fr. Se aplicó en todos los casos una predilatación con un balón de alta presión o de corte, así como una posdilatación con un balón de alta presión. Tras la reintroducción de la guía en la RL, se realizó una posdilatación final con balón kissing (KB) en todos los casos de estrategia compleja, con diámetros de balón adecuados para el diámetro de la RL y el diámetro del VP distal a la bifurcación. La presión de hinchado quedó a criterio del operador, en función del tipo de lesión, la distensibilidad del balón, etc. Se utilizó la técnica de culotte en todos los casos complejos. La decisión de utilizar una técnica simple o compleja se dejó a criterio del operador y se tomó en función de las características anatómicas de la lesión de la bifurcación. El éxito de la intervención se definió por una estenosis del diámetro final < 30% en el VP y < 50% en la RL según la evaluación visual realizada, con un flujo TIMI 3 tanto en el VP como en la RL.
Tratamiento farmacológico y dispositivos utilizados
Antes de la intervención, todos los pacientes recibieron tratamiento con ácido acetilsalicílico y 300-600 mg de clopidogrel. Durante la intervención, se utilizó heparina no fraccionada (UFH) o bien bivalirudina: la administración de UFH se realizó de manera que se mantuviera un tiempo de coagulación activado ≥ 250 s, con un bolo inicial de 70 U/kg, mientras que la bivalirudina se administró en función del peso corporal del paciente. La administración intravenosa o intracoronaria de inhibidores de la glucoproteína IIb/IIIa quedó a criterio del operador.
Análisis angiográfico cuantitativo
Todas las lesiones de bifurcaciones se clasificaron según la clasificación de Medina, en función de la presencia o ausencia de estenosis > 50% en el VP proximal y distal y en el ostium de la RL11. La arteriografía vascular cuantitativa se llevó a cabo con el empleo de un programa informático dedicado de 3 segmentos (QAngio XA 7.1, Medis Medical Imaging System, Leiden, Países Bajos), según lo descrito con anterioridad12.
Técnica de imagen de tomografía de coherencia óptica
En este estudio se utilizó un microcatéter de orificio terminal (0,021" TransitTM, Cordis Neurovascular, Miami Lakes, Florida, Estados Unidos) que se introdujo hasta una posición distal a la lesión en el VP sobre una guía convencional, que se sustituyó luego por la guía de imagen de OCT. La adquisición de imagen de OCT (M3 System, LightLab Imaging Inc. Westford, MA, Estados Unidos) se realizó con una técnica no oclusiva13, con irrigación continua de iodixanol (VisipaqueTM, GE Healthcare, Reino Unido) y con inyector de potencia (2-5 ml/s) y una velocidad de retirada fijada en 3 mm/s. La adquisición de las imágenes a lo largo de un segmento vascular de 30-35 mm se realizó en todos los pacientes sin complicaciones.
Análisis de imágenes de tomografía de coherencia óptica
Las imágenes transversales obtenidas con la retirada de la OCT se analizaron cada 450 mm (cada 3 fotogramas). Dado que la superficie metálica del strut es opaca a la luz infrarroja, no puede observarse la superficie del strut abluminal; por consiguiente, se diagnosticó una mala aposición del strut si la distancia entre la superficie intraluminal siquiera de un solo strut del stent y la pared vascular era superior al grosor del strut (metal + polímero) más un margen de error adicional de 15 mm, correspondiente a la resolución de la OCT14. El grosor de los stents utilizados en el estudio fue el siguiente: Cypher Select, 154 mm; Taxus Liberté, 127 mm; Endeavor Resolute, 95 mm; Xience V, 88 mm; Antares, 88 mm; Costar, 89 mm, y Driver, 91 mm14. La aposición de los struts se evaluó en cuatro segmentos: segmento de VP proximal (que se extendía hasta 8 mm proximalmente al primer corte transversal en el que era visible la RL), bifurcación (dividida en dos mitades de 180°, correspondientes al lado del origen de la RL y al lado opuesto) y segmento de VP distal (que se extendía hasta 4 mm del último corte transversal en el que era visible la RL) (figs. 1 y 2). Con objeto de unificar el análisis, todas las distancias se midieron en cortes transversales perpendiculares a partir de una retirada de la OCT en el VP, y no se obtuvieron a partir de imágenes longitudinales (lo cual en la práctica resulta muy difícil). La distancia de mala aposición en la mitad del segmento de bifurcación correspondiente al lado de la RL se midió como en los segmentos rectos: a partir de una retirada de la OCT en el VP, se ha tomado como medida la distancia más corta entre el strut con mala aposición/flotante y la pared vascular. Al utilizar la técnica compleja, los stents de VP y RL diferían en el grosor de sus struts. El stent de RL es el externo y el del VP, el interno, con lo que es probable que los struts con una mala aposición pertenezcan al stent del VP a nivel de la bifurcación y en el segmento proximal. La mala aposición de los struts se calculó en función del tipo de stent de VP y el grosor de sus struts.
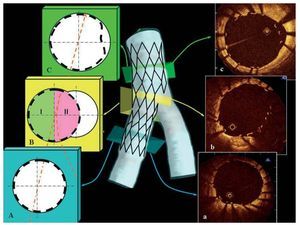
Fig. 1. Esquema de los cortes transversales secuenciales del segmento distal (A), la bifurcación (B) y el segmento proximal (C) tras el tratamiento de la bifurcación con la técnica simple. A nivel del corte transversal de la bifurcación se establecen dos mitades: I, la mitad del lado opuesto a la rama lateral; II, la mitad del lado de la rama lateral. En el vaso principal, se evaluó la aposición de los struts hasta 8 mm antes de la bifurcación, y en el vaso principal distal, hasta 4 mm más allá de la bifurcación. En el lado derecho se presentan los correspondientes cortes transversales de la tomografía de coherencia óptica (a-c).
Fig. 2. A: resultado angiográfico tras la implantación de dos stents en la arteria descendente anterior izquierda y en una rama diagonal (técnica de culotte). La flecha blanca indica el trayecto de la guía de obtención de imagen de tomografía de coherencia óptica. Imágenes de tomografía de coherencia óptica. B: segmento distal con struts con buena aposición. C y D: región de la bifurcación con struts con mala aposición/flotantes en la mitad opuesta a la rama lateral. E: dos capas de struts con buena aposición en el segmento proximal. F: imagen ampliada de las dos capas de struts de la imagen E. variables discretas se expresan mediante frecuencia y porcentaje. Para el conjunto de la población, las diferencias de las variables continuas en los cuatro segmentos de la lesión se evaluaron con la prueba de Kruskal-Wallis dada la presencia de una distribución no normal de las variables continuas. Las comparaciones de los dos grupos se realizaron con la prueba de la U de Mann-Whitney, según fuera apropiado. Se consideró estadísticamente significativo un valor de p bilateral < 0,05. Si se observaba una diferencia significativa (es decir, p < 0,05) entre los 4 grupos, se realizaban comparaciones múltiples de 2 ´ 2 aplicando la corrección de Bonferroni con un valor de significación estadística de p < 0,05/número de comparaciones que, por lo tanto, correspondía a p < 0,05/6, p < 0,0083. Las variables discretas se analizaron con la prueba de la c2 o la exacta de Fisher, según fuera apropiado. El efecto del tipo de estrategia (compleja frente a simple), los diferentes segmentos expresados en forma de variable discreta y la interacción entre el tipo de estrategia y los cuatro segmentos sobre la distancia de
Biomarcadores cardiacos
El infarto de miocardio periintervención, con o sin ondas Q patológicas, se definió por una elevación de la troponina I tras la intervención ≥ 3 veces el límite superior de la normalidad (0,04 mg/l).
Análisis estadístico
La distribución normal de las variables continuas se evaluó mediante una estimación visual de su histograma de frecuencias y con el uso de la prueba de Shapiro-Wilk. Las variables continuas se expresan en forma de media ± desviación estándar o mediana [intervalo intercuartílico] en función de si tenían o no una distribución normal, respectivamente. Las separación entre el strut y la pared vascular se evaluaron con un análisis de regresión lineal de efectos múltiples, con objeto de tener en cuenta el carácter correlacionado de los datos: es decir, la presencia de segmentos dentro de la lesión y de múltiples struts dentro de los segmentos. De forma resumida, se consideraron tres niveles: nivel 1, el strut únicamente; nivel 2, el segmento (proximal, distal, mitad de la bifurcación del lado de la RL y mitad del lado opuesto a la RL); nivel 3, la lesión, añadiendo la presencia/ausencia de struts con mala aposición en la localización del lado de la RL como efecto aleatorio al nivel 1. Dado que el porcentaje de struts con mala aposición no se expresaba a nivel del strut, se utilizó para esta variable de valoración un análisis de ANCOVA, con ponderación de mínimos cuadrados como estimador para corregir la heterocedasticidad, tras una transformación logarítmica, para obtener valores de p ajustados. Si se observaba un efecto significativo de un tipo de estrategia o de su interacción con los 4 segmentos sobre la variable de valoración, se realizaban comparaciones múltiples de 2 ´ 2 entre los segmentos correspondientes del grupo de estrategia simple y de estrategia compleja. Se aplicó una corrección de Bonferroni (p < 0,05/10). Todos los análisis se realizaron con el programa informático de análisis estadístico STATA 10.1 (Statacorp, Texas, Estados Unidos).
RESULTADOS
Características clínicas basales
Las características demográficas y los datos clínicos basales se presentan en la tabla 1. Se incluyó en el estudio a un total de 27 pacientes (edad, 69 [61-73] años) con 31 lesiones de bifurcaciones. En 4 pacientes se trataron dos bifurcaciones. La mayor parte de los pacientes (70%) presentaban una angina estable al ingreso en el hospital.
Características angiográficas y de la intervención
En la tabla 2 se resumen los datos angiográficos y de la intervención en función de la estrategia de tratamiento aplicada: en 17 lesiones (55%) se utilizó un tratamiento simple, mientras que en 14 (45%) se utilizó un tratamiento complejo de la bifurcación. En total, 26 de los 31 stents (83,9%) implantados en los VP eran farmacoactivos; 9 de los 14 stents implantados en las RL (64,3%) al utilizar la técnica compleja eran de bifurcación de diseño específico Tryton, 3 eran metálicos sin fármacos (21,4%) y 2 eran farmacoactivos (14,3%). La localización más frecuente de la lesión diana de una bifurcación fue la arteria descendente anterior izquierda/arteria diagonal (DAI/Dg) (n = 17; 55%), seguida de la arteria circunfleja/arteria marginal obtusa (Cx/Om) (n = 13; 42%), y en 1 caso la lesión estaba en la arteria coronaria derecha/descendente posterior (ACD/ADP) (3%). La localización de la lesión difería en los dos grupos de tratamiento, de tal manera que las lesiones de DAI/Dg eran más frecuentes (el 86 frente al 29%) y las de Cx/Om lo eran menos (el 14 frente al 65%) en el grupo de estrategia de tratamiento compleja en comparación con el grupo de estrategia simple. La técnica compleja se utilizó con más frecuencia para tratar lesiones de bifurcación con afectación de la RL: estenosis del diámetro de la RL ≥ 50% (el 79 frente al 12%; p < 0,001), estenosis de mayor diámetro de la RL (el 63 frente al 29%; p = 0,001), diámetro luminal mínimo de RL (0,8 frente a 1,4 mm; p = 0,007) y longitud de la lesión de la RL (5,6 frente a 2,9 mm; p = 0,04). No hubo diferencias en la estrategia de tratamiento en cuanto al diámetro luminal de referencia de la RL.
Había lesiones verdaderas de la bifurcación en 13 de las 31 lesiones (42%). En 11 de las 13 lesiones verdaderas de bifurcación (85%) se utilizó un tratamiento con la técnica compleja y solamente 2 lesiones verdaderas de bifurcación (15%) se trataron con la técnica simple (p < 0,001). Se aplicó una presión del balón significativamente mayor para la posdilatación de la RL al utilizar una técnica compleja (15 atmósferas frente a 11,2 atmósferas; p = 0,04). Se alcanzó un éxito de la intervención en todos los casos (flujo TIMI 3 en ambas ramas y estenosis residual del diámetro de la RL < 50%). Se produjo un pequeño infarto de miocardio relacionado con la intervención en ambos grupos, sin diferencias significativas al respecto (el 76,5 frente al 100%; p = 0,1).
Distribución longitudinal de los struts con mala aposición
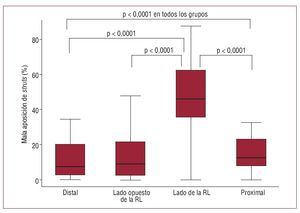
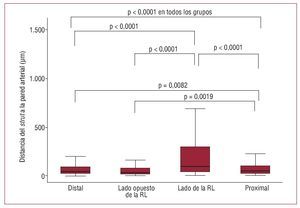
El análisis de OCT se presenta en las figuras 3 y 4. En total, se evaluaron 8.666 struts: 4.281 (49,4%) en el segmento vascular proximal, 1.434 (16,5%) a la altura de la bifurcación y 2.951 (34,1%) en el segmento vascular distal. La prevalencia de struts con mala aposición fue significativamente mayor en la mitad de la bifurcación correspondiente al lado de la RL (46,1% [35,3-62,5]) en comparación con la mitad de la bifurcación opuesta a la RL (9,1% [2,2-21,6]; p < 0,0001], el segmento distal (7,5% [2,3-20,2]; p < 0,0001, p ajustada) o el segmento proximal (12,6% [7,8-23,1]; p < 0,0001), sin diferencias significativas entre los segmentos proximal y distal (p = 0,07), entre la mitad de la bifurcación opuesta a la RL y el segmento proximal (p = 0,22) ni entre la mitad de la bifurcación opuesta a la RL y el segmento distal (p = 0,76) (Kruskal-Wallis entre los cuatro grupos, p = 0,0001) (fig. 3) (ANCOVA, p < 0,0001). La distancia entre strut y pared vascular en los struts con mala aposición fue mayor en el lado de la bifurcación correspondiente a la RL (98 mm [37-297]) en comparación con el lado opuesto a la RL (31 mm [13-74]; p < 0,0001), el segmento proximal (49 mm [20-100]; p < 0,0001) o el segmento distal (38 mm [17-90]; p < 0,0001), y también fue mayor en el segmento proximal en comparación con el segmento distal (p = 0,0082) y con el lado opuesto a la RL (p = 0,0019), sin diferencias significativas entre el lado opuesto a la RL y el segmento distal (0,23) (Kruskal-Wallis para la comparación de los 4 grupos, p = 0,0001) (fig. 4) (20,5 mm, intervalo de confianza [IC] del 95%, 6,8-34,2; p = 0,003 en el análisis de regresión lineal de efectos mixtos).
Fig. 3. Distribución longitudinal del porcentaje de struts con mala aposición en los cuatro segmentos: distal, mitad de la bifurcación del lado opuesto a la rama lateral (RL), mitad de la bifurcación del lado de la rama lateral, proximal. Solamente se indican los valores de p significativos.
Fig. 4. Distribución longitudinal de la distancia entre strut y pared vascular en los cuatro segmentos: distal, mitad de la bifurcación del lado opuesto a la rama lateral (RL), mitad de la bifurcación del lado de la RL, proximal. Solamente se indican los valores de p significativos.
Análisis de tomografía de coherencia óptica: diferencias entre la técnica simple y la compleja
Tanto el número total de struts por paciente como el número de struts en el segmento proximal fueron significativamente mayores con la técnica de implantación de stents compleja en comparación con la técnica simple (323 ± 97 frente a 243 ± 102, p = 0,036 y 175 ± 18 frente a 107 ± 64, p = 0,015, respectivamente). La prevalencia de los struts con mala aposición y la distancia de separación entre strut y pared vascular en los dos grupos se presentan en la tabla 3. Por lo que respecta a la variable de valoración consistente en el porcentaje de struts con mala aposición, el análisis de ANCOVA mostró que el uso de una estrategia compleja (p = 0,31) y la interacción entre la estrategia compleja y los cuatro segmentos (p = 0,75) no alcanzaban significación estadística. De hecho, no se observaron diferencias significativas entre los segmentos proximales (p = 0,56), los distales (p = 0,95), los del lado opuesto a la RL (p = 0,2) y los del lado de la RL (p = 0,68). Por lo que respecta a la distancia entre strut y pared vascular, el análisis de regresión lineal de efectos mixtos mostró que la interacción entre la estrategia compleja y los cuatro segmentos de la lesión era significativa (-9,3 mm; IC del 95%, -17,9 a -0,7; p = 0,033), mientras que el uso de la estrategia compleja no alcanzaba significación estadística (3,4 mm; IC del 95%, -31,3-38,1; p = 0,85), lo cual indica que la estrategia compleja se asociaba a una menor distancia entre strut y pared vascular en segmentos específicos. De hecho, la distancia de separación entre strut y pared vascular fue significativamente inferior en el segmento proximal en el grupo de estrategia compleja en comparación con el grupo de estrategia simple (p = 0,0008), sin diferencias significativas entre los segmentos distales (p = 0,25), los del lado opuesto a la RL (p = 0,083) y los del lado de la RL (p = 0,0878).
DISCUSIÓN
La angiografía evalúa solamente la luz vascular y, por lo tanto, tiene una capacidad muy limitada de determinar si la expansión del stent y la aposición en la pared son adecuadas. La IVUS permite obtener una buena valoración de la expansión del stent, pero para la detección de su aposición, su baja resolución (alrededor de 120 mm) es insuficiente para cuantificar este fenómeno de manera precisa. Los datos de IVUS del ensayo Sirolimus-Eluting Stent (SLS) in De Novo Coronary Lesions (SIRIUS) han puesto de manifiesto que la aposición incompleta del stent (AIS) se dio en el 16,2% de 80 implantaciones de SLS15. Se observó una incidencia similar de AIS en los estudios de IVUS de Kimura et al16 tras la implantación de SLS en 168 pacientes (18%) y en los de Kim et al17, tras la implantación de stents liberadores de paclitaxel (SLP) y SLS en 299 pacientes (13,9%). Sin embargo, la IVUS puede infravalorar la prevalencia de la mala aposición de los struts: en un estudio de comparación de la IVUS y la OCT en 27 pacientes tratados con ICP, Hou et al18 observaron que la IVUS identificaba la mala aposición del stent tan sólo en un 10,5% de los casos, frente al 63,2% cuando la evaluación se realizaba mediante OCT. Además, en vez de valorar la prevalencia de la mala aposición de los struts de stents, como se ha hecho con la OCT, los análisis previos de IVUS evaluaron solamente el número de pacientes que tenían al menos un strut con mala aposición. Por último, los análisis de IVUS han excluido específicamente los segmentos de bifurcación de la evaluación de la aposición incompleta de los stents, partiendo del supuesto acertado de que la mala aposición era inevitable en esos casos15. De hecho, tan sólo en unos pocos análisis de IVUS se han abordado los resultados de la implantación de stents en bifurcaciones y en estos casos se han centrado en la mala expansión más que en la mala aposición. Costa et al19 realizaron una evaluación de IVUS postintervención en 40 pacientes tratados con la técnica de «aplastamiento» y observaron AIS en más del 60% de los casos, principalmente en zonas proximales a la bifurcación en donde había 3 capas de stents.
La comparación detallada mediante OCT en este estudio mostró una incidencia muy superior de mala aposición por lesión. Creemos que los artefactos prominentes inducidos por los struts de los stents en la IVUS limitan la visualización de la pared subyacente, lo que dificulta la capacidad de detección de grados menores de mala aposición. La geometría tridimensional compleja de las lesiones de bifurcaciones hace que sea difícil alcanzar una aposición de los struts comparable a la que se observa en un segmento recto. Los estudios realizados en modelos in vitro ya han demostrado la dificultad de alcanzar una buena aposición del stent en el ostium de la RL, sea cual sea la técnica de implantación de stents utilizada20. Los stents con una mala aposición a menudo crean una neocarina metálica, tanto en el extremo proximal como en el extremo distal de la abertura, habitualmente excéntrica, de la RL (fig. 2). En todos los casos, se intentó reintroducir una guía en la RL en la celda más distal del stent cerca de la carina, cruzando el stent con una guía con bucle retirada hasta la bifurcación. Aun cuando esto se consiga, es necesario un diámetro del balón que corresponda exactamente al ostium de la RL e hinchado a una presión suficiente para desplazar todos los struts. En observaciones previas de OCT, la tasa de struts con una mala aposición después del tratamiento de lesiones simples en segmentos vasculares rectos ha sido del 9%7, mientras que la de struts con mala aposición en stents solapados fue de hasta el 41,8%, en comparación con el 20,1 y el 9,7% en los segmentos proximales y distales sin solapamiento, respectivamente14.
Aunque los estudios anatomopatológicos indican que la mala aposición del stent puede contribuir a producir acontecimientos adversos, hay discrepancias en cuanto al establecimiento de las consecuencias pronósticas de la AIS en los únicos estudios de IVUS disponibles. Los datos existentes proceden principalmente de subestudios de IVUS de los estudios de stents farmacoactivos inicialmente muy seleccionados en segmentos rectos, con exclusión de las lesiones de bifurcaciones. Se observaron unos porcentajes de mala aposición del stent similares en los pacientes que presentaron acontecimientos adversos y en los que no los sufrieron21. Otros autores han puesto de manifiesto una mayor prevalencia de resultados de IVUS anormales en cuanto a la aposición y expansión del stent tras la implantación en pacientes que presentaron trombosis aguda de éste, en comparación con un grupo control19.
Sorprendentemente, nuestro estudio no indicó ninguna diferencia significativa entre la técnica simple y la compleja en cuanto a la mala aposición de los struts. Con la técnica compleja cabría prever, teóricamente, unas tasas más altas de mala aposición de struts, debido simplemente a la inserción de mayor cantidad de metal. Estas observaciones pueden explicarse por el empleo de una posdilatación con KB más agresiva en la técnica de dos stents en comparación con la estrategia de un solo stent, sin temor a causar una disección que comprometiera el estado de la RL. Además, el amplio uso de un stent de bifurcación de diseño específico en nuestra serie puede haber influido, aun cuando no pudo realizarse una comparación entre los diferentes tipos de stents, en el grupo de la técnica de culotte, dado el pequeño tamaño muestral.
Los estudios de anatomía patológica han indicado que los puntos de ramificación arterial son focos de baja velocidad de flujo y baja fuerza tangencial y constituyen lugares de predisposición a la formación de placas ateroscleróticas y trombos22.
La observación importante fue la de que el área más vulnerable de la bifurcación es la situada en el lado opuesto al lugar de división del flujo23. Dado que la dilatación de la RL mediante los struts del stent puede causar una deformación del stent del VP6, es prudente centrarse no sólo en la carina (cabría prever que la peor aposición de struts se diera en esa zona, hecho este que nosotros hemos corroborado), sino también en el lado opuesto al divisor del flujo, donde las menores fuerzas tangenciales podrían crear un nido para la reestenosis o la trombosis24. Nuestras observaciones no indicaron un aumento de la frecuencia de struts con mala aposición en la mitad opuesta al lado de la RL, en comparación con los segmentos sin bifurcación (proximal y distal a la bifurcación), aunque esto puede explicarse por la elevada frecuencia de uso de posdilatación con KB.
Cicatrización de struts con mala aposición
Las consecuencias pronósticas de una aposición aguda subóptima de los struts tras la ICP, según lo indicado por la OCT, en pacientes con imágenes angiográficas satisfactorias, no se conocen.
Posdilatación final con balón kissing
Dado que la técnica simple puede causar un estrechamiento de la RL a través del desplazamiento de la carina25, mientras que la dilatación de la RL causa una distorsión del stent en el VP6, se recomienda claramente el KB final al tratar lesiones de bifurcaciones. El efecto favorable del KB final ha sido respaldado por observaciones clínicas previas26. Sin embargo, las pruebas de laboratorio indican que el hinchado del KB final puede reducir, aunque no necesariamente eliminar, la separación entre el strut y la pared vascular27.
Limitaciones
La limitación principal deriva de la ausencia de un análisis estadístico que permita explicar por completo los datos de OCT correlacionados, que tienen una estructura jerárquica con más lesiones agrupadas en los mismos pacientes, cuatro segmentos en una única lesión y más struts en el mismo segmento, para cada variable de valoración analizada. Los cálculos formales del tamaño muestral son difíciles en esta situación y no hay ningún algoritmo para el cálculo de la potencia estadística basado en supuestos, generalmente aceptados, relativos a los factores de diseño para la correlación intragrupal. El hecho de que no hubiera una asignación aleatoria a la técnica simple o compleja podría haber introducido un sesgo en los resultados del estudio. De hecho, la técnica compleja tendía a elegirse para el tratamiento de las bifurcaciones verdaderas, mientras que se reservaba la técnica simple para otros subtipos de lesiones de bifurcaciones. En segundo lugar, utilizamos diferentes tipos de stents (incluidos los específicamente diseñados para bifurcaciones) para el tratamiento de una parte de las lesiones de RL en la técnica compleja; cada uno de estos stents tiene una geometría y un tamaño de célula específicos, y ello podría haber influido en nuestros resultados. En consecuencia, no podemos descartar una pequeña diferencia en la prevalencia de los struts con mala aposición y en la distancia entre struts y pared vascular entre las dos técnicas, como consecuencia de una falta de potencia estadística. En tercer lugar, los resultados pueden no ser necesariamente aplicables a otras técnicas de dos stents para el tratamiento de las bifurcaciones, distintas de la implantación con la técnica de culotte. Por último, las imágenes de OCT se obtuvieron tan sólo para el VP. Esto penaliza obviamente a la técnica simple, puesto que los struts con mala aposición en la RL no son detectados. En este estudio, la OCT se utilizó únicamente al final de la optimización bajo guía angiográfica del despliegue del stent.
CONCLUSIONES
En las lesiones de bifurcaciones coronarias, la mala aposición de struts se produce con mayor frecuencia y es más grave en el origen de la RL. Nuestros resultados indican que el uso de una técnica compleja (de culotte) no afecta de manera significativa a la frecuencia de malas aposiciones de struts en los cuatro segmentos de las lesiones de bifurcaciones y se asocia a una menor distancia de separación del strut respecto a la pared vascular en los struts con mala aposición en el segmento proximal, en comparación con una estrategia simple de implantación de stent en el vaso principal únicamente. Serán necesarios nuevos estudios para determinar si la mala aposición puede desempeñar un papel en la elevada incidencia de reestenosis en el stent o trombosis en el stent que afecta a las lesiones de bifurcaciones.
ABREVIATURAS
ICP: intervención coronaria percutánea.
IVUS: ecografía intravascular.
KB: balón kissing.
OCT: tomografía de coherencia óptica.
RL: rama lateral.
VP: vaso principal.
Full English text available from: www.revespcardiol.org
Correspondencia: Prof. C. Di Mario.
Cardiology Department. Royal Brompton Hospital. Sydney Street. London SW3 3NP. Reino Unido.
Correo electrónico: C.DiMario@rbht.nhs.uk
Recibido el 20 de octubre de 2009.
Aceptado para su publicación el 25 de marzo de 2010.