El momento óptimo para un cateterismo en el síndrome coronario agudo sin elevación del segmento ST (SCASEST) y la necesidad de pretratamiento son motivo de controversia. El objetivo principal del registro IMPACT-TIMING-GO es conocer el porcentaje de pacientes examinados con una coronariografía precoz (0-24 h) y que no recibieron doble antiagregación plaquetaria antes del cateterismo (estrategia sin pretratamiento) en España.
MétodosEstudio observacional, prospectivo y multicéntrico, que incluyó a pacientes consecutivos con diagnóstico de SCASEST sometidos a cateterismo en los que se evidenció enfermedad coronaria ateroesclerótica causal.
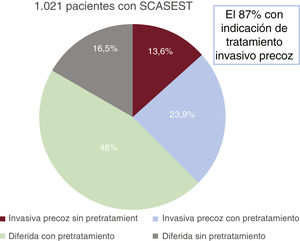
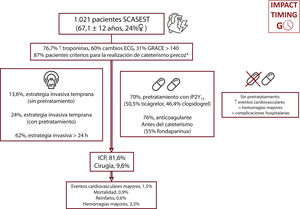
ResultadosEntre abril y mayo de 2022 se incluyó a 1.021 pacientes (media de edad, 67±12 años; el 23,6% mujeres). El 86,8% de los pacientes cumplían criterios de alto riesgo (elevación de troponina, cambios electrocardiográficos o puntuación GRACE>140); sin embargo, únicamente el 37,8% se sometió a una estrategia invasiva precoz, y el 30,3% no recibió pretratamiento. Globalmente, solo el 13,6% de los pacientes se sometieron a una estrategia invasiva precoz sin un segundo antiagregante plaquetario, y la estrategia diferida con pretratamiento fue la más utilizada (46%). Durante el ingreso, 9 pacientes (0,9%) fallecieron y 34 (3,3%) presentaron una hemorragia grave.
ConclusionesEn España, solo el 13,6% de los pacientes con SCASEST sometidos a cateterismo reciben una estrategia invasiva precoz sin pretratamiento. La incidencia de eventos cardiovasculares y hemorragias graves en el ingreso es baja.
Palabras clave
La cardiopatía isquémica es la principal causa de mortalidad en los países desarrollados1 y su incidencia, especialmente la de los síndromes coronarios agudos sin elevación del segmento ST (SCASEST), ha aumentado durante los últimos años2. El mecanismo fisiopatológico subyacente más frecuente es la rotura o erosión de una placa de ateroma que da lugar a un proceso de agregación plaquetaria y, secundariamente, la formación de un trombo intraluminal. En este sentido, los pacientes reciben un tratamiento antitrombótico específico y un abordaje invasivo en la mayoría de los casos1,2. Las recomendaciones recogidas en la guía vigente de la Sociedad Europea de Cardiología sobre el diagnóstico y tratamiento del SCASEST incluyen novedades en relación con el tratamiento antitrombótico y la estrategia de revascularización, algunas de las cuales han generado cierta controversia3. Destacan la recomendación de realizar por sistema un cateterismo en las primeras 24 h de ingreso de los pacientes en alto riesgo1 (nivel de evidencia I A) y desaparece la ventana de recomendación previa de 0-72 h para pacientes con riesgo moderado4. Por otro lado, se desaconseja el uso sistemático de pretratamiento al ingreso con un antiagregante plaquetario inhibidor del receptor P2Y12 (iP2Y12) —ticagrelor, prasugrel o clopidogrel— para los pacientes que van a someterse a una estrategia invasiva precoz.
Sin embargo, y a pesar de estas recomendaciones, los principales estudios publicados no han demostrado el beneficio del tratamiento invasivo precoz por sistema5–11. Por otro lado el pretratamiento con prasugrel12 o ticagrelor13 no ha logrado reducir los eventos trombóticos en pacientes con SCASEST, con un potencial aumento del riesgo de hemorragias graves con prasugrel12, no así con ticagrelor13. El reciente ensayo clínico ISAR-REACT 5 demostró que una estrategia sin pretratamiento con prasugrel fue superior a una estrategia pretratando con ticagrelor14. Hay que resaltar que los tiempos hasta el cateterismo en estos estudios fueron de escasas horas12,14.
Los datos disponibles en relación con el tratamiento del SCASEST en España son previos a la publicación de las últimas guías de práctica clínica15–17. Por ello, el objetivo del registro Impact of time of intervention in patients with myocardial infarction with non-st segment elevation. Management and outcomes (IMPACT-TIMING-GO) es conocer el abordaje terapéutico actual del SCASEST en nuestro país en relación con los tiempos de cateterismo y el uso de pretratamiento.
MÉTODOSDiseño del estudioEl estudio IMPACT-TIMING-GO es un registro observacional, prospectivo y multicéntrico, promovido por el Grupo de Jóvenes Cardiólogos de la Sociedad Española de Cardiología, en el que han participado 23 centros hospitalarios españoles (tabla 1 del material adicional). El diseño del estudio se ha descrito previamente18, y cumple con la lista de verificación de estudios observacionales STROBE. El protocolo fue aprobado por los comités de ética de investigación con medicamentos de todos los hospitales participantes y cumple con el protocolo de Helsinki. Se obtuvo el consentimiento informado por escrito de todos los participantes.
Población de estudioSe incluyó consecutivamente a todos los pacientes con diagnóstico de SCASEST (infarto agudo de miocardio sin elevación del segmento ST o angina inestable) a los que se realizó una coronariografía diagnóstica en la que se observó enfermedad coronaria ateroesclerótica inestable o causal, independientemente del tratamiento decidido por el equipo médico responsable (figura 1). Se consideró criterio de exclusión presentar infarto de miocardio tipo 2, síndrome de tako-tsubo, disección coronaria espontánea, antecedente de enfermedad coronaria no revascularizable o cualquier causa de elevación de troponina sin evidencia de enfermedad coronaria (miocarditis, espasmo coronario, etc.)18. Se registraron las principales características basales, los datos angiográficos, el tratamiento médico recibido, los tiempos de cateterismo, la evolución clínica hospitalaria y el tratamiento al alta. Los tratamientos antitrombóticos durante el procedimiento, así como el material y dispositivos empleados, fueron decisión exclusiva del equipo médico responsable de acuerdo con la práctica clínica habitual.
Objetivos y definicionesEl objetivo primario del estudio es conocer los porcentajes de pacientes sometidos a un cateterismo en las primeras 24 h y de pacientes que recibieron doble antiagregación plaquetaria con un iP2Y12 antes del cateterismo, de acuerdo con las recomendaciones recogidas en las guías de práctica clínica. El infarto agudo de miocardio sin elevación del segmento ST se definió de acuerdo con la cuarta definición universal vigente19. Se consideró SCASEST de alto riesgo cuando se cumplía al menos uno de los siguientes: infarto de miocardio; cambios electrocardiográficos (ECG) nuevos o dinámicos de la onda T/segmento ST sugestivos de isquemia; ascenso transitorio del segmento ST; puntuación del Global Registry of Acute Coronary Events (GRACE) mayor de 140. La estrategia invasiva se definió como precoz o temprana si se realizaba una coronariografía en las primeras 24 h desde el ingreso y diferida si se realizaba posteriormente. Los pacientes que recibieron un iP2Y12 además del ácido acetilsalicílico antes del cateterismo formaron el grupo de pretratamiento.
Se definió un combinado de eventos cardiovasculares hospitalarios que englobaba mortalidad por cualquier causa y reinfarto y un objetivo de seguridad que incluía la incidencia de hemorragias graves según la escala del Bleeding Academic Research Consortium (BARC)20 tipo 3, 4 y 5. Se recogieron también en un combinado de complicaciones durante el ingreso las ya citadas, la insuficiencia renal aguda (definida como un aumento del 50% de los valores basales de creatinina o necesidad de depuración extrarrenal), la aparición de fibrilación auricular o arritmias ventriculares, el cuadro confusional agudo y las complicaciones mecánicas del infarto.
Análisis estadísticoLas variables categóricas se expresan como número y porcentaje y las cuantitativas, como media±desviación estándar. Las variables cuantitativas con distribución normal se expresan como mediana [intervalo intercuartílico]. La distribución normal de las variables cuantitativas se evaluó mediante la prueba de Kolmogorov-Smirnoff. Para las variables de referencia, se utilizaron la prueba de la t de Student, análisis de la varianza, Mann-Whitney y Kruskal-Wallis para la comparación de las variables cuantitativas, y la prueba de la χ2 o la prueba exacta de Fisher, en su caso, para las variables categóricas. Se consideró estadísticamente significativo un valor bilateral de p<0,05. El análisis estadístico se realizó con el programa SPSS versión 22.0 (IBM Corp., Estados Unidos).
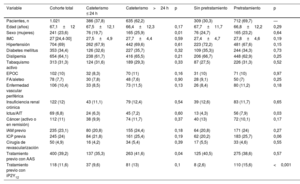
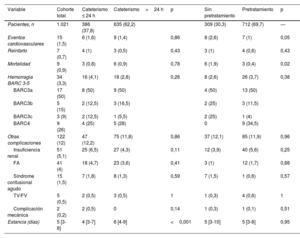
RESULTADOSEntre el 1 de abril y el 31 de mayo de 2022, se incluyó a 1.021 pacientes con diagnóstico de SCASEST sometidos a coronariografía. La media de edad fue 67,1±12 años y el 23,6% eran mujeres. Se sometió al 37,8% de los pacientes a cateterismo en las primeras 24 h de ingreso y el 30,3% no recibió pretratamiento con doble antiagregación. Globalmente, el 13,6% de los pacientes se sometieron a una estrategia invasiva precoz sin pretratamiento (figura 2 y figura 3); la estrategia diferida con pretratamiento fue la más utilizada (46%). La tabla 1 muestra las principales características basales de la población del estudio. No hubo diferencias en función del tipo de estrategia utilizada, excepto una mayor frecuencia de mujeres en la estrategia diferida (el 19,7 frente al 25,9%; p=0,01) y una mayor prevalencia de ictus previo (el 7,9 frente al 4,3%; p=0,03) en pacientes pretratados.
Características basales de toda la cohorte y en función de la estrategia de tratamiento
| Variable | Cohorte total | Cateterismo ≤ 24 h | Cateterismo>24 h | p | Sin pretratamiento | Pretratamiento | p |
|---|---|---|---|---|---|---|---|
| Pacientes, n | 1.021 | 386 (37,8) | 635 (62,2) | 309 (30,3) | 712 (69,7) | — | |
| Edad (años) | 67,1±12 | 67,5±12,1 | 66,4±12,3 | 0,17 | 67,7±11,7 | 66,8±12,2 | 0,29 |
| Sexo (mujeres) | 241 (23,6) | 76 (19,7) | 165 (25,9) | 0,01 | 76 (24,7) | 165 (23,2) | 0,64 |
| IMC | 27 [24,4-30] | 27,5±4,9 | 27,7±4,4 | 0,59 | 27,4±4,7 | 27,8±4,6 | 0,19 |
| Hipertensión | 704 (69) | 262 (67,9) | 442 (69,6) | 0,61 | 223 (72,2) | 481 (67,6) | 0,15 |
| Diabetes mellitus | 353 (34,4) | 126 (32,6) | 227 (35,7) | 0,32 | 109 (35,3)) | 244 (34,3) | 0,73 |
| Dislipemia | 654 (64,1) | 238 (61,7) | 416 (65,5) | 0,21 | 206 (66,7) | 448 (62,9) | 0,25 |
| Tabaquismo activo | 313 (31,3) | 124 (31,6) | 189 (29,3) | 0,33 | 87 (27,5) | 226 (31,3) | 0,52 |
| EPOC | 102 (10) | 32 (8,3) | 70 (11) | 0,16 | 31 (10) | 71 (10) | 0,97 |
| FA/aleteo | 78 (7,7) | 30 (7,8) | 48 (7,6) | 0,90 | 28 (9,1) | 50 (7) | 0,25 |
| Enfermedad vascular periférica | 106 (10,4) | 33 (8,5) | 73 (11,5) | 0,13 | 26 (8,4) | 80 (11,2) | 0,18 |
| Insuficiencia renal crónica | 122 (12) | 43 (11,1) | 79 (12,4) | 0,54 | 39 (12,6) | 83 (11,7) | 0,65 |
| Ictus/AIT | 69 (6,8) | 24 (6,3) | 45 (7,2) | 0,60 | 13 (4,3) | 56 (7,9) | 0,03 |
| Cáncer (activo o en remisión) | 112 (11) | 38 (9,9) | 74 (11,7) | 0,37 | 40 (13) | 72 (10,1) | 0,17 |
| IAM previo | 235 (23,1) | 80 (20,8) | 155 (24,4) | 0,18 | 64 (20,8) | 171 (24) | 0,27 |
| ICP previa | 245 (24) | 84 (21,8) | 161 (25,4) | 0,19 | 62 (20,2) | 183 (25,7) | 0,06 |
| Cirugía de revascularización | 50 (4,9) | 16 (4,2) | 34 (5,4) | 0,39 | 17 (5,5) | 33 (4,6) | 0,55 |
| Tratamiento previo con AAS | 400 (39,2) | 137 (35,3) | 263 (41,6) | 0,04 | 125 (40,5) | 275 (38,6) | 0,57 |
| Tratamiento previo con iP2Y12 | 118 (11,6) | 37 (9,6) | 81 (13) | 0,1 | 8 (2,6) | 110 (15,6) | <0,001 |
AAS: ácido acetilsalicílico; AIT: accidente isquémico transitorio; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; IAM: infarto agudo de miocardio; ICP: intervención coronaria percutánea; IMC: índice de masa corporal; iP2Y12: inhibidor del P2Y12.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
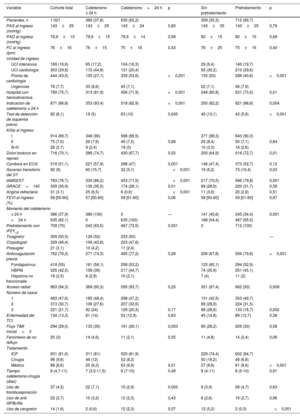
Las principales características relacionadas con la situación clínica y el tratamiento en el ingreso hospitalario se muestran en la tabla 2 y la tabla 2 del material adicional. El 87% de los pacientes cumplían los criterios de alto riesgo de la guía de práctica clínica1 para recibir una estrategia invasiva precoz. Para los pacientes pretratados (69,7%), el ticagrelor fue el segundo antiagregante plaquetario en frecuencia (50,5%), seguido del clopidogrel (46,4%). Además, el 76% de los pacientes recibieron algún anticoagulante antes del cateterismo; el fondaparinux fue el pautado con más frecuencia (55%). Al analizar la estrategia utilizada (tabla 2), los pacientes sometidos a cateterismo precoz presentaron más frecuentemente elevación de troponina (el 86,2 frente al 71,5%; p<0,001), cambios en el ECG (el 57,9 frente al 47%; p=0,001), elevación transitoria del segmento ST (el 15,7 frente al 5,1%; p<0,001), una puntuación GRACE>140 (el 35,5 frente al 28,1%; p=0,01) y angina refractaria (el 6,5 frente al 0,6%; p<0,001). Además, ingresaron más en unidades de cuidados intensivos (el 62 frente al 36,7%; p<0,001) y recibieron pretratamiento con menos frecuencia (el 63,5 frente al 73,5%; p=0,001). Por su parte, los pacientes que no recibieron pretratamiento presentaron menos infarto agudo de miocardio sin elevación del segmento ST (el 70,5 frente al 79,8%; p=0,001), ascenso transitorio del segmento ST (el 6,2 frente al 10,4%; p=0,03) y angina de reposo (el 64,9 frente al 72,7%; p=0,01). Asimismo, ingresaron menos en unidades de críticos a cargo de medicina intensiva (el 9,4 frente al 19,7%; p<0,001), se sometieron más frecuentemente a tratamiento invasivo precoz (el 45,6 frente al 34,4%; p=0,001) y recibieron con menos frecuencia anticoagulantes antes del cateterismo (el 67,8 frente al 79,8%; p<0,001). Por último, los pacientes que ingresaron en hospitales con sala de hemodinámica se sometieron con más frecuencia a tratamiento precoz sin pretratamiento.
Características clínicas, angiográficas y tratamiento en la cohorte principal y en función de la estrategia de tratamiento
| Variable | Cohorte total | Cateterismo ≤ 24 h | Cateterismo>24 h | p | Sin pretratamiento | Pretratamiento | p |
|---|---|---|---|---|---|---|---|
| Pacientes, n | 1.021 | 386 (37,8) | 635 (62,2) | 309 (30,3) | 712 (69,7) | - | |
| PAS al ingreso (mmHg) | 143±25 | 143±25 | 143±24 | 0,80 | 143±35 | 143±25 | 0,79 |
| PAD al ingreso (mmHg) | 79,9±15 | 79,9±15 | 79,9±14 | 0,99 | 80±15 | 80±15 | 0,69 |
| FC al ingreso (lpm) | 76±16 | 76±15 | 75±16 | 0,43 | 76±25 | 75±16 | 0,40 |
| Unidad de ingreso | |||||||
| UCI intensivos | 169 (16,6) | 65 (17,2) | 104 (16,3) | 29 (9,4) | 140 (19,7) | ||
| UCI cardiología | 303 (29,8) | 172 (44,8) | 131 (20,4) | 93 (30,2) | 210 (29,6) | ||
| Planta de cardiología | 444 (43,5) | 105 (27,1) | 339 (53,6) | <0,001 | 155 (50) | 289 (40,6) | <0,001 |
| Urgencias | 78 (7,7) | 33 (8,6) | 45 (7,1) | 22 (7,1) | 56 (7,9) | ||
| Hospital con hemodinámica | 769 (75,7) | 313 (81,9) | 456 (71,9) | <0,001 | 248 (80,8) | 521 (73,5) | 0,01 |
| Indicación de cateterismo ≤ 24 h | 871 (86,8) | 353 (93,4) | 518 (82,9) | <0,001 | 250 (82,2) | 621 (88,8) | 0,004 |
| Test de detección de isquemia previo | 82 (8,1) | 19 (5) | 63 (10) | 0,005 | 40 (13,1) | 42 (5,9) | <0,001 |
| Killip al ingreso | |||||||
| I | 914 (89,7) | 348 (90) | 566 (89,5) | 271 (88,3) | 643 (90,3) | ||
| II | 75 (7,5) | 29 (7,6) | 46 (7,5) | 0,89 | 25 (8,4) | 50 (7,1) | 0,64 |
| III-IV | 28 (2,7) | 9 (2,4) | 19 (3) | 10 (3,3) | 18 (2,6) | ||
| Dolor torácico en reposo | 716 (70,1) | 286 (74,7) | 430 (67,7) | 0,02 | 200 (64,9) | 516 (72,7) | 0,01 |
| Cambios en ECG | 519 (51,1) | 221 (57,9) | 298 (47) | 0,001 | 146 (47,4) | 373 (52,7) | 0,12 |
| Ascenso transitorio del ST | 92 (9) | 60 (15,7) | 32 (5,1) | <0,001 | 19 (6,2) | 73 (10,4) | 0,03 |
| IAMSEST | 783 (76.7) | 330 (86,2) | 453 (71,5) | <0,001 | 217 (70,5) | 566 (79,8) | 0,001 |
| GRACE>140 | 309 (30,9) | 135 (35,5) | 174 (28,1) | 0,01 | 89 (28,9) | 220 (31,7) | 0,39 |
| Angina refractaria | 31 (3,1) | 25 (6,5) | 6 (0,9) | <0,001 | 11 (3,6) | 20 (2,8) | 0,51 |
| FEVI al ingreso (%) | 58 [50-60] | 57 [50-60] | 59 [51-60] | 0,06 | 58 [50-60] | 59 [51-60] | 0,97 |
| Momento del cateterismo | |||||||
| ≤ 24 h | 386 (37,9) | 386 (100) | 0 | — | 141 (45,6) | 245 (34,4) | 0,001 |
| >24 h | 635 (62,1) | 0 | 635 (100) | 168 (54,4) | 467 (65,5) | ||
| Pretratamiento con iP2Y12 | 709 (70) | 242 (63,5) | 467 (73,5) | 0,001 | 0 | 712 (100) | |
| Ticagrelor | 359 (50,5) | 126 (52) | 233 (50) | — | |||
| Clopidogrel | 329 (46,4) | 106 (43,8) | 223 (47,6) | ||||
| Prasugrel | 21 (3,1) | 10 (4,2) | 11 (2,4) | ||||
| Anticoagulación previa | 762 (76,2) | 277 (74,3) | 485 (77,2) | 0,28 | 206 (67,8) | 556 (79,8) | <0,001 |
| Fondaparinux | 419 (55) | 161 (58,1) | 258 (53,2) | 125 (60,1) | 294 (52,9) | ||
| HBPM | 325 (42,5) | 108 (39) | 217 (44,7) | 74 (35,9) | 251 (45,1) | ||
| Heparina no fraccionada | 18 (2,5) | 8 (2,9) | 10 (2,1) | 7 (4) | 11 (2) | ||
| Acceso radial | 963 (94,3) | 368 (95,3) | 595 (93,7) | 0,20 | 301 (97,4) | 662 (93) | 0,008 |
| Número de vasos | |||||||
| 1 | 483 (47,6) | 185 (48,4) | 298 (47,2) | 131 (42,5) | 353 (49,7) | ||
| 2 | 313 (30,7) | 106 (27,6) | 207 (32,6) | 89 (28,9) | 224 (31,5) | ||
| 3 | 221 (21,7) | 92 (24) | 129 (20,3) | 0,17 | 88 (28,6) | 133 (18,7) | 0,002 |
| Enfermedad del TCI | 134 (13,3) | 81 (14) | 53 (12,9) | 0,63 | 45 (14,8) | 89 (12,7) | 0,38 |
| Flujo TIMI inicial<3 | 294 (29,5) | 133 (35) | 161 (26,1) | 0,003 | 85 (28,2) | 209 (30) | 0,58 |
| Fenómeno de no reflujo | 25 (3) | 14 (4,6) | 11 (2,1) | 0,05 | 11 (4,8) | 14 (2,4) | 0,06 |
| Tratamiento | |||||||
| ICP | 831 (81,6) | 311 (81) | 520 (81,9) | 229 (74,4) | 602 (84,7) | ||
| Cirugía | 98 (9,6) | 46 (12) | 52 (8,2) | 50 (16,2) | 48 (6,8) | ||
| Médico | 88 (8,6) | 25 (6,3) | 63 (9,9) | 0,01 | 27 (8,8) | 61 (8,6) | <0,001 |
| Tiempo cateterismo-cirugía (días) | 8 (4,7-11) | 7 (3,5-11,5) | 8 (7-10) | 0,49 | 8 (4-11) | 8 (5-10) | 0,91 |
| Uso de tromboaspiración | 37 (4,5) | 22 (7,1) | 15 (2,9) | 0,005 | 9 (3,9) | 28 (4,7) | 0,63 |
| Uso de anti-GPIIb/IIIa | 22 (2,7) | 10 (3,2) | 12 (2,3) | 0,43 | 6 (2,6) | 16 (2,7) | 0,96 |
| Uso de cangrelor | 14 (1,6) | 2 (0,6) | 12 (2,3) | 0,07 | 12 (5,2) | 2 (0,3) | <0,001 |
AAS: ácido acetilsalicílico; FC: frecuencia cardiaca; FEVI: fracción de eyección del ventrículo izquierdo; GP: glucoproteína; HBPM: heparina de bajo peso molecular; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; ICP: intervención coronaria percutánea; iP2Y12: inhibidor del P2Y12; PAS: presión arterial sistólica; PAD: presión arterial diastólica; TCI: tronco coronario izquierdo; TIMI: thrombolysis in myocardial infarction; UCI: unidad de cuidados intensivos.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartil].
El 47,6% de los pacientes tuvo enfermedad aguda causal de un vaso, el 21,7%, enfermedad de 3 vasos y el 13,3%, enfermedad de tronco coronario izquierdo. Se revascularizó mediante intervención coronaria percutánea en el 81,6% de los casos, y mediante cirugía de revascularización coronaria en el 9,6%, con una mediana de tiempo cateterismo-cirugía de 8 [4,7-11] días. Los pacientes con tratamiento precoz tuvieron con más frecuencia un flujo TIMI<3 en la arteria culpable (el 35 frente al 26,1%; p=0,003) y se realizó más tromboaspiración (el 7,1 frente al 2,9%; p=0,005). Por su parte, los pacientes no pretratados requirieron con más frecuencia cangrelor (el 5,2 frente al 0,3%; p<0,001), presentaron más enfermedad de 3 vasos (el 28,6 frente al 18,7%; p<0,001) y se sometieron con mayor frecuencia a cirugía de revascularización (el 16,2 frente al 6,8%; p<0,001).
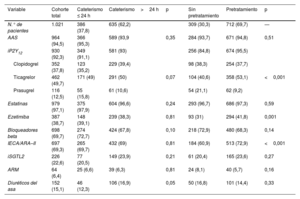
Las principales complicaciones hospitalarias y el tratamiento al alta se muestran en la tabla 3, la tabla 4 y la tabla 3 del material adicional. La mediana de estancia hospitalaria fue de 5 [3-8] días y fue menor para los pacientes con estrategia invasiva precoz: 4 [3-7] frente a 6 [4-9] días (p<0,001). El ticagrelor fue el iP2Y12 pautado al alta más a menudo (49,7%), seguido del clopidogrel (37,8%) y del prasugrel (12,5%). La incidencia global de complicaciones fue del 12%; 15 pacientes (1,5%) presentaron un evento cardiovascular, 9 (0,9%) fallecieron y 7 (0,7%) sufrieron un reinfarto; 34 pacientes (3,3%) tuvieron una hemorragia grave.
Complicaciones hospitalarias en la cohorte y en función de la estrategia de tratamiento
| Variable | Cohorte total | Cateterismo ≤ 24 h | Cateterismo>24 h | p | Sin pretratamiento | Pretratamiento | p |
|---|---|---|---|---|---|---|---|
| Pacientes, n | 1.021 | 386 (37,8) | 635 (62,2) | 309 (30,3) | 712 (69,7) | — | |
| Eventos cardiovasculares | 15 (1,5) | 6 (1,6) | 9 (1,4) | 0,86 | 8 (2,6) | 7 (1) | 0,05 |
| Reinfarto | 7 (0,7) | 4 (1) | 3 (0,5) | 0,43 | 3 (1) | 4 (0,6) | 0,43 |
| Mortalidad | 9 (0,9) | 3 (0,8) | 6 (0,9) | 0,78 | 6 (1,9) | 3 (0,4) | 0,02 |
| Hemorragia BARC 3-5 | 34 (3,3) | 16 (4,1) | 18 (2,8) | 0,26 | 8 (2,6) | 26 (3,7) | 0,38 |
| BARC3a | 17 (50) | 8 (50) | 9 (50) | 4 (50) | 13 (50) | ||
| BARC3b | 5 (15) | 2 (12,5) | 3 (16,5) | 2 (25) | 3 (11,5) | ||
| BARC3c | 3 (9) | 2 (12,5) | 1 (5,5) | 2 (25) | 1 (4) | ||
| BARC4 | 9 (26) | 4 (25) | 5 (28) | 0 | 9 (34,5) | ||
| Otras complicaciones | 122 (12) | 47 (12,2) | 75 (11,8) | 0,86 | 37 (12,1) | 85 (11,9) | 0,96 |
| Insuficiencia renal | 51 (5,1) | 25 (6,5) | 27 (4,3) | 0,11 | 12 (3,9) | 40 (5,6) | 0,25 |
| FA | 41 (4) | 18 (4,7) | 23 (3,6) | 0,41 | 3 (1) | 12 (1,7) | 0,88 |
| Síndrome confusional agudo | 15 (1,5) | 7 (1,8) | 8 (1,3) | 0,59 | 7 (1,5) | 1 (0,6) | 0,57 |
| TV/FV | 5 (0,5) | 2 (0,5) | 3 (0,5) | 1 | 1 (0,3) | 4 (0,6) | 1 |
| Complicación mecánica | 2 (0,2) | 2 (0,5) | 0 | 0,14 | 1 (0,3) | 1 (0,1) | 0,51 |
| Estancia (días) | 5 [3-8] | 4 [3-7] | 6 [4-9] | <0,001 | 5 [3-10] | 5 [3-8] | 0,95 |
BARC: Bleeding Academic Research Consortium; FA: fibrilación auricular; TV/FV: taquicardia/fibrilación ventricular.
Los valores expresan n (%) y mediana [intervalo intercuartílico].
Tratamiento al alta de la cohorte principal y en función de las distintas estrategias de tratamiento
| Variable | Cohorte total | Cateterismo ≤ 24 h | Cateterismo>24 h | p | Sin pretratamiento | Pretratamiento | p |
|---|---|---|---|---|---|---|---|
| N.° de pacientes | 1.021 | 386 (37,8) | 635 (62,2) | 309 (30,3) | 712 (69,7) | — | |
| AAS | 964 (94,5) | 366 (95,3) | 589 (93,9 | 0,35 | 284 (93,7) | 671 (94,8) | 0,51 |
| iP2Y12 | 930 (92,3) | 349 (91,1) | 581 (93) | 256 (84,8) | 674 (95,5) | ||
| Clopidogrel | 352 (37,8) | 123 (35,2) | 229 (39,4) | 98 (38,3) | 254 (37,7) | ||
| Ticagrelor | 462 (49,7) | 171 (49) | 291 (50) | 0,07 | 104 (40,6) | 358 (53,1) | <0,001 |
| Prasugrel | 116 (12,5) | 55 (15,8) | 61 (10,6) | 54 (21,1) | 62 (9,2) | ||
| Estatinas | 979 (97,1) | 375 (97,9) | 604 (96,6) | 0,24 | 293 (96,7) | 686 (97,3) | 0,59 |
| Ezetimiba | 387 (38,7) | 148 (39,1) | 239 (38,3) | 0,81 | 93 (31) | 294 (41,8) | 0,001 |
| Bloqueadores beta | 698 (69,7) | 274 (72,7) | 424 (67,8) | 0,10 | 218 (72,9) | 480 (68,3) | 0,14 |
| IECA/ARA–II | 697 (69,3) | 265 (69,7) | 432 (69) | 0,81 | 184 (60,9) | 513 (72,9) | <0,001 |
| iSGTL2 | 226 (22,6) | 77 (20,5) | 149 (23,9) | 0,21 | 61 (20,4) | 165 (23,6) | 0,27 |
| ARM | 64 (6,4) | 25 (6,6) | 39 (6,3) | 0,81 | 24 (8,1) | 40 (5,7) | 0,16 |
| Diuréticos del asa | 152 (15,1) | 46 (12,3) | 106 (16,9) | 0,05 | 50 (16,8) | 101 (14,4) | 0,33 |
AAS: ácido acetilsalicílico; ARA–II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralocorticoides; IECA: inhibidores de la enzima de conversión de la angiotensina; iP2Y12: inhibidor del receptor P2Y12; iSGTL2: inhibidores del cotransportador de sodio-glucosa tipo 2.
Los valores expresan en n (%).
La primera conclusión del registro IMPACT-TIMING-GO es que el cumplimiento en España de las recomendaciones de la guía sobre SCASEST1 en cuanto a tiempos de cateterismo y pretratamiento antiagregante plaquetario es bajo. Este incumplimiento afecta tanto a la recomendación de abordaje y tratamiento sistemático precoz en menos de 24 h (cumplido en solo el 37,8% de los pacientes) como a la de no pretratar con iP2Y12 (indicados a menos de un tercio de la cohorte). Este hecho no se debe a un bajo riesgo isquémico, dado que casi el 90% de los pacientes cumplían al menos un criterio de alto riesgo para indicar el cateterismo sistemático en menos de 24 h. Estos resultados son novedosos, pues son los primeros que describen el abordaje actual de los pacientes con SCASEST desde la publicación de la guía vigente. La segunda conclusión es que, independientemente de la combinación de estrategias seleccionada, la incidencia hospitalaria de eventos adversos, tanto isquémicos como hemorrágicos, es baja, lo cual indica que el abordaje en la vida real basado en la individualización del riesgo de los pacientes y la integración con las capacidades locales para la realización de cateterismos son seguros y eficaces.
Nuestro trabajo arroja interesantes datos sobre el perfil de los pacientes que se somenten a las distintas estrategias de tratamiento en la vida real en España. En primer lugar, tanto los pacientes sometidos a cateterismo precoz como los que reciben pretratamiento tienen un perfil de mayor riesgo isquémico al ingreso, con mayor prevalencia de infarto y de cambios electrocardiográficos. En segundo lugar, los pacientes no pretratados tuvieron mayor prevalencia de enfermedad de 3 vasos y más revascularización quirúrgica, y los pretratados tuvieron más enfermedad de 1 vaso y recibieron más intervención coronaria percutánea (ICP). Impresiona que pueda haber cierto grado de adaptación de la estrategia al perfil del paciente, que es más agresivo en términos de tiempos y pretratamiento para los pacientes con sospecha clínica de una lesión trombótica que pueda requerir una ICP ad hoc. Podría decirse que pretratar a los pacientes tuviera impacto en el tipo de revascularización indicada, lo cual inclinaría la balanza hacia la ICP, mera hipótesis con los datos actuales. En cuarto lugar, se han observado diferencias en la estrategia utilizada dependiendo del lugar de ingreso del paciente y de que haya una sala de hemodinámica local. Estos hechos, aunque complejos de solucionar, deberían suponer áreas de mejora futura en el tratamiento de los pacientes con SCASEST. Por último, casi un 10% de los pacientes se sometieron a cirugía de revascularización coronaria, un porcentaje mayor que en registros previos en nuestro medio15–17 y que en ensayos clínicos con iP2Y1212,14. Los tiempos hasta la cirugía desde el cateterismo en nuestra serie (8 días) son a nuestro juicio excesivos y con un potencial impacto clínico negativo. El seguimiento a largo plazo será de gran utilidad para valorar las posibles implicaciones terapéuticas del tipo de revascularización en la vida real.
Los estudios específicamente dirigidos a valorar el impacto de un abordaje sistemático precoz en el SCASEST no han mostrado un claro beneficio en los eventos cardiovasculares5–11. Sin embargo, los ensayos TIMACS6 y VERDICT5 apuntaron a una posible relación con el perfil de riesgo isquémico, pues se halló beneficio en el análisis de subgrupos en pacientes con puntuación GRACE>140, resultados similares a los del registro CARDIOCHUS-HUSJ17. Los datos hospitalarios de nuestro estudio no indican que un abordaje sistemático precoz tenga un impacto pronóstico, a excepción de una menor estancia media, ni siquiera en pacientes con alto riesgo. De hecho, la estrategia diferida, especialmente en doble antiagregación plaquetaria (la combinación más utilizada), mostró una incidencia hospitalaria de eventos cardiovasculares muy baja, con un buen perfil de seguridad en términos de hemorragias.
Pese a que el beneficio del pretratamiento con iP2Y12 en pacientes con SCASEST no se ha demostrado en ensayos clínicos recientes12–14 e incluso puede existir un peaje en términos de hemorragias graves, como se evidenció en el ensayo ACCOAST12, en nuestro medio aún seguimos pretratando con frecuencia a los pacientes con SCASEST. En cualquier caso, la evidencia disponible del beneficio de no pretratar se sustenta en ensayos clínicos con tiempos de cateterismo muy precoces, de horas10,12,14, por lo que se desconoce el posible impacto de esperar varios días al cateterismo o a la cirugía de revascularización únicamente con ácido acetilsalicílico. De hecho, se anticoagulaba menos a estos pacientes antes del cateterismo, lo que a nuestro juicio, en ausencia de un segundo antiagregante plaquetario, debería ser práctica clínica habitual en un contexto de acceso sistemáticamente radial. Por último, llama la atención la baja utilización del prasugrel (el 12,5% al alta), incluso en pacientes sin pretratamiento, y la alta utilización del clopidogrel (el 46% como parte del pretratamiento; el 37% al alta). Asumiendo que el estudio ISAR-REACT-514 es la principal causa del cambio de directrices en la guía de práctica clínica, no se puede descartar un posible impacto pronóstico relacionado con desligar los tiempos de cateterismo y el uso de pretratamiento del propio antiagregante plaquetario utilizado.
LimitacionesLas principales limitaciones de nuestro estudio son las inherentes a todo registro, con los evidentes potenciales sesgos que conlleva cualquier relación causal pronóstica identificada. Por lo tanto, las conclusiones deben entenderse como generadoras de hipótesis. Los centros de inscripción se prestaron voluntariamente a participar en el registro, por lo que no pueden descartarse diferencias en los protocolos locales de pretratamiento y los tiempos de cateterismo que impidan una correcta extrapolación a todo el territorio nacional. Asimismo, el registro IMPACT-TIMING-GO incluyó específicamente a pacientes con SCASEST confirmado, por lo que sus resultados no son aplicables a un contexto de dolor torácico en urgencias o a pacientes con diagnósticos de SCASEST en los que no se demuestre finamente enfermedad coronaria causal, lo que puede llegar a ocurrir en un 10-30% de los pacientes en los ensayos clínicos6,13. A pesar de estas limitaciones, creemos que nuestro estudio, de carácter nacional, prospectivo y multicéntrico, aporta datos interesantes y novedosos sobre las características, el abordaje, el tratamiento y los resultados hospitalarios de una gran cohorte de pacientes consecutivos y no seleccionados con diagnóstico de SCASEST en España.
CONCLUSIONESEn España, solo el 13,6% de los pacientes con SCASEST sometidos a cateterismo reciben una estrategia invasiva precoz sin pretratamiento. La incidencia de eventos cardiovasculares y hemorragias graves en el ingreso es baja.
- –
Para los pacientes con SCASEST de alto riesgo (elevación de troponina; cambios en el ECG; GRACE>140), se recomienda un cateterismo precoz por sistema en menos de 24 h desde el ingreso.
- –
Se recomienda además no pretratar con un segundo antiagregante plaquetario a los pacientes sometidos a cateterismo precoz. El ticagrelor o el prasugrel son de elección sobre el clopidogrel en ausencia de contraindicación; puede haber un beneficio asociado con el tratamiento con prasugrel.
- –
Se desconoce el grado de implementación de las recomendaciones vigentes en nuestro medio tanto del cateterismo precoz y el pretratamiento como de la selección del tratamiento antiagregante plaquetario.
- –
En España solo un 13,6% de los pacientes con SCASEST sometidos a cateterismo reciben una estrategia invasiva precoz sin pretratamiento. Por estrategias, un 37,8% se sometieron a cateterismo en las primeras 24 h de ingreso y un 30,3% no recibieron pretratamiento con doble antiagregación plaquetaria.
- –
El ticagrelor es el segundo antiagregante plaquetario más utilizado (49,7%), seguido del clopidogrel (37,8%) y el prasugrel (12,5%).
- –
Independientemente del momento del cateterismo y el uso de pretratamiento, la incidencia de eventos cardiovasculares y hemorragias graves en el ingreso es baja.
Los autores del manuscrito garantizan que los siguientes investigadores son responsables de los datos publicados en este estudio:
F. Díez-Delhoyo, G. Marañón, Madrid; M.T. López Lluva, Hospital Universitario de León; P. Cepas-Guillén, Hospital Clínic de Barcelona; A. Jurado-Román, Hospital La Paz, Madrid; P. Bazal-Chacón, Complejo Hospitalario de Navarra; M. Negreira-Caamaño, Hospital General Universitario de Ciudad Real; I. Olavarri-Miguel, Hospital de Valcedilla, Santander; A. Elorriaga, Hospital de Basurto, Bilbao; R. Rivera López, Hospital Virgen de las Nieves, Granada; D. Escribano, Hospital de San Juan de Alicante; P. Salinas, Hospital Clínico, Madrid; J. Vaquero-Luna, Hospital Txagorritxu, Vitoria; A. Prieto-Lobato, Hospital Universitario de Albacete; L. Pérez-Cebey, Hospital Universitario de A Coruña; A. Carrasquer, Hospital Joan XXIII, Tarragona; I. Llaóo, Hospital de Bellvitge, L’Hospitalet de Llobregat; F.J. Torres Mezcúa, Hospital Universitario de Alicante Doctor Balmis; T. Giralt-Borrell, Hospital del Mar, Barcelona; M. Abellas, Hospital Ramón y Cajal, Madrid; S. García-Blas, Hospital Clínico Universitario de Valencia, Valencia; L. Matute-Blanco, Hospital Universitario Arnau de Vilanova, Lleida; C. Robles-Gamboa, Hospital Universitario de Toledo; y P. Díez-Villanueva, Hospital de la Princesa, Madrid, en representación de los investigadores del registro IMPACT-TIMING-GO.
FINANCIACIÓNSe trata de un estudio no financiado promovido por el Grupo Jóvenes Cardiólogos, con el aval científico de la Sociedad Española de Cardiología.
CONTRIBUCIÓN DE LOS AUTORESDiseño del estudio, recogida y revisión de los datos, análisis estadístico y elaboración del manuscrito: P. Díez-Villanueva, F. Díez-Delhoyo, M.T. López-LLuva. Todos los autores: recogida de datos, revisión y aprobación del manuscrito.
CONFLICTO DE INTERESESNinguno que declarar.
A la Sociedad Española de Cardiología por el apoyo al Grupo Jóvenes Cardiólogos y su apuesta por el fomento de la investigación entre los más jóvenes.
Se puede consultar material adicional a este artículo en su versión electrónica disponible en https://doi.org/10.1016/j.recesp.2023.07.017.
La lista de investigadores del registro IMPACT-TIMING-GO se puede consultar en el material adicional.