La prevalencia de la insuficiencia cardiaca (IC) aumenta paralelamente al envejecimiento poblacional y la mayor supervivencia de los pacientes con infarto de miocardio. Recientemente se han desarrollado nuevas terapias percutáneas con el objetivo de complementar los tratamientos actuales de la IC aguda/descompensada y crónica minimizando los riesgos. En la IC aguda, el fracaso del tratamiento médico ya no puede ser el final de la estrategia terapeútica para el shock cardiogénico, dado el éxito de los dispositivos de soporte circulatorio mecánico. A pesar de que la evidencia en esta área es difícil de generar, el pronóstico de la IC aguda está cambiando radicalmente gracias a la investigación en red sobre dispositivos de flujo pulsátil (balón de contrapulsación intraaórtico), continuo axial (Impella) o continuo centrífugo (TandemHeart; HeartMate PHP) junto con el implante percutáneo de oxigenador extracorpóreo de membrana. Las nuevas terapias percutáneas en la IC crónica se basan en atractivas hipótesis como la descompresión de la aurícula izquierda (shunts), la restauración ventricular (compartimentación) o la monitorización intratorácica de presiones mediante dispositivos implantables que permitan tratar precozmente las descompensaciones. Actualmente solo la última se ha probado efectiva en un estudio aleatorizado. Por lo tanto, es necesario estudiar a fondo este dinámico y prometedor campo.
Palabras clave
La prevalencia de la insuficiencia cardiaca (IC) ha aumentado al 2% de los adultos debido a su incremento progresivo con la edad1. El envejecimiento de la población mundial ha conducido a una creciente incidencia mundial de IC, lo que implica un deterioro del bienestar del paciente y eleva los costes de asistencia sanitaria1,2. Diversas mejoras en el tratamiento de los pacientes con IC y fracción de eyección reducida han hecho que disminuya la tasa de mortalidad, que sigue siendo más alta que la del infarto agudo de miocardio (IAM), y el trastorno se asocia a una tasa de rehospitalizaciones del 40% al año1,2. El pronóstico a medio plazo de la IC continúa siendo muy malo y en muchas situaciones es similar al del cáncer2. Además, la IC supone entre un 1,8 y un 3,1% del presupuesto de salud pública en nuestro entorno, principalmente debido a los costes hospitalarios (un 73% en España)2.
Por lo tanto, los esfuerzos deben centrarse en reducir la incidencia de la IC y de las descompensaciones, evitar las hospitalizaciones y mejorar el pronóstico. Diversas estrategias farmacológicas y no farmacológicas —como los desfibriladores, la terapia de resincronización cardiaca, los dispositivos de asistencia ventricular izquierda (DAVI) y el trasplante cardiaco— constituyen hitos importantes en el tratamiento de la IC avanzada1,3,4. En los últimos años, se han desarrollado nuevos tratamientos percutáneos para simplificar y reducir la agresividad de las intervenciones que complementan los tratamientos actualmente establecidos para la IC aguda o descompensada y la IC crónica. El objetivo de este artículo de revisión es resumir las principales alternativas percutáneas actuales y en fase de desarrollo para el tratamiento de la IC tanto aguda como crónica.
TRATAMIENTOS PERCUTÁNEOS PARA LA INSUFICIENCIA CARDIACA AGUDAEl shock cardiogénico se define como una hipoperfusión tisular sistémica secundaria a un bajo gasto cardiaco a pesar de que haya un volumen circulatorio y una presión de llenado del ventrículo izquierdo (VI) adecuados. Como consecuencia de ello, la presión arterial media se mantiene por debajo de 90mmHg o se reduce en 30mmHg o más, con un índice cardiaco < 1,8 l/min/m2 (sin apoyo hemodinámico) o < 2,2 l/min/m2 si el paciente recibe apoyo hemodinámico, y una presión pulmonar enclavada ≥ 15mmHg5-8.
La tasa de mortalidad en esta situación grave ha mejorado en las últimas décadas, pero continúa siendo inaceptablemente alta (≈50%), al igual que ocurre con la morbilidad derivada del fallo multiorgánico resultante. El hecho de que los fármacos inotrópicos y vasoactivos no logren recuperar esta situación crítica ha dejado de ser el final del camino en el shock circulatorio refractario; de hecho, el empleo de dispositivos de apoyo circulatorio mecánico (ACM) percutáneos es un nuevo hito en el contexto de la asistencia sanitaria con disponibilidad de recursos. El objetivo del ACM es doble: estabilizar al paciente y evaluar las opciones posteriores que pueden ir de un tratamiento puente hasta la toma de decisión, la recuperación, los dispositivos de apoyo a largo plazo, como los dispositivos de asistencia ventricular percutáneos, el corazón artificial total o el trasplante cardiaco5. La elección de la estrategia de ACM de rescate inicial tiene importantes consecuencias no solo para limitar el mayor daño iatrogénico en la situación aguda, sino también para planificar estrategias a largo plazo en ausencia de recuperación del miocardio. El desarrollo de vías institucionales predeterminadas en los centros es crucial para el éxito de estos programas de ACM. De hecho, el momento idóneo para el implante de un dispositivo de ACM percutáneo continúa siendo objeto de controversia y el único consenso general es que deben aplicarse cuanto antes. En la IC avanzada, la puntuación INTERMACS, que incluye 7 categorías, es útil para identificar los estadios (1 y 2) en los que puede aportar un beneficio el ACM debido al fallo del tratamiento inotrópico9,10. El consenso de los expertos es que los dispositivos de asistencia ventricular percutáneos están indicados para los pacientes a los que se practica una angioplastia coronaria de alto riesgo (clase II B) y los que tienen un shock cardiogénico debido a un IAM (clase I B)5,11, aunque se reconoce también su posible uso en el shock cardiogénico debido a otras etiologías (tabla 1 del material suplementario).
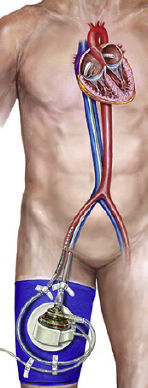
Aunque la evidencia resulta difícil de generar en este campo, las redes de investigación pueden facilitar el volumen de datos ncesario para aumentar el conocimiento de los clínicos respecto a cuándo, dónde y qué tipo de estas tecnologías se puede y se debe utilizar. Los dispositivos de ACM se clasifican según el tipo de bomba de sangre: pulsátil (balón de contrapulsación intraaórtico [BCIA]), continuo axial (Impella) o continuo centrífugo (TandemHeart, CentriMag, Rotaflow, HeartMate PHP)12. El BCIA continúa siendo el método más ampliamente utilizado para la asistencia mecánica5 de los pacientes con insuficiencia del ventrículo izquierdo (VI), debido a sus capacidades hemodinámicas moderadas, el corto tiempo necesario para iniciar el tratamiento y las tasas de complicaciones relativamente bajas. Los DAVI percutáneos (DAVIp) son una nueva opción emergente para el apoyo circulatorio parcial o total, y diversos estudios han comparado la seguridad y la eficacia de estos dispositivos con la del BCIA. Se presenta a continuación una descripción de cada una de las técnicas, que se resumen en la tabla 1.
Características técnicas y estudios principales de los actuales dispositivos percutáneos de apoyo circulatorio mecánico
| Tipo de dispositivo | BCIA (flujo pulsátil) | Impella (flujo continuo axial) | HeartMate PHP (flujo continuo centrífugo) | TandemHeart (flujo continuo centrífugo) | VA-ECMO (flujo continuo centrífugo) | ||||
|---|---|---|---|---|---|---|---|---|---|
| Figuras | |||||||||
| 2,5 | 4 (CP) | 5 | |||||||
| Tamaño (Fr) | 7-8 | 12 | 14 | 21 | 13 | V- 21 | A- 15-19 | V- 18-31 | A- 15-23 |
| Gasto (lpm) | 0,5 | 2,5 | 4 | 5 | 4 | 3,5-4,5 | 4,5-8 | ||
| Complejidad del implante | + | ++ | +++ (quirúrgico) | ++ | +++ | ++++ | |||
| Posibles complicaciones | Isquemia de extremidad Hemorragia | Isquemia de extremidad Hemorragia Hemolisis | Isquemia de extremidad Hemorragia Hemolisis | Isquemia de extremidad Hemorragia Hemolisis | Isquemia de extremidad Hemorragia Hemolisis | ||||
| Ensayos | 1. SHOCK-II13 (frente al tratamiento médico) | 1. ISAR shock14 (Impella 2.5 frente a BCIA) 2. Ensayo RECOVER RIGHT15 (Impella CP) 3. Ensayo PROTECT-II16 (Impella 2.5 frente a BCIA) 4. Ensayo IMPRESS17 (Impella CP frente a BCIA) | 1. SHIELD-I18 2. SHIELD-II19 | 1. Estudio TH20 (frente a BCIA) 2. Registro TH21 | 1. Registro de ECMO en parada cardiaca22 2. Falta de ensayos aleatorizados | ||||
| Contexto clínico | 1. Shock cardiogénico | 1. Shock cardiogénico 2. Insuficiencia del VD tras 48 h con DAVI 3. ICP de alto riesgo | 1. ICP de alto riesgo 2. ICP de alto riesgo | 1. Shock cardiogénico 2. Insuficiencia cardiaca derecha | 1. Parada cardiaca extrahospitalaria | ||||
| Resultados | 1. Sin diferencias en la mortalidad a 30 días (48% BCIA; 49% médico) | 1. Sin diferencias en la mortalidad a 30 días (el 46% en ambos grupos) 2. Mortalidad a 30 días, 27% 3. Sin diferencias en la mortalidad a 30 días (40,1% BCIA; 35,1% Impella) | 1. Estudio de seguridad (no aleatorizados) 2. En curso | 1. Sin diferencias en la mortalidad a 30 días (45% BBIA; 43% TH) 2. Mortalidad hospitalaria, 57% | 1. Mortalidad hospitalaria, 50% | ||||
A: arterial; BBIA: bomba de balón intraaórtico; DAVI: dispositivo de asistencia ventricular izquierda; ECMO: oxigenador extracorpóreo de membrana; ICP: intervención coronaria percutánea; TH: TandemHeart; V: venoso; VD: ventrículo derecho.
Imágenes reproducidas con permiso del titular del copyright.
El BCIA sigue siendo el DAVIp más ampliamente utilizado en todo el mundo, a pesar de que no haya pruebas de beneficio clínico13. No obstante, las guías de Estados Unidos y Europa las recomiendan para los pacientes con IAM y shock (clase II A)23,24 y en 2014 la mitad de los pacientes tratados con trasplante de corazón en España estaban recibiendo apoyo hemodinámico con BCIA25,26. Los principales componentes son un catéter de doble luz de calibre 7,5-8,0 Fr y un balón de poliestireno que se hincha con helio y permite un hinchado y deshinchado rápido debido a su baja viscosidad. Esto crea una acción de bombeo pulsátil, con la deflación durante la sístole, que ayuda a reducir la poscarga, aumentando la perfusión coronaria y reduciendo la demanda de oxígeno del miocardio, pero con un discreto aumento del gasto cardiaco27. Por consiguiente, por debajo de cierto umbral de gasto cardiaco puede no resultar efectivo. Además, su empleo no es posible en caso de inestabilidad eléctrica, enfermedad vascular o insuficiencia aórtica grave.
Impella (Abiomed; Danvers, Massachusetts, Estados Unidos)En unos pocos ensayos clínicos controlados y aleatorizados se ha observado un mejor perfil hemodinámico con el empleo de DAVIp en comparación con BCIA14,16,28. Sin embargo, esto no se ha traducido en una mejora de la supervivencia a 30 días. Además, los pacientes tratados con DAVIp tendían a tener mayor incidencia de isquemia de extremidades y hemorragia asociada al dispositivo29. Se esperaba que el uso de fármacos inotrópicos o vasopresores fuera menor en los pacientes tratados con el dispositivo Impella, pero no se han detectado diferencias en el uso general de estos fármacos. Sin embargo, el uso del dispositivo Impella tiende a aumentar en los pacientes que no responden a inotrópicos y BCIA. En consecuencia, el proceso de toma de decisiones sobre el tratamiento requiere un abordaje integral escalonado. En 2012, O’Neill et al.16 presentaron los resultados del estudio PROTECT II, un ensayo prospectivo en el que se comparó el apoyo hemodinámico con el dispositivo Impella 2.5 frente a BCIA en pacientes a los que se practicaba una intervención coronaria percutánea de alto riesgo. El ensayo se interrumpió prematuramente por futilidad. Actualmente, apenas hay evidencia de que el dispositivo Impella mejore los resultados de salud netos de los pacientes con shock cardiogénico tras cardiotomía o intervenciones coronarias percutáneas de alto riesgo. Los resultados de los estudios iniciales indican que, aunque las medidas hemodinámicas son uniformemente superiores, no se han demostrado cambios clínicamente relevantes en los resultados.
Existen 2 dispositivos de Impella percutáneos: el Impella 2.5 y el Impella CP, ambos con forma distal de pigtail, que se introduce en el VI, donde se crea un flujo continuo hacia la aorta ascendente30. Debido a este mecanismo, el flujo no requiere una señal de activación (a diferencia de lo que ocurre con el BCIA) y no se ve afectado por la presencia de arritmias. Actualmente ha sido aprobado para usarlo durante un periodo de hasta 4 días (Food and Drug Administration [FDA]) o 5 días (marca de Conformité Européenne [CE])31. Como limitaciones, es preciso citar que requiere un ventrículo derecho con función suficiente o el uso de un dispositivo de asistencia ventricular derecha y que su empleo está contraindicado en presencia de prótesis aórticas mecánicas o enfermedad vascular grave. Las complicaciones son también similares a las del BCIA, incluidos los episodios hemorrágicos debidos a la necesidad de anticoagulación sistémica y las lesiones vasculares. Más concretamente, la mala colocación del dispositivo inadvertida es un motivo de especial preocupación que puede conducir a un rápido deterioro, y puede producirse hemolisis en hasta un 10% de los pacientes30–32. Generalmente se puede resolver ambos problemas recolocando el dispositivo y ajustando los parámetros de flujo.
TandemHeart (CardiacAssist Inc.; Pittsburgh, Pensilvania, Estados Unidos)Este dispositivo lleva una cánula de calibre 21 Fr que se sitúa en la aurícula izquierda (AI) a través de una punción transeptal e impulsa la sangre de la AI a la arteria iliofemoral a través de una cánula de calibre 15-19 Fr30. Su uso ha sido autorizado por la FDA durante un periodo de 6 h, mientras que tiene aprobación CE en Europa para un periodo de hasta 30 días.
Al igual que el dispositivo Impella, la función ventricular derecha debe estar conservada30 y la enfermedad vascular es una contraindicación. Hay poca información sobre su uso en pacientes con insuficiencia aórtica o complicaciones asociadas al IAM33,34. Una causa específica de complicaciones es la necesidad de una punción transeptal que debe guiarse mediante ecocardiografía transesofágica para minimizar el riesgo5. Además, el posible desplazamiento de la cánula situada en la AI hacia la aurícula derecha es una complicación infrecuente pero de solución compleja. Varios estudios de comparación del dispositivo TandemHeart con BCIA han puesto de relieve que el índice cardiaco aumentó en los 2 grupos (y en general hubo una mejora hemodinámica), pero fue significativamente superior en el grupo de TandemHeart35,36. En cambio, la mortalidad total a los 30 días fue similar en ambos grupos, mientras que la tasa de eventos, como isquemia de extremidades inferiores, hemorragia grave o sepsis, fue mayor en los pacientes tratados con el dispositivo TandemHeart. Como en los dispositivos previos, probablemente el bajo número de pacientes no permitiera realizar una evaluación relevante de las posibles diferencias de mortalidad, pero los resultados indican que el dispositivo TandemHeart debe utilizarse solo si el estado hemodinámico del paciente no mejora lo suficiente con BCIA.
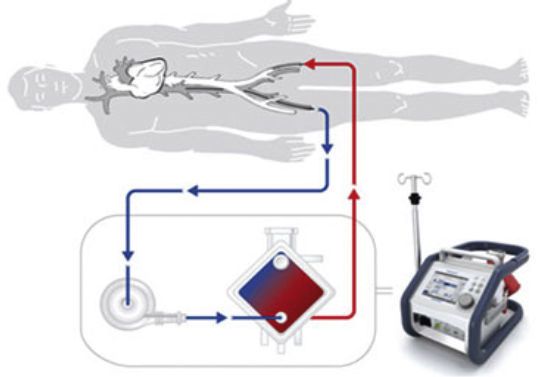
Oxigenador extracorpóreo de membranaRecientemente ha aumentado el uso de oxigenador extracorpóreo de membrana (ECMO) para proporcionar un ACM de un modo incremental, bien con un ECMO venoarterial periférico o central, bien con dispositivos de asistencia venovenosos. El uso de ECMO en la reanimación cardiopulmonar está aumentando también y en centros experimentados se han descrito resultados favorables37,38. Se ha demostrado que el abordaje percutáneo es seguro y efectivo y ahorra tiempo, a la vez que minimiza el sangrado en el lugar de introducción de la cánula. Además, el ECMO puede implantarse a la cabecera del paciente, sin necesidad de guía de fluoroscopia5,30. No obstante, la canulación percutánea continúa siendo un verdadero reto y no está exenta de complicaciones. De hecho, la isquemia de la extremidad correspondiente continúa requiriendo una modificación quirúrgica en un 17% de los pacientes. En consecuencia, es esencial utilizar una técnica de introducción cuidadosa y una estrecha monitorización. El tamaño de la cánula es similar al del dispositivo de TandemHeart y el implante de los dispositivos portátiles es relativamente sencillo. Las complicaciones más frecuentes están relacionadas con la trombosis, la hemorragia39 y los episodios infecciosos. Al igual que ocurre con el dispositivo TandemHeart, se recomienda emplear una cánula de perfusión anterógrada para evitar la isquemia de la extremidad. La FDA y la marca de CE europea han aprobado el uso continuo del ECMO durante 30 días, pero en el registro de la Extracorporeal Life Support Organization se ha descrito repetidamente mayor duración22.
Se carece de ensayos aleatorizados, pero hay consenso respecto a que el ECMO puede ser útil en casos de shock cardiogénico, insuficiencia tras cardiotomía y miocarditis y durante la reanimación37,38 o si fracasa el implante tras un trasplante primario. De hecho, un tercio de los pacientes a los que se practicó un trasplante de corazón de urgencia en España en 2014 estaban siendo tratados con ECMO14.
Una de las principales razones del aumento de la morbilidad y la mortalidad de los pacientes tratados con ACM es la insuficiencia ventricular derecha. Actualmente, el uso de ECMO venoarterial probablemente sea la mejor alternativa si se produce esta complicación, si bien los resultados del estudio RECOVER RIGHT apuntan a un nuevo uso posible e interesante del dispositivo Impella en esta situación15,38.
Nuevos tratamientos percutáneos para la insuficiencia cardiaca agudaEl dispositivo HeartMate PHP (Percutaneous Heart Pump) de Thoratec (St. Jude) es un nuevo catéter de flujo continuo axial cuya colocación es similar a la del dispositivo Impella (tabla 1) y que dispone de la aprobación de marca CE europea desde julio de 2015 para el uso en intervenciones coronarias percutáneas de alto riesgo. Su posible uso en el shock cardiogénico se evaluará en el estudio SHIELD-II (coronary interventionS in HIgh-risk patiEnts using a novel percutaneous LV support device). Teóricamente, puede reducir la tasa de hemolisis disminuyendo la tensión de cizallamiento (shear stress) y aumentar la estabilidad en el interior del VI.
Hay varias nuevas tecnologías prometedoras que se encuentran en fases de investigación preclínica y son también de interés en este contexto. Este es un campo muy dinámico y 2 de los ejemplos que representan solo la punta del iceberg son el dispositivo Aortix (Procyrion; Houston, Texas, Estados Unidos) y el dispositivo BoLetz micro-LVAD (OCR; Yale, Reino Unido). El primero consiste en un marco autoexpandible que fija la bomba a la pared de la aorta descendente, con lo que se evita el riesgo de embolia en los troncos supraaórticos; tras el implante, se retira el catéter de calibre 18 Fr y se deja solo un cable eléctrico flexible que se tuneliza hasta un sistema de transferencia de energía transcutáneo. El dispositivo BoLetz micro-LVAD, de despliegue endovascular, es un nuevo concepto que se encuentra en las fases iniciales de desarrollo y puede representar el concepto futuro de los tratamientos de DAVIp.
TRATAMIENTOS PERCUTÁNEOS PARA LA INSUFICIENCIA CARDIACA CRÓNICADe cada 5 personas, 1 sufrirá IC a lo largo de su vida1,2. Una de las principales razones de ello es la mejor supervivencia actual tras un IAM, que ha llevado a una mayor prevalencia de disfunción crónica del VI. Sin embargo, la IC continúa teniendo mal pronóstico y, concretamente, la IC progresiva es la principal causa de muerte de los pacientes en clase funcional III-IV de la New York Heart Association (NYHA). Por consiguiente, limitar esta progresión es un objetivo importante para mejorar no solo la calidad de vida, sino también la supervivencia a medio plazo1. Además, aunque ha habido avances importantes en los tratamientos de la IC con fracción de eyección reducida, son muy pocos los que se han hecho en el escenario heterogéneo de la IC con fracción de eyección conservada, para la que se carece de tratamientos de eficacia probada, a pesar de que sus tasas de morbilidad y mortalidad son comparables1. Dado el gran número de pacientes afectados por este problema y los enormes costes que supone para el sistema sanitario, no es de extrañar que haya habido una prolífica investigación en este campo en las últimas décadas40. Las principales nuevas estrategias percutáneas para el tratamiento de la IC crónica se muestran de manera esquemática en la tabla 2. Los tratamientos valvulares percutáneos, así como los destinados a tratar las complicaciones mecánicas, no son objeto de esta revisión.
Nuevos tratamientos percutáneos para la insuficiencia cardiaca crónica
| Estrategias terapéuticas | Descompresión de AI | Restauración del VI | Monitorización de la presión | Tratamientos inyectables | Otros | ||
|---|---|---|---|---|---|---|---|
| Dispositivos | AFR (Mia Medical, Estambul, Turquía) | V-Wave (V-Wave Ltd., Or-Akiva, Israel) | IASD (DC Devices Inc., Tewksbury, Massachusetts, Estados Unidos) | Parachute (CardioKinetix Inc., Menlo Park, California, Estados Unidos) | CardioMEMS HF (CardioMEMS, Atlanta, Georgia, Estados Unidos) | Terapia celular/génica + sistema de aplicación transendocárdica Helix (BioCardia, San Carlos, California, Estados Unidos) | Nuevos dispositivos de resincronización, neuromodulación, etc. |
| Figuras | ND | ||||||
| Tamaño (Fr) | 14 | 14 | 16 | 14-16 | 12 | Variable | — |
| Complejidad de la implantación | ++ | ++++ | ++ | +++ | +++ | ||
| Estudios | Registro (PHT) | Registro (IC-FEr)41 | Registro (IC-FEc)42 | 1 Registros43 2. PARACHUTE-IV44 (ensayo en curso) | 1 Registros45 2. Ensayo CHAMPIONl46 | Registros | Registros |
| Resultados | Reducción de las rehospitalizaciones | Reducción de volumen del VI y mejora de la distancia en 6MWT | Reducción de las rehospitalizaciones. Incluido en la guía de IC | En fase de evaluación | En fase de evaluación | ||
| Otros dispositivos | Dispositivos artesanales «caseros» | VenTouch (Mardil Medical, Minneapolis, Minnesota, Estados Unidos) | Chronicle (Medtronic, Minneapolis, Minnesota, Estados Unidos) | Algisyl (LoneStar Heart Inc., Laguna Hills, California, Estados Unidos) | Múltiple | ||
6MWT: prueba de 6 min de marcha; AI: aurícula izquierda; HP: hipertensión pulmonar; IC: insuficiencia cardiaca; IC-FEc: insuficiencia cardiaca con fracción de eyección conservada; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; ND: no disponible; VI: ventrículo izquierdo.
Imágenes reproducidas con permiso del titular del copyright.
La mayoría de los pacientes con IC tienen síntomas relacionados con la congestión y el bajo gasto cardiaco. Los nuevos tratamientos se centran principalmente en reducir las presiones de llenado de las cámaras para mejorar la congestión y reducir el consumo miocárdico de oxígeno45,47. Con este objetivo, se han propuesto diferentes mecanismos, como los dispositivos de monitorización de la presión implantables, la descompresión auricular izquierda y los sistemas de restauración del VI.
Dispositivos de monitorización de la presiónDurante décadas, se han venido utilizando determinaciones directas de la presión intracardiaca mediante catéter de Swan-Ganz para obtener un diagnóstico exacto, evaluar el pronóstico y tratar a los pacientes con IC, con base en los resultados de estudios retrospectivos clásicos. Sin embargo, estudios prospectivos como SUPPORT48, ESCAPE49 o PAC-Man50 no han podido demostrar su efecto beneficioso, pese a lo cual con frecuencia se sigue utilizando la monitorización invasiva de la presión en la atención a los pacientes con IC51,52. La brecha existente entre la práctica clínica y la evidencia científica actual podría cubrirse con dispositivos de monitorización de la presión implantables. Esta nueva tecnología tiene como objetivo prevenir y tratar de inmediato las descompensaciones de la IC crónica empleando dispositivos inalámbricos intracardiacos que permitan registrar las presiones de llenado del VI53. El dispositivo Chronicle (Medtronic; Minneapolis, Minnesota, Estados Unidos) realiza un registro continuo de esta presión a través de una guía similar a la de los marcapasos, colocada dentro del tracto de salida del ventrículo derecho. El estudio COMPASS-HF54 demostró que la descompensación clínica se precede de un aumento de las presiones de llenado, y ayudó a alcanzar una reducción del 36% en el riesgo relativo de rehospitalización en los pacientes con una IC crónica que estaban en NYHA III. Se obtuvieron resultados similares en el estudio REDUCE HR55 que, sin embargo, se interrumpió prematuramente a causa de un mal funcionamiento de la guía. Por este motivo, la FDA rechazó la autorización para su uso clínico en 2007; no obstante, constituye la prueba de concepto de la estrategia de monitorización inalámbrica de la presión.
Más recientemente, el estudio CHAMPION45,46, en el que participaron pacientes con IC en NYHA III, aleatorizó a los pacientes a tratamiento convencional o guiado por la presión y ha descrito que con el dispositivo CardioMEMS HF (CardioMEMS; Atlanta, Georgia, Estados Unidos) se alcanzó una reducción del 28% en la tasa de rehospitalizaciones en los primeros 6 meses siguientes al implante. Este dispositivo ha sido autorizado por las autoridades reguladoras, y ello ha conducido a su inclusión en la versión más reciente de la guía para pacientes con IC1. Este pequeño dispositivo (15 × 3 mm) tiene una encapsulación de silicio y nitinol que lo ancla para evitar que migre. El implante se realiza a través de un catéter de calibre 12 Fr que se introduce hasta la arteria pulmonar y puede cargarse mediante radiofrecuencia.
Por último, el dispositivo HeartPOD (St. Jude Medical) registra la presión en la AI a través de un registrador de 3 × 7 mm anclado en el tabique interauricular. Los estudios en curso LAPTOT-HF y CRT-D LAP56 tienen como objetivo evaluar las presiones de la AI y después informar al paciente sobre cómo ajustar las medicaciones en función de ello. La principal limitación de este nuevo dispositivo puede ser la necesidad de una punción del tabique interauricular que tiene riesgos asociados, pero la relación riesgo/beneficio está aún en fase de evaluación.
Dispositivos de descompresión de la aurícula izquierda (shunts)El fundamento de los dispositivos de descompresión de la aurícula izquierda (shunts) mediante el desvío de sangre entre las 2 aurículas como medio para reducir las presiones elevadas se basa en el conocimiento médico, que data de la década de los sesenta (creación de septostomías auriculares), para derivar la sangre de una aurícula a otra en el tratamiento de las presiones elevadas (descarga derecha e izquierda)57. Además, actualmente la guía de hipertensión pulmonar recomienda las intervenciones de septostomía para los pacientes con hipertensión pulmonar avanzada y presión auricular derecha elevada, y se han diseñado dispositivos específicos, como el Heartx AFR, para este fin (tabla 2). Los datos publicados y los estudios de viabilidad en modelos animales de IC demuestran que cabe prever que el desvío de 1.000-1.500ml/min para un gradiente de presión de 6 mmHg (entre la presión arterial izquierda y la derecha) y de 1.500-1.900ml/min para un gradiente de presión de 10 mmHg reduzcan la presión auricular izquierda en un 20 y un 30% respectivamente, sin que se produzca un aumento significativo de la presión auricular derecha58,59. La población para la que están indicados estos nuevos dispositivos de shunt incluye a los pacientes con secuelas clínicas debidas a una presión de la AI elevada, que constituyen alrededor del 90% de los pacientes hospitalizados por congestión pulmonar47. La reducción de esta presión a una cifra < 18 mmHg podría mejorar el estado de congestión pulmonar del paciente, con un efecto directo y positivo en la ventilación, la disnea y las tasas de hospitalización41,42,60,61.
Hasta el momento se ha descrito en 2 series pequeñas el uso de dispositivos de shunt izquierda-derecha específicos para el ser humano. La primera es la experiencia inicial con el dispositivo V-Wave (V-Wave Ltd.; Or Akiva, Israel) para el tratamiento de la IC con fracción de eyección reducida41. El V-Wave es un dispositivo dedicado que se ha diseñado para el implante percutáneo en la fosa oval. Este dispositivo intenta abordar algunas de las limitaciones que caracterizan las septostomías auriculares. Está formado por un shunt de nitinol en forma de reloj de arena, con una encapsulación de politetrafluoroetileno y 3 valvas de pericardio porcino unidas mediante sutura. El catéter de aplicación del dispositivo V-Wave es de calibre 14 Fr y está destinado a aplicar el shunt ondulado. Se recomienda emplear anticoagulación oral durante los 3 meses siguientes. El dispositivo se implantó con éxito en 10 pacientes; no se produjeron eventos adversos relacionados con el dispositivo o con la intervención durante el seguimiento. La clase funcional mejoró de NYHA III a II-I en el 89% de los pacientes, con un aumento significativo de la calidad de vida según lo indicado por cuestionarios específicos y por la distancia recorrida en la prueba de los 6 min de marcha. La presión capilar pulmonar enclavada se redujo de 23 ± 5 a 17 ± 8mmHg a los 3 meses, sin ningún cambio en la presión auricular derecha, la presión arterial pulmonar o la resistencia pulmonar. Ningún paciente fue ingresado en el hospital por un agravamiento de la IC41.
En la segunda serie, se trató a 68 pacientes con diagnóstico de IC y fracción de eyección conservada mediante el IASD (Corvia Medical; Tewksbury, Massachusetts, Estados Unidos), y se pudo colocar el dispositivo con éxito a 64 de ellos42. El IASD es también un dispositivo dedicado hecho de nitinol, con diámetros externo e interno de 19 y 8 mm respectivamente. Así pues, se crea una comunicación interauricular permanente de 8 mm. Los ejes de sujeción del dispositivo son planos en el lado de la AI con objeto de minimizar el riesgo de formación de trombos. Se coloca una vaina de 16 Fr en la vena femoral y se utiliza un catéter de aplicación patentado para implantar en la localización deseada en la fosa oval. Después de la intervención, se dio a los pacientes un tratamiento antiagregante plaquetario doble, pero no se recomendó la anticoagulación, puesto que no hay ninguna válvula suturada dentro de la estructura de nitinol. Ningún paciente sufrió eventos cardiacos o cerebrovasculares periintervención ni necesitó una intervención de cirugía cardiaca por complicaciones relacionadas con el dispositivo durante el seguimiento de 6 meses. El 52% presentó una reducción de la presión capilar pulmonar enclavada en reposo y un 58% durante el ejercicio, con un aumento de la duración media de este, lo cual indica que la derivación de sangre auricular podría ser una nueva estrategia en el tratamiento de la IC con fracción de eyección conservada42.
Hasta la fecha, la efectividad de los dispositivos de descompresión de la AI no se ha comparado con el patrón de referencia del tratamiento en un ensayo controlado y aleatorizado. Por consiguiente, esta intrigante hipótesis y los datos preliminares sobre la mejora hemodinámica y funcional deberán interpretarse con precaución.
Dispositivos percutáneos de restauración ventricular izquierdaLas estrategias invasivas agresivas que actualmente se aplican al IAM han aumentado las tasas de supervivencia. Sin embargo, esto ha creado una población creciente con lesión miocárdica residual grande. La dilatación del VI y el remodelado tras el infarto de miocardio constituyen un fenómeno bien conocido con origen en la reducción de la contractilidad, que hace aumentar la tensión de la pared, fomenta la activación molecular del proceso fibroso y da lugar a remodelado adverso. El concepto de la restauración percutánea del VI se basa en la premisa de que un dispositivo de partición deformable dedicado, aplicado por vía percutánea, puede lograr una reducción del volumen del VI, una reconfiguración geométrica y un movimiento sincronizado de la pared para alcanzar una eyección más efectiva, al tiempo que se minimiza el riesgo que tendría un abordaje quirúrgico. Su eficacia terapéutica depende de la mejora de los volúmenes del VI que reduciría la tensión de la pared.
El sistema Parachute (CardioKinetix Inc.; Menlo Park, California, Estados Unidos) incluye un sistema de aplicación con un balón que facilita la expansión del dispositivo y un catéter de aplicación premoldeado. El dispositivo, de diversos tamaños, incluye un marco de nitinol autoexpandible y una membrana impermeable de politetrafluoroetileno expandida, con un pie de polímero radioopaco atraumático destinado a establecer un punto de contacto con la pared apical del VI, que permite colocar el dispositivo dirigido hacia el tracto de salida.
Tras unos resultados preclínicos inicialmente prometedores62, se llevó a cabo un estudio prospectivo no aleatorizado (PARACHUTE III) con el objetivo de evaluar la seguridad y la eficacia a largo plazo del dispositivo Parachute. Participaron un total de 100 pacientes con IC en NYHA II-IV, fracción de eyección del VI del 15-40% y pared anterior-apical acinética o discinética dilatada. De los 100 pacientes incluidos, se implantó el dispositivo con éxito a 97. El objetivo principal de seguridad fueron los eventos cardiacos o cerebrales adversos mayores relacionados con la intervención (7%) y el secundario, la combinación de mortalidad y morbilidad (32,3%). Los objetivos secundarios de eficacia fueron diversos parámetros de diagnóstico por imagen y funcionales, y se alcanzaron por lo que respecta a la reducción del volumen del VI y la mejora de la distancia recorrida en la prueba de 6 min de marcha43. Estos resultados de seguridad y eficacia aceptables tendrán que validarse también en ensayos controlados y aleatorizados, como el estudio PARACHUTE IV actualmente en curso44.
En resumen, estos nuevos tratamientos destinados a mejorar los síntomas y el pronóstico de los pacientes con IC crónica parecen prometedores, pero continúa habiendo una brecha en la evidencia que previsiblemente se reducirá con los estudios que se están llevando a cabo actualmente. El primer paso, consistente en demostrar la importancia de ajustar el tratamiento de la IC guiado por monitorización de presión, ya se ha logrado en un estudio aleatorizado que constituye el primer hito de esta nueva generación de tratamientos percutáneos.
COMENTARIOS FINALESLa IC tiene una incidencia creciente y unos mecanismos variables que requieren tratamientos específicos. En las formas de presentación agudas o descompensadas, el fallo del tratamiento médico ha dejado de equivaler al agotamiento de las opciones terapéuticas en el shock circulatorio refractario; el uso de dispositivos de ACM es el siguiente paso en contextos sanitarios que dispongan de recursos. Aunque la evidencia existente respecto a la supervivencia es escasa porque esta situación específica dificulta la aleatorización, la creciente variedad de dispositivos alternativos debe manejarse con precaución, pero también con audacia, para reducir la inaceptable tasa de mortalidad de los pacientes con shock cardiogénico.
Más complejo aún es el tratamiento de los pacientes con IC crónica. Dado el gran número de pacientes que tienen este problema, el deterioro de su calidad de vida y los costes asociados a la asistencia sanitaria, son necesarias estrategias igualmente eficaces y eficientes para mejorar la calidad de vida de nuestros pacientes con una reducción paralela de las hospitalizaciones y las descompensaciones. El proceso lento de evaluación de los nuevos tratamientos percutáneos para tratar la IC crónica es necesario y suficiente para integrar a nuestro arsenal terapéutico las tecnologías que tienen beneficios demostrados.
En conclusión, los nuevos dispositivos percutáneos para el tratamiento de la IC aguda y crónica están llevando a un cambio de paradigma desde una vía de tratamiento común a un enfoque individualizado de la atención a estos pacientes. Este campo dinámico continúa requiriendo una investigación detallada y precaución, pero también la intervención de médicos con una mentalidad audaz para avanzar en esta nueva era trepidante.
FINANCIACIÓNL.H. Varela-Falcón recibió ayuda de la Fundación Carolina-BBVA. El ICICOR recibió ayuda para un proyecto relacionado del Instituto de Salud Carlos III (proyecto FIS PI 15/01695) y de fondos FEDER.
CONFLICTO DE INTERESESI.J. Amat-Santos ha recibido de V-Wave Ltd. una subvención para el centro. W.T. Abraham es consultor y accionista de V-Wave Ltd. y ha sido consultor y ha recibido subvenciones de Medtronic Inc., CardioMEMS, St. Jude Medical y CVRx.
A Amada Recio-Platero por su amable ayuda y a los demás profesionales de la Unidad de Insuficiencia Cardiaca del ICICOR (Instituto de Ciencias del Corazón).