Los avances del tratamiento médico no serían posibles sin la contribución de la comunidad científica. Varios ensayos controlados y aleatorizados han conducido a las guías de que actualmente disponemos. Concretamente, los ensayos COMPANION y CARE-HF dieron un giro a la terapia de resincronización cardiaca, que pasó a ser un método reconocido de tratamiento para pacientes con insuficiencia cardiaca, QRS ≥ 120, fracción de eyección ≤ % y ritmo sinusal, para reducir las hospitalizaciones y la mortalidad por cualquier causa. Posteriormente se establecieron nuevas indicaciones para casos de fibrilación auricular, pacientes dependientes de marcapasos y pacientes sintomáticos leves, pero es necesario abordar nuevos retos, como la reducción de las tasas de complicaciones y de pacientes sin respuesta. Para ello, se están realizando nuevos estudios y se investigan actualmente nuevas técnicas de implantación.
Palabras clave
La insuficiencia cardiaca (IC) es una de las enfermedades cardiovasculares que causan más invalidez, más mortalidad y mayor gasto en los países occidentales. Durante las últimas décadas, se han producido muchos avances del tratamiento farmacológico que han elevado la esperanza de vida de los pacientes con IC y han mitigado los síntomas de este trastorno. No obstante, la mortalidad y la calidad de vida siguen siendo motivo de preocupación en la inmensa mayoría de los pacientes con IC. En 1990, Mower1 introdujo en la práctica clínica el uso del marcapasos biventricular (BiV) para el tratamiento de la disfunción miocárdica asociada a bloqueo de rama izquierda del haz (BRIH). Desde entonces, se ha producido una notable evolución de la terapia de resincronización cardiaca (TRC), tanto en su desarrollo técnico como en el conocimiento de la fisiopatología y la patobiología de la disincronía mecánica. Además, en los últimos 20 años, varios ensayos controlados, prospectivos y aleatorizados han contribuido a establecer y ampliar las indicaciones de la TRC en la población de pacientes con IC. A pesar de esta notable evolución, aún exixten dudas e incertidumbres. Los objetivos actuales de la TRC son: a) mejorar la tasa de pacientes que responden al tratamiento, y b) potenciar la respuesta al tratamiento en los individuos que obtienen un efecto beneficioso con la TRC.
En este artículo se revisan los ensayos más importantes que han llevado a las indicaciones actuales de la TRC, señalando también los subgrupos de pacientes en los que la indicación de TRC no está tan bien establecida. Conviene señalar que hasta ahora no se ha establecido formalmente ninguna exclusión o contraindicación para la TRC.
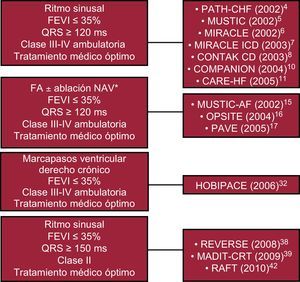
Indicaciones de la terapia de resincronización cardiaca. Dos décadas de estudiosPoco después de la primera descripción del marcapasos BiV realizada por Mower1, en 1994 Cazeau et al2 en Francia y Bakker et al3 en los Países Bajos describieron el tratamiento de la IC avanzada mediante marcapasos auriculo-BiV. A estos informes iniciales, siguieron los primeros dos estudios aleatorizados, prospectivos y de grupos cruzados PATH-CHF4 y MUSTIC5. Ambos estudios mostraron de manera muy consistente una mejora clínicamente relevante de la clase funcional de la New York Heart Association (NYHA), la prueba de 6 min de marcha, la calidad de vida y el consumo máximo de oxígeno (VO2máx). Posteriormente, los ensayos MIRACLE6 y MIRACLE ICD7 y el estudio CONTAK CD8 confirmaron, en poblaciones más amplias, los efectos beneficiosos de la TRC anteriormente descritos, pero también demostraron de forma convincente un efecto significativo de la TRC en la fracción de eyección ventricular izquierda (FEVI), acompañada de una reducción muy notable de los volúmenes sistólico y diastólico del ventrículo izquierdo (VI) y de la masa de este6, 9. Finalmente, dos ensayos clave, el COMPANION10 en 2004 y el CARE-HF11 en 2005, establecieron el efecto beneficioso de la TRC en cuanto a las hospitalizaciones y la mejora en la supervivencia de los pacientes a los que se aplicó este tratamiento. El COMPANION fue un ensayo con tres grupos de tratamiento, en el que participaron 1.520 pacientes en clase III o IV de la NYHA que recibían un tratamiento farmacológico óptimo; los pacientes tenían una FEVI ≤ 35%, un QRS ≥ 120 ms y un intervalo PR ≥ 150 ms. Se les asignó aleatoriamente, en una proporción 1:2:2, el tratamiento farmacológico solo, la TRC sola (TRC-P) o la TRC más desfibrilador (TRC-D), respectivamente. El objetivo primario fue la combinación de muerte por cualquier causa y hospitalización por cualquier causa. El seguimiento para el objetivo primario fue una mediana de 11,9, 16,2 y 15,7 meses en los grupos de tratamiento farmacológico, TRC-P y TRC-D, respectivamente. Tanto la TRC-P como la TRC-D redujeron significativamente el riesgo del objetivo primario en comparación con el tratamiento médico óptimo solo: el 19% (p=0,014) y el 20% (p=0,001) respectivamente. El riesgo de mortalidad por cualquier causa y hospitalización por IC se redujo en un 34% (p<0,001) y un 40% (p<0,001) en los grupos de TRC-P y TRC-D respectivamente. La mortalidad por todas las causas se redujo significativamente con la TRC-D (36%; p=0,003), pero no con la TRC-P (reducción del 24%; p=0,059). La falta de significación estadística en este último caso puede deberse al seguimiento relativamente breve, puesto que la tasa de mortalidad por año en el grupo de tratamiento farmacológico ascendió al 19%. Las dudas que pudieran quedar respecto al efecto beneficioso en cuanto a la mortalidad aportado por la TRC se disiparon un año después, con la publicación de los resultados del estudio CARE-HF, en el que participaron pacientes en clase funcional III/IV de la NYHA a pesar del tratamiento farmacológico, una FEVI ≤ 35% y una duración del QRS ≥ 150 ms o en 120-149 ms junto con criterios ecocardiográficos de disincronía. A todos los pacientes del grupo de tratamiento activo se les implantó una TRC-P. Durante una media de seguimiento de 29,4 meses, el riesgo del objetivo primario formado por muerte y hospitalizaciones por IC se redujo en un 37% (p<0,001) y el de hospitalizaciones por IC, en un 39% (p<0,001). Al igual que en el ensayo COMPANION, se produjeron mejoras significativas en la clase de la NYHA y la calidad de vida. En el CARE-HF, la TRC-P redujo la muerte por cualquier causa en un 36% (p<0,002), reducción similar a la del estudio COMPANION. Además, en un seguimiento a largo plazo predefinido, durante una media de 37,4 meses, tomando la muerte por cualquier causa como objetivo primario, se observó una reducción significativa del 40% con la TRC-P (p<0,0001). Se registró también una reducción del riesgo de muerte súbita cardiaca con la TRC-P en el CARE-HF12. Parecía concebible prever que la mejora de la función cardiaca con la TRC pudiera reducir la incidencia de arritmias graves y, por lo tanto, el riesgo de muerte súbita, pero esta cuestión continúa sin haberse esclarecido. En 2006, un metaanálisis de ensayos controlados y aleatorizados de la TRC en la IC que sumaban unos 3.000 pacientes describió una reducción de la mortalidad por cualquier causa del 29% con la TRC13.
Estos resultados favorables y consistentes se han resumido adecuadamente en las recomendaciones más recientes de las guías de la Sociedad Europea de Cardiología14: pacientes que continúan en clase III-IV de la NYHA a pesar del tratamiento farmacológico optimizado y tienen FEVI baja (≤ 35%), ritmo sinusal y QRS ≥ 120 ms (indicación de clase I, nivel de evidencia A).
Pacientes en fibrilación auricularLos pacientes con IC que están en fibrilación auricular (FA) suelen tener más comorbilidades y peor pronóstico a pesar del tratamiento farmacológico óptimo que los que están en ritmo sinusal. Este grupo de pacientes con IC y FA representa hasta un 30% del total de la población con IC crónica, y su prevalencia aumenta entre los pacientes de edad avanzada. La mayor gravedad de los síntomas en esta población puede explicarse por la falta de llenado auricular activo y de la sincronía auriculoventricular (AV) asociada, y por un intervalo RR irregular y una frecuencia cardiaca media comparativamente superior, características ambas que acortan significativamente el tiempo de llenado ventricular.
En el primer estudio multicéntrico y aleatorizado (MUSTIC-AF)15 participaron 64 pacientes en FA persistente y permanente, FEVI<35% y clase III de la NYHA. Sin embargo, sólo 37 pacientes completaron el seguimiento del estudio. Es de destacar que en un 63% de los pacientes se realizó una ablación del nódulo AV. Durante un periodo de 6 meses, se asignó aleatoriamente a los pacientes a dos periodos cruzados de 3 meses cada uno, en los que se comparó el marcapasos ventricular derecho (VD) univentricular con el marcapasos BiV. El objetivo primario fue la distancia recorrida en 6 min; los objetivos secundarios fueron el VO2máx, la calidad de vida, los ingresos hospitalarios por IC, la mortalidad y el modo de marcapasos preferido por el paciente. No hubo diferencias estadísticamente significativas entre las modalidades de tratamiento en el análisis por intención de tratar, pero en los 37 pacientes que completaron las evaluaciones de la eficacia hubo una mejora significativa de la distancia recorrida en 6 min y del VO2máx con el marcapasos BiV. La mayoría de estos pacientes (84,6%) prefirieron el periodo correspondiente a la fase de marcapasos BiV. La elevada tasa de abandonos del estudio limitó la potencia estadística de este ensayo.
En un segundo ensayo prospectivo y aleatorizado (OPSITE)16 participaron 56 pacientes con FA permanente divididos en dos subgrupos: FEVI>40% y ausencia de BRIH frente a FEVI<40% y BRIH. En todos los pacientes se realizó una ablación del nódulo AV y se implantó un dispositivo BiV. Se asignó aleatoriamente a los pacientes con un diseño de grupos cruzados de 3 meses, en el que se compararon los marcapasos VD, VI y BiV durante un periodo de seguimiento de 12 meses. Los objetivos primarios fueron la calidad de vida y la capacidad de ejercicio. Todos los pacientes tuvieron mejoras de su calidad de vida y su capacidad de ejercicio respecto a la situación basal, pero hasta un 25% de los pacientes obtuvieron mejores resultados con el marcapasos VD que con el VI o el BiV, y se observó un efecto dominante del control de la frecuencia cardiaca sobre la resincronización. No hubo diferencias estadísticamente significativas en el análisis de subgrupos.
Posteriormente, el ensayo PAVE17 comparó el uso crónico de los marcapasos BiV y VD en pacientes a los que se practicó una ablación del nódulo AV para el tratamiento de una FA permanente con frecuencias ventriculares rápidas. Se asignó aleatoriamente a los 148 pacientes con FEVI 0,46±0,16 y en clase II-III de la NYHA (en promedio, sin diferencias significativas entre los grupos) al tratamiento con un sistema de marcapasos BiV (n=103) o un sistema de marcapasos VD (n=81). El objetivo primario fue el cambio en la prueba de distancia recorrida en 6 min a los 6 meses de la ablación. Los objetivos secundarios fueron los cambios de la calidad de vida y la FEVI. A los 6 meses de la ablación, los pacientes tratados con resincronización cardiaca presentaron una mejora significativa en la prueba de los 6 min de marcha (el 31% respecto al valor basal, 82,9±94,7 m), en comparación con los pacientes tratados con el marcapasos VD (el 24% por encima del valor basal, 61,2±90 m; p=0,04). No hubo diferencias significativas en los parámetros de calidad de vida. La FEVI en el grupo de BiV (0,46 ± 0,13) fue significativamente superior a la de los pacientes tratados con marcapasos VD (0,41 ± 0,13; p=0,03). Es de destacar que los pacientes del grupo de marcapasos BiV con FEVI ≤ 45% (37 pacientes del grupo de marcapasos BiV y 39 del grupo de marcapasos VD) o síntomas de clase II-III de la NYHA (90 pacientes del grupo de marcapasos BiV y 61 del grupo de marcapasos VD) presentaron mejoras en la distancia recorrida en 6 min superiores a las de los pacientes con función sistólica normal o síntomas de clase I.
Más recientemente, varios registros observacionales amplios han descrito resultados positivos con la resincronización en pacientes con FA y disfunción del VI que presentaban un BRIH18, 19, 20, 21, 22, 23, 24. Gasparini et al25 publicaron el estudio prospectivo observacional con una muestra más amplia (673 pacientes) y un seguimiento más largo (4 años) para la comparación de pacientes con FA permanente (162) con pacientes en ritmo sinusal (511). El efecto beneficioso de la resincronización fue similar en ambos grupos por lo que respecta a la capacidad funcional, el remodelado inverso y la función del VI. Es de destacar que solamente el grupo de pacientes a los que se practicó una ablación del nódulo AV mostró mejoría de la FEVI (p<0,001), el volumen telesistólico del VI (p<0,001), la capacidad de ejercicio (p<0,001) y un mayor porcentaje de pacientes con respuesta a los 12 meses (el 68% en el grupo de ablación en comparación con sólo el 18% en el grupo sin ablación).
A pesar de los resultados positivos obtenidos en este y otros estudios26, la necesidad de la ablación del nódulo AV en esta población sigue siendo muy controvertida y apunta a la necesidad de realizar estudios multicéntricos y aleatorizados al respecto.
En consecuencia, la indicación de la resincronización en las guías internacionales más recientes27 es de clase IIa, con un nivel de evidencia B si se realiza una ablación del nódulo AV y un nivel de evidencia C si hay ≥ 95% de marcapasos BiV sin ablación del nódulo AV.
Pacientes con dependencia de marcapasosHoy ya hay suficiente evidencia para afirmar que el marcapasos de vértice VD tiene efecto negativo en la sincronía de los pacientes con y sin disfunción del VI28, 29. Este tipo de estimulación causa un patrón electrocardiográfico de BRIH que genera una disincronía similar a la del BRIH espontáneo y un retraso en la contracción del VI. Desde los estudios experimentales a pequeña escala30, 31 hasta el primer ensayo aleatorizado realizado en 2006 (HOBIPACE)32 y los estudios observacionales más recientes33, 34, 35, 36, todos los estudios han mostrado de manera uniforme un resultado positivo tras la adición de un electrodo VI en los pacientes con dependencia de marcapasos que presentan una disfunción del VI moderada-grave, síntomas de IC grave (clase III-IV de la NYHA) y son portadores de un marcapasos VD apical a largo plazo. Aunque la mayor parte de los estudios han mostrado mejoras significativas de la FEVI, el diámetro telediastólico del VI, el diámetro telesistólico del VI y la clase funcional, hasta el momento no se han descrito reducciones en las tasas de hospitalizaciones, mortalidad y morbilidad.
En pacientes con función sistólica normal, Yu et al37 han descrito recientemente que el marcapasos apical VD convencional produjo un remodelado del VI adverso y una reducción de la FEVI; estos efectos se evitaron con un marcapasos BiV. Este estudio tiene varias limitaciones. La muestra era pequeña y el estudio no disponía de la potencia estadística necesaria para detectar diferencias significativas en los eventos clínicos. Sin embargo, se diseñó con la potencia suficiente para evaluar las diferencias esperadas entre los dos grupos de marcapasos respecto a la función sistólica y el volumen del VI. La tasa de éxitos con la implantación del sistema de marcapasos BiV fue del 92%, muy inferior a lo observado con el marcapasos bicameral convencional, pero similar a lo obtenido con los marcapasos implantados en pacientes con IC. Están todavía en fase de realización ensayos prospectivos amplios, controlados y aleatorizados en diferentes poblaciones de pacientes con alguna indicación para el uso del marcapasos VD convencional, y se espera disponer en breve de los resultados.
Pacientes levemente sintomáticosEn los últimos dos años, se han publicado varios estudios clave en los que se ha incluido a pacientes con menos síntomas. El primero de ellos, el ensayo REVERSE38, incluyó a 610 pacientes en clase I o II de la NYHA, con QRS ≥ 120 ms y FEVI ≤ 40%. En todos los pacientes se utilizó un dispositivo de TRC (con o sin desfibrilador) y se los asignó aleatoriamente al grupo de TRC activa o al de control. El análisis principal se llevó a cabo después de 12 meses de seguimiento; la población de Europa (n=262) permaneció en el ensayo y se la analizó de nuevo a los 24 meses. El REVERSE utilizó un objetivo combinado y evaluó a los pacientes según presentaran empeoramiento, ausencia de cambios o mejoría. Dado que resulta difícil demostrar una mejoría clínica en pacientes de clase I de la NYHA, el criterio para definir el éxito del tratamiento se estableció a priori basándolo en el porcentaje de pacientes con empeoramiento únicamente. Este objetivo primario no se alcanzó a los 12 meses, a pesar de la diferencia significativa, favorable a la TRC, en la distribución de los pacientes que empeoraron, se mantuvieron sin cambios o mejoraron. La TRC redujo también el riesgo de muerte o de hospitalizaciones por IC a los 12 y a los 24 meses, con una disminución del 53% (p=0,03) a los 12 meses y del 62% (p=0,0003) a los 24 meses. Tanto la función como el remodelado del VI mejoraron significativamente con la TRC. Aunque hubo una tendencia no significativa a menos mortalidad por cualquier causa con el tratamiento activo, el ensayo no disponía de la potencia estadística suficiente para mostrar diferencias en la mortalidad por cualquier causa en esta población, en la que las tasas de mortalidad fueron bajas.
El ensayo MADIT-CRT39, de mayor tamaño (n=1.820), presentó unos resultados muy similares. Los pacientes incluidos tenían una IC de clase I o II de la NYHA, FEVI ≤ 30% y QRS ≥ 130 ms. Se asignó aleatoriamente a los pacientes, en una proporción 3:2, al tratamiento con TRC y desfibrilador o al desfibrilador solo. Aunque no se utilizó un diseño ciego para los médicos respecto a la asignación del tratamiento, sí se cegó a los miembros del comité de evaluación. Durante un seguimiento medio de 2,4 años, la TRC redujo el riesgo del objetivo primario compuesto por muerte por cualquier causa y los episodios de IC no mortales en un 34% (p=0,001), aunque no hubo una reducción de la muerte por cualquier causa considerada sola. Al igual que en el REVERSE, la TRC mejoró significativamente la función del VI a los 12 meses. Aunque la mortalidad no se redujo significativamente en ninguno de los dos estudios, la consistencia de los demás resultados clínicamente relevantes y de las mejoras de la función del VI va en favor del efecto beneficioso de la TRC en los pacientes en clase II de la NYHA. Un subanálisis del ensayo MADIT-CRT puso de manifiesto que el efecto beneficioso de la TRC se debía a la evolución de los pacientes con un intervalo QRS>150 ms y BRIH40.
Se obtuvo cierta evidencia de un posible efecto beneficioso en la mortalidad por cualquier causa o la hospitalización por IC en estos pacientes con mejor estado de salud (un 21,5% de la población en estudio se encontraba en clase I o II) en un análisis post-hoc del estudio CARE-HF, en el que se observó que los resultados obtenidos en estos pacientes eran similares a los de la población total del ensayo41.
La evidencia definitiva la aportó el estudio RAFT42, un ensayo multicéntrico, doble ciego y aleatorizado, en el que participaron 1.798 pacientes asignados a desfibrilador automático implantable (DAI) o DAI con TRC. Los criterios de inclusión fueron: clase II (80%) o III de la NYHA, FEVI ≤ 30% y QRS ≥ 120 ms o marcapasos con QRS ≥ 200ms. El objetivo primario fue la muerte por cualquier causa o la IC que motivaba una hospitalización. Se produjo una reducción del riesgo relativo de muerte por todas las causas del 25% en los pacientes tratados con TRC-D, en comparación con los tratados con DAI solamente. El riesgo de muerte cardiovascular y de hospitalización por IC se redujo también de forma significativa. De manera similar a lo observado en el MADIT-CRT, el efecto beneficioso fue superior en los pacientes con QRS ≥ 150ms.
Estos resultados llevaron a la actualización más reciente de las guías europeas de 201043 sobre el tratamiento mediante dispositivos en la IC, en las que se establece la indicación de la TRC en los pacientes con IC de clase II de la NYHA, FEVI ≤ 35%, ritmo sinusal y amplitud del QRS ≥ 150 ms (recomendación de clase I, nivel de evidencia A) (Figura).
Figura. Ampliación de las recomendaciones para el uso de la terapia de resincronización cardiaca en relación con los principales ensayos clínicos. FA: fibrilación auricular; FEVI: fracción de eyección ventricular izquierda; NAV: nódulo auriculoventricular. *Es necesario ≥ 95% de marcapasos biventricular si no se realiza una ablación el nódulo auriculoventricular.
Pacientes con QRS estrechoHay una notable heterogeneidad en la definición del QRS amplio respecto al estrecho. En realidad, algunos autores consideran «estrecha» la duración del QRS<150 ms, mientras que otros establecen un valor de corte del QRS de 130 ms para establecer una dicotomía estrecho/ancho, y unos pocos fijan la duración del QRS estrecho en<120 ms (lo cual indica claramente una duración normal del QRS). Así pues, es importante reconocer estas diferencias para poder realizar comparaciones adecuadas de los diversos estudios.
En varios pequeños estudios unicéntricos se ha abordado la eficacia de la TRC en pacientes con IC que presentan un complejo QRS estrecho (< 120 ms) en comparación con los que tienen un complejo QRS ancho. En un estudio inicial publicado en 200344, se comparó a 38 pacientes con un complejo QRS ancho con 14 pacientes con un complejo QRS estrecho. Todos ellos presentaban signos ecocardiográficos de retraso interventricular>20 ms y disincronía interventricular (retraso en la activación de la pared del VI posterolateral>intervalo entre inicio del QRS e inicio del llenado transmitral). Después de 6 meses de TRC, se observaron grados similares de mejora de la clase funcional de la NYHA, distancia recorrida en 6 min, FEVI, diámetro telesistólico del VI, diámetro telediastólico del VI e insuficiencia mitral en ambos grupos. En otro estudio45 de 102 pacientes con IC de clase funcional III o IV de la NYHA, se utilizó la desviación estándar del tiempo hasta alcanzar la velocidad sistólica máxima en las imágenes de Doppler tisular en 12 segmentos del VI (> 32,6 ms) para definir a los pacientes con una disincronía mecánica del VI en un grupo de 51 pacientes con QRS estrecho. Se observó una reducción del volumen telesistólico del VI en el grupo de pacientes con QRS estrecho o ancho a los 3 meses de la implantación de la TRC; se detectaron también mejoras de la clase funcional de la NYHA, la capacidad de ejercicio máxima, la distancia recorrida en 6 min, la FEVI y la insuficiencia mitral. En cambio, suspender la TRC durante 4 semanas produjo una pérdida de los efectos beneficiosos ecocardiográficos. En ambos grupos, el remodelado inverso del VI estaba determinado en una medida similar por el grado de disincronía mecánica basal. En un estudio similar46 se comparó de manera prospectiva a 33 pacientes consecutivos con un complejo QRS estrecho y 33 pacientes consecutivos con un complejo QRS ancho. Los criterios de inclusión fueron la clase funcional III o IV de la NYHA, FEVI ≤ 35% y signos de disincronía del VI en las imágenes de Doppler tisular (retraso máximo entre las velocidades sistólicas máximas en las cuatro paredes del VI ≥ 65 ms). No se observó una relación significativa entre la duración basal del QRS y la disincronía del VI, y las mejoras de los síntomas clínicos (clase funcional de la NYHA, distancia recorrida en 6 min, calidad de vida) o del remodelado inverso del VI (reducción del volumen telesistólico del VI, aumento de la FEVI) eran similares en ambos grupos después de 6 meses de TRC. Un metaanálisis de los tres estudios antes mencionados47 confirmó la obtención de una mejora con la TRC de los valores medios de FEVI y de la clase funcional de la NYHA en los pacientes con IC y complejos QRS estrechos. Estos pequeños estudios piloto pusieron de manifiesto que, en pacientes seleccionados en función de criterios de disincronía basados en la ecocardiografía, podía obtenerse un efecto beneficioso con la TRC, de manera independiente de la duración del QRS.
Conviene mencionar el estudio longitudinal observacional de Gasparini et al48, que confirma la observación de una mejora de la capacidad funcional y la función del VI en pacientes con QRS estrecho (≥ 120 ms) a los que, sin embargo, no se había preseleccionado según criterio ecocardiográfico de disincronía alguno.
Aunque los resultados fueron uniformes en todos estos estudios pequeños, todos tenían las limitaciones de no utilizar objetivos de valoración «duros», un tamaño muestral reducido y un seguimiento corto. El entusiasmo inicial por un posible efecto beneficioso de la TRC en pacientes con QRS estrecho se vio atenuado por el resultado de los ensayos multicéntricos realizados posteriormente.
Se han completado dos estudios de diseño prospectivo, aunque moderadamente grandes, en pacientes con IC avanzada y un complejo QRS normal: el ensayo ReThinQ49 y el ensayo ESTEEM-CRT50. En ninguno de los dos estudios se alcanzó el objetivo primario y ambos resultaron negativos. En el RethinQ se incluyó a 172 pacientes con IC de clase III de la NYHA, FEVI ≤ 35%, intervalo QRS<130 ms y evidencia de una asincronía mecánica según las mediciones ecográficas. En todos los pacientes se utilizó un desfibrilador y todos recibían un tratamiento médico optimizado. En un pequeño subgrupo preespecificado con intervalos QRS de 120-130 ms, se observaron mejoras significativas del VO2máx con la TRC. A pesar de las diversas limitaciones del estudio RethinQ, el ensayo multicéntrico ESTEEM-CRT confirmó sus resultados. En el ESTEEM-CRT se evaluaron los efectos de la TRC en pacientes con IC, QRS estrecho y signos de disincronía mecánica. Los criterios de inclusión fueron FEVI ≤ 35%, QRS ≤ 120 ms, clase funcional III de la NYHA y disincronía mecánica (definida como la desviación estándar del tiempo hasta la velocidad máxima de 12 segmentos>28,7 ms). Después de 6 meses de TRC, no se observaron mejoras del VO2máx, la FEVI ni el volumen telesistólico del VI. En cambio, las medidas subjetivas, como la puntuación de calidad de vida y la clase funcional de la NYHA, mejoraron de forma significativa, lo cual indica un posible efecto favorable de la TRC en la función diastólica, a la que se considera el más importante factor determinante de los síntomas de la IC51. Las limitaciones principales del estudio ESTEEM-CRT son su carácter no aleatorizado, con un solo grupo y sin diseño ciego; por consiguiente, las medidas subjetivas, como la mejora de la clase funcional, son muy susceptibles a la acción del efecto placebo. Además, las mismas preocupaciones generales que generaba el estudio RethinQ se pueden aplicar aquí. Por un lado, puede que los criterios de las técnicas de imagen de Doppler tisular utilizados no hayan definido a los pacientes apropiados para el uso de la TRC. Sin embargo, es más importante señalar que el diseño de un solo grupo, el bajo número de pacientes y el periodo de seguimiento breve limitan la validez del estudio para evaluar los efectos a largo plazo de la TRC en el remodelado del VI y, en última instancia, la morbilidad y la mortalidad. Además, a diferencia de lo que ocurre en los estudios unicéntricos, las variaciones interobservadores en cuanto a la evaluación de la disincronía pueden ser considerablemente más altas entre los distintos centros participantes en los ensayos multicéntricos, lo que puede haber impedido una selección uniforme de los pacientes apropiados. Teniendo en cuenta los resultados de los ensayos actuales, la TRC no debe usarse en pacientes con una duración normal del QRS. Un ensayo actualmente en marcha, el EchoCRT52, con más de 1.000 pacientes con intervalo QRS < 130 ms y disincronía mecánica, está evaluando el efecto de la TRC en la variable de valoración primaria combinada de muerte por todas las causas y hospitalizaciones por IC. Se prevé disponer de los resultados de este ensayo en 2013-2014.
«Ablación y marcapasos» para los pacientes en fibrilación auricular permanenteEl pasado año se publicaron los resultados del ensayo Ablate and Pace for Atrial Fibrillation53. Se incluyó en el estudio a pacientes en los que estaba indicada la ablación del nódulo AV a causa de una FA permanente sintomática grave. El objetivo primario fue la combinación de muerte por IC, hospitalizaciones debidas a IC y agravamiento de la IC. Se asignó a los 186 pacientes aleatoriamente al tratamiento con marcapasos BiV (97 pacientes) o con marcapasos VD solamente (89 pacientes). En todos los participantes se utilizó un dispositivo de TRC y se llevó a cabo una ablación del nódulo AV, con lo que se descartó la influencia de la taquiarritmia en los síntomas de los pacientes de ambos grupos. La media de FEVI fue de 0,38±0,14 en el grupo de TRC y de 0,37±0,14 en el grupo de marcapasos VD. La mediana de seguimiento fue de 20 meses. Aunque el objetivo primario se alcanzó en el grupo BiV con una incidencia significativamente inferior de muertes, hospitalizaciones y empeoramiento de la IC (el 11% de incidencia en comparación con un 26% en el grupo con marcapasos VD solamente), no hubo diferencias significativas de la mortalidad total entre los dos grupos.
Este es el primer ensayo en que se compara la TRC con el marcapasos VD en pacientes con una indicación de «ablación y marcapasos» por FA. A pesar de los resultados no significativos en cuanto a la mortalidad, los resultados clínicos positivos obtenidos pueden estimular la realización de nuevos estudios en esa dirección.
Pacientes con miocardiopatía obstructiva hipertróficaMuy recientemente, Berruezo et al54 han observado los efectos del marcapasos VI en 9 pacientes con miocardiopatía obstructiva hipertrófica y un gradiente de presión del VI significativo (≥ 50 mmHg). La mejor configuración del ajuste fue la BiV en 6 pacientes que no sólo presentaron mejoras significativas de los parámetros clínicos (clase funcional, prueba de la distancia recorrida en 6 min, calidad de vida), sino que también mostraron una disminución progresiva del gradiente de presión del VI, que pasó de 74±23 mmHg en la situación basal a 28±17 mmHg después de 1 año y una reducción significativa de la masa del VI. Aunque la población en estudio era demasiado pequeña y se necesitarán ensayos controlados y aleatorizados más amplios, estos resultados prometedores indican que se podría considerar el uso de marcapasos BiV cuando el tratamiento quirúrgico o de ablación está contraindicado o el paciente lo rechaza.
Contraindicaciones de la terapia de resincronización cardiacaHasta la fecha, no se ha establecido ninguna contraindicación formal para la TRC. Sin embargo, hay que tener gran precaución en determinados contextos clínicos. Hay evidencia creciente que indica escaso beneficio con el uso de TRC en los pacientes en descompensación aguda o con dependencia de catecolaminas. En cambio, los pacientes ambulatorios en clase IV de la NYHA son formalmente elegibles para la TRC; sin embargo, el estudio COMPANION ha demostrado un beneficio limitado en cuanto a la tasa de hospitalización, pero no en cuanto a la supervivencia.
La presencia de una cicatrización extensa de la pared lateral puede considerarse una contraindicación relativa. Aunque no se ha realizado ningún estudio formal que abordara prospectivamente esta situación específica, varios estudios retrospectivos pequeños han indicado ausencia de beneficios significativos en los pacientes con cicatrices grandes en la pared libre del VI.
Por último, no se considera contraindicación la presencia de un bloqueo de rama derecha del haz (BRDH), pero será preciso demostrar el efecto beneficioso de la TRC, ya que los pacientes con disfunción del VI y BRDH han estado infrarrepresentados en todos los ensayos clínicos. Algunos estudios han indicado la presencia de una disincronía mecánica del VI en los pacientes con un BRDH en los que puede ser beneficioso el uso de TRC55, pero es necesario investigar más al respecto.
¿Cuál puede ser el futuro?La idea de que la pared lateral es el lugar idóneo para la colocación del electrodo del VI ha sido puesta en duda por algunos grupos. Recientemente, Derval et al56 han demostrado, en una población sin isquemia, que el marcapasos en la mejor localización del VI (endocárdica o epicárdica a través del seno coronario y determinada mediante el mejor gasto del VI medido de forma invasiva) se asoció de forma aguda al doble de mejora de la contractilidad del VI. Es de destacar que no fue posible correlacionar ninguna región ventricular con la mejor localización de marcapasos. En consecuencia, la mejor localización del marcapasos para la aplicación de la TRC parece ser específica para cada paciente. El enfoque individualizado del uso del marcapasos en la mejor localización posible resultó superior a otras estrategias de uso de marcapasos (marcapasos a partir de una localización en el interior del seno coronario, en la pared lateral o en la región de la pared con mayor retraso identificada mediante mediciones del strain miocárdico).
Sin embargo, para poder diseñar un enfoque específico para cada paciente en cuanto a la colocación del electrodo del VI, será necesario un cierto desarrollo técnico. Puede conseguirse una aplicación más dirigida del marcapasos con el empleo de un electrodo de VI endocárdico. Con ello se evita la elección limitada de la colocación, la estimulación del nervio frénico que se da con frecuencia al utilizar electrodos epicárdicos y, finalmente, el uso de múltiples lugares de aplicación del marcapasos VI. Estudios preclínicos recientes en los que se han simulado diferentes contextos clínicos han aportado la primera evidencia de que el marcapasos de VI endocárdico es superior al epicárdico57. De hecho, en el modelo más habitual del BRIH en el perro, los marcapasos BiV endocárdicos aumentaron a más del doble el grado de resincronización eléctrica y potenciaron el efecto favorable en la contractilidad y el trabajo de expulsión de sangre en un 90 y un 50%, respectivamente, en comparación con los marcapasos BiV epicárdicos más tradicionales. Incluso, en un modelo del perro con infarto de miocardio o en el que un marcapasos ventricular rápido crónico añadido al BRIH determinó una IC grave, el marcapasos endocárdico aumentó significativamente la contractilidad del VI en comparación con el marcapasos epicárdico. El mecanismo que explica la superioridad del marcapasos endocárdico respecto al epicárdico no se ha esclarecido por completo, aunque pueden plantearse algunas hipótesis. La localización endocárdica del marcapasos en el VI es más natural, sigue una activación intrínseca y produce una diseminación más homogénea de la activación que la que proporciona el marcapasos epicárdico. La dificultad del marcapasos endocárdico está en el acceso a la cavidad del VI. Hasta el momento, la mayor parte de los electrodos endocárdicos se han colocado mediante un abordaje transeptal, que accede a la cavidad del VI desde la aurícula derecha, pasando a través de la aurícula izquierda. Más recientemente, se ha propuesto el uso de marcapasos sin electrodos. Este enfoque tiene la posible ventaja de simplificar los procedimientos de implantación, mejorar el acceso a la TRC en pacientes con una anatomía del seno coronario poco favorable, y finalmente aumentar la capacidad de aplicación de marcapasos en niños. Recientemente se ha descrito el uso de una transferencia de energía por ultrasonidos o inducción58 a un electrodo receptor. Esta tecnología está siendo investigada actualmente en el estudio Wireless Endocardial CRT, un estudio controlado prospectivamente que se ha diseñado para evaluar la seguridad y viabilidad de esta nueva modalidad de marcapasos.
ConclusionesLa TRC ha supuesto una verdadera revolución en el tratamiento de la IC. Los objetivos modernos de la TRC son potenciar la respuesta a esta terapia en los pacientes que responden a ella y reducir el porcentaje de casos que no responden. A este respecto, un mejor conocimiento fisiopatológico de la disincronopatía mecánica, mediante la integración de los aspectos moleculares, eléctricos y mecánicos, puede ser útil para aplicar una terapia de resincronización «personalizada», adaptada a cada paciente.
Conflicto de interesesNinguno.
Recibido 19 Febrero 2012
Aceptado 24 Febrero 2012
Autor para correspondencia: Divisione di Cardiologia, Fondazione Cardiocentro Ticino, Via Tesserete 48, CH-6900, Lugano, Suiza. angelo.auricchio@cardiocentro.org