La muerte súbita probablemente sea el desafío más importante de la cardiología moderna. En este artículo, después de realizar una revisión histórica de la muerte súbita, se comentan la epidemiología y las enfermedades asociadas a ella y se hace énfasis en los aspectos fisiopatológicos, especialmente los factores desencadenantes que actuando sobre un miocardio vulnerable precipitan la arritmia final, que en general lleva a la fibrilación ventricular y en menor medida a bradiarritmia y muerte súbita. Se comentan especialmente la importancia de la isquemia aguda y la disfunción ventricular y el papel de la genética, no sólo en las cardiopatías de origen genético, sino también su posible efecto desencadenante en la cardiopatía isquémica aguda y crónica. Por último, se describe cuál es la mejor forma de identificar a los pacientes en riesgo, cómo prevenir la muerte súbita y qué conducta seguir ante un paciente resucitado de una parada cardiaca.
Palabras clave
Se considera muerte súbita (MS) la que ocurre de manera inesperada dentro de la primera hora desde el inicio de los síntomas o si se produce en ausencia de testigos cuando el fallecido ha sido visto en buenas condiciones menos de 24 h antes de hallarlo muerto. Algunos pacientes fallecen instantáneamente pero la mayoría tiene algunos pródromos.
Perspectiva históricaSe tienen datos de la existencia de la MS desde hace miles de años1. En el Antiguo Egipto, hace más de 4.000 años, ya se relacionaba la MS con la isquemia miocárdica. En el papiro de Ebers se afirma: «Si un paciente presenta dolor en el brazo y la parte izquierda del tórax, la muerte lo está amenazando». Más tarde, en China, hace unos 2.500 años, Chio relacionaba la MS con una arritmia cuando decía: «La intermitencia del pulso es un predictor de muerte próxima». También Hipócrates, por las mismas fechas, ponía de manifiesto que «el dolor intenso precordial que se irradia hacia la clavícula y la espalda es un signo de mal pronóstico». Dicho autor expuso por primera vez el concepto de factores de riesgo. Dijo: «Los individuos obesos son más propensos a morir súbitamente que los delgados». Estos conceptos sobre la MS perduraron hasta nuestros días. Sólo mencionaremos que a lo largo de todos estos siglos se publicaron diversos trabajos que ponen de manifiesto la sorpresa y el espanto que la MS produce2, 3, 4, 5. En el siglo xiv , el conde Gaston de Foix, que falleció súbitamente al volver de una cacería después de estar en contacto con agua helada, afirmó al mismo tiempo que sentía una opresión en el pecho: «Soy hombre muerto. Que Dios se apiade de mí»5 (Figura 1). En el siglo xviii se publicó el libro que por encargo del Papa Clemente XI escribió Lancisi6 sobre los frecuentes casos de MS que ocurrían en Roma. Los estudios clínicos y necrópsicos pusieron de manifiesto la relación de la MS con la presencia de dolor precordial y signos anatomopatológicos de enfermedad coronaria. A finales del siglo xviii , Heberden publicó por primera vez una descripción de la «angina de pecho». En el siglo xix , Von Bezold demostró que la oclusión experimental de las arterias coronarias producía una parada cardiaca. Por último, ya en el siglo xx , Herrick7 describió el cuadro clínico del infarto de miocardio (IM). A lo largo del siglo xx el interés por la MS fue aumentando, habiéndose reforzado, por una parte, la idea de su relación con la enfermedad coronaria8 y, por otra, la importancia que tiene el deterioro de la función ventricular (insuficiencia cardiaca [IC]) relacionada o no con la isquemia, en su presentación.
Figura 1. Muerte del conde Gaston de Foix 5 .
Por último, en la segunda mitad del siglo xx se puso de manifiesto que, a pesar de que la cardiopatía isquémica (CI) continuaba siendo causa de la MS en al menos el 80% de los casos9, hay un conjunto de enfermedades hereditarias con alteraciones estructurales (miocardiopatías) o sin aparente causa orgánica (canalopatías) que explican muchos de los casos de MS en la juventud relacionados o no con el esfuerzo, pero en individuos sin CI1.
EpidemiologíaLa MS probablemente sea el desafío más importante de la cardiología moderna, por el gran número de casos que existen (tan sólo en Estados Unidos, más de 300.000/año), aunque su incidencia parece haber disminuido recientemente y es más baja en algunos países mediterráneos como España10, 11, 12, 13, y por su importante impacto social.
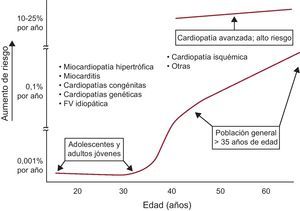
Aunque la MS puede verse incluso en lactantes, pues se la ha relacionado con trastornos de la repolarización, alteraciones del sistema nervioso autónomo e incremento del tono vagal, de hecho es una rareza en las primeras décadas de la vida y a esas edades suele aparecer durante la actividad deportiva14 y en presencia de cardiopatías de origen genético (miocardiopatía hipertrófica, displasia/miocardiopatía arritmogénica del ventrículo derecho [VD] y canalopatías). La incidencia de MS aumenta gradualmente con la edad, pero de manera significativa a partir de los 35-40 años, y es particularmente alta en la fase aguda del IM. También es frecuente en la fase crónica de esta enfermedad y en cualquier cardiopatía, especialmente en presencia de IC (Figura 2).
Figura 2. Relación entre incidencia de muerte súbita y edad. Obsérvese que la muerte súbita se asocia a diferentes enfermedades a lo largo de la vida. FV: fibrilación ventricular. Reproducido con permiso de Myerbrug et al 15 .
Enfermedades asociadasComo acabamos de exponer, la CI aguda se asocia frecuentemente con MS en el adulto. Sin embargo, en la mayoría de los casos de MS, fuera de la CI aguda y las cardiopatías hereditarias (miocardiopatías y canalopatías), se puede evidenciar la existencia de IC, o al menos disfunción ventricular. La IC puede estar asociada a miocardiopatía idiopática o darse en pacientes con CI crónica, hipertensión arterial, miocardiopatías de otra etiología, etc. Las cardiopatías de origen genético pueden originar MS a cualquier edad, pero su impacto total es pequeño, y además suelen tener especialmente una ventana de peligro que hace que se presente más desde la adolescencia hasta la cincuentena o la sesentena. Cabe destacar, sin embargo, que son origen de muchos de los casos de MS que ocurren antes de los 35 años (Figura 2). Las cardiopatías de origen genético se manifiestan más en varones, y la MS puede ocurrir más durante el ejercicio físico (miocardiopatías) o en reposo o durante el sueño (canalopatías).
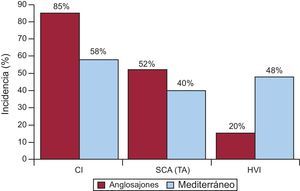
Nuestro grupo ha realizado un estudio, dentro de la red de grupos del Instituto de Salud Carlos III (estudio EULALIA), que incluyó 204 casos de MS ocurridos en el área del Mediterráneo (Cataluña y Andalucía)16. En este estudio se han analizado los aspectos epidemiológicos y anatomopatológicos de las enfermedades asociadas a la MS. La Tabla 1 muestra el diagnóstico anatomopatológico obtenido en este grupo de pacientes. Llama la atención, comparado con estudios anglosajones parecidos17, que la incidencia de casos de CI detectada en la autopsia es menor (un 80-90 frente a un 58%), y también es menor, dentro de estos casos, la incidencia de trombosis aguda, expresión anatomopatológica de infarto agudo de miocardio (IAM) (el 52 frente al 40%) (Figura 3). Todo ello concuerda con las evidencias ya conocidas10, 11, 12, 13, 17, 18 de que la incidencia de CI en los países mediterráneos es menor, probablemente en relación no sólo con la dieta, sino también con la forma de vivir en general y los aspectos ambientales (cultura mediterránea). Por otra parte, respecto a Estados Unidos, hemos visto un mayor número de casos de MS que presentan hipertrofia ventricular izquierda (HVI) (el 48 frente al 20%)16, 19 (Figura 3). Desde el punto de vista clínico y comparadas con el estudio de Maastricht20, las víctimas de MS del estudio EULALIA presentaban menos antecedentes de angina de pecho (el 20 frente al 37%), lo que concuerda con el menor número de casos de CI encontrados en la autopsia. En nuestra serie, la incidencia de posibles enfermedades de origen genético asociadas fue un 3% de los casos (miocardiopatías hipertrófica y arritmogénica del VD), y en alrededor del 7% no hubo hallazgos en la necropsia. Ello hace pensar que probablemente algunos de ellos presentaran una canalopatía.
Tabla 1. Enfermedades asociadas a la muerte súbita: estudio necrópsico
| n (%) | |
| Víctimas de MS | 204 |
| Enfermedades cardiovasculares | 183 |
| Cardiopatías | 161 |
| Enfermedad coronaria | 119 (58,4) |
| Cardiopatía hipertensiva | 20 (9,9) |
| Valvulopatías | 5 (2,4) |
| HVI idiopática | 4 (1,9) |
| Miocardiopatía dilatada | 4 (1,9) |
| Miocardiopatía hipertrófica | 3 (1,5) |
| Miocardiopatía arritmogénica del VD | 3 (1,5) |
| Miocarditis | 1 (0,5) |
| Cardiopatías congénitas | 1 (0,5) |
| Amiloidosis | 1 (0,5) |
| Enfermedad vascular | 22 |
| Embolia pulmonar | 8 (3,9) |
| Disección aórtica | 9 (4,4) |
| Hemorragia cerebral | 5 (2,4) |
| Enfermedades no cardiovasculares | 7 |
| Trastornos gastrointestinales | 3 (1,5) |
| Trastornos pulmonares | 4 (1,9) |
| Sin hallazgos | 14 (6,9) |
HVI: hipertrofia ventricular izquierda; MS: muerte súbita; VD: ventrículo derecho.
Reproducido con permiso de Subirana et al 16 .
Figura 3. Estudio comparativo de la incidencia de cardiopatía isquémica, síndrome coronario agudo con infarto: trombosis aguda e hipertrofia ventricular izquierda entre Estados Unidos y el área mediterránea. CI: cardiopatía isquémica; HVI: hipertrofia ventricular izquierda; SCA: síndrome coronario agudo; TA: trombosis aguda. Reproducido con permiso de Subirana et al 16 .
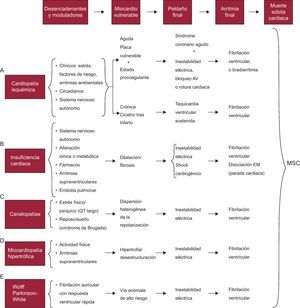
Fisiopatología de la muerte súbitaLa MS es el estadio final de una cadena de eventos que conducen a parada cardiaca, en general por fibrilación ventricular (FV), o menos a menudo por una bradiarritmia extrema21. En todos los casos, hay una serie de factores moduladores y/o desencadenantes que, actuando sobre el miocardio vulnerable, precipitan la MS. En la Figura 4 se puede observar cómo se produce esta cadena de eventos en distintas cardiopatías. En resumen, la FV suele desencadenarse en presencia de un miocardio vulnerable debido a la acción de distintos factores moduladores y/o desencadenantes, entre los que probablemente deba incluirse un entorno genético y ambiental adecuado, y/o el aumento de la actividad simpática en relación con estrés físico o psíquico que, aunque no tiene consecuencias en situaciones normales, puede ser el desencadenante de la MS en situaciones especiales (isquemia aguda), enfermedades hereditarias (miocardiopatías y canalopatías), etc.
Figura 4. Cadena de eventos que precipitan la muerte súbita cardiaca y parámetros que presentan las diversas enfermedades en los diferentes estadios que llevan a la muerte súbita cardiaca. AV: auriculoventricular; EM: electromecánica; MSC: muerte súbita cardiaca. Adaptado de Bayés-Genís et al 21 , con permiso de los autores.
Miocardio vulnerable y factores desencadenantesEn la Figura 4 constan las características del miocardio vulnerable en las cardiopatías que más a menudo presentan MS (CI, IC, cardiopatías de origen genético y también, aunque la MS es poco frecuente, en el síndrome de Wolff-Parkinson-White). Ahora se comenta con cierto detalle los tres factores que con más frecuencia son la causa de que un miocardio sea vulnerable: a) la isquemia; b) la disfunción del ventrículo izquierdo (VI), y c) la predisposición genética. Hemos de tener en cuenta que a menudo los dos primeros están interconectados y probablemente el tercero tiene también un papel protagonista, no sólo en las enfermedades hereditarias de origen genético, sino en las que tienen el papel más importante, al parecer, la isquemia o la disfunción del VI.
Cardiopatía isquémicaLa isquemia aguda y sus consecuencias tienen una gran importancia en la aparición de la MS, en especial debido a las características de la cicatriz y/o de la asociación con la disfunción del VI.
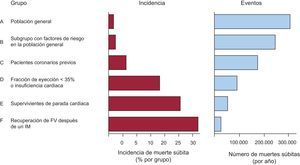
Isquemia aguda y muerte súbitaUn gran número de casos de MS ocurren como primera manifestación de un síndrome coronario agudo, y representan un gran porcentaje de la carga total de MS (Figura 5). En los pacientes con IAM, los marcadores de FV no están claramente determinados. Vamos a comentar distintos estudios destinados a determinar por qué algunos pacientes con isquemia aguda (en especial aquellos con síndrome coronario agudo con elevación del ST) sufren una MS, mientras que otros no. Naturalmente el grado de la isquemia aguda desempeña un papel muy importante.
Figura 5. Izquierda: el porcentaje de pacientes que sufren muerte súbita es mucho más alto en los grupos de alto riesgo (D-F) que en la población general (A, B). Sin embargo, el total de casos que se presentan en la población general (A y B) es mayor que el de todos los otros grupos (C-F) de pacientes en riesgo, lo que indica que un gran número de casos de muerte súbita procede de los grupos con menor riesgo (A y B). FV: fibrilación ventricular; IM: infarto de miocardio.
En presencia de isquemia aguda, la valoración de su gravedad se puede conocer en gran parte por el electrocardiograma (ECG)22, 23, 24, 25. Los síndromes coronarios agudos con elevación del ST con isquemia de grado 322 presentan un segmento ST elevado que se lleva hacia arriba la onda S. Los síndromes coronarios agudos sin elevación del ST con una isquemia importante presentan signos de afección circunferencial en más de un territorio (≥ 7 derivaciones con descenso del ST y ascenso del ST en VR). Ello se ve cuando existe una suboclusión importante del tronco común o están afectados tres vasos proximales (al menos la descendente anterior y la circunfleja o la coronaria derecha)24.
Es importante el grado de isquemia, pero también lo es su duración. Hemos comprobado26, en un estudio realizado con 21 pacientes que presentaron 120 crisis de espasmo coronario, que había una relación directa entre la elevación del ST y la aparición de extrasístoles ventriculares, pero debido a la brevedad del espasmo, a pesar de que los ascensos del ST podían llegar a ser del tipo del potencial de acción transmembrana monofásico, ningún caso presentó taquicardia ventricular (TV) sostenida ni FV.
Los síndromes coronarios agudos sin elevación del ST tienen una incidencia de MS menor que los síndromes coronarios agudos con elevación del ST. Los síndromes coronarios agudos sin elevación del ST con mortalidad más baja son los que presentan un score de riesgo bajo que incluye, entre otros factores, la presencia de ritmo sinusal no taquicárdico y la falta de arritmias ventriculares27.
En la CI aguda y crónica, la interacción de la isquemia con las arritmias en presencia de alteraciones del sistema nervioso autónomo, disfunción del ventrículo izquierdo (VI) y las influencias geneticoambientales28 son importantes para que se produzcan FV y MS (Figura 4A). Más adelante se habla con más detalle de la influencia de la genética en la aparición de CI y MS.
Los síndromes coronarios agudos a menudo evolucionan a IM. Con los tratamientos actuales, el número de casos con las complicaciones graves del infarto a largo plazo como IC y fracción de eyección (FE) deprimida es mucho más bajo. No obstante, la CI sigue muy a menudo asociada a MS cardiaca, aunque no se sabe bien si la MS se presenta en presencia de CI porque existe una serie de factores que potencian esta asociación o si una crisis de isquemia aguda es la causa directa de la MS. Este probablemente sea el reto más importante de la cardiología moderna.
En Estados Unidos, la CI se asocia a un 80-90% de los casos de MS, pero esta asociación en el área mediterránea es menor16. Sin embargo, globalmente, en menos de un 50% de los casos de MS, tal como muestra la Figura 6, existen datos clínicos (presencia de angina)20, 29, electrocardiográficos (cambios del ST en el registro Holter)30 o angiográficos (trombosis aguda)31 de que la isquemia aguda sea el factor directo causal de la MS. Es más, también en alrededor de un 50% de los casos de MS existen evidencias anatomopatológicas de infarto agudo (trombo fresco)16, 17. Estas conclusiones son importantes porque ponen de manifiesto que, aproximadamente, sólo un 50% de los casos de MS se deben a un ataque isquémico agudo. Probablemente, en la mayoría de los demás casos de MS en pacientes con CI, la causa de la muerte sea una TV sostenida debida a una reentrada alrededor de una cicatriz antigua de infarto que desencadena la TV/FV.
Figura 6. Importancia de la isquemia aguda como desencadenante de muerte súbita: pruebas clínicas, electrocardiográficas, angiográficas y anatomopatológicas. ECG: electrocardiograma; MSC: muerte súbita cardiaca.
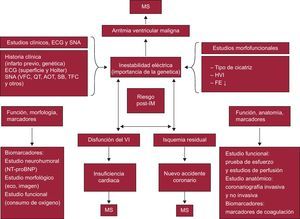
Muerte súbita de pacientes tras infartoEl riesgo de arritmias ventriculares graves y MS es especialmente alto en los primeros 6 meses después de un IAM. A pesar de que la estratificación de riesgo en los pacientes con CI crónica, en especial para la MS, evoluciona continuamente32, en los pacientes post-IM actualmente se relaciona especialmente con tres factores de riesgo principales: a) presencia de isquemia residual (peligro de nuevo accidente isquémico33; b) mala función ventricular (peligro de IC)34, y c) inestabilidad eléctrica (peligro de arritmias graves y MS)34, 35.
En la Figura 7 se resumen los parámetros que pueden ser marcadores de riesgo de estas posibles complicaciones, así como las técnicas más utilizadas para su estudio1, 24. Los parámetros más importantes que se debe considerar para la estratificación de riesgo, de acuerdo con el triángulo de riesgo de dicha figura, son los siguientes:
• Parámetros de inestabilidad eléctrica: a) estudios morfológicos y funcionales (tipo de cicatriz, presencia de HVI y FEVI deprimida, tamaño del infarto, etc.); b) aspectos clínicos: edad, antecedentes familiares, IM previo y datos del ECG de superficie, como la presencia de onda Q y la anchura del QRS, entre otros; c) registro Holter (presencia de extrasístoles ventriculares y frecuencia cardiaca [FC], etc.), y d) estudio de alteraciones del sistema nervioso autónomo, tales como la variabilidad de la FC (heart rate variability) y la sensibilidad barorrefleja, que ponen de manifiesto la disminución del tono y los reflejos vagales36, un descenso de la respuesta vagal37 y un aumento del tono simpático. Otros parámetros estudiados incluyen la alternancia eléctrica de la T38, 39 y la turbulencia de la FC40, entre otros.
• Parámetros para estudiar la función del VI. Se obtienen de: a) estudio de la función del VI con técnicas de imagen como, por ejemplo, la ecocardiografía; b) estudio de la capacidad funcional mediante prueba de esfuerzo (consumo de oxígeno), y c) una analítica sanguínea con marcadores neurohumorales como la fracción aminoterminal del propéptido natriurético tipo B (NT-proBNP).
• Parámetros de isquemia residual. Incluyen los estudios anatómicos (coronariografía invasiva y no invasiva) y funcionales (ECG de esfuerzo y estudios de perfusión mediante técnicas de imagen), así como de los biomarcadores de coagulación. Incluso la presencia de isquemia silente es un marcador de MS a largo plazo (riesgo a 5 años)41.
Figura 7. Estratificación de riesgo en pacientes tras un infarto, de acuerdo con la presencia y la interacción de: a) inestabilidad eléctrica; b) disfunción del ventrículo izquierdo, y c) isquemia residual. Véase en cada uno de ellos los distintos factores que pueden precipitar la aparición de complicaciones y muerte súbita, y los tests que se utilizan para detectarlos. AOT: alternancias de la onda T; ECG: electrocardiograma; FE: fracción de eyección; HVI: hipertrofia ventricular izquierda; IM: infarto de miocardio; MS: muerte súbita; NT-proBNP: fracción aminoterminal del propéptido natriurético tipo B; SB: sensibilidad barorrefleja; SNA: sistema nervioso autónomo; TFC: turbulencia de la frecuencia cardiaca; VFC: variabilidad de la frecuencia cardiaca; VI: ventrículo izquierdo.
No obstante, llama la atención que, incluso en presencia de los mismos factores desencadenantes clásicos antes citados —como por ejemplo número de complejos ventriculares prematuros (CVP), igualdad de tamaño del infarto y otras características clínicas—, unos pacientes presenten crisis, a veces frecuentes, de TV sostenida y otros no. Sin duda, aspectos de tipo ambiental y genético y alteraciones a veces sutiles del sistema nervioso autónomo pueden influir, aunque la medición de estos parámetros tiene un valor predictivo positivo bajo. En cambio, recientemente se ha podido demostrar que existen diferencias en el sustrato de la cicatriz desde el punto de vista electrofisiológico y anatómico que pueden explicar la tendencia a sufrir TV. Efectivamente, se ha comprobado42 que, a igualdad de CVP ambientales y de similares características clínicas, presentaban más TV sostenidas los infartos que tenían una cicatriz más parcheada, con más fibrosis y con más electrogramas fraccionados. En este trabajo se demuestra que el sustrato anatómico (características de la cicatriz) es más importante que la presencia de CVP ambientales (factor desencadenante y modulador) como inductor de TV sostenida. Este estudio pone de manifiesto la necesidad de marcadores no invasivos para identificar la presencia de este sustrato. Algunos de ellos, como la presencia de QRS fraccionado y bloqueos intraventriculares, ya se han mencionado. Todo ello indica que la ablación extensa, incluyendo las áreas con puentes de tejido miocárdico entre las zonas cicatrizales, probablemente sea el enfoque más válido y eficaz en caso de TV repetitivas.
También es llamativo37 que, en pacientes con infarto antiguo sin isquemia residual, la presencia de arritmias ventriculares significativas fuera mucho mayor en los infartos inferiores que en los infartos anteriores. Esta mayor incidencia de arritmias ventriculares en los IM inferiores es incluso más inesperada si se tiene en cuenta que la FEVI era significativamente mayor en los IM inferiores que en los IM anteriores. Una posible explicación puede ser que en la pared inferior hay gran densidad de receptores con actividad vagal que son cardioprotectores. Por lo tanto, después de un infarto de esta zona, el efecto protector de la respuesta vagal es menor, y esto explica que el riesgo de arritmias ventriculares sea mayor.
Disfunción ventricular e insuficiencia cardiacaExcepto los casos de MS en pacientes con cardiopatías genéticas, y los relacionados con un IAM, especialmente con elevación del ST, la mayoría de los pacientes que mueren súbitamente, sea cual sea su etiología, presentan un deterioro en la función ventricular con, a menudo, IC en general con FE deprimida (IC sistólica).
En la Figura 4B se puede ver la cadena de eventos que desencadenan la arritmia ventricular (TV/FV) que causa la MS en pacientes con IC (clase III-III de la New York Heart Association)21. La identificación y el control de todos estos factores, si se presentan, es vital para reducir el número de casos de MS.
Aproximadamente, el 40% de las muertes cardiovasculares que aparecen en pacientes con IC son súbitas. El resto se explica por progresión de la IC. Un 20-30% de los pacientes con IC de grado II-III de la New York Heart Association fallecen en 3 años de seguimiento, y aproximadamente la mitad de los casos se deben a MS (corazones todavía en estado demasiado bueno para morir). Los casos de MS en pacientes en clase funcional II y III se deben especialmente a una arritmia ventricular (TV/FV) como arritmia final, pero en los pacientes en clase funcional IV la MS se explica más por bradiarritmias. Esto puede explicar la ineficacia de los fármacos antiarrítmicos para evitar la MS en los pacientes con IC y clase funcional IV de la New York Heart Association.
A pesar de que existen resultados contradictorios, la mayoría de los estudios actuales demuestran que la MS se observa más frecuentemente en casos de IC sistólica, especialmente en pacientes con miocardiopatía dilatada (MD) isquémica, que en los casos de IC diastólica.
Por otra parte, hay muchas evidencias que ponen de manifiesto el papel como marcadores de riesgo de MS de distintas alteraciones del sistema nervioso autónomo (variabilidad de la FC, turbulencia de la FC, taquicardia sinusal)43, aunque su valor predictivo positivo es bajo. También existen evidencias de que la microalternancia de voltaje de la onda T puede ser útil como marcador de riesgo de MS38, 39.
El incremento de la inervación simpática, que puede detectarse por medio de imágenes Im-IBG, se correlaciona con una mejora del pronóstico de la IC y una disminución de las arritmias ventriculares.
Recientemente, hemos publicado (red de grupos del Instituto Carlos III) una escala de riesgo de muerte en pacientes con IC (estudio MUSIC)44. Dicho estudio se diseñó para analizar las variables clínicas, electrocardiográficas (del ECG de 12 derivaciones y del registro Holter), ecocardiográficas y bioquímicas implicadas en la aparición de MS en pacientes con IC. Se trata de un estudio prospectivo de 992 pacientes con IC sistólica (75%) o diastólica (25%). El 78% de los pacientes se encontraban en clase funcional II de la New York Heart Association en el momento de la inclusión. Se siguió a los pacientes durante 44 meses, y se analizó el motivo de muerte por todas las causas, muerte cardiovascular, muerte por fallo de bomba y MS. Entre todas las variables analizadas, se encontraron 10 con significado pronóstico independiente (distinto valor numérico para cada variable). Cabe destacar que únicamente la dilatación auricular y las concentraciones de NT-proBNP formaron parte del score para todos los tipos de muerte. La combinación de estas variables permitió establecer una puntuación (score) de riesgo, como se muestra en la Figura 8. Se puede ver en ella la curva de mortalidad según el tipo de muerte estudiada. Con este score de riesgo, se identifican dos poblaciones bien definidas, la que tiene una puntuación < 20, que consideramos de bajo riesgo, y la de alto riesgo, con puntuación > 20. Recientemente, se ha identificado un nuevo marcador sérico de MS, el ST245, que permitirá mejorar aún más la estratificación de riesgo de MS. Sin embargo, son necesarios más estudios en este campo para la validación de estos resultados. El impacto económico que representaría disminuir la implantación de un desfibrilador automático implantable (DAI) aconseja realizar más estudios de este tipo en el futuro.
Figura 8. A: puntuación de riesgo para predecir diferentes tipos de muerte. Se observan los parámetros utilizados para determinar la puntuación. B: curvas de mortalidad para diferentes tipos de muerte durante un periodo de 3 años. Reproducido con permiso de Vázquez et al 43 . AI: aurícula izquierda; BRI: bloqueo de rama izquierda; CVP: complejos ventriculares prematuros; EVA: enfermedad vascular arterial; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; FGe: filtrado glomerular; MS: muerte súbita; TCIV: trastorno de conducción intraventricular; TVNS: taquicardia ventricular no sostenida.
GenéticaYa hemos comentado la posible interacción genética en el desarrollo de la CI aguda y crónica y la MS. Creemos que una de las claves de la investigación de la MS en el futuro está en estudiar la influencia que tiene la genética en la MS de los pacientes con isquemia y/o IC.
Recientemente se ha descrito el posible papel de factores genéticos en el desarrollo de FV durante los síndromes coronarios agudos con elevación del ST46. Se ha postulado la asociación entre la densidad de la corriente iónica Ito, responsable del síndrome de Brugada y otros síndromes de onda J47, y el riesgo de FV durante los síndromes coronarios agudos con elevación del ST. Ello podría explicar tanto la alta incidencia de FV entre los varones en el infarto inferior con compromiso ventricular derecho. La corriente Ito es mucho más prominente en varones, y más en el VD que en el VI. Creemos que estas interacciones genéticas probablemente sean cruciales para explicar la aparición de arritmias ventriculares fatales. De hecho, se ha propuesto que los mecanismos fundamentales de la elevación del ST y la iniciación de la FV probablemente sean similares en la fase inicial de los síndromes coronarios agudos con elevación del ST y en los síndromes de onda J genéticos. En ambos casos, una dispersión heterogénea de la repolarización y una reentrada fase 2 son el desencadenante y el sustrato reentrante que explica la aparición de TV/FV48.
También se han publicado tres grandes estudios que han identificado diferentes variantes genéticas asociadas con el riesgo de MS para los pacientes con CI. En el primer trabajo, realizado en Países Bajos49, se identificó un locus en el cromosoma 21, en el que el alelo raro del polimorfismo rs2824292 se asociaba con mayor riesgo de FV en pacientes con IAM (odds ratio = 1,49; intervalo de confianza del 95%, 1,14-1,95). El gen más cercano a este locus es CXADR, que codifica un receptor viral implicado previamente en miocarditis y MD y que modula la conducción del impulso eléctrico cardiaco. En los otros dos estudios, realizados en poblaciones de Estados Unidos50, 51, se ha identificado que el alelo raro del polimorfismo rs3864180 localizado en el gen GPC5 se asocia con menos riesgo de MS para los pacientes con CI (hazard ratio = 0,85; intervalo de confianza del 95%, 0,74-0,98). La presencia de este alelo también se asoció a una menor duración del intervalo QT. Por último, el alelo raro del polimorfismo rs4665058 se asocia con mayor riesgo de MS para los pacientes con CI crónica (odds ratio = 1,91).
Ahora vamos a referirnos a la MS que se presenta en las enfermedades inducidas genéticamente. Ello incluye52: las miocardiopatías debidas a alteraciones de las proteínas cardiacas, como la miocardiopatía hipertrófica, la displasia arritmogénica del VD, la miocardiopatía no compactada y ciertas formas de MD; la alteración del sistema específico de conducción (enfermedad de Lenegre), y las canalopatías (enfermedades sin afección estructural aparente o sólo mínima), debidas a alteraciones aisladas de los canales iónicos como los síndromes del QT largo y QT corto, el síndrome de Brugada y la TV catecolaminérgica, y también con gran probabilidad la fibrilación auricular familiar y otros casos de MS debidos a arritmias ventriculares malignas como la TV en torsión de puntas familiar y la FV considerada hasta ahora como idiopática, e incluso probablemente algunos casos de bradicardia sinusal de origen genético y quizá del síndrome de Wolff-Parkinson-White.
Algunas de las canalopatías mejor conocidas muestran un patrón fenotípico característico en el ECG, el cual con frecuencia nos lleva al diagnóstico correcto e incluso a la identificación del gen involucrado. Sin embargo, se ha publicado que algunas de las canalopatías propiamente dichas pueden presentar ciertos cambios ultraestructurales. Recientemente se han descrito alteraciones histológicas53, así como anomalías sutiles en la morfología del VD, detectadas mediante resonancia magnética cardiaca54 en familiares asintomáticos de pacientes con síndrome de Brugada que son portadores de mutaciones del gen SCN5A. También Papavassiliu et al55 han demostrado la existencia de ciertas anomalías ultraestructurales en el sídrome de Brugada. Esto confirma que la manifestación fenotípica del síndrome de Brugada y su fisiopatología son más complejas de lo que se creía en principio, y que las alteraciones iónicas aparentemente aisladas pueden acompañarse de cambios ultraestructurales detectados por resonancia magnética.
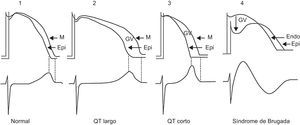
Las canalopatías tienen el peligro de desencadenar distintos tipos de TV/FV y MS. En los síndromes de QT largo, de QT corto y de Brugada, la aparición de TV/FV se explica por la existencia de una dispersión heterogéna de la repolarización más en unas zonas del miocardio que en otras, tanto si consideramos que la dispersión es transregional56 como si ocurre en el espesor de la pared del VI (dispersión transmural)57. Esta dispersión heterogénea de la repolarización facilita que un impulso prematuro pueda inducir seguramente, por un fenómeno de reentrada fase 2, una TV/FV (Figura 9). Se ha demostrado que la dispersión heterogénea de la repolarización ventricular explica que aumente la distancia Tpico-Tfinal, y que este parámetro es un marcador de mal pronóstico y de arritmias ventriculares.
Figura 9. Ejemplo de reentrada fase 2-3 en caso de que la reentrada se origine por dispersión heterogénea de la repolarización. Según Antzelevitch 57 , la dispersión sería a nivel transmural, y el potencial de acción transmembrana de las células M es el más prolongado comparado con el potencial de acción transmembrana del resto de la pared. Esta dispersión heterogénea de la repolarización explica que se origine un gradiente de voltaje entre la zona con potencial de acción transmembrana más largo y la zona que lo presenta más corto, el epicardio, y la posibilidad de que se inicie taquicardia ventricular/fibrilación ventricular en los pacientes con síndrome de QT largo, y síndrome del QT corto. En el síndrome de Brugada la dispersión heterogénea de la repolarización se produce entre el endocardio y el epicardio del ventrículo derecho en el inicio de la fase 2, creando un gradiente de voltaje debido al predominio transitorio de la corriente de salida Ito. Endo: endocardio; Epi: epicardio; GV: gradiente ventricular; M: capa de células M.
La miocardiopatía hipertrófica es en general una enfermedad familiar de origen genético, caracterizada por una alteración de las proteínas del miocardiocito, que origina una desestructuración (disarray) de la fibra miocárdica, hipertrofia cardiaca y un aumento de la incidencia de MS58.
La MD puede ser idiopática (un 30-40% de los casos) o debida a muchas etiologías (infecciones, tóxicos, fármacos, procesos autoinmunitarios, enfermedades neuromusculares, metabólicas, mitocondriales, etc.), pero las causas más frecuentes son la CI crónica y/o la hipertensión arterial. Sin embargo, en la nueva clasificación de miocardiopatías58 se ha excluido, a nuestro entender sin ningún argumento convincente, la afección miocárdica que es consecuencia directa de otras enfermedades cardiovasculares como la hipertensión, la CI, las valvulopatías y las cardiopatías congénitas.
Hay evidencia de que hasta el 35% de las MD idiopáticas tienen antecedentes familiares o comparten un entorno medioambiental59. Probablemente, en un futuro próximo se demostrará que todavía hay más casos genéticamente inducidos. Se han identificado más de 20 mutaciones en distintos genes, entre ellos el gen lámina A/C, que está presente en el 30% de los casos de MD y se relaciona con alta incidencia de MS. Además, se han publicado las relaciones genéticas entre MD y distrofias musculares tipo enfermedad de Duchene, de Emery-Dreifus y de Becker, que pueden producir alteraciones cardiacas que llevan a MD e IC60.
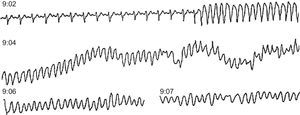
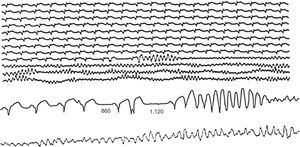
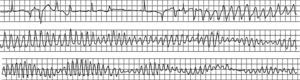
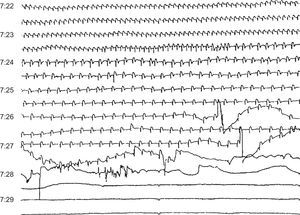
Arritmias finalesLas arritmias finales que precipitan la MS no son siempre las mismas (Figura 10, Figura 11, Figura 12, Figura 13) ni son siempre agudas en las diferentes situaciones clínicas. En un estudio que realizamos revisando las cintas de 157 pacientes ambulatorios que fallecieron de MS llevando un registro Holter30 (Figura 14B y Tabla 2), encontramos que en casi dos tercios de los casos la MS se debió a una TV sostenida que precipitó una FV, en general, en presencia de una FC basal rápida (taquicardia sinusal o fibrilación auricular rápida), lo que pone de manifiesto un aumento de la actividad simpática (Figura 10). En cambio, la FV sin TV desencadenante, que se asocia a menudo a la CI aguda, se presenta muchas veces como consecuencia de un CVP con fenómeno R-sobre-T (Figura 11). En nuestra experiencia, en pacientes ambulatorios este patrón se observó en menos del 10% de los casos. Curiosamente, en un 13% de los casos, la MS se debió a una TV en torsión de puntas que precipitó la FV, en general en pacientes sin cardiopatía grave pero que tomaban fármacos antiarrítmicos de clase I por arritmias ventriculares poco frecuentes, a menudo CVP aislados (efecto proarrítmico) (Figura 12). Creemos que, si el estudio se repitiera hoy, el número de estos casos sería mucho menor porque hay evidencia, desde el estudio CAST63, de que los fármacos antiarrítmicos tipo I son peligrosos, especialmente para los cardiópatas. Por lo tanto, actualmente la prescripción de fármacos antiarrítmicos de clase I en pacientes tras un IAM es mucho menor. Por último, cuando la bradiarritmia extrema era la causa de MS (un 15% en nuestro estudio) (Figura 13), se debe más a una depresión progresiva del automatismo sinusal y de la unión auriculoventricular que a bloqueo auriculoventricular.
Figura 10. Muerte súbita ambulatoria por fibrilación ventricular de un paciente coronario tratado con amiodarona por frecuentes contracciones ventriculares prematuras. A las 9:02 le sobrevino una taquicardia ventricular monomórfica sostenida, seguida de una fibrilación ventricular a las 9:04 tras un aumento del ritmo de la taquicardia ventricular y de la anchura del complejo QRS.
Figura 11. Muerte súbita ambulatoria por fibrilación ventricular primaria originada por una extrasístole ventricular con un breve intervalo de acoplamiento, tras una pausa postextrasistólica (1.120 ms) mayor que la anterior que había originado una extrasístole ventricular aislada. Obsérvese que la secuencia de eventos empezó con una extrasístole auricular que originó la primera pausa más corta (860 ms).
Figura 12. Inicio de una taquicardia ventricular en torsión de puntas en una mujer tratada con quinidina por salvas de taquicardia ventricular no sostenida sin enfermedad coronaria. En este caso la taquicardia ventricular en torsión de puntas desencadenó una fibrilación ventricular.
Figura 13. Muerte súbita debida a bradicardia progresiva en un paciente con infarto agudo y probable disociación electromecánica.
Tabla 2. Características clínicas de los pacientes que han fallecido súbitamente llevando un registrador de Holter
| Grupo I, FV primaria y TV→V 8 (n = 112) | Grupo II, TV en torsión de puntas (n = 23) | Grupo III, bradiarritmias (n = 26) | |
| Edad (años) | 58 | 60 | 70 |
| Varones | 76% | 40% | 39% |
| Pacientes coronarios | 90% | 50% | 70% |
| Sin cardiopatía aparente | 4% | 22% | 10% |
| Tratamiento antiarrítmico | 51% | 70% | — |
FV: fibrilación ventricular; TV: taquicardia ventricular.
Adaptado de Bayés de Luna et al 30 .
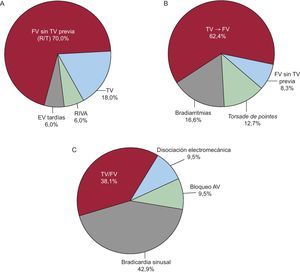
En la Figura 14 se muestran las arritmias finales que causaron la MS de pacientes con diferentes características clínicas: en una unidad coronaria móvil con un cuadro agudo isquémico camino del hospital61 (Figura 14A); en pacientes ambulatorios (registro Holter)30 (Figura 14B) y en pacientes ingresados por IC grave62 (Figura 14C). En el primer caso (A) se apreció un número mucho mayor de casos de FV sin TV previa que en el grupo de pacientes ambulatorios de nuestro estudio (B), con seguridad en relación con que todos los enfermos del grupo A estaban en la fase aguda del IM. En los pacientes con IC avanzada (grupo C), se comprobó que había muchos más casos de MS debida a bradiarritmia grave. Ello podría explicar la ineficacia de los fármacos antiarrítmicos para evitar la MS de los pacientes con IC avanzada. En nuestra serie (Figura 14B), el 80% de los pacientes tenían una FE deprimida, pero su capacidad funcional era en general aceptable. Se trataba de enfermos «demasiado sanos para morir», y muchos de estos casos de MS podrían haberse evitado con un tratamiento adecuado, el cual a veces consiste en no prescribir agentes antiarrítmicos de clase I. Debemos recordar el juramento hipocrático: «Primum non nocere».
Figura 14. Muerte súbita: arritmias finales. A: en pacientes con cardiopatía isquémica aguda (Adgey et al 61 ). B: en pacientes ambulatorios, en el 80% de casos con fracción de eyección deprimida (Bayés de Luna et al 30 ). C: en pacientes con insuficiencia cardiaca avanzada (Luu et al 62 ). AV: auriculoventricular; EV: extrasístoles ventriculares; FV: fibrilación ventricular; RIVA: ritmo idioventricular acelerado; TV: taquicardia ventricular. Reproducida con permiso de Bayés de Luna 52 .
Nuestros resultados fueron similares a los encontrados en pacientes con DAI con terapia de resincronización cardiaca o sin ella. En este caso, las TV rápidas también aparecieron frecuentemente, y se trataron con estimulación antitaquicárdica64, 65. Por otro lado, en una pequeña serie de pacientes tras IAM con fracción de eyección < 40% y un dispositivo de registro de eventos implantado (loop recorder) que murieron súbitamente, se demostró que en la mayoría de los casos la MS se debió a una FV primaria no desencadenada por una TV66. Sin embargo, no se conocía la información sobre los eventos clínicos alrededor de la hora de la muerte. Esta falta de información y el reducido número de casos hacen difícil la comparación de estas series con nuestros resultados. Por otro lado, en la mayoría de los pacientes que murieron por diferentes tipos de bradiarritmias, la muerte ocurrió más de 1 h después de iniciados los síntomas15.
Cómo identificar a los pacientes en riesgoConocemos mucho más todo lo referente a identificar y prevenir la MS de los pacientes en riesgo (antecedentes de parada cardiaca, cardiopatías genéticas, algunos pacientes tras un IAM pacientes con IC, etc.) que de cómo adivinar los casos en que la MS aparece como primera manifestación en la población general67. En la Figura 5 se puede ver que estos casos (A y B) representan más del 50% de los pacientes que sufren MS. Muchos de ellos corresponden a pacientes que presentan un IAM y cuya manfiestación incial es la MS.
Conocer quiénes son los candidatos que no han tenido síntomas previamente ni tienen factores de riesgo graves que van a sufrir una MS es, pues, muy difícil, ya que no es posible hacer un cribado exhaustivo de toda la población. Actualmente, a lo máximo que podemos aspirar es: a) hacer un estudio detallado de los familiares de los pacientes que hayan sufrido MS; b) realizar, cuando se atiende a un paciente por otro motivo, un correcto interrogatorio para conocer si existen antecedentes familiares de cardiopatías genéticas, CI o factores de riesgo evidentes, y c) en la primera visita médica de un adulto, practicar una exploración física adecuada y las pruebas complementarias pertinentes (analítica en busca de factores de riesgo, colesterolemia y glucemia especialmente, toma de la presión arterial y un ECG).
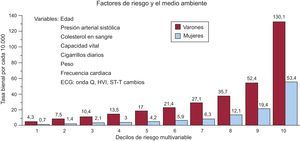
Poder descubrir a los candidatos de la MS en la población general es uno de los mayores desafíos de la moderna cardiología. En el estudio de Framingham, realizado en población general, se comprobaron dos cosas68: a) que la presencia de alteraciones en el ECG, sobre todo bloqueos de rama, y signos de HVI izquierda aumenta mucho, principalmente en los varones, el peligro de MS, y b) que en un análisis de riesgo multivariable el peligro de MS aumentó, sobre todo para los varones, en relación con el número de variables de riesgo que presentaban (Figura 15). Recientemente se ha descrito que marcadas elevaciones de NT-proBNP indican peligro de MS en el futuro para las mujeres, más que algunos factores clásicos de riesgo (alteraciones de los lípidos)69.
Figura 15. Riesgo de muerte súbita en el estudio de Framingham según el riesgo multivariable en varones y mujeres. ECG: electrocardiograma; HVI: hipertrofia ventricular izquierda. Adaptado con permiso de Kannel et al 68 .
Cómo prevenir la muerte súbitaNaturalmente, la mejor forma de prevenirla es identificar a los candidatos. Existen grupos de riesgo de MS, y en ellos es clave seleccionar quiénes son los que están en más peligro para, una vez se han agotado todas las estrategias farmacológicas o de otro tipo, como la ablación de una vía anómala o de un foco arritmogénico (p. ej., de TV), decidir la conveniencia de implantar un DAI. Naturalmente, con el DAI no se previene la aparición de la arritmia fatal; lo que se consigue es evitar la MS cuando aquella aparece.
Todo lo que hace referencia a la prevención de la MS en los pacientes con alto riesgo es bien conocido (Figura 5, Figura 7). Lo que es mucho más difícil es prevenir la MS en la población general70, 71, 72, 73. Para ello se debe realizar una lucha eficaz contra las enfermedades más frecuentes asociadas a ella, como la CI, la IC y las cardiopatías genéticas. La prevención de la CI debe empezar ya desde la infancia mediante una educación sanitaria que promueva unos hábitos de vida cardiosaludables favoreciendo el ejercicio físico y dietas adecuadas que ayuden a luchar contra la obesidad y a prevenir la aparición de los factores de riesgo. Naturalmente, es importante luchar eficazmente contra el colesterol, la hipertensión y la diabetes mellitus y evitar, si es posible (y si no, tratar), la IC de manera eficaz ya desde su inicio. Es también necesario conocer los aspectos clave que permitan diagnosticar las cardiopatías genéticas que implican peligro de MS, lo que incluye que debemos ser conscientes de la importancia de la historia clínica familiar y personal (antecedentes de síncopes o MS) y de que un simple patrón de ECG nos puede poner sobre la pista de que nos encontremos ante un posible candidato a la MS.
De hecho, mirando el futuro de forma visionaria, lo que sería muy útil para reducir la MS es un agente estabilizador de la placa de ateroma, que podría ser un aditivo químico en la comida o el agua, que incluso podría darse generalizadamente a toda la población, que pasivice la cubierta fibrosa de la placa ateromatosa activa para reducir la probabilidad de erosión o rotura y la MS74.
Conducta con un paciente resucitado de parada cardiacaLos pacientes a los que se resucita de una parada cardiaca fuera del hospital deben ser enviados a un centro de referencia para proceder a su estudio integral e identificar la causa de la parada cardiaca mediante el estudio clínico exhaustivo del caso, que incluye pruebas invasivas y no invasivas. Esta forma de actuar es la adecuada para los pacientes que han sufriodo una parada cardiaca sin aparente cardiopatía de base, aunque no se aconseja en estos casos practicar sistemáticamente estudios genéticos. Cuando sean más asequibles y económicos, se podrá aconsejar su uso sistemático en los familiares de pacientes con cardiopatías de origen genético.
En la mayoría de los casos, la causa de la parada es una FV. Por lo tanto, es necesario prevenir el primer episodio y organizar la prevención apropiada de episodios futuros. En ocasiones hay que tomar decisiones específicas. Por ejemplo, si la FV parece estar asociada con la presencia de isquemia, debe considerarse la posibilidad de revascularización. Se debe descartar también otros mecanismos involucrados como desencadenantes de FV; por ejemplo, en el caso de una fibrilación auricular rápida en pacientes con síndrome de Wolff-Parkinson-White, es obligada la ablación de la vía accesoria. Si el paciente ha sufrido un síncope, debe someterse a una evaluación completa75. Naturalmente, en los casos en que la parada cardiaca se debe a una arritmia pasiva, deberá implantarse de urgencia un marcapasos52.
En todos los demás supuestos, lo más prudente es que, si se confirma que la parada cardiaca ha sido por una TV/FV sin causa solucionable que la explique, se proceda a implantar un DAI con, a veces, resincronizador, de ser necesario. Recomendamos consultar las guías de las sociedades científicas de Estados Unidos76 y Europa77 para conocer la situación actual de la implantación de un DAI.
Conflicto de interesesNinguno.
Recibido 30 Marzo 2012
Aceptado 31 Marzo 2012
Autor para correspondencia: Institut Català de Ciències Cardiovasculars, Avda. S. Antoni M. Claret 167, 08025 Barcelona, España. abayes@csic-iccc.org