Las bradiarritmias son una observación clínica frecuente y comprenden diversos trastornos del ritmo, como la disfunción del nódulo sinusal y las alteraciones de la conducción auriculoventricular. La forma de presentación clínica varía entre los signos electrocardiográficos asintomáticos (p. ej., en un examen médico ordinario) y una amplia gama de síntomas como los de insuficiencia cardiaca, el casi síncope o síncope, síntomas del sistema nervioso central o síntomas inespecíficos y crónicos como mareo o fatiga. Los trastornos que llevan a la bradiarritmia se dividen en trastornos intrínsecos y extrínsecos que causan daños en el sistema de conducción. Además, las bradiarritmias pueden ser una reacción fisiológica normal en determinadas circunstancias. Un diagnóstico correcto, que incluya la correlación entre síntomas y ritmo cardiaco, es de extraordinaria importancia y por lo general se establece con exploraciones diagnósticas no invasivas (electrocardiograma de 12 derivaciones, electrocardiograma Holter, prueba de esfuerzo, dispositivo de registro de eventos, monitor cardiaco implantable de bucle continuo). Excepcionalmente se necesitan pruebas electrofisiológicas invasivas. Si se descartan las posibles causas extrínsecas reversibles de las bradiarritmias, como los fármacos (generalmente bloqueadores beta, glucósidos y/o antagonistas del calcio) o enfermedades subyacentes tratables, el marcapasos cardiaco suele ser el tratamiento de elección para las bradiarritmias sintomáticas. En este artículo de la serie que se está publicando sobre las arritmias, se examinan la fisiopatología, el diagnóstico y las opciones de tratamiento de las bradiarritmias, en especial, la disfunción del nódulo sinusal y los bloqueos de la conducción auriculoventricular.
Palabras clave
Las bradiarritmias y los bloqueos de la conducción son una observación clínica frecuente y pueden ser una reacción fisiológica (p. ej., en deportistas sanos) o corresponder a un trastorno patológico. De manera arbitraria, las bradiarritmias se definen por la presencia de una frecuencia cardiaca < 60 latidos por minuto (lpm). Pueden clasificarse en función del nivel de la alteración dentro de la jerarquía del sistema de conducción cardiaco normal1. Las dos categorías principales son la disfunción del nódulo sinusal (DNS) y los trastornos o bloqueos de la conducción auriculoventricular (AV). En este artículo se examinan la fisiopatología, el diagnóstico, el pronóstico y las opciones de tratamiento de estos trastornos del ritmo. Se puede consultar información adicional en el libro recientemente publicado por Antonio Bayés de Luna, Clinical Arrhythmology2.
Forma de presentación clínicaLa forma de presentación clínica de las arritmias va desde los signos electrocardiográficos asintomáticos hasta una amplia variedad de síntomas, comunes a la mayor parte de las bradicardias (Tabla 1). Los pacientes pueden presentar un casi síncope o síncope, síntomas de insuficiencia cardiaca como disnea, angina o incapacidad mental prematura; pero también síntomas inespecíficos y crónicos (mareo, fatiga, letargia). Los síntomas pueden ser permanentes o intermitentes e impredecibles, como ocurre en la DNS.
Tabla 1. Síntomas de las bradiarritmias
| Mareo, aturdimiento, vértigo |
| Presíncope, síncope, crisis de Adam-Stokes |
| Fatiga, letargia |
| Angina, disnea |
| Insuficiencia cardiaca congestiva |
| Incapacidad mental |
El sistema de conducción fisiológico está formado por el nódulo sinusal, el nódulo AV y el haz de His, que incluye las ramas derecha e izquierda del haz, así como el sistema de Purkinje. El sistema de conducción puede entenderse como una jerarquía de marcapasos, en la que el nódulo sinusal es el marcapasos primario del corazón.
En 1907, Keith y Flack3 identificaron el nódulo sinusal como la región encargada de la activación primaria del corazón. Se trata de una estructura en forma de media luna que se encuentra en una posición epicárdica en el surco terminal, entre la vena cava superior y la aurícula derecha. Aunque el nódulo sinusal se representa a menudo en los manuales médicos como un área pequeña y localizada, no concuerda con lo que los datos electrofisiológicos indican4, 5. Según los modelos experimentales en animales (especialmente en conejos), es más probable que el nódulo sinusal sea un área difusa y extensa situada entre la vena cava superior y la inferior4, 6. Está formado por células marcapasos que sufren despolarizaciones espontáneas, con un patrón peculiar de canales iónicos necesario para la generación y la propagación de los potenciales de acción. La irrigación sanguínea del nódulo sinusal procede de la arteria del nódulo sinusal, que tiene su origen en la arteria coronaria derecha (en alrededor del 60% de los casos) o circunfleja izquierda (40%) y llega al nódulo en sentido horario o antihorario rodeando la vena cava superior1, 7, 8.
Durante mucho tiempo se ha pensado que los impulsos procedentes del nódulo sinusal llegan al nódulo AV a través de tres vías intraarteriales (el tracto internodular anterior, el medio y el posterior), pero los estudios más recientes indican que la orientación de las fibras auriculares puede explicar las vías de conducción preferentes1, 9, 10.
Excepto en los pacientes que tienen vías accesorias, el nódulo AV constituye la única conexión entre las aurículas y los ventrículos. Los impulsos que van de las aurículas al ventrículo están modulados por el nódulo AV. Una de las principales funciones del nódulo AV es retrasar y limitar el número de impulsos auriculares que llegan al ventrículo. Además, las extensiones inferiores del nódulo AV pueden actuar como marcapasos subsidiario en casos de bloqueo AV11. El nódulo AV forma parte de la unión AV, que puede dividirse en tres regiones distintas en función de la notable heterogeneidad existente en la onda del potencial de acción: la zona de transición, la porción compacta o nódulo AV propiamente dicho y la parte penetrante del haz AV (haz de His)10, 11. La porción compacta del nódulo AV está situada debajo del endocardio auricular derecho, por delante del ostium del seno coronario y por encima de la inserción de la valva septal de la válvula tricúspide11. A su entrada en el tejido fibroso central, el nódulo AV pasa a ser la porción penetrante del haz de His. A continuación, los impulsos pasan del haz de His a las ramas derecha e izquierda del haz. La arteria del nódulo AV irriga la parte proximal del nódulo AV, mientras que la parte distal tiene una doble irrigación que hace que sea menos vulnerable a la isquemia12. La arteria del nódulo tiene su origen en la arteria coronaria derecha en un 80-90% de las personas, y en la arteria circunfleja en el 10-20%1, 7, 12. En consecuencia, las anomalías de la conducción del nódulo AV durante el infarto agudo de miocardio suelen estar causadas por un infarto de cara diafragmática.
El sistema de conducción cardiaco recibe una inervación abundante tanto del sistema nervioso simpático como del parasimpático. La estimulación del sistema nervioso simpático aumenta el automatismo, potencia la conducción y acorta los periodos refractarios. El sistema parasimpático tiene efectos opuestos. No obstante, la conducción en el haz de His no se ve influida por la estimulación simpática ni por la vagal10.
Disfunción del nódulo sinusalLa DNS (también denominada síndrome del seno enfermo en los pacientes sintomáticos) incluye diversos trastornos que afectan a la generación del impulso del nódulo sinusal, y su transmisión en el interior de las aurículas puede causar tanto bradiarritmias como taquicardias13. Viene a ser un espectro de trastornos. Las posibles manifestaciones electrocardiográficas son:
• Bradicardia sinusal persistente.
• Pausas o paradas sinusales.
• Bloqueo de salida senoauricular.
• Incompetencia cronotrópica.
• Taquicardia auricular (incluidos la fibrilación auricular y el aleteo o flutter auricular) y, por lo tanto,
• Síndrome de bradicardia-taquicardia.
Actualmente la DNS es una de las principales causas de implantación de marcapasos, aparte del bloqueo AV. En 2009 y 2010 supuso aproximadamente un 50% de las implantaciones de marcapasos en Estados Unidos, un 30-50% en Europa y aproximadamente un 40% en España14, 15. En general, la DNS es un trastorno crónico y progresivo, se produce principalmente en ancianos, con una incidencia que aumenta al doble entre la quinta y la sexta década de la vida y alcanza un máximo en la séptima y la octava década16, 17. Aunque no disponemos de cifras exactas de incidencia de la DNS, se estima que se da en 150 a 200 pacientes por millón de habitantes18.
Bradicardia sinusalPor convención, la bradicardia sinusal se define por una frecuencia cardiaca < 60 lpm, cuando el nódulo sinusal actúa como marcapasos primario. En la mayoría de los casos, la bradicardia sinusal es más una reacción fisiológica que un estado patológico. La bradicardia sinusal es una observación frecuente, a menudo transitoria, y se debe predominantemente a un aumento del tono vagal. Se observa en deportistas entrenados y en adultos jóvenes sanos en reposo y por la noche (la frecuencia cardiaca puede reducirse a menos de 30 lpm durante la noche)19, 20, 21, 22. En los pacientes con bradicardia sinusal persistente, sobre todo si se documentan frecuencias cardiacas < 40 lpm durante el día y síntomas de bradicardia, la bradicardia sinusal es patológica y a menudo manifestación de una DNS17, 18.
Pausas sinusales o paradasLa parada o las pausas sinusales implican un fallo de la activación auricular esperada23. Puede deberse a un problema de generación del impulso en el nódulo sinusal o a un fallo de la conducción del impulso a la aurícula. Aunque actualmente no hay valores de corte establecidos, las pausas de 3 s o más son infrecuentes y justifican la implantación de un marcapasos en los pacientes sintomáticos24, 25. Sin embargo, no parece que las pausas de 3 s o más predigan mayor mortalidad, según lo indicado por un estudio más reciente26.
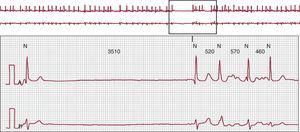
Las pausas son frecuentes en el síndrome de bradicardia-taquicardia (Figura 1) cuando una taquiarritmia auricular finaliza espontáneamente y el tiempo de recuperación del nódulo sinusal es prolongado. Este es el periodo durante el cual los centros de marcapasos secundarios o terciarios no asumen el control del ritmo hasta que el nódulo sinusal reanuda su actividad. La reproducibilidad de estas pausas con un ritmo auricular de frecuencia rápida es relativamente baja. La supresión de la actividad del nódulo sinusal puede agravarse por los fármacos antiarrítmicos.
Figura 1. Ejemplo de un paciente con un síndrome de bradicardia-taquicardia típico: la fibrilación auricular termina de forma súbita y se sigue de una pausa hasta el primer latido sinusal debido a un tiempo de recuperación prolongado del nódulo sinusal.
Incompetencia cronotrópicaLa incompetencia cronotrópica se define como la incapacidad del corazón de ajustar adecuadamente su frecuencia en respuesta al aumento de la actividad física o el cambio de las demandas metabólicas23, 27. A menudo pasa inadvertida en la práctica clínica, lo que puede deberse en parte a la falta de criterios diagnósticos universalmente aceptados. El criterio utilizado por la mayoría de los médicos y de los estudios es no alcanzar el 80% de la frecuencia cardiaca máxima esperada (220 menos la edad) en el ejercicio máximo de una prueba de esfuerzo17, 23, 27.
Las taquiarritmias auriculares se han abordado ya en esta serie sobre las arritmias, por lo que no se comentan aquí. Se remite al lector a los capítulos anteriores en los que se ha tratado la taquicardia auricular, el aleteo auricular28 y la fibrilación auricular29.
Fisiopatología de la disfunción del nódulo sinusalLa DNS puede ser consecuencia de diversos trastornos que causan una depresión del automatismo del nódulo sinusal y de la conducción eléctrica a partir de este nódulo y en el tejido perinodular y auricular16. Estos trastornos pueden ser intrínsecos (enfermedades que alteran de manera directa el nódulo sinusal o la estructura senoauricular) o extrínsecos (la mayoría de las veces fármacos cardiovasculares o enfermedades sistémicas como la apnea del sueño)23. Las posibles causas de DNS se enumeran en la Tabla 2. La causa más frecuente de DNS es la fibrosis degenerativa idiopática del tejido nodular que se asocia a la edad avanzada16, 30, 31. Se cree que la fibrosis conduce a una pérdida de células marcapasos y su desplazamiento de la parte central a la inferior del nódulo sinusal4, 32. La despolarización diastólica espontánea es más lenta en esas células, lo que da lugar a la bradicardia.
Tabla 2. Causas de disfunción del nódulo sinusal
| Causas extrínsecas | Causas intrínsecas |
| Agentes farmacológicos* | Fibrosis degenerativa idiopática* |
| Bloqueadores beta | Isquemia (incluido el infarto) |
| Antagonistas del calcio | Enfermedades infecciosas |
| Glucósidos cardiacos | Enfermedad de Chagas |
| Fármacos antiarrítmicos (clase I, III) | Endocarditis |
| Antihipertensivos simpaticolíticos | Difteria |
| Otros: litio, fenitoína | Enfermedad inflamatoria |
| Alteraciones electrolíticas | Miocarditis |
| Hipotiroidismo | Trastornos infiltrativos |
| Apnea del sueño | Enfermedades del colágeno |
| Hipoxia | Trastornos osteomusculares |
| Hipotermia | Cirugía cardiotorácica |
| Aumento del tono vagal | Sustitución valvular |
| Vómitos | Cardiopatía congénita |
| Tos | |
| Defecación, micción |
* Causas más frecuentes.
Aunque, como ya se ha mencionado, la DNS a menudo se asocia a una cardiopatía subyacente y es una enfermedad fundamentalmente de los ancianos, se sabe que se da también en fetos, lactantes, niños y adultos jóvenes, sin que se identifiquen cardiopatías u otros factores contribuyentes obvios4, 33, 34. Además, se han descrito casos familiares compatibles con una herencia autosómica dominante de penetración reducida o con una herencia recesiva33, 35, 36, 37. En pacientes con una DNS aislada o idiopática, se han identificado mutaciones en el gen del canal de sodio cardiaco (SCN5A) y en el gen del HCN4 encargado de la corriente funny (If) en el tejido del nódulo humano33, 38, 39, 40, 41.
Diagnóstico de la disfunción del nódulo sinusalPara establecer el diagnóstico de DNS, es crucial encontrar una relación causal entre los síntomas de los pacientes y las mencionadas anomalías del electrocardiograma (ECG). Dada la naturaleza predominantemente intermitente y a menudo impredecible de la DNS, puede resultar muy difícil. Aparte de una evaluación detallada de los antecedentes médicos, generalmente basta con un ECG de superficie de 12 derivaciones, un registro de ECG Holter (ECG de larga duración) y una prueba de esfuerzo. Si el ECG de superficie y el registro Holter repetido no logran documentar la causa de los síntomas de un paciente, debe considerarse la conveniencia de utilizar un dispositivo de registro de eventos externo o de un monitor cardiaco implantable de bucle continuo. En los pacientes con síntomas que se producen más de una vez al mes, a menudo basta con un dispositivo de registro de eventos externo, que pueden llevar de manera continua durante un máximo de 30 días. Puede usarse un monitor cardiaco implantable de bucle continuo en los pacientes con síntomas poco frecuentes y transitorios, en los que ninguno de los registros electrocardiográficos citados permitiría obtener una información diagnóstica1.
Estudio electrofisiológico invasivo en la disfunción del nódulo sinusalLos estudios electrofisiológicos no suelen ser necesarios en los pacientes con bradiarritmias sintomáticas como el bloqueo AV completo de alto grado o la DNS, ya que en la mayoría de las ocasiones es suficiente la información aportada por el ECG de superficie. Sin embargo, los estudios electrofisiológicos pueden ser de utilidad en pacientes con síntomas que hagan sospechar claramente la presencia de anomalías de la conducción AV o de una DNS, y en los que el registro del ECG de superficie o el registro Holter ambulatorio no ha dado resultado, así como en los pacientes con un bloqueo AV 2:1 asintomático persistente.
Tratamiento de la disfunción del nódulo sinusalEl tratamiento debe limitarse a los pacientes en los que se ha documentado una clara correlación entre síntomas y ritmo13, 42. Los pacientes con una DNS asintomática no requieren un tratamiento específico. El primer paso consiste en descartar o tratar las causas extrínsecas reversibles de DNS (Tabla 2) y descartar la bradicardia sinusal fisiológica. El tratamiento farmacológico no es eficaz en la DNS.
Si no hay ningún trastorno reversible que cause la DNS, debe utilizarse un marcapasos cardiaco para aliviar los síntomas (Tabla 3). El modo adecuado del marcapasos ha sido objeto de numerosos estudios (ensayo Pacemaker Selection in the Elderly43, Canadian Trial of Physiological Pacing44, Mode Selection Trial in Sinus-Node Dysfunction45, un ensayo danés46). Los objetivos de valoración utilizados en esos estudios que compararon el marcapasos auricular con el ventricular fueron la mortalidad, la fibrilación auricular, la frecuencia de episodios tromboembólicos incluido el ictus, la insuficiencia cardiaca, el síndrome de marcapasos y la calidad de vida de los pacientes42. Según indican estos estudios, los modos de marcapasos que preservan la sincronía AV (AAIR o DDDR) parecen ser mejores que el marcapasos ventricular solo y son los recomendados en la guía actual de la Sociedad Europea de Cardiología (ESC)42. Los resultados del estudio recientemente publicado por los investigadores del DANPACE47 ponen en duda el concepto de que se deba preferir el modo AAIR, y respaldan en cambio el uso habitual del marcapasos DDDR en vez del AAIR. Sin embargo, el AAIR se sigue recomendando para determinados pacientes con DNS según la guía de la ESC42, aunque en el estudio DANPACE se observó que dicho modo se asociaba a mayor incidencia de fibrilación auricular y aumento al doble del riesgo de reoperaciones del marcapasos.
Tabla 3. Indicaciones de marcapasos cardiaco en la disfunción del nódulo sinusal, según la guía de 2007 de la Sociedad Europea de Cardiología 42
| Indicación clínica | Clase | Nivel de evidencia |
| 1. La DNS se manifiesta por una bradicardia sintomática con/sin taquicardia dependiente de la bradicardia. Debe establecerse la correlación de los síntomas con el ritmo: aparición espontánea, inducida por medicación cuando no se dispone de un tratamiento farmacológico alternativo | I | C |
| 2. Síncope con DNS, bien de aparición espontánea, bien en un estudio electrofisiológico | ||
| 3. La DNS se manifiesta por una incompetencia cronotrópica sintomática | ||
| 1. DNS sintomática, ya sea espontánea o inducida por un fármaco para el que no existe alternativa, pero no se ha documentado correlación entre síntomas y ritmo. La frecuencia cardiaca en reposo debe ser < 40 lpm | IIa | C |
| 2. Síncope para el que no haya otra explicación, pero los resultados electrofisiológicos son anormales (TRNS > 800 ms) | ||
| 1. Pacientes mínimamente sintomáticos con DNS, frecuencia cardiaca en reposo < 40 lpm estando despiertos y ausencia de evidencia de incompetencia cronotrópica | IIb | C |
| 1. DNS sin síntomas, ni siquiera con el empleo de fármacos que provocan bradicardia | III | C |
| 2. Resultados del ECG correspondientes a DNS con síntomas no debidos directa ni indirectamente a la bradicardia | ||
| 3. DNS sintomática cuyos síntomas se pueda atribuir de manera fiable a una medicación no esencial |
TRNS: tiempo de recuperación del nódulo sinusal; DNS: disfunción del nódulo sinusal; ECG: electrocardiograma.
Teniendo en cuenta que las taquiarritmias auriculares, y en especial la fibrilación auricular, son frecuentes en los pacientes con DNS y que la trombembolia es la causa más importante de mortalidad en la DNS23, se debe considerar el uso de anticoagulación oral en todos los pacientes con DNS y antecedentes de taquicardias intermitentes. La anticoagulación oral debe aplicarse según lo establecido en la guía más reciente de la ESC para el manejo de la fibrilación auricular48.
Pronóstico de la disfunción del nódulo sinusalLa evolución natural de la DNS es muy diversa y a menudo impredecible. Sin embargo, los pacientes con antecedentes de síncope a causa de una DNS pueden presentar síncopes recurrentes49. Se considera que la aparición de un bloqueo AV completo asociado es baja, con una mediana anual de incidencia del 0,6% (prevalencia total del 2,1%) y no es un aspecto predominante en el curso clínico de la DNS17. La incidencia de muerte súbita parece ser también baja y no parece que el tratamiento con marcapasos mejore la supervivencia total, aunque sí reduce la morbilidad49, 50, 51, 52. La progresión y el pronóstico de la DNS dependen de varios factores: edad, enfermedades cardiovasculares coexistentes, presencia simultánea de un bloqueo de la conducción AV y fibrilación auricular que comporta un mayor riesgo de complicaciones tromboembólicas18, 53. En pacientes con DNS y función preservada del ventrículo izquierdo tratados con marcapasos cardiacos, no parece que el modo del marcapasos influya en la incidencia de complicaciones tromboembólicas ni en la supervivencia47. No obstante, como ya se ha dicho, la fibrilación auricular parece ser más frecuente con el empleo del modo AAIR.
Bloqueo de la conducción auriculoventricularEl bloqueo de la conducción AV es un trastorno en el que los impulsos auriculares son conducidos con retraso o no son conducidos en absoluto a los ventrículos en un momento en que la vía de conducción AV no está en un periodo refractario fisiológico1, 42. Históricamente, esta fue la primera indicación para el uso de marcapasos cardiacos y sigue siendo la principal razón (aproximadamente un 50%) para la implantación de marcapasos14, 15, 17. La incidencia de los trastornos de la conducción AV aumenta con la edad y se estima que es de hasta un 30% en ciertos grupos seleccionados54, 55. El bloqueo AV congénito es muy poco frecuente y se da en 1:15.000 a 1:22.000 nacidos vivos8, 55, 56, 57.
Aplicando criterios electrocardiográficos, el bloqueo AV se clasifica tradicionalmente como bloqueo AV de primero, segundo o tercer grado (completo). En función de los registros de electrofisiología intracardiaca, pueden diferenciarse bloqueos suprahisianos, intrahisianos o infrahisianos.
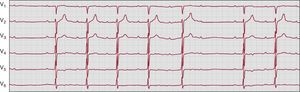
Bloqueo auriculoventricular de primer gradoPor convención, el bloqueo AV de primer grado se define como una prolongación anormal del intervalo PR (> 0,2 s). Cada onda P va seguida de un complejo QRS, pero con un intervalo PR prolongado de forma constante. La prolongación del intervalo PR puede ser consecuencia de un retraso de la conducción en el interior de la aurícula, el nódulo AV (intervalo AH) o el sistema de His-Purkinje (intervalo HV), pero la mayoría de las veces se debe a un retraso de la conducción dentro del nódulo AV58. Los pacientes con un bloqueo AV de primer grado suelen estar asintomáticos. Sin embargo, si se produce una prolongación notable del intervalo PR (> 0,3 s) (Figura 2), pueden presentar un síndrome de tipo marcapasos debido a una disincronía AV. Muchos de estos pacientes son especialmente sintomáticos durante el ejercicio, ya que el intervalo PR no sufre el acortamiento apropiado a medida que se reduce el intervalo R-R8.
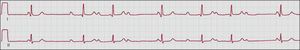
Figura 2. Ejemplo de un paciente con bloqueo auriculoventricular de primer grado asintomático, con una prolongación marcada del intervalo PR (0,4 s). Todas las ondas P se conducen y con un intervalo PR constante. La amplitud de la onda P es superior a la normal (0,3-0,4 mV) y las ondas P son difásicas en V1 (no se muestra en la tira de electrocardiograma), lo cual indica un crecimiento auricular derecho. Sin embargo, la ecocardiografía y la resonancia magnética cardiaca fueron normales (calibrado a 25 mm/s, 10 mm/mV).
Bloqueo auriculoventricular de segundo gradoEl término bloqueo AV de segundo grado se aplica cuando se produce un fallo intermitente de la conducción AV10. El bloqueo AV de segundo grado puede dividirse en dos tipos, según los patrones observados en el ECG: tipo I (Mobitz I o Wenckebach) y tipo II (Mobitz II). Esta clasificación no debe utilizarse para describir la localización anatómica del bloqueo, ya que los términos tipo I y tipo II sólo hacen referencia a un determinado patrón de conducción en el ECG. Para evitar errores y confusiones a menudo asociadas al diagnóstico de bloqueo AV de segundo grado, es importante atenerse a una definición correcta59.
El bloqueo AV de segundo grado Mobitz tipo I clásico se caracteriza por una prolongación progresiva del intervalo PR antes de la onda P no conducida (conducta de Wenckebach). La primera onda P conducida después de la onda P no conducida es la que tiene el intervalo PR más corto del ciclo, de tal manera que la pausa entre los complejos QRS que engloban la onda P no conducida será de menos del doble del intervalo P-P60. En presencia de un ritmo sinusal estable, el ciclo del bloqueo tiene normalmente una relación P:R fija (en el tipo I clásico, 3:2, 4:3 o 5:4). Sin embargo, muchas secuencias de bloqueo AV de segundo grado tipo I son atípicas y no muestran la prolongación progresiva clásica del intervalo PR59, 61 (Figura 3).
Figura 3. Bloqueo auriculoventricular de segundo grado tipo Mobitz I (Wenckebach) con una relación 6:5. La secuencia observada en este paciente no sigue la estructura matemática propuesta por Wenckebach. Los intervalos PR segundo a cuarto están prolongados pero son constantes, y es el quinto intervalo PR, no el segundo, el que muestra mayor incremento. La primera onda P conducida tras la onda P no conducida es la que tiene el intervalo PR más corto (240 ms). La pausa entre los complejos QRS que engloban la onda P no conducida es inferior a dos intervalos PP (calibrado a 25 mm/s, 10 mm/mV).
Según lo indicado por las declaraciones de la Organización Mundial de la Salud y el American College of Cardiology, una definición más apropiada del bloqueo AV de segundo grado tipo I es la de una sola onda P no conducida asociada a intervalos PR no constantes antes y después del impulso bloqueado en tanto haya al menos dos ondas P conducidas consecutivas (es decir, bloqueo AV 3:2) para poder determinar el comportamiento de los intervalos PR62.
El bloqueo AV de segundo grado tipo II (Figura 4) se define por la aparición de una sola onda P no conducida asociada a intervalos PR constantes antes y después de un solo impulso bloqueado (los intervalos PP y RR son constantes)58, 59. La pausa que engloba la onda P bloqueada es igual a dos ciclos P-P. El bloqueo AV de segundo grado tipo II se produce de forma característica conjuntamente con un bloqueo intraventricular.
Figura 4. Bloqueo auriculoventricular de segundo grado tipo Mobitz II, con bloqueo intermitente de rama izquierda del haz: las primeras tres ondas P (de izquierda a derecha) se conducen con un intervalo PR constante de 140 ms; la cuarta P no se conduce. La pausa entre los dos complejos QRS que engloban la onda P no conducida es igual a dos intervalos PP. El complejo QRS de la primera onda P conducida es estrecho y reaparece con un patrón similar. Los complejos QRS siguientes son más anchos (0,14 s) y cumplen los criterios de bloqueo completo de rama izquierda del haz. El patrón de tipo Mobitz II en el contexto de un bloqueo de rama izquierda del haz indica un bloqueo por debajo del haz de His. FC: frecuencia cardiaca.
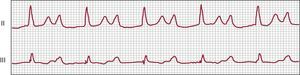
Bloqueo auriculoventricular 2:1Con un solo intervalo PR antes de la onda P bloqueada, un bloqueo AV 2:1 (Figura 5), también denominado bloqueo AV avanzado, no puede clasificarse como bloqueo AV de segundo grado tipo I o tipo II mediante un solo registro (corto) del ECG de superficie. La localización anatómica del bloqueo puede estar en el nódulo AV o en el sistema de His-Purkinje, y tanto el bloqueo AV de segundo grado de tipo I como el de tipo II pueden presentar una progresión o una regresión a un bloqueo 2:159. La presencia de un bloqueo intraventricular indica un bloqueo distal al nódulo AV, mientras que un bloqueo con un complejo QRS pequeño suele encontrarse dentro del nódulo AV. Teniendo en cuenta que el bloqueo AV de segundo grado tipo II constituye una indicación de clase I para el uso de un marcapasos permanente, establecer el diagnóstico exacto tiene una enorme importancia terapéutica. El registro de una tira de ECG de superficie prolongada, la prueba de presión en el seno carotídeo y la administración de atropina o el ejercicio pueden revelar el tipo correcto del bloqueo AV de segundo grado. Un paciente con un bloqueo AV 2:1 en el que se observan ciclos de Wenckebach durante el registro del ECG de larga duración, o a veces durante registros más largos del ECG estándar, hace pensar que en tal caso el bloqueo AV 2:1 muy probablemente sea la forma extrema de un ciclo de Wenckebach.
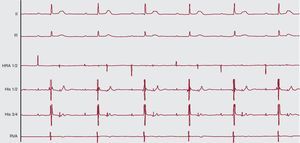
Figura 5. Paciente de 15 años de edad con bloqueo auriculoventricular de segundo grado y bloqueo auriculoventricular de tercer grado intermitente (no mostrado), durante un estudio electrofisiológico invasivo (electrocardiograma de 12 derivaciones, catéter en parte alta de aurícula derecha, His y apical ventricular derecho). El ritmo básico es un ritmo sinusal relativamente estable, pero sólo una de cada dos ondas P es conducida al ventrículo, con un complejo QRS estrecho. El intervalo PR es constante (calibrado a 25 mm/s, 10 mm/mV). HRA: parte alta de aurícula derecha; RVA: catéter apical ventricular derecho.
Bloqueo auriculoventricular de tercer gradoEl bloqueo AV de tercer grado o completo se caracteriza por el fallo de la conducción al ventrículo en cada onda P o cada impulso auricular, con lo que se produce una disociación AV completa, con unas frecuencias auriculares superiores a las ventriculares (Figura 6, Figura 7). Puede ser congénito o adquirido y estar localizado en el nódulo AV, el haz de His o las ramificaciones de las ramas derecha e izquierda del haz. El ritmo de escape ventricular revela la localización anatómica del bloqueo: un bloqueo AV completo con un ritmo de escape de 40 a 60 lpm y un complejo QRS estrecho en el ECG de superficie se encuentra generalmente dentro de la unión AV y se observa a menudo en el bloqueo AV congénito (Figura 2). Un complejo QRS ancho o una frecuencia de 20 a 40 lpm implican un bloqueo en el sistema de His-Purkinje, como ocurre la mayoría de las veces en los bloqueos AV adquiridos60.
Figura 6. Ejemplo de bloqueo auriculoventricular de tercer grado, con disociación auriculoventricular completa y ritmo de escape de la unión auriculoventricular, con complejos QRS estrechos (calibrado a 25 mm/s, 10 mm/mV).
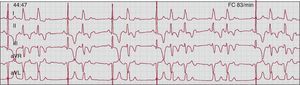
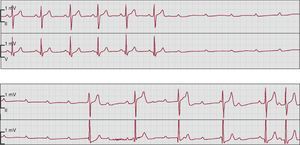
Figura 7. Bloqueo auriculoventricular de tercer grado intermitente con asistolia en un paciente hospitalizado por síncopes recurrentes. En el panel superior se muestra inicialmente la aparición súbita de un bloqueo auriculoventricular de tercer grado sin ritmo de escape ventricular, seguido de un ritmo de escape de la unión auriculoventricular con complejos QRS estrechos en el panel inferior (primeros 4 latidos), así como dos ondas P conducidas al final del panel inferior.
Etiología y fisiopatología del bloqueo de la conducción auriculoventricularEl bloqueo AV adquirido puede estar causado por diversos trastornos extrínsecos e intrínsecos ya comentados en relación con la DNS (Tabla 2). La degeneración progresiva idiopática del sistema de conducción cardiaco, denominada enfermedad de Lenegre63 o enfermedad de Lev64, es la causa de aproximadamente la mitad de los casos de bloqueo AV. Además de las causas citadas para la DNS, se puede observar trastornos progresivos de la conducción AV en enfermedades neuromusculares (distrofia muscular, síndrome de Kearns-Sayre), enfermedades sistémicas (p. ej., sarcoidosis cardiaca, amiloidosis), trastornos neoplásicos (linfoma cardiaco primario65 o tras radioterapia) o después de la ablación percutánea de vías accesorias septales o de una vía AV lenta o rápida para la taquicardia de reentrada del nódulo AV. En los individuos más jóvenes, debe considerarse siempre la posibilidad de una enfermedad de Lyme como posible causa reversible de un bloqueo AV.
El bloqueo AV completo congénito puede darse como enfermedad aislada, en cuyo caso con frecuencia se debe a la exposición intrauterina a anticuerpos maternos (Rho, La) o puede asociarse a cualquier cardiopatía congénita56, 57, 66. Desde el punto de vista anatomopatológico, existen cuatro tipos de bloqueo AV congénito: falta de conexión entre las aurículas y el sistema de conducción periférico, interrupción del haz AV, enfermedad de la rama del haz y formación anormal o interrupción del haz AV55. El bloqueo AV completo es una manifestación relativamente frecuente de la entidad muy poco común de transposición de grandes vasos corregida congénitamente.
Diagnóstico del bloqueo auriculoventricularLos pacientes que presentan un bloqueo AV avanzado refieren generalmente síntomas de mareo, vértigo o síncope, pero pueden sufrir también cualquiera de los síntomas ya mencionados para las bradiarritmias. El diagnóstico del bloqueo AV puede establecerse en la mayoría de los casos por medios no invasivos. Si el registro es lo suficientemente largo, el ECG de superficie generalmente aporta la información necesaria para caracterizar el tipo y localizar el nivel en que se encuentra el bloqueo. En los pacientes con un bloqueo AV intermitente, el registro del ECG Holter y la prueba de esfuerzo son importantes para establecer una correlación entre los síntomas y el ritmo.
Con raras excepciones, como la presencia de un bloqueo AV 2:1 persistente o cuando no se establece relación entre síntomas y ritmo, el estudio electrofisiológico invasivo no aporta nada importante al manejo de los pacientes con bloqueo AV completo.
Tratamiento de los bloqueos de la conducción auriculoventricularAl igual que en la DNS, el tratamiento del bloqueo AV debe empezar con la búsqueda de posibles causas reversibles, como por ejemplo la enfermedad de Lyme o la isquemia miocárdica. Si es posible, se debe suspender los fármacos que causan retraso de la conducción dentro del nódulo AV, como digital o los antagonistas del calcio.
En la situación aguda, se puede tratar el bloqueo AV sintomático con fármacos vagolíticos por vía intravenosa, como la atropina o las catecolaminas (orciprenalina). Si estos fármacos no son efectivos, está indicado el uso de un marcapasos temporal. En el tratamiento de urgencia inmediata de las bradiarritmias sintomáticas graves (sin ritmo de escape), se puede aplicar estimulación transcutánea.
El marcapasos cardiaco transitorio y permanente es el tratamiento de elección establecido en la mayoría de los casos de bloqueo AV completo sintomático. La indicación depende del tipo y la localización del bloqueo AV, los síntomas, el pronóstico y las enfermedades concomitantes. En la Tabla 4 se indican las recomendaciones exactas de la ESC para los marcapasos cardiacos en el bloqueo AV adquirido.
Tabla 4. Recomendaciones para el uso de marcapasos cardiaco en el bloqueo auriculoventricular adquirido, según la guía de 2007 de la Sociedad Europea de Cardiología 42
| Indicación clínica | Clase | Nivel de evidencia |
| 1. Bloqueo auriculoventricular de segundo grado (Mobitz I o II) o de tercer grado sintomático crónico | I | C |
| 2. Enfermedades neuromusculares (p. ej., distrofia muscular miotónica, síndrome de Kearns-Sayre, etc.) con un bloqueo auriculoventricular de segundo o tercer grado | I | B |
| 3. Bloqueo auriculoventricular de segundo grado (Mobitz I o II) o de tercer grado | I | C |
| • Después de ablación percutánea de la unión auriculoventricular | ||
| • Después de cirugía valvular cuando no se espera que el bloqueo se resuelva | ||
| 1. Bloqueo auriculoventricular de segundo grado (Mobitz I o II) o de tercer grado asintomático | IIa | C |
| 2. Bloqueo auriculoventricular de primer grado sintomático prolongado | IIa | C |
| 1. Enfermedades neuromusculares (p. ej., distrofia muscular miotónica, síndrome de Kearns-Sayre, etc.) con bloqueo auriculoventricular de primer grado | IIb | B |
| 1. Bloqueo auriculoventricular de primer grado asintomático | III | C |
| 2. Bloqueo de segundo grado Mobitz I asintomático con bloqueo de la conducción suprahisiano | ||
| 3. Bloqueo auriculoventricular que se espera que se resuelva |
Los pacientes con un bloqueo AV de primer grado generalmente no necesitan un marcapasos cardiaco. No obstante, si el intervalo PR no se adapta a la frecuencia cardiaca durante el ejercicio y es lo suficientemente prolongado (la mayoría de las veces > 0,3 s) para causar síntomas por pérdida de la sincronía AV, se debe considerar la posible conveniencia de implantar un marcapasos DDD (clase IIa)42.
El bloqueo AV de segundo grado tipo I (Wenckebach) asintomático se considera casi siempre un trastorno benigno, con un pronóstico excelente en individuos jóvenes o deportistas entrenados, en reposo19, 20, 21, 22, 67. Sin embargo, existe cierta controversia respecto al pronóstico y la necesidad de un marcapasos permanente en el bloqueo AV de segundo grado tipo I crónico en pacientes de más edad (> 45 años)8, 68, 69, 70. Así pues, en los pacientes de más edad con un bloqueo AV de segundo grado tipo I asintomático se debe aplicar, como mínimo, una vigilancia estrecha.
En los pacientes con un bloqueo AV completo congénito, la decisión de implantar un marcapasos suele basarse en varios factores, como la evolución natural, la edad (la importancia de la bradicardia depende de la edad) y los síntomas del paciente y la cardiopatía estructural/congénita existente42. Las indicaciones para el uso de un marcapasos cardiaco permanente en el bloqueo AV completo congénito están todavía en proceso de cambio. Sin embargo, hay consenso entre los pediatras respecto a que la presencia de una cardiopatía subyacente grave, síntomas y una frecuencia cardiaca < 50-55 lpm constituye indicación para el uso de un marcapasos cardiaco42, 56. En la actualidad, sabemos también que incluso los pacientes asintomáticos con una cardiopatía congénita aislada tienen un riesgo impredecible de síncope, por lo que debe considerarse seriamente el uso de un marcapasos en todo paciente con un bloqueo AV completo congénito71, 72, 73.
Pronóstico del bloqueo auriculoventricularEl pronóstico de los pacientes con trastornos de la conducción AV depende de la localización del bloqueo, pero también y en especial de la cardiopatía subyacente o simultánea. El conocimiento de la evolución natural de los diferentes tipos de bloqueo AV se remonta a la época anterior al tratamiento con marcapasos, puesto que no hay ningún otro tratamiento alternativo para los pacientes con un bloqueo AV sintomático.
El bloqueo AV de primer grado tiene un pronóstico excelente, ya que el riesgo de progresión a bloqueo AV de tercer grado es extremadamente bajo10, 74, 75. Hay cierta controversia respecto al pronóstico del bloqueo AV de segundo grado tipo I crónico, como se ha mencionado antes. En jóvenes sanos con una amplitud del QRS normal, se lo considera un trastorno benigno76. En los pacientes de más edad (> 45 años) y en los que presentan un bloqueo de rama del haz asociado, lo que indica una localización infranodular, el pronóstico parece ser peor que el de individuos de iguales edad y sexo, a menos que se implante un marcapasos8, 68, 69.
La evolución natural del bloqueo AV de segundo grado tipo II se caracteriza por una tasa elevada de progresión al bloqueo AV completo. Estos pacientes presentan una tasa de supervivencia a 5 años significativamente inferior a la de los pacientes a los que se ha implantado un marcapasos para un bloqueo AV de segundo grado68, 77.
En ausencia de marcapasos, los pacientes con un bloqueo AV completo adquirido tienen muy mal pronóstico, con unas tasas de supervivencia a 1 año de tan sólo un 50-70% (en comparación con una población de control igualada en cuanto a edad y sexo) después de haber sufrido un síncope a causa de un bloqueo AV completo8, 42, 78, 79, 80, 81.
El pronóstico de los pacientes con bloqueo AV congénito depende en gran parte de la presencia de una cardiopatía congénita y el momento en que se realice el diagnóstico66. El pronóstico del bloqueo cardiaco completo congénito aislado es más favorable que el de los pacientes que presentan al mismo tiempo una cardiopatía estructural10, 81. Sin embargo, la estabilidad de los ritmos de escape y la incidencia de síncope son impredecibles. Debe considerarse seriamente el uso de un marcapasos cardiaco incluso en pacientes asintomáticos cuando hay un bloqueo AV congénito aislado71, 72, 73. La aparición de arritmias ventriculares complejas también puede motivar la implantación de un marcapasos en individuos asintomáticos.
Anomalías de la conducción intraventricularLas anomalías de la conducción intraventricular incluyen el bloqueo de la rama derecha del haz, de la rama izquierda del haz o el fascicular o combinaciones de ellos. Se observan con frecuencia en los ECG periódicos de pacientes ancianos, pero pueden darse también en pacientes de menos edad como observación aislada o de forma asociada a una miocardiopatía dilatada. Su incidencia se ha estimado en un 11% en los varones y en un 5% en las mujeres de más de 60 años, según un análisis del estudio de Framingham82, y está aumentando con la edad.
Fisiopatología de las anomalías de la conducción intraventricularLas anomalías de la conducción intraventricular y los bloqueos de ramas del haz pueden deberse a isquemia, como ocurre en el infarto de miocardio o tras la cirugía cardiotorácica, o pueden ser inducidos mecánicamente tras la cirugía de sustitución de la válvula aórtica (en la mayor parte de los casos) o tras un implante de válvula aórtica percutáneo. También pueden ser consecuencia de la cirugía en las cardiopatías congénitas. El bloqueo de rama izquierda del haz (BRIH), que se define por una prolongación del QRS por encima de 0,11 s junto con un retraso de la deflexión intrínseca en las derivaciones V5 y V6 de más de 60 ms, además de ausencia de ondas Q septales en las derivaciones I, V5 y V6, a menudo se produce en asociación con miocardiopatía dilatada. Sin embargo, la mayoría de los casos de bloqueo de rama del haz crónicos son idiopáticos y parecen asociarse a una fibrosis del sistema de conducción, aunque hay pocos estudios en que se haya investigado la fisiopatología subyacente.
Pronóstico de las anomalías de la conducción intraventricularEl bloqueo de rama del haz (en especial el BRIH) y el bloqueo bifascicular se asocian generalmente a una mortalidad superior a la de los controles igualados por edad y sexo, pero algunos trastornos como el bloqueo de rama derecha del haz aislado se consideran benignos42. La mayor mortalidad se explica más por la cardiopatía asociada, sobre todo de enfermedad coronaria, que por las anomalías de la conducción83, 84, 85. Sin embargo, el BRIH puede ser de por sí una causa o un factor agravante de la insuficiencia sistólica ventricular izquierda a causa de la reducción de la función de bombeo producida como consecuencia de la activación eléctrica asincrónica de los ventrículos en el BRIH. En algunos casos, el BRIH puede ser el primer signo del desarrollo de una miocardiopatía dilatada latente86.
La incidencia anual de progresión a un bloqueo AV avanzado o completo y, por lo tanto, el riesgo de muerte por bradiarritmia son bajos42, 87, 88, 89. El síncope y la muerte parecen ser más frecuentemente consecuencia de taquiarritmias o infarto de miocardio que de la anomalía de la conducción en sí87.
Diagnóstico de las anomalías de la conducción intraventricularEl ECG y el ECG Holter (en el retraso de la conducción intermitente) aportan la información necesaria para identificar el tipo de retraso de la conducción. En los pacientes con retraso de la conducción intraventricular y antecedentes de síncope, los estudios electrofisiológicos invasivos pueden ser útiles. Si el intervalo HV es de más de 100 ms, debe considerarse la posibilidad de implantar un marcapasos17, 42. Según la guía de la ESC de 2007, el estudio electrofisiológico también es patológico si la administración intravenosa de ajmalina pone al descubierto un bloqueo de His-Purkinje de alto grado42. Sin embargo, no se comenta la relevancia de la exposición a ajmalina en la práctica clínica.
Además, en todo paciente con un bloqueo de rama del haz debe evaluarse la posible presencia de una cardiopatía estructural subyacente, dada las elevadas incidencias de enfermedad coronaria y cardiopatía hipertensiva. En general, la incidencia es mayor con el BRIH que con el de rama derecha.
Tratamiento de las anomalías de la conducción intraventricularDada la baja incidencia de bloqueo AV completo, los pacientes asintomáticos con un bloqueo aislado de rama derecha, izquierda o bifascicular, con o sin bloqueo AV de primer grado, lo que a menudo se denomina erróneamente bloqueo «trifascicular», no requieren un marcapasos cardiaco permanente. Según la guía de la ESC, se debe implantar un marcapasos cardiaco a los pacientes con un bloqueo trifascicular verdadero (es decir, un bloqueo alternante de las ramas del haz), un bloqueo bifascicular crónico o un bloqueo AV de segundo grado Mobitz II o un bloqueo AV completo intermitente. En la Tabla 5 se presentan las recomendaciones detalladas.
Tabla 5. Recomendaciones para el uso de marcapasos cardiacos en el bloqueo bifascicular y trifascicular crónico, según la guía de 2007 de la Sociedad Europea de Cardiología 42
| Indicación clínica | Clase | Nivel de evidencia |
| 1. Bloqueo auriculoventricular de tercer grado intermitente | I | C |
| 2. Bloqueo auriculoventricular de segundo grado Mobitz II | ||
| 3. Bloqueo de rama alternado | ||
| 4. Resultados del estudio electofisiológico indicativos de un intervalo HV marcadamente prolongado (≥ 100 ms) o bloqueo infrahisiano inducido por el marcapasos en pacientes con síntomas | ||
| 1. Síncope que no se ha demostrado que se deba a un bloqueo auriculoventricular cuando se han descartado otras causas probables, y específicamente la taquicardia ventricular | IIa | B |
| 2. Enfermedades neuromusculares (p. ej., distrofia muscular miotónica, síndrome de Kearns-Sayre, etc.) con cualquier grado de bloqueo fascicular | IIa | C |
| 3. Observación incidental en un estudio electofisiológico de un intervalo HV marcadamente prolongado (≥ 100 ms) o bloqueo infrahisiano inducido por el marcapasos en pacientes sin síntomas | IIa | C |
| 1. Bloqueo de rama del haz sin bloqueo auriculoventricular o síntomas | III | B |
| 2. Bloqueo de rama del haz con bloqueo auriculoventricular de primer grado sin síntomas |
Además de las bradiarritmias, en los pacientes con BRIH y miocardiopatía dilatada se debe evaluar la posible conveniencia de un tratamiento de resincronización cardiaca.
Bradiarritmias asociadas a infarto agudo de miocardioLas bradiarritmias aparecidas en el contexto de un infarto agudo de miocardio son frecuentes y se deben a anomalías en la formación del impulso o en su conducción90. La bradicardia sinusal es uno de los más frecuentes trastornos del ritmo relacionados con el infarto de miocardio, sobre todo en los casos de afección de la coronaria derecha (alrededor del 30-40%)91, 92. Las principales anomalías de la conducción asociadas al infarto de miocardio son los trastornos de la conducción AV e intraventriculares42. A pesar de la introducción de nuevas técnicas, como la trombolisis y la intervención coronaria percutánea, la incidencia de trastornos de la conducción intraventricular no se ha modificado significativamente. Sin embargo, la incidencia absoluta del bloqueo AV se ha reducido, aunque sigue siendo alta42, 93, 94, 95, 96, 97. El bloqueo AV se produce en un 6-7%93 de los casos de infarto agudo de miocardio y se asocia con frecuencia 2-3 veces mayor al infarto de cara diafragmática que al de cara anterior94, 95, 98. Los retrasos de la conducción intraventricular son transitorios en hasta un 18% de los pacientes y en aproximadamente un 5% son persistentes42, 99.
Fisiopatología de las bradiarritmias asociadas a infarto agudo de miocardioLos mecanismos fisiopatológicos que subyacen a la mayor parte de las bradiarritmias aparecidas en el infarto de miocardio son: isquemia reversible, necrosis irreversible del sistema de conducción u otros trastornos como la alteración de la función del sistema autónomo a causa de, por ejemplo, aumento del tono parasimpático, alteraciones electrolíticas, hipoxia sistémica o aumentos locales de la adenosina90, 94, 100. Según indican los estudios histológicos, la necrosis, es decir, la lesión estructural obvia del sistema de conducción, parece ser muy poco común y suele deberse a un infarto de miocardio de cara anterior extenso, con necrosis del tabique101, 102.
Tratamiento de las bradiarritmias asociadas a infarto agudo de miocardioEl tratamiento agudo del bloqueo AV de grado alto sintomático incluye la administración de fármacos intravenosos como la atropina o un marcapasos cardiaco temporal. Rara vez se necesita implantar un marcapasos cardiaco permanente en el infarto agudo de miocardio, sobre todo en casos de infarto de cara diafragmática, ya que el bloqueo AV de verdad persistente es muy poco común94, 103. Las recomendaciones de la ESC42 para el uso de marcapasos cardiacos permanentes son las siguientes:
1. Bloqueo cardiaco de tercer grado persistente, precedido o no por trastornos de la conducción intraventricular.
2. Bloqueo cardiaco de segundo grado tipo Mobitz II persistente, asociado a bloqueo de rama del haz, con o sin prolongación del intervalo PR.
3. Bloqueo cardiaco de segundo grado tipo Mobitz II o de tercer grado transitorio, asociado a bloqueo de rama del haz de nueva aparición.
El enorme problema que plantean las recomendaciones para el uso de marcapasos cardiacos en el infarto agudo de miocardio es la definición de «persistente». Según la guía de la ESC42, las alteraciones de la conducción son persistentes si no se resuelven tras más de 14 días. Sin embargo, esto ha sido y sigue siendo objeto de discusión.
Pronóstico de las bradiarritmias asociadas a infarto agudo de miocardioA pesar del uso del tratamiento trombolítico y de la intervención coronaria percutánea, el bloqueo AV y las alteraciones de la conducción intraventricular como complicaciones del infarto agudo de miocardio se siguen asociando a un riesgo elevado de mortalidad a corto plazo, sobre todo a 30 días42, 93, 94, 97, 98.
Conflicto de interesesNinguno.
Recibido 16 Enero 2012
Aceptado 20 Enero 2012
Autor para correspondencia: Abteilung für Rhythmologie, Department für Kardiologie und Angiologie, Universitätsklinikum Münster, Albert-Schweitzer-Campus 1, 48149 Münster, Alemania. Julia.Vogler@ukmuenster.de