El área de las intervenciones percutáneas en la cardiopatía estructural ha crecido de manera exponencial en los últimos años. Ello ha estimulado en paralelo el desarrollo de nuevos protocolos y tecnologías en el campo de la imagen para facilitar los procedimientos percutáneos. La fusión de imagen es una atractiva nueva tecnología que combina las posibilidades de 2 modalidades de imagen, lo cual tiene el potencial de mejorar la planificación y la seguridad de muchos de los procedimientos transcatéter habituales. En esta revisión se discuten conceptos básicos de fusión de imagen y se comentan las fortalezas y debilidades de las modalidades de fusión dinámica y estática. Se centra prioritariamente en la fusión de imágenes de ecocardiografía y fluoroscopia y en su aplicación a los procedimientos transcatéter.
Palabras clave
En la última década, el campo de las intervenciones percutáneas para la enfermedad cardiaca estructural ha tenido un crecimiento exponencial. Como consecuencia de los avances que se han producido tanto en la tecnología como en los métodos de intervención, actualmente hay múltiples intervenciones estructurales, como el reemplazo percutáneo de la válvula aórtica (TAVI), la reparación percutánea de la válvula mitral, el cierre de fugas paravalvulares, la oclusión de la orejuela auricular izquierda y otras muchas técnicas, que se llevan a cabo con frecuencia en laboratorios de cateterismo cardiaco en todo el mundo. Junto con estas técnicas mínimamente invasivas, ha surgido una mayor necesidad de una guía por imagen precisa antes de la intervención y durante ella en tiempo real, para facilitar las intervenciones de reparación seguras y exitosas sin disponer de la visualización directa que proporciona la cirugía cardiaca abierta. Uno de los retos clave de la visualización fluoroscópica durante las intervenciones estructurales cardiacas es correlacionar la anatomía del paciente con las proyecciones fluoroscópicas bidimensionales (2D). La fusión de imágenes constituye un avance tecnológico novedoso que permite la integración de imágenes muy detalladas de ecocardiografía, tomografía computarizada y cardiorresonancia magnética con la fluoroscopia. Esta revisión aborda los principios básicos de la imagen de fusión y también las aplicaciones clínicas específicas detalladas de la fusión de imágenes de ecocardiografía y fluoroscopia en diversas intervenciones percutáneas para trastornos estructurales cardiacos.
IMAGEN DE FUSIÓN: CONCEPTOS BÁSICOSA diferencia de la cirugía cardiaca abierta, las intervenciones estructurales percutáneas no permiten una visualización directa de la anatomía y la afección cardiacas, por lo que el éxito de la intervención depende de la guía de imagen. Las exploraciones de imagen óptimas para las cardiopatías estructurales proporcionan una imagen tridimensional (3D) que se corresponde con la anatomía patológica subyacente, lo que permite planificar la intervención, guiarla y evaluarla después. Tradicionalmente, la fluoroscopia 2D en una proyección fija ha sido el método principal de diagnóstico por imagen para los cardiólogos intervencionistas. La fluoroscopia muestra la posición y el trayecto de los catéteres y las guías de intervención en un campo de visión amplio. La fluoroscopia biplanar es útil porque aporta una segunda proyección 2D, generalmente en un plano ortogonal a la primera proyección, para guiar la navegación 3D dentro del sistema cardiovascular. La adición de una lumenografía con contraste permite delimitar la anatomía arterial coronaria y las cámaras cardiacas. Sin embargo, la fluoroscopia 2D en proyección fija tiene limitaciones en la caracterización del tejido blando y en la anatomía cardiaca compleja. Las limitaciones de la fluoroscopia 2D para las intervenciones estructurales pueden atenuarse combinando o «fusionando» la fluoroscopia con otras modalidades de diagnóstico por imagen que aportan una mejor caracterización de la anatomía y la resolución espacial. La imagen de fusión es la superposición de las imágenes adquiridas con diferentes modalidades de imagen y las mismas coordenadas espaciales. Este proceso de correlación se denomina «corregistro» o «registro de imagen». Se han desarrollado varios métodos de registro de imágenes que proporcionan una imagen de fusión para diversas intervenciones guiadas por imagen, como la radioterapia, la cirugía mínimamente invasiva y la radiología intervencionista1. Las imágenes de fusión o híbridas de fluoroscopia 2D en combinación con imágenes estáticas o dinámicas proporcionadas por la tomografía computarizada multicorte (TCMC), la resonancia magnética (RM) y la ecocardiografía transesofágica (ETE) se han utilizado con éxito para intervenciones cardiacas estructurales.
Imagen de fusión estática: «hoja de ruta»La imagen de fusión estática consiste habitualmente en el uso de conjuntos de datos 3D obtenidos antes de la intervención programada, que se fusionan con la fluoroscopia durante la intervención para obtener una «hoja de ruta» para ella. La modalidad de imagen de fusión utilizada con más frecuencia para este fin es la TCMC 3D-fluoroscopia. La descripción detallada del método de registro de imágenes para la técnica de fusión de TCMC 3D-fluoroscopia queda fuera del ámbito de esta revisión, pero este proceso utiliza algoritmos informatizados en combinación con un ajuste manual y emplea las regiones anatómicas de interés para registrar las imágenes de TCMC 3D con la fluoroscopia1. Actualmente hay sistemas de fusión de TCMC 3D-fluoroscopia disponibles para uso clínico (Syngo DynaCT, Siemens Healthcare, Erlangen, Alemania; HeartNavigator, Philips Healthcare, Andover, Massachusetts, Estados Unidos). Una vez registrados los conjuntos de datos de tomografía computarizada (TC), la «hoja de ruta» de TC 3D resultante puede superponerse en una pantalla de fluoroscopia 2D en tiempo real para que sirva de guía para la intervención2,3. La fusión de TCMC 3D-fluoroscopia se ha utilizado con éxito en múltiples intervenciones estructurales, como el cierre de fugas paravalvulares4,5, el TAVI3,6, la oclusión de la orejuela auricular izquierda7 y el implante de stents en venas pulmonares8.
Además de la fusión de TCMC 3D-fluoroscopia, se ha utilizado la angiografía rotacional (AR) para las cardiopatías congénitas y las intervenciones vasculares9-11. La angiografía rotacional utiliza una rotación del arco conjuntamente con una inyección de contraste sincronizada para generar múltiples series de datos 2D que permiten reconstruir una serie de datos volumétricos 3D9. La «hoja de ruta» de la AR 3D superpuesta puede seguir al arco durante la intervención o el arco puede seguir la manipulación de la imagen de la AR 3D. El uso de AR 3D como guía para la intervención se ha descrito en intervenciones sobre la válvula pulmonar12 y en la angioplastia con balón de la arteria pulmonar13. En las intervenciones de TAVI, se han utilizado reconstrucciones de AR 3D para determinar el ángulo de despliegue óptimo de la fluoroscopia 2D14, la medición de los anillos15, las alturas del óstium coronario16 y la evaluación de la expansión de las válvulas tras el implante17. Se ha demostrado que la fusión de AR 3D-fluoroscopia reduce el tiempo de fluoroscopia durante el implante de stents en la coartación de aorta en poblaciones pediátricas11.
La técnica de fusión de resonancia magnética-fluoroscopia es otro ejemplo de «hoja de ruta» para la intervención. Las imágenes de RM previas a la intervención se registran para la fluoroscopia mediante algoritmos informáticos en combinación con marcas de referencia y modificaciones manuales18,19. Entre los posibles beneficios que aporta la fusión de RM-fluoroscopia, se encuentra una reducción de la dosis de radiación ionizante y la capacidad de incorporar el movimiento cardiaco y respiratorio a las imágenes de RM previas a la intervención, lo cual puede mejorar la eficacia en la alineación de las imágenes durante la intervención20,21.
Aunque las técnicas de imagen de fusión estática tienen un enorme potencial para mejorar la planificación y la ejecución de las intervenciones para trastornos estructurales cardiacos, tienen también limitaciones por lo que respecta a la exactitud posicional y la supervisión de la intervención. Como ocurre con cualquier técnica de fusión de imágenes, existe la posibilidad de una mala alineación con la fluoroscopia 2D a causa de un error de registro. En un estudio de un método 2D-3D de fusión de RM-fluoroscopia que utilizaba marcadores internos para el registro de la imagen, se observó una mediana de error medido de 2,15 mm19. La mala alineación en el registro puede mitigarse en cierta medida manipulando las imágenes superpuestas y utilizando puntos de referencia anatómicos específicos. Sin embargo, dado que el volumen 3D de la técnica de fusión es una «hoja de ruta» estática, los cambios en la posición o el movimiento del paciente durante la intervención pueden introducir un nuevo error o amplificar la mala alineación del registro de imagen subyacente. El aumento de la velocidad de giro del arco, la sincronización con el ECG y los algoritmos informáticos pueden aportar una corrección razonable para el movimiento respiratorio o cardiaco periódico. Sin embargo, el movimiento anatómico no periódico que introduce la manipulación con dispositivos o catéteres rígidos y que se produce durante las intervenciones es una causa de error problemática y sin solución clara. Por último, aunque el uso de técnicas de fusión de imagen estática aporta una «hoja de ruta» para las intervenciones programadas, estas modalidades de imagen generalmente no proporcionan la posibilidad de evaluar de manera íntegra las complicaciones que se producen durante la intervención ni determinar los resultados después.
Imagen de fusión dinámica: ETE-fluoroscopiaLa modalidad de imagen ideal en las intervenciones percutáneas para cardiopatías estructurales sería la que proporcione una excelente caracterización de la anatomía en tiempo real junto con el seguimiento y la localización precisos de los dispositivos y catéteres. La ecocardiografía proporciona una visualización excepcional del tejido blando, así como información hemodinámica en tiempo real. Sin embargo, la ecocardiografía tiene un campo de visión limitado y los ultrasonidos pueden sufrir interferencias relacionadas con los dispositivos y catéteres de intervención. La fluoroscopia de rayos X proporciona un campo de visión amplio, con una excelente visualización de los dispositivos de intervención, pero carece de fidelidad en la caracterización de los tejidos blandos. La fusión de las imágenes de ecocardiografía y fluoroscopia aprovecha las características de ambas modalidades para optimizar las intervenciones de cardiopatías estructurales en el laboratorio de cateterismo cardiaco. La fusión y superposición de las imágenes de ETE sobre la proyección fluoroscópica proporciona una mejor apreciación de la orientación de los dispositivos o catéteres de intervención respecto a la anatomía cardiaca y permite una navegación y un despliegue del dispositivo más precisos.
Las soluciones iniciales para el registro de imagen de ecocardiografía-fluoroscopia se basaron en dispositivos de rastreo electromagnéticos22,23, que requerían aparatos adicionales y modificaciones de las plataformas de imagen existentes. Recientemente, se ha puesto en el mercado software (EchoNavigator-Philips Healthcare, Best, Países Bajos; TrueFusion-Siemens Healthineers, Erlangen, Alemania) que permite el registro automático de imágenes de ecocardiografía transesofágica 2D y 3D con la fluoroscopia de rayos X utilizando las plataformas de obtención de imagen existentes, sin necesidad de aparatos adicionales.
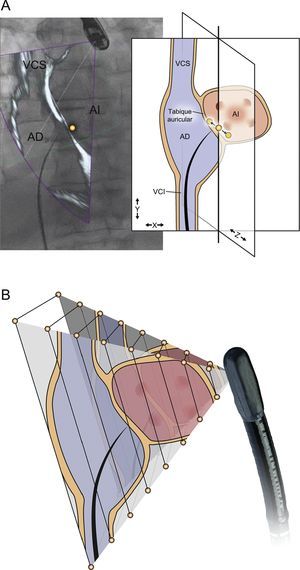
El proceso de registro de las imágenes requiere localizar y rastrear la posición de la sonda transesofágica dentro del campo de fluoroscopia de rayos X. Esta técnica se basa en una reconstrucción 3D del transductor de ETE creada a partir del conjunto de datos de TC de alta resolución (figura 1), lo cual permite que el sistema prediga la firma fluoroscópica del transductor de ETE en diversas posiciones. Se utiliza un algoritmo de registro de imagen 2D-3D para emparejar la firma fluoroscópica de la sonda de ETE con la firma de rayos X predicha según la reconstrucción 3D, lo cual permite que el sistema siga los movimientos del transductor de ETE en las dimensiones de traslación (posición de la sonda) y rotación (angulación de la sonda) durante la fluoroscopia activa. Este seguimiento facilita un registro continuo y automático de las imágenes y su superposición casi en tiempo real mientras se emplea la fluoroscopia25,26.
Estados del registro del transductor de ecocardiografía transesofágica (ETE). A: reconstrucción tridimensional de la punta de la sonda de ETE empleando el conjunto de datos de tomografía computarizada de arco de alta resolución. B: durante el registro, este conjunto de datos se emplea como plantilla y se empareja con la proyección radiográfica observada en la fluoroscopia. C: el registro de la punta de la sonda se muestra mediante una superposición en color en la que el verde indica un registro satisfactorio, el rojo indica un registro no satisfactorio (D) y el transparente indica un registro desconocido que se produce después de que la fluoroscopia haya estado inactiva durante varios segundos (E). Reproducido con permiso de Thaden et al.24. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
La exactitud del algoritmo 2D-3D depende del seguimiento preciso de la sonda de ETE con objeto de superponer correctamente el campo de visión de ecografía a la imagen de fluoroscopia. Los estudios preclínicos indicaban una mediana de error de registro de 2-4 mm en el plano de imagen de fluoroscopia del arco27,28. El error en el registro rotacional se amplifica al aumentar la distancia al transductor de ecografía, y en estudios previos se ha demostrado que una discordancia de 2° en el registro de imagen puede producir un aumento del error al doble, pasando de 1,7 mm a 5 cm de profundidad de los ultrasonidos a 3,5 mm a 10 cm (figura 2)25. El error por mala alienación (error de traslación) en el registro de imagen es generalmente más importante en la dirección del haz de rayos X y puede acentuarse al usar solo una imagen de rayos X monoplanar para el registro de la sonda de ETE (figura 2). La exactitud del registro de imagen mejora empleando múltiples (como mínimo 2-3) imágenes fluoroscópicas secuenciales de la sonda de ETE a diferentes ángulos del arco. A pesar de estas limitaciones, los estudios de viabilidad iniciales demostraron una exactitud aceptable a una profundidad de imagen de ecocardiografía de unos 5-6 cm25, aunque será necesaria una validación adicional para los sistemas disponibles para uso clínico.
Posibles causas de inexactitud del registro. Los errores en el registro pueden producirse en la dimensión traslacional (A) o en la dimensión rotacional (B). La máxima exactitud del registro es la del plano de la imagen fluoroscópica (A, plano X-Y), pero este método de registro es vulnerable al error en la dirección del haz de fluoroscopia (A, dimensión Z). Este error puede atenuarse si se emplean múltiples ángulos de registro B: un error en el registro rotacional por el que la magnitud del error aumenta según se mueve del campo ecocardiográfico cercano al campo lejano. AD: aurícula derecha; AI: aurícula izquierda; VCI: vena cava inferior; VCS: vena cava superior. Reproducido con permiso de Thaden et al.24.
Los sistemas actualmente disponibles permiten la fusión en vivo de imágenes de ecocardiografía 2D, 3D y Doppler color con imágenes de fluoroscopia simultáneas. Otra característica importante de la fusión de imagen de ecocardiografía-fluoroscopia es la capacidad de identificar estructuras anatómicas o puntos de referencia en el campo de visión ecográfico y documentar luego su ubicación en la imagen de fluoroscopia. Estos puntos anotados pueden usarse después como marcas de referencia durante la intervención. La creación de marcas de referencia requiere un registro de imagen de ecocardiografía-fluoroscopia tal como ya se ha descrito, y lo ideal es que la imagen del transductor de la sonda de ETE se obtenga en 3 ángulos de fluoroscopia (de ser posible, 45° oblicuo anterior izquierdo, 0° y 45° oblicuo anterior derecho) para optimizar la exactitud del registro. Las marcas de referencia continuarán siendo exactas con el movimiento horizontal de la mesa de intervención, pero la exactitud puede afectarse con el movimiento vertical (hacia arriba o hacia abajo) de la mesa de intervención o al cambiar la posición del paciente en ella.
Imagen de fusión dinámica frente a estáticaLas técnicas de fusión de imágenes dinámicas y estáticas tienen diferentes puntos fuertes y débiles. La técnica de ETE-fluoroscopia, como modalidad de imagen en tiempo real, proporciona imágenes dinámicas que ilustran los cambios que se producen en la anatomía durante la intervención. Por ejemplo, la fusión de ETE-fluoroscopia puede ilustrar la distorsión no periódica durante la intervención de la anatomía cardiaca subyacente, a causa de dispositivos y catéteres rígidos, lo cual aporta al operador una retroalimentación importante. Además, las técnicas de imagen de ETE-fluoroscopia proporcionan un seguimiento de las complicaciones de la intervención que son difíciles de evaluar con la fluoroscopia 2D sola y permiten realizar una evaluación completa de los resultados de la intervención. Las ventajas de la ETE en cuanto a la visualización de los tejidos y la evaluación hemodinámica permiten al equipo de intervención evaluar el éxito de esta en tiempo real, mientras el paciente se encuentra en el laboratorio de cateterismo. Sin embargo, la ETE tiene limitaciones respecto al campo de visión y la resolución de las imágenes 3D. Comparativamente, las modalidades de fusión estáticas como la TCMC y la RM proporcionan imágenes 3D de alta resolución con campos de visión anchos. Además, las reconstrucciones de AR 3D aportan una excelente visualización de la anatomía vascular compleja, en especial por lo que respecta a las estructuras anteriores, que pueden ser difíciles de visualizar con la ETE.
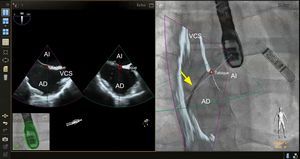
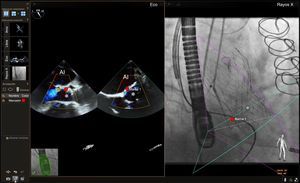
IMÁGENES DE FUSIÓN DE ETE-FLUOROSCOPIA ESPECÍFICAS PARA CADA INTERVENCIÓNPunción transeptalLa capacidad de realizar una punción transeptal en una localización precisa continúa siendo una etapa crítica para una lista cada vez mayor de intervenciones percutáneas para cardiopatías estructurales. Ya se ha descrito la fusión de imágenes de ecocardiografía-fluoroscopia para este fin24,29-32. Los datos iniciales indican que, en manos de operadores experimentados, la fusión de imágenes de ecocardiografía-fluoroscopia es segura y puede reducir el tiempo necesario para realizar con éxito una punción transeptal30. La imagen de fusión proporciona simultáneamente visualización del tabique auricular y el tejido blando circundante, que se observan mejor mediante ecocardiografía (modalidades de imagen 2D y 3D), junto con los dispositivos y catéteres, que se observan mejor con fluoroscopia (figura 3). La localización óptima de la punción transeptal puede identificarse mediante ecocardiografía. Se puede situar marcas de referencia en el lugar de interés de la imagen de ecocardiografía y trasponerlas automáticamente al «espacio fluoroscópico» (figura 3), con lo que se facilita una localización más precisa del lugar de punción transeptal en la imagen de fluoroscopia. En el futuro, la incorporación de los modelos 3D a la imagen de fusión permitiría una mejor planificación previa a la intervención y una localización más precisa del lugar de punción transeptal basada en la anatomía específica del paciente.
Imagen de fusión ecocardiografía-fluoroscopia para la punción transeptal. El panel de la izquierda muestra una ecografía transesofágica biplanar típica, en la que se aprecia el eje superoinferior (imagen de la izquierda, proyección bicava) y el eje anteroposterior (imagen de la derecha). En el panel de la derecha, la proyección bicava obtenida en la ecocardiografía transesofágica se superpone a la imagen fluoroscópica en vivo para producir la fusión de ecocardiografía y fluoroscopia. La totalidad del catéter transeptal (flecha amarilla) se visualiza bien mediante la fluoroscopia, pero no se aprecia bien en la ecocardiografía bidimensional. La fusión de las imágenes de ecocardiografía y fluoroscopia proporciona una visualización simultánea del catéter transeptal y la anatomía relevante de los tejidos blandos aportada por la ecocardiografía en una sola imagen y orientación. En este caso, también se colocó en el espacio ecocardiográfico una marca de referencia empleando ecografía biplanar (círculos rojos, imagen de la izquierda) y esta marca se transfirió automáticamente al espacio fluoroscópico (círculo rojo, imagen de la derecha). AD: aurícula derecha; AI: aurícula izquierda; VCS, vena cava superior. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
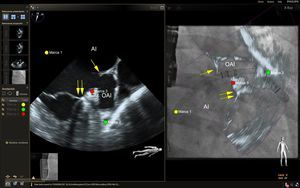
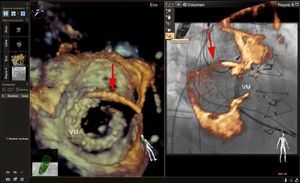
La imagen de fusión ecocardiografía-fluoroscopia en vivo parece prometedora para guiar la intervención de oclusiones de la orejuela de la aurícula izquierda33. Los catéteres, las guías y el dispositivo de oclusión se visualizan bien mediante fluoroscopia, y la adición de la anatomía de los tejidos blandos obtenida con la ecocardiografía haría posible reducir los tiempos de fluoroscopia y mejorar la seguridad, aunque no hay datos que lo respalden. Después de la punción transeptal, se ha observado que un ángulo multiplanar de ecocardiografía transesofágica de 70-90° suele ser suficiente para visualizar simultáneamente el anillo mitral, la orejuela auricular izquierda, el borde de cumadina y la vena pulmonar superior izquierda en proyección de fluoroscopia oblicua anterior derecha (figura 4). Esto proporciona la visualización simultánea del catéter y las guías mediante fluoroscopia y de la anatomía importante de tejidos blandos mediante ecocardiografía, lo cual facilita una canulación segura y eficiente de la orejuela auricular izquierda. Los marcadores anotados en la localización de la arteria coronaria circunfleja y el lóbulo más proximal de la orejuela auricular izquierda pueden ser útiles para orientar la profundidad de implante del dispositivo de oclusión. La futura incorporación de modelos 3D exactos de la orejuela auricular izquierda podría ser útil para planificar y localizar la mejor localización de la punción transeptal de manera más precisa, con objeto de asegurar la alineación coaxial del dispositivo de oclusión con el eje largo de la orejuela auricular izquierda.
Imagen de fusión ecocardiografía-fluoroscopia para la oclusión de la orejuela auricular izquierda. En el panel izquierdo se muestra una proyección mesoesofágica de la orejuela auricular izquierda a un ángulo multiplanar de 73°. En esta proyección se observa también el borde de cumadina (flecha simple) y el anillo mitral (flechas dobles). En el panel de la derecha se muestra una imagen de fusión ecocardiografía bidimensional (2D)-fluoroscopia desde un ángulo de fluoroscopia oblicuo anterior de 29°. El catéter guía se observa mediante la fluoroscopia, y se aprecia que atraviesa el lugar de punción transeptal (círculo amarillo), y la anatomía de los tejidos blandos pertinentes se aprecia mediante la ecocardiografía que se fusiona casi en tiempo real (panel de la derecha). Se colocaron marcas de referencia en el lugar óptimo de punción transeptal (círculo amarillo), la arteria coronaria circunfleja izquierda (círculo rojo) y la punta de la orejuela auricular izquierda (círculo verde). Obsérvese que, en la imagen de fusión de la derecha, el catéter guía aparece apoyado en la punta de la orejuela auricular izquierda cuando se examina la superposición de la imagen de ecocardiografía 2D. Sin embargo, esto se debe al escorzo de la orejuela, ya que el vértice real de esta quedaba fuera del plano de imagen 2D. La verdadera punta de la orejuela auricular izquierda, marcada con el círculo verde, está en una posición más distal de lo que podría parecer con la imagen 2D sola. AI: aurícula izquierda; OAI: orejuela auricular izquierda. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
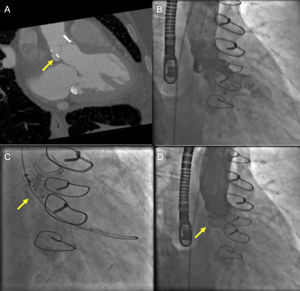
Las técnicas de fusión de imágenes de ecocardiografía y fluoroscopia pueden facilitar la reparación percutánea de una regurgitación paravalvular. En nuestra práctica clínica, la TCMC sin fusión ha sido útil en la planificación previa a la intervención para el cierre de la regurgitación paravalvular aórtica (figura 5). La colocación de marcas de referencia o las imágenes 2D y de Doppler color superpuestas pueden facilitar la canulación de los defectos paravalvulares aórticos complejos (figura 6). Los marcadores anotados pueden ser de especial utilidad en caso de que el defecto paravalvular sea pequeño o se utilice un abordaje retrógrado (ventricular izquierdo) para un defecto paravalvular mitral. En los ejemplos previos, el defecto y la guía de canulación pueden no visualizarse usando solo ecocardiografía 3D. Una de las limitaciones de los sistemas actualmente existentes es el carácter estático de las marcas de referencia24, que puede limitar su utilidad cuando haya movimiento del anillo mitral o aórtico en el plano de la imagen.
Tomografía computarizada (TC) cardiaca y fluoroscopia para guiar el cierre de una fuga paravalvular aórtica. A: angio-TC cardiaca sincronizada que muestra un defecto paravalvular aórtico posterior (flecha) en proyección caudal oblicua anterior derecha. B: angiografía aórtica que muestra una fuga paravalvular moderada. C: empleando el ángulo fluoroscópico derivado de la TC, se realiza el cierre de la fuga paravalvular mediante técnica de guía de ancla con colocación de un Amplatzer Vascular II Plug (flecha). D: la angiografía aórtica posterior al implante del dispositivo (flecha) no muestra regurgitación aórtica residual.
Imagen de fusión ecocardiografía-fluoroscopia para el cierre de una fuga valvular aórtica. En el panel de la izquierda se muestra la ecocardiografía biplanar con imágenes de Doppler color que permiten visualizar el chorro de regurgitación paravalvular en proyecciones de eje largo y eje corto simultáneamente. Esto facilita localizar con precisión el origen del chorro para colocar una marca de referencia en el espacio ecocardiográfico (punto rojo). En este caso, se observa un chorro de regurgitación paravalvular aórtica moderado en la parte posterior (imagen de flujo de color azul). En la imagen de fluoroscopia de la derecha, se aprecian mejor diversos catéteres y guías y la estructura del stent de la válvula aórtica percutánea (*). La marca de referencia en el lugar del chorro de regurgitación paravalvular se traspone al espacio fluoroscópico (punto rojo), lo cual facilita la canulación en este caso difícil. AI: aurícula izquierda. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Además, se ha observado que, en circunstancias específicas, la adición de datos extraecocardiográficos o fluoroscópicos puede motivar una distracción; estas circunstancias se dan de manera característica cuando todas las estructuras de interés se observan bien con una sola modalidad de imagen, lo cual hace innecesaria la fusión de imágenes. Para guiar el cierre de una regurgitación paravalvular mitral, habitualmente se facilita la canulación del defecto paravalvular empleando ecocardiografía 3D con una imagen frontal de la prótesis mitral. Esto suele ser suficiente para visualizar el catéter, la guía y el lugar de la regurgitación paravalvular. En nuestra opinión, agregar una imagen de fusión ecocardiografía-fluoroscopia no es necesaria en todos los casos y a veces los datos ecocardiográficos pueden oscurecer los catéteres, las guías y las prótesis mitrales, que se observan bien con la fluoroscopia sola (figura 7). En tales casos, el uso en vivo de la ecocardiografía 3D en tándem con imágenes de fluoroscopia sin fusión, con o sin un marcador anotado en el lugar de la regurgitación paravalvular, resulta más útil.
Imagen de fusión ecocardiografía-fluoroscopia para el cierre de una fuga valvular mitral. En el panel de la izquierda se muestra una imagen de ecocardiografía tridimensional (3D) de una válvula mitral bioprotésica desde la perspectiva de la aurícula izquierda. Se observa un catéter guía (flecha roja) que atraviesa el tabique auricular y que se ha canulado un defecto paravalvular anterolateral. En el panel de la derecha se muestra una proyección fluoroscópica oblicua anterior derecha de la válvula mitral bioprotésica con imágenes de ecocardiografía 3D superpuestas (grosor de corte parcial). La superposición de la información ecocardiográfica con la información fluoroscópica parece exacta, pero el artefacto de blooming de la ecocardiografía 3D, el ruido ecocardiográfico y la información adicional de tejidos blandos procedente de la serie de datos de ecocardiografía 3D oscurecen la proyección fluoroscópica del catéter guía y la válvula mitral bioprotésica. En nuestra experiencia, con un abordaje anterógrado de estos defectos, la ecocardiografía 3D combinada con la fluoroscopia sin fusión suele ser suficiente para guiar la intervención. La adición de una marca de referencia en el lugar del defecto paravalvular puede ser útil, en especial en casos de que el defecto sea pequeño y no se observe bien en la ecocardiografía 3D. VM: válvula mitral bioprotésica. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Se dispone de datos iniciales que demuestran la seguridad y la eficacia de la imagen de fusión ecocardiografía-fluoroscopia como guía para la reparación percutánea de la válvula mitral con el dispositivo MitraClip (Abbott Vascular)34. La guía por imagen para la reparación percutánea de la válvula mitral continúa siendo difícil debido a la complejidad de la anatomía de la válvula mitral y la precisión que es necesaria en la punción transeptal y la colocación del clip. Dadas estas dificultades, la imagen de fusión ecocardiografía-fluoroscopia podría mejorar la seguridad y la eficacia de esta compleja intervención. Sin embargo, falta consenso respecto a cómo se utiliza mejor la imagen de fusión para facilitar la reparación percutánea de la válvula mitral, y hay pocos datos que evalúen su repercusión en los resultados.
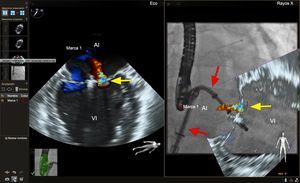
En nuestra experiencia, el uso de marcas de referencia para la localización de la punción transeptal y la vena pulmonar superior izquierda puede ser útil para confirmar rápidamente la posición de la guía durante la intervención empleando solo imágenes de fluoroscopia (figura 8). Uno de los pasos críticos en esta intervención es ajustar la trayectoria del clip para asegurar que la fijación se produzca en el lugar de regurgitación mitral. A menudo esto se visualiza bien combinando ecocardiografía 2D y 3D, por lo que esta sigue siendo el método principal de visualización. Sin embargo, en determinados casos, cuando la calidad de la imagen sea subóptima o haya una sombra importante del catéter guía, el uso de marcas de referencia o la imagen de fusión en vivo superponiendo imágenes 2D-Doppler color o 3D puede ser útil para dirigir el clip al lugar de la regurgitación (figura 8).
Imagen de fusión ecocardiografía-fluoroscopia para la reparación percutánea de la válvula mitral (MitraClip). En el panel de la izquierda se muestra una proyección comisural de la válvula mitral con imágenes de Doppler color que muestran el origen del chorro de regurgitación mitral (flecha amarilla). En el panel de la derecha se muestra una proyección oblicua anterior derecha del catéter guía y el dispositivo MitraClip con fusión en vivo de la imagen de ecocardiografía Doppler color bidimensional en el lado izquierdo. Obsérvese que las posiciones del catéter guía y el dispositivo no se aprecian bien en la imagen de ecocardiografía de la izquierda. La imagen de fusión ecocardiografía-fluoroscopia del lado derecho muestra el catéter guía y su posición respecto al chorro de regurgitación, lo cual facilita ajustar con precisión la posición del clip o la colocación de un segundo clip. AI: aurícula izquierda; VI: ventrículo izquierdo. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
La imagen de fusión en vivo tiene la ventaja de que es dinámica y sensible al movimiento en la región de interés. Por ejemplo, la afección de las valvas mitrales cambia de posición con la respiración, los cambios del ciclo cardiaco, los cambios de posición del paciente y a causa de la tensión a que los catéteres y dispositivos someten a los tejidos. La imagen de fusión en vivo continúa siendo exacta, con independencia de estos cambios debido a su carácter dinámico, y responde casi en tiempo real. En cambio, las marcas de referencia son estáticas y, si la posición de los cambios patológicos relevantes se modifica a causa de cualquiera de los factores mencionados, pueden dejar de estar correlacionadas con la anatomía o la estructura de interés.
Reemplazo percutáneo de la válvula aórticaSe ha demostrado que el TAVI es una alternativa razonable al reemplazo quirúrgico para grupos de pacientes seleccionados35-40, y esta técnica se ha integrado rápidamente a la práctica clínica en los últimos años. La guía por imagen utilizada para el TAVI varía entre los distintos centros, pero habitualmente se basa en fluoroscopia en combinación con ecocardiografía transtorácica o transesofágica41. También se emplea con frecuencia la TC cardiaca antes de la intervención para determinar el tamaño del anillo aórtico, lo cual hace que la imagen de fusión TC-fluoroscopia sea una opción atractiva si se dispone de ella, aunque tiene también la limitación de que no es una técnica dinámica en vivo. La imagen de fusión ETE-fluoroscopia puede ser útil en algunos casos, ya que se aprecia mejor la posición de la guía y el dispositivo (bien visualizado mediante fluoroscopia) respecto al ventrículo izquierdo, la raíz aórtica y la aorta ascendente (bien visualizada con ETE). También son pocos los datos que indican que la fusión de ETE-fluoroscopia puede ser útil para determinar el ángulo de despliegue óptimo mediante fluoroscopia42. Dado que el anillo aórtico también puede medirse con exactitud mediante la ETE 3D43,44, es posible un TAVI «sin contraste» para los pacientes con enfermedad renal significativa. Una limitación de la imagen de fusión ecocardiografía-fluoroscopia es que, en muchos centros, se realiza de manera recurrente solo la ecocardiografía transtorácica periintervención para el TAVI, y actualmente no hay ningún sistema que permita registrar conjuntamente y fusionar en vivo las imágenes transtorácicas y fluoroscópicas.
CONCLUSIONESEn los últimos años, el número y la complejidad de las intervenciones percutáneas para cardiopatías estructurales ha aumentado de manera significativa al tiempo que los protocolos y las técnicas de imagen continúan evolucionando en paralelo para facilitar estas intervenciones. Las técnicas de fusión de imágenes tienen un potencial único de combinar las ventajas de 2 modalidades de imagen para mejorar la planificación previa a la intervención y posiblemente aumentar la seguridad y la eficiencia de las intervenciones percutáneas. Los sistemas para imagen de fusión ETE-fluoroscopia actualmente existentes tienen como características únicas que proporcionan imágenes dinámicas en vivo, que responden a los cambios de la anatomía durante la intervención, lo cual permite al operador visualizar los catéteres y dispositivos (mediante fluoroscopia) y la anatomía de los tejidos blandos (mediante ecocardiografía) en la misma imagen y con la misma orientación. Es probable que nuestro uso de esta técnica continúe evolucionando en paralelo con los avances en los dispositivos y las intervenciones en el campo de las intervenciones percutáneas para cardiopatías estructurales. Los futuros trabajos deberán centrarse en la seguridad y el valor adicional aportado por el uso de esta nueva y atractiva tecnología.
CONFLICTO DE INTERESESNo se declara ninguno.