Tras su introducción hace unos 15 años, la angiografía por tomografía computarizada se ha convertido actualmente en el instrumento clínico más exacto para la evaluación no invasiva de la aterosclerosis coronaria. Los importantes avances técnicos han conducido a un torrente continuo de nuevas aplicaciones clínicas junto con una reducción significativa de la dosis de exposición a la radiación. Los escáneres de tomografía computarizada de última generación (≥ 64 cortes) brindan la posibilidad de obtener imágenes de perfusión estáticas o dinámicas durante la aplicación de estrés mediante vasodilatadores coronarios (adenosina, dipiridamol o regadenosón), combinando la información funcional y anatómica en la misma exploración. En este artículo se examina el papel emergente y el estado actual de las imágenes de perfusión miocárdica con tomografía computarizada, y se ilustra con casos clínicos de la propia experiencia con un escáner de segunda generación de 128 cortes y doble fuente (Somatom Definition Flash, Siemens; Erlangen, Alemania). Se examinan los aspectos técnicos, el análisis de los datos, la exactitud diagnóstica, la dosis de radiación y las perspectivas futuras.
Palabras clave
En los últimos 15 años se ha asistido a diversos avances en la angiografía por tomografía computarizada (angio-TC) coronaria que la han convertido en uno de los instrumentos diagnósticos clave para la evaluación no invasiva de la aterosclerosis coronaria en pacientes con una probabilidad entre baja e intermedia de enfermedad coronaria (EC)1–4. La angio-TC coronaria muestra una elevada sensibilidad y un alto valor predictivo negativo para determinar la presencia de estenosis significativa (≥ 50% de reducción de la luz), que se aproximan al 100%1–4. Sin embargo, considerando tan solo las características morfológicas de las lesiones coronarias, no es posible determinar la trascendencia hemodinámica de las estenosis, especialmente las de grado intermedio (reducción de la luz del 40–70%), según indican los estudios de determinación invasiva de la reserva fraccional de flujo (RFF)5. El estudio de referencia FAME ha puesto de manifiesto que un abordaje mediante intervención coronaria percutánea guiada por la RFF es superior al tratamiento con una intervención coronaria percutánea basada solo en la evaluación angiográfica visual de las lesiones coronarias, con una mejora de los resultados clínicos y una repercusión económica positiva en cuanto a los costes de la asistencia sanitaria5. Hasta la fecha, los dos ensayos controlados y aleatorizados más amplios, COURAGE6 y BARI 2D7, no han podido demostrar que la intervención coronaria percutánea basada solo en un abordaje visual estándar sea superior al tratamiento médico óptimo para reducir la mortalidad o la recurrencia del infarto de miocardio. En consecuencia, estos estudios indican que la evaluación funcional de las lesiones coronarias puede ser útil para identificar a los pacientes que pueden obtener un efecto beneficioso con la revascularización en la EC estable. Además, los estudios que han correlacionado la información anatómica aportada por la angio-TC coronaria con la tomografía por emisión monofotónica (SPECT) han mostrado un valor predictivo positivo moderado (de alrededor del 50%) de la angio-TC para determinar la presencia de isquemia miocárdica inducible8,9. Por estas razones, en la práctica clínica, la información morfológica obtenida con angio-TC coronaria a menudo requiere una integración con las exploraciones de imagen funcionales, como la SPECT, la tomografía por emisión de positrones o la resonancia magnética (RM) en estrés farmacológico, con objeto de resaltar los defectos de perfusión que tienen repercusiones en el tratamiento y el pronóstico de los pacientes. Sin embargo, los escáneres de tomografía computarizada (TC) de última generación (≥ 64 cortes) permiten obtener imágenes de TC de perfusión (TCP) estáticas y dinámicas durante el estrés producido por agentes vasodilatadores coronarios (adenosina, dipiridamol o regadenosón), con lo que se combina la información funcional y anatómica en la misma exploración, lo cual es esencial para el tratamiento actual de los pacientes2,5. En este artículo se revisa el papel emergente y la situación actual de la TCP miocárdica con estrés farmacológico, y se ilustra con casos clínicos de la propia experiencia preliminar con un escáner de TC de doble fuente (TCDF) de segunda generación de 128 cortes (Somatom Definition Flash, Siemens; Erlangen, Alemania). Se examinan los aspectos técnicos, el análisis de los datos, la exactitud diagnóstica, la dosis de radiación y el posible papel futuro de esta innovación.
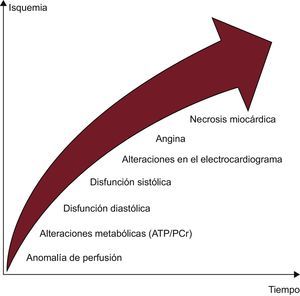
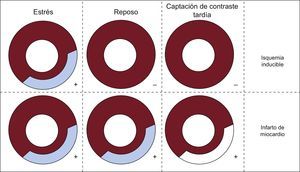
FISIOPATOLOGÍA DE LA ISQUEMIALa perfusión miocárdica es un proceso muy regulado, que se ve influido por numerosos factores, como los vasos epicárdicos, los vasos de resistencia y el endotelio10. En reposo, el porcentaje de extracción del oxígeno del miocardio es muy alto (75-80%) y, si la demanda aumenta, el miocardio es capaz de aportar un flujo sanguíneo coronario y un suministro de oxígeno crecientes10. La isquemia puede aparecer de forma secundaria a una reducción del flujo sanguíneo/presión de perfusión coronarios que no compensa el proceso de autorregulación, que es la capacidad de mantener una perfusión coronaria relativamente estable dentro de un amplio margen de presiones de perfusión, gracias a la dilatación de los vasos sanguíneos de resistencia. El flujo sanguíneo coronario en reposo no se afecta por una estenosis epicárdica de hasta un 85-90%, pero en presencia de una hiperemia máxima, se reduce cuando la estenosis es > 45%10. Además, el efecto fisiológico de una estenosis depende también del grado de compensación del lecho vascular microcirculatorio distal10,11. El proceso isquémico afecta inicialmente a la capa subendocárdica, con un frente endo-subpericárdico que origina una cascada de procesos fisiopatológicos, entre los que se encuentra la reducción de la perfusión como un cambio temprano (figura 1)10. Por esta razón, las pruebas de estrés para evaluar este parámetro son más sensibles a la hora de identificar las estenosis hemodinámicamente relevantes, en comparación con lo que proporciona el análisis de las anomalías del movimiento de la pared inducidas por el estrés o los cambios del electrocardiograma (ECG) por sí solos (figura 1)10.
MODALIDAD DE ADQUISICIÓNLas imágenes de TCP miocárdica de estrés pueden adquirirse en modo estático o dinámico. En las exploraciones de TCP estáticas, se adquieren las imágenes en una sola fase arterial durante el primer paso arterial del medio de contraste12. De entre las técnicas estáticas, la adquisición de energía dual (ED) recientemente introducida es una de las técnicas más prometedoras y consiste en el empleo de diferentes espectros de rayos X generados mediante diferentes voltajes del tubo13,14. La adquisición de las imágenes de TCP con resolución temporal dinámica permite captar múltiples fases consecutivas con contraste, a medida que el bolo transita por el miocardio, de manera similar a lo que se hace en la RM de estrés12. Calculando la curva de atenuación en el tiempo (CAT), la adquisición dinámica permite calcular los parámetros de perfusión utilizando para ello una modelización matemática9.
Adquisición estática monoenergéticaSe realiza una única adquisición arterial estacionaria de primer paso con contraste durante un estrés farmacológico. Así pues, la optimización de los momentos de captación de imágenes es crucial para obtener el conjunto de datos durante la máxima captación miocárdica de contraste15,16. Existen varias técnicas de adquisición con una reducción progresiva del perfil de dosis y la administración de medios de contraste: sincronización de ECG retrospectiva (con modulación prospectiva de la corriente del tubo)17,18, sincronización de ECG prospectiva19,20 y adquisición espiral de factor de paso alto activada por ECG prospectivamente, aplicada con un escáner de TCDF de 128 cortes de segunda generación21,22.
Adquisición estática con la técnica de energía dualLa técnica de ED permite el análisis cuantitativo evaluando la distribución del yodo durante la fase de primer paso de los medios de contraste, basándose en sus características de absorción de rayos X a diferentes ajustes del voltaje del tubo de rayos X (kV), que afectan a los niveles de energía de los rayos X23. La adquisición de ED puede realizarse con un escáner de TCDF con dos tubos que emiten simultáneamente un nivel de energía más alto (140–150 kV) y otro más bajo (80-90-100 kV)23,24. Un segundo enfoque consiste en utilizar un escáner de TC de una sola fuente con un cambio de voltaje rápido del tubo (de 80 a 140 kV) o en una rotación de una sola grúa (GSI Cardiac, GE Healthcare) o en rotaciones consecutivas (Acquilion One, Toshiba)9. Otra posibilidad que está todavía en estudio es el método de doble capa, con dos detectores superpuestos, hechos de materiales diferentes (prototipo de Philips Medical Systems)9.
La introducción de los escáneres de TCDF de segunda21 o tercera generación25 con alta resolución temporal (75 o 66ms respectivamente) puede superar los artefactos de movimiento cardiaco de la TCP de ED, sobre todo en pacientes con alta frecuencia cardiaca y gran variabilidad de la frecuencia cardiaca.
Adquisición de imágenes de tomografía computarizada de perfusión dinámicaLa adquisición dinámica en la TCP permite cuantificar el volumen y el flujo sanguíneo miocárdicos y determinar también otros parámetros hemodinámicos a través de cálculos matemáticos basados en la CAT9. La exploración de TCP dinámica requiere una resolución temporal lo suficientemente alta para obtener imágenes a las frecuencias cardiacas que se producen en estrés, así como un detector lo suficientemente amplio para visualizar la totalidad del miocardio en una sucesión rápida. Se puede llegar a cubrir la totalidad del corazón empleando un escáner de un solo tubo, con un sistema de TC de detector amplio de 256 cortes, manteniendo la mesa estacionaria con una cobertura de 78mm26, o empleando un escáner de TCDF en modo de lanzadera27,28. En este modo, la mesa avanza y retrocede en dos posiciones de examen alternas que cubren un total de 73mm27,28. El escáner de TCDF de tercera generación recién introducido, con 192 detectores, facilita una cobertura Z más amplia de 105mm, lo que permite estudiar también corazones más grandes o dilatados25. Para ambas modalidades (mesa estacionaria o modo lanzadera), los datos se adquieren durante aproximadamente 30 s a lo largo del acortamiento longitudinal sistólico del ventrículo izquierdo, en que el miocardio ventricular izquierdo es más grueso, lo cual proporciona un conjunto de datos más robusto para el análisis de la perfusión. La cantidad de medio de contraste administrado es generalmente de 50 ml, seguidos de 50 ml de suero fisiológico a una velocidad de 5–6 ml/s16,27.
PROTOCOLO DE EXPLORACIÓNLos protocolos combinados de TCP y angio-TC coronaria pueden realizarse con un protocolo de reposo/estrés o estrés/reposo. Ambas fases son necesarias para poder diferenciar con exactitud el miocardio isquémico y necrótico. En general, la evaluación estática de la perfusión en reposo se obtiene con la adquisición anatómica de los datos de las arterias coronarias; como alternativa, puede realizarse una adquisición dinámica de los datos de perfusión tanto en estrés como en reposo para las determinaciones cuantitativas de la reserva de flujo coronario28.
La adquisición de la TCP de estrés se realiza durante una vasodilatación arteriolar inducida farmacológicamente (mediante dipiridamol, adenosina o regadenosón) por mecanismos directos y mediados por el endotelio, con un aumento de 3,5 a 4 veces del flujo sanguíneo coronario10. La adenosina activa de modo no selectivo cuatro subtipos de receptores: A1, A2A, A2B y A3, de los cuales solo la activación del receptor A2A causa una vasodilatación de los lechos arteriales coronarios, aumenta el flujo sanguíneo miocárdico y causa una excitación simpática; la activación de los demás receptores produce efectos secundarios indeseables de corta duración29. El dipiridamol aumenta la concentración de adenosina endógena al reducir su captación por las células endoteliales10. Tanto la adenosina como el dipiridamol pueden causar un broncoespasmo a los pacientes con asma y enfermedad pulmonar obstructiva crónica, mientras que el regadenosón, un agonista selectivo de los receptores A2A recientemente introducido, puede usarse de manera segura en esos pacientes29. Otras contraindicaciones frecuentes son el bloqueo auriculoventricular grave sin marcapasos, la bradicardia sinusal, la hipotensión sistémica (presión arterial < 90mmHg) y la estenosis carotídea grave. Estos fármacos, al dilatar las arteriolas pequeñas de resistencia, reducen la presión de perfusión más allá de la estenosis y, al aumentar el flujo sanguíneo subepicárdico, inhiben el mecanismo de autorregulación (fenómeno de robo coronario transmural). Esto da lugar a una reducción progresiva del flujo distal a medida que aumenta la entidad de la estenosis10,12. Todos estos fármacos han mostrado buenas sensibilidad y especificidad: el dipiridamol tiene la ventaja de ser poco costoso, pero produce un efecto de vasodilatación más prolongado (varios minutos en vez de los pocos segundos que tiene el efecto con la adenosina), y ello requiere el empleo de un antagonismo con aminofilina (inyección intravenosa lenta de 50 a 250 mg)12. Las complicaciones son consecuencia de la vasodilatación sistémica (taquicardia, hipotensión, rubefacción, cefalea y mareo) y la inducción de isquemia miocárdica (dolor torácico, disnea, depresión del segmento ST), taquicardia ventricular o bloqueo auriculoventricular transitorio12,29. Se recomienda a los pacientes que, antes de la exploración, eviten las sustancias antagonistas, como las metilxantinas contenidas en productos como el café, el té, el chocolate, las bebidas energéticas o los broncodilatadores9. La dobutamina, un agonista sintético de los receptores β1 y β2, se emplea con frecuencia en la ecocardiografía de estrés para el análisis del movimiento de la pared, y actualmente no tiene aplicación clínica en la obtención de imágenes de TCP10,12.
Son necesarias dos vías de acceso intravenoso para la inyección del fármaco que produce el estrés y el medio de contraste. La adenosina se infunde a una velocidad estándar de 0,14mg/kg/min durante 3-5 min mediante una bomba de infusión, mientras que el dipiridamol se infunde a una dosis de 0,56-0,84mg/kg en 4-6 min10,12. Por el contrario, el regadenosón se puede administrar mediante una dosis única (400 μg)29. Durante la exploración, se mantiene una vigilancia constante de la frecuencia cardiaca empleando un ECG de 12 derivaciones, así como de la presión arterial y la saturación de oxígeno. Se pregunta repetidas veces al paciente por la posible aparición de síntomas de cualquier tipo, que generalmente desaparecen cuando se suspende la inyección del fármaco o se administra un antagonista.
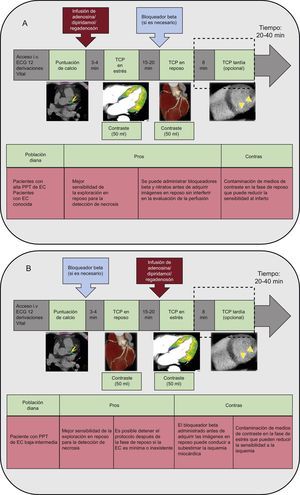
Se han propuesto y publicado varios protocolos que describen sus ventajas e inconvenientes (figura 2)9,12. El protocolo de TCP de estrés/reposo, que permite obtener una mayor sensibilidad en la detección de isquemia, debe usarse de manera preferente en los pacientes con alta probabilidad de EC pretest o EC conocida, para quienes la presencia de calcificaciones amplias, una enfermedad multivaso o antecedentes de implante de stents pueden reducir la exactitud de la angio-TC coronaria en la evaluación de la EC. Por el contrario, se debe optar por el protocolo de TCP de reposo/estrés como primera elección para los pacientes con probabilidad de EC pretest baja o intermedia, puesto que ello permite interrumpir el protocolo cuando se detecta una EC inexistente o mínima durante la fase de reposo, con objeto de reservar el estrés farmacológico para los pacientes con EC moderada o grave (figura 2)9,12.
Protocolos de perfusión miocárdica con tomografía computarizada de estrés en reposo (A) y reposo-estrés (B), con sus ventajas (pros) e inconvenientes (contras). EC: enfermedad coronaria; ECG: electrocardiograma; i.v.: intravenoso; PPT: probabilidad pretest; TCP: tomografía computarizada de perfusión.
Aunque se encuentra todavía en una fase experimental, puede añadirse una secuencia tardía a los 8–10 min sin inyección de más medio de contraste, con objeto de poner de manifiesto la presencia de una captación de contraste tardía en el miocardio, que indica miocardio no viable; se debe preferir los protocolos de bajo voltaje (70-80-90-100 kV) debido al espectro de atenuación de la TC característico del yodo, con una atenuación alta a energías fotónicas bajas23. Sin embargo, la obtención de imágenes con captación de contraste tardía no es imprescindible en la práctica clínica, debido a las relaciones de señal-ruido y contraste-ruido de la TC, comparativamente peores que las de la RM, y la dificultad de evaluar la extensión transmural del infarto12,24.
PROCESAMIENTO DE LOS DATOSAnálisis cualitativo y cuantitativo estáticoEl análisis cualitativo de la TCP de estrés se lleva a cabo mediante un análisis visual de las imágenes captadas en condiciones de estrés y de reposo utilizando un patrón de normalidad basado en la experiencia. Las imágenes se interpretan en función de la presencia, la localización y la extensión del defecto de perfusión utilizando planos estándar de eje largo y de eje corto del corazón30. Generalmente se prefiere la reconstrucción multiplanar gruesa, de aproximadamente 5–8 mm, para optimizar la relación contraste-ruido12,30. La evaluación cualitativa se puede facilitar por la evaluación de la atenuación miocárdica midiendo los niveles de densidad de señal dentro del miocardio. Para facilitar el análisis de la TCP, se ha aplicado un programa informático automático que utiliza un gráfico de «ojo de buey» del cociente de perfusión transmural (un cociente de los valores de atenuación del endocardio respecto a la media del epicardio), que es un índice semicuantitativo validado inicialmente para las imágenes de RM de estrés; sin embargo, esto parece ser poco fiable si hay antecedentes de infarto o artefactos de movimiento o endurecimiento del haz significativos30.
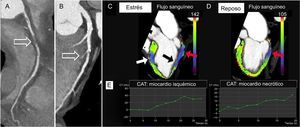
Además del análisis cualitativo, la técnica de ED permite también un análisis cuantitativo. A partir de los datos brutos de la exploración de ED, se extraen dos series de datos a voltajes diferentes, con lo que se obtiene un conjunto de datos fusionado que combina la reducción del ruido del nivel de energía alto (140-150 kV) con la alta resolución de contraste del nivel de energía bajo (80-90-100 kV); con ello se alcanza una mejor diferenciación entre el miocardio normal y el hipoperfundido23. Sacando partido de la información de la ED, se puede obtener un mapa de distribución del yodo con un código de colores (que constituye un marcador sustitutivo del aporte sanguíneo miocárdico) y superponerlo a la reconstrucción virtual sin contraste (figura 3)13,23. La técnica de ED permite cuantificar la de concentración de yodo por vóxel en el miocardio expresada en mg/ml (figura 3), un marcador sustitutivo del aporte sanguíneo miocárdico23. Además, dada su capacidad de generar reconstrucciones de imagen monocromáticas, se ha demostrado que la técnica de ED mitiga o incluso elimina los artefactos de endurecimiento del haz asociados a la geometría cardiaca y el medio de contraste yodado, que a veces se asemejan a defectos de perfusión y se observan con frecuencia en la pared posterobasal del ventrículo izquierdo9.
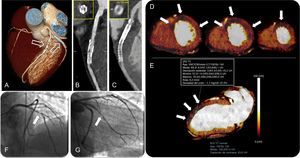
Volumen tridimensional obtenido mediante tomografía computarizada (A) en la que se observa un stent en el segmento medio de la arteria descendente anterior izquierda y un doble stent en la rama marginal obtusa principal proximal (fechas). Reformas de presentación planas curvadas de la arteria descendente anterior izquierda (B) y la rama marginal obtusa (C) con las correspondientes proyecciones perpendiculares, en las que se observa reestenosis en el stent. Los mapas miocárdicos de eje corto de distribución del yodo con código de colores de las imágenes de perfusión por tomografía computarizada de energía dual correspondientes a los segmentos medios a apicales muestran defectos de perfusión en las paredes anteroseptal, anterior, anterolateral y lateral, que corresponden a territorio de las arterias descendente anterior izquierda y circunfleja izquierda (D, flechas). El análisis cuantitativo del mapa de energía dual en la pared anterior (flechas) muestra una reducción del contenido de yodo del 37% respecto al del miocardio de una zona alejada en la pared inferior (E). La angiografía coronaria invasiva confirmó la reestenosis en el stent de la arteria descendente anterior izquierda (F, flecha) y la rama marginal obtusa (G, flecha). FA: fibrilación auricular; RF: radiofrecuencia; ROI: región de interés; TC: tomografía computarizada. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
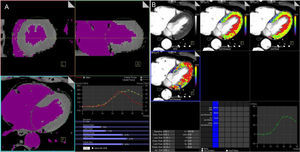
Las imágenes de TCP dinámicas permiten realizar un análisis de la perfusión que puede ser semicuantitativo o plenamente cuantitativo9. La medición semicuantitativa simple, de modo similar al de la perfusión de la RM de estrés, permite evaluar los parámetros cinéticos de flujo sanguíneo derivados de la pendiente de ascenso de la CAT (tiempo hasta el máximo, intensificación máxima, pendiente de ascenso y área bajo la curva)9,10,26,28. Dado que el análisis semicuantitativo solo requiere el cálculo de la parte de pendiente de ascenso de la CAT, se requiere menos tiempo para obtención de muestras, con la consiguiente reducción de la dosis de radiación. Por el contrario, la cuantificación absoluta de la perfusión miocárdica requiere una cobertura de primer paso completa del miocardio y se basa en un algoritmo dedicado que se ha utilizado anteriormente con éxito en estudios de RM9,10. Para el análisis cuantitativo empleando un escáner de TCDF, se utiliza una técnica de desconvolución paramétrica modificada, basada en un modelo bicompartimental de los espacios intravascular y extravascular, para el ajuste de la CAT9,28. El conjunto de datos de imágenes volumétricas (≈10-15 series de datos) se procesa usando un programa informático de perfusión comercial dedicado en una estación de trabajo estándar (Syngo VPCT body-myocardium, Siemens Healthcare; Erlangen, Alemania). Tras la doble obtención de muestras de la FEA (función de entrada arterial), el desarrollo matemático de la CAT permite el cálculo del flujo sanguíneo miocárdico (FSM), en ml/100 ml/min, y el volumen sanguíneo miocárdico (VSM), en ml/100 ml, de cada vóxel, lo cual genera una representación en un mapa tridimensional con códigos de colores (figura 4). El FSM y el VSM se calculan con las siguientes ecuaciones:
A: los conjuntos de datos de imágenes volumétricas dinámicas (≈ 10–15 series de datos), obtenidos con un escáner de segunda generación para tomografía computarizada de 128 cortes con doble fuente, se procesan con un programa informático de perfusión de volumen específico dedicado. El algoritmo utiliza una doble muestra de la función de entrada arterial procedente de regiones de interés que se han situado en la aorta descendente en el extremo craneal y caudal de las superposiciones de dos imágenes, y se combina en una sola función de entrada arterial que tiene el doble de frecuencia de muestreo de la curva de atenuación en el tiempo del tejido. B: para cada vóxel, se puede calcular el flujo sanguíneo miocárdico estimado (ml/100 ml/min) y el volumen sanguíneo miocárdico estimado (ml/100 ml) con la técnica de desconvolución paramétrica basada en un modelo bicompartimental de los espacios intravascular y extravascular para adaptarlo a la curva de atenuación en el tiempo. Se puede calcular otros parámetros hemodinámicos, como la constante de tránsito (Ktrans, ml/100 ml/min), que describe la permeabilidad mediante el cálculo de la transferencia de volumen entre el plasma sanguíneo y el espacio extravascular extracelular. La perfusión miocárdica se representa en un mapa tridimensional con códigos de color. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Actualmente existe un programa informático semiautomático que permite mostrar un gráfico polar del modelo de miocardio de la American Heart Association de 17 segmentos modificado, con unos tiempos de análisis notablemente reducidos y una mejora de la estandarización del análisis de perfusión.
INTERPRETACIÓN DE LAS IMÁGENESDe manera similar a lo que ocurre con la interpretación de las imágenes de SPECT y RM, la demostración de un defecto de perfusión en estrés, que es parcial o totalmente reversible en reposo, indica miocardio isquémico pero viable; por el contrario, un defecto que se corresponda en las imágenes de estrés y de reposo indica un defecto fijo compatible con necrosis miocárdica (figura 5)12,30. La técnica de TCP de ED, mediante la representación de la distribución estática del medio de contraste durante el marco temporal de la adquisición de imagen en un mapa tridimensional con código de colores13,23, muestra una reducción del contenido de yodo en el miocardio isquémico o necrótico en comparación con el miocardio de zonas distantes (figura 3).
Guía para el análisis de las imágenes de perfusión con tomografía computarizada. La demostración de un defecto de perfusión de estrés parcial o totalmente reversible en reposo indica miocardio isquémico pero viable (isquemia inducible); cuando el defecto de perfusión persiste en las imágenes obtenidas en reposo, indica infarto de miocardio.
La TCP de estrés dinámica muestra una reducción del FSM y el VSM en los segmentos que corresponden a los defectos de perfusión, debido a la isquemia inducible o el infarto (figura 6). Además, el análisis de la CAT permite diferenciar el miocardio isquémico del necrótico. El miocardio isquémico pero viable muestra una disminución del lavado interno con un retraso y una reducción de la captación máxima de contraste y un lavado externo conservado en comparación con lo que se observa en el miocardio distante, mientras que el miocardio necrótico muestra una reducción del lavado tanto interno como externo en las áreas de cicatrización y necrosis (figura 6). La integración del análisis de la TCP con los datos anatómicos coronarios es un paso crucial para la interpretación de las imágenes y permite determinar si un defecto de perfusión se corresponde con una región irrigada por una arteria coronaria estenótica, con lo que se determina la importancia hemodinámica de las lesiones coronarias (figura 6). Es importante tener presentes las variaciones existentes en la distribución del territorio vascular en la perfusión miocárdica, lo cual explica la variabilidad de la anatomía coronaria. Además, los defectos de perfusión reversibles pueden estar localizados en el territorio de distribución de arterias coronarias epicárdicas normales si hay una disfunción microvascular y/o endotelial10,11.
Reforma de presentación plana curvada que muestra una oclusión total crónica de la parte proximal-media de la arteria coronaria derecha (A, flecha) y una estenosis crítica (> 70%) del segmento medio de la arteria descendente anterior izquierda a causa de una placa aterosclerótica mixta que afecta a la segunda rama perforante septal (B, flecha). Las imágenes de perfusión por tomografía computarizada bicameral oblicuas y tridimensionales con códigos de color obtenidas en estrés (C) y en reposo (D) muestran un defecto de perfusión reversible en el territorio de la arteria descendente anterior izquierda (C: flecha blanca, parte media de la pared anteroseptal, código azul), que es compatible con isquemia inducida, y un defecto de perfusión fijo en el territorio de la arteria coronaria derecha (C y D: flechas rojas, parte proximal de la pared inferior, código azul-violeta), que indica necrosis miocárdica. Obsérvese también un defecto reversible en el territorio de la arteria coronaria derecha (C: flecha negra, parte media de la pared inferior, código azul) que indica isquemia periinfarto. Las correspondientes curvas de atenuación en el tiempo de los tejidos del miocardio isquémico (E, izquierda) y necrótico (E, derecha), que se encuentran respectivamente en la pared anteroseptal y la pared inferior, muestran una disminución del lavado interno con retraso y reducción de la captación máxima, sobre todo en el área de cicatrización. Durante el estrés, se observó una reducción significativa del flujo sanguíneo miocárdico y el volumen sanguíneo miocárdico del tejido necrótico (flujo sanguíneo, 50 ± 14ml/100 ml/min; volumen sanguíneo, 7 ± 2 ml/100 ml) e isquémico (flujo sanguíneo, 65 ± 15 ml/100 ml/min; volumen sanguíneo, 10 ± 2 ml/100 ml). CAT: curva de atenuación en el tiempo. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
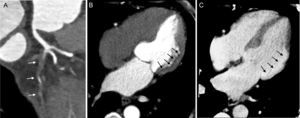
Los medios de contraste yodados, como los productos basados en gadolinio que se emplean en la RM, quedan atrapados y se acumulan en el espacio intracelular de los miocardiocitos que han experimentado un daño irreversible tras el infarto de miocardio o en el espacio extracelular expandido debido al tejido cicatrizal fibroso: estas lesiones necróticas o fibrosas pueden manifestarse en forma de áreas hiperdensas (hipercaptación) en una secuencia tardía obtenida 8–10 min después de la inyección del medio de contraste (figura 7)24.
Reforma de presentación plana curvada que muestra una oclusión total crónica a la altura del ostium de la arteria circunfleja izquierda (A, flechas). Una imagen de perfusión por tomografía computarizada de cuatro cámaras en reposo, obtenida durante el primer paso del contraste, muestra un gran defecto de perfusión en la pared lateral (B, flechas) en el territorio de la arteria circunfleja izquierda. La imagen de cuatro cámaras correspondiente con captación de contraste tardía, obtenida a los 8 min empleando un protocolo de voltaje bajo (80 kV) muestra hipercaptación debida a necrosis del miocardio (C, flechas).
En la última década, diversas mejoras tecnológicas han permitido alcanzar una reducción drástica del perfil de dosis asociado a la angio-TC coronaria, junto con una mejora de la calidad de las imágenes. En consecuencia, partiendo del valor inicial de 20 mSv, actualmente la dosis puede reducirse a solo 2 mSv o menos mediante la activación prospectiva del ECG, que incluye métodos de espiral de factor de paso alto y métodos de reconstrucción iterativa21,22.
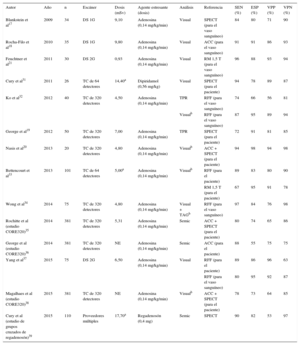
En las tablas 1 y 2 se muestran la dosis de radiación, los protocolos de examen y la exactitud diagnóstica de la TCP estática. La dosis efectiva comunicada está en el intervalo de 4,2 a 7,7 mSv con la modalidad de ED, es ≤ 5 mSv con la técnica monoenergética de activación de ECG prospectiva, y se aproxima a 1 mSv con la adquisición con espiral de factor de paso alto del sistema de escáner de TCDF (tablas 1 y 2). En consecuencia, un protocolo completo de estrés/reposo empleando escáner de TCDF de 128 cortes con factor de paso alto puede dar lugar a una dosis de radiación de apenas 2,5 mSv, al tiempo que mantiene una sensibilidad del 96% y una especificidad del 88%, en comparación con la RM cardiaca, a nivel del vaso21. Por el contrario, la dosis efectiva de la TCP dinámica es muy variable y oscila entre 3,8 mSv16 y 12,5 mSv27, con unos valores que dependen estrictamente de la optimización del protocolo16 (tabla 3). En consecuencia, el examen combinado de TCP dinámica en reposo/estrés con 100 kV puede requerir una dosis media de radiación de 18 mSv28. Este valor puede reducirse de manera uniforme utilizando los avances técnicos recientes, como la adquisición con voltajes bajos (70-80 kV) y la reconstrucción iterativa49,50.
Imagen estática de perfusión por tomografía computarizada
| Autor | Año | n | Escáner | Dosis (mSv) | Agente estresante (dosis) | Análisis | Referencia | SEN (%) | ESP (%) | VPP (%) | VPN (%) |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Blankstein et al17 | 2009 | 34 | DS 1G | 9,10 | Adenosina (0,14 mg/kg/min) | Visual | SPECT (para el vaso sanguíneo) | 84 | 80 | 71 | 90 |
| Rocha-Filo et al18 | 2010 | 35 | DS 1G | 9,80 | Adenosina (0,14 mg/kg/min) | Visual | ACC (para el vaso sanguíneo) | 91 | 91 | 86 | 93 |
| Feuchtner et al21 | 2011 | 30 | DS 2G | 0,93 | Adenosina (0,14 mg/kg/min) | Visual | RM 1,5 T (para el vaso sanguíneo) | 96 | 88 | 93 | 94 |
| Cury et al31 | 2011 | 26 | TC de 64 detectores | 14,40a | Dipiridamol (0,56 mg/kg) | Visual | SPECT (para el paciente) | 94 | 78 | 89 | 87 |
| Ko et al32 | 2012 | 40 | TC de 320 detectores | 4,50 | Adenosina (0,14 mg/kg/min) | TPR | RFF (para el vaso sanguíneo) | 74 | 66 | 56 | 81 |
| Visualb | RFF (para el vaso sanguíneo) | 87 | 95 | 89 | 94 | ||||||
| George et al19 | 2012 | 50 | TC de 320 detectores | 7,00 | Adenosina (0,14 mg/kg/min) | TPR | SPECT (para el paciente) | 72 | 91 | 81 | 85 |
| Nasis et al20 | 2013 | 20 | TC de 320 detectores | 4,80 | Adenosina (0,14 mg/kg/min) | Visualb | ACC + SPECT (para el paciente) | 94 | 98 | 94 | 98 |
| Bettencourt et al33 | 2013 | 101 | TC de 64 detectores | 5,00a | Adenosina (0,14 mg/kg/min) | Visualb | RFF (para el paciente) | 89 | 83 | 80 | 90 |
| RM 1,5 T (para el paciente) | 67 | 95 | 91 | 78 | |||||||
| Wong et al34 | 2014 | 75 | TC de 320 detectores | 4,80 | Adenosina (0,14 mg/kg/min) | Visual + TAGb | RFF (para el vaso sanguíneo) | 97 | 84 | 76 | 98 |
| Rochitte et al (estudio CORE320)35 | 2014 | 381 | TC de 320 detectores | 5,31 | Adenosina (0,14 mg/kg/min) | Semic | ACC + SPECT (para el paciente) | 80 | 74 | 65 | 86 |
| George et al (estudio CORE320)36 | 2014 | 381 | TC de 320 detectores | NE | Adenosina (0,14 mg/kg/min) | Semic | ACC (para el paciente) | 88 | 55 | 75 | 75 |
| Yang et al37 | 2015 | 75 | DS 2G | 6,50 | Adenosina (0,14 mg/kg/min) | Visual | RFF (para el paciente) | 89 | 86 | 96 | 63 |
| RFF (para el vaso sanguíneo) | 80 | 95 | 92 | 87 | |||||||
| Magalhaes et al (estudio CORE320)38 | 2015 | 381 | TC de 320 detectores | NE | Adenosina (0,14 mg/kg/min) | Visualb | ACC + SPECT (para el paciente) | 78 | 73 | 64 | 85 |
| Cury et al (estudio de grupos cruzados de regadenosón)39 | 2015 | 110 | Proveedores múltiples | 17,70a | Regadenosón (0,4 mg) | Semic | SPECT | 90 | 82 | 53 | 97 |
1G: primera generación; 2G: segunda generación; ACC: angiografía coronaria cuantitativa; DS: escáner de doble fuente; ESP: especificidad; NE: no evaluable; RFF: reserva fraccional de flujo; RM: resonancia magnética; Semic: análisis semicuantitativo mediante puntuación de estrés; SEN: sensibilidad; SPECT: tomografía computarizada por emisión monofotónica; TAG: gradiente de atenuación transluminal; TC: tomografía computarizada; TPR: cociente de perfusión transmural; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
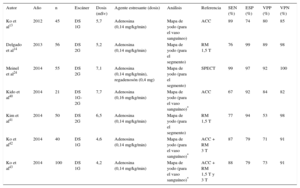
Imágenes estáticas de perfusión por tomografía computarizada de energía dual
| Autor | Año | n | Escáner | Dosis (mSv) | Agente estresante (dosis) | Análisis | Referencia | SEN (%) | ESP (%) | VPP (%) | VPN (%) |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Ko et al13 | 2012 | 45 | DS 1G | 5,7 | Adenosina (0,14 mg/kg/min) | Mapa de yodo (para el vaso sanguíneo) | ACC | 89 | 74 | 80 | 85 |
| Delgado et al14 | 2013 | 56 | DS 2G | 5,2 | Adenosina (0,14 mg/kg/min) | Mapa de yodo (para el segmento) | RM 1,5 T | 76 | 99 | 89 | 98 |
| Meinel et al24 | 2014 | 55 | DS 2G | 7,1 | Adenosina (0,14 mg/kg/min), regadenosón (0,4 mg) | Mapa de yodo (para el segmento) | SPECT | 99 | 97 | 92 | 100 |
| Kido et al40 | 2014 | 21 | DS 1G-2G | 7,7 | Adenosina (0,16 mg/kg/min) | Mapa de yodo (para el vaso sanguíneo)* | ACC | 67 | 92 | 84 | 82 |
| Kim et al41 | 2014 | 50 | DS 2G | 6,5 | Adenosina (0,14 mg/kg/min) | Mapa de yodo (para el segmento) | RM 1,5 T | 77 | 94 | 53 | 98 |
| Ko et al42 | 2014 | 40 | DS 1G | 4,6 | Adenosina (0,14 mg/kg/min) | Mapa de yodo (para el vaso sanguíneo)* | ACC + RM 3 T | 87 | 79 | 71 | 91 |
| Ko et al43 | 2014 | 100 | DS 1G | 4,2 | Adenosina (0,14 mg/kg/min) | Mapa de yodo (para el vaso sanguíneo)* | ACC + RM 1,5 T y 3 T | 88 | 79 | 73 | 91 |
1G: primera generación; 2G: segunda generación; ACC: angiografía coronaria cuantitativa; DS: escáner de doble fuente; ESP: especificidad; RM: resonancia magnética; SEN: sensibilidad; SPECT: tomografía computarizada por emisión monofotónica; TC: tomografía computarizada; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Imágenes de perfusión por tomografía computarizada dinámica en estudios en seres humanos
| Autor | Año | n | Escáner | Dosis (mSv) | Agente estresante | Referencia | Análisis | SEN (%) | ESP (%) | VPP (%) | VPN (%) |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Bastarrika et al27 | 2010 | 10 | DS 2G | 12,50 | Adenosina (0,14 mg/kg/min) | RM (segmento) | Visual, semic, FSM cuantitativo | 86 | 98 | 94 | 96 |
| Ho et al28 | 2010 | 35 | DS 2G | 9,10 | Dipiridamol (0,56 mg/kg en 4 min) | SPECT (segmento) | FSM cuantitativo | 83 | 78 | 79 | 82 |
| Bamberg et al44 | 2011 | 33 | DS 2G | 10,00 | Adenosina (0,14 mg/kg/min) | RFF (vaso sanguíneo) | FSM cuantitativo* | 93 | 87 | 75 | 97 |
| Wang et al45 | 2012 | 30 | DS 2G | 9,50 | Adenosina (0,14 mg/kg/min) | ACC + SPECT (vaso sanguíneo) | Visual, FSM y VSM cuantitativos | 100 | 76 | 54 | 100 |
| Greif et al46 | 2013 | 65 | DS 2G | 9,70 | Adenosina (0,14 mg/kg/min) | RFF (vaso sanguíneo) | FSM cuantitativo | 95 | 74 | 49 | 98 |
| Huber et al26 | 2013 | 32 | TC de 256 detectores | 9,50 | Adenosina (0,14 mg/kg/min) | RFF (vaso sanguíneo) | FSM cuantitativo | 76 | 100 | 100 | 91 |
| Bamberg et al47 | 2014 | 31 | DS 2G | 11,08 | Adenosina (0,14 mg/kg/min) | RM 3 T (vaso sanguíneo) | FSM y VSM cuantitativos | 100 | 75 | 92 | 100 |
| Rossi et al48 | 2014 | 80 | DS 2G | 9,40 | Adenosina (0,14 mg/kg/min) | RFF (vaso sanguíneo) | FSM cuantitativo | 88 | 90 | 77 | 95 |
2G: segunda generación; ACC: angiografía coronaria cuantitativa; DS: escáner de doble fuente; ESP: especificidad; FSM: flujo sanguíneo miocárdico; RFF: reserva fraccional de flujo; RM: resonancia magnética; Semic: análisis semicuantitativo; SEN: sensibilidad; SPECT: tomografía computarizada por emisión monofotónica; TC: tomografía computarizada; VPN: valor predictivo negativo; VPP: valor predictivo positivo; VSM: volumen sanguíneo miocárdico.
A la vista de los datos antes mencionados, se puede considerar que la TCP de estrés es una técnica competitiva por lo que respecta a la dosis total, en comparación con las imágenes de SPECT (dosis de 10 mSv empleando 99mTc y 20–40 mSv en la gammagrafía con 201Tl)22, lo cual hace posible la integración de datos funcionales y anatómicos en una sola exploración.
EXACTITUDEn múltiples ensayos unicéntricos y en el primer ensayo multicéntrico realizado se ha observado que la TCP de estrés aporta una buena exactitud diagnóstica para la detección de los defectos de perfusión miocárdicos tanto en la modalidad de ED como en la monoenergética estática (tablas 1 y 2). Concretamente, Ko et al13 han demostrado la mayor exactitud de los exámenes de TCP de ED, en comparación con solo exploración por angio-TC coronaria, por lo que respecta a la detección de estenosis significativa establecida mediante la angiografía coronaria convencional. En un reciente estudio que comparó la exactitud de diferentes protocolos de adquisición con técnicas de ED y SPECT, Meinel et al24 llegaron a la conclusión de que un examen que incluya la TCP de ED tanto en estrés como en reposo es la modalidad de elección para detectar los posibles defectos de perfusión, con sensibilidad del 99%, especificidad del 97%, valor predictivo positivo del 92% y valor predictivo negativo del 100%; la adquisición con captación de contraste tardía no mejoró significativamente el rendimiento diagnóstico24. Los resultados proporcionados por un estudio multicéntrico prospectivo actualmente en curso, el DECIDE-Gold, en el que se evalúa la exactitud de las imágenes de TCP de ED en reposo/estrés en comparación con la RFF (objetivos principales) y las imágenes funcionales (objetivos secundarios), permitirán mejorar la evidencia actualmente disponible respecto al uso de la TCP de ED en la detección de isquemia miocárdica51.
El estudio CORE320, un ensayo internacional, multicéntrico y prospectivo que empleó un escáner de 320 detectores y contó con 381 participantes, ha evaluado la exactitud diagnóstica de la combinación de angio-TC y TCP de estrés con adenosina estática, en comparación con la angiografía invasiva y la SPECT. El estudio llegó a la conclusión de que el rendimiento general de las imágenes de TCP de estrés en el diagnóstico de la estenosis coronaria anatómica (≥ 50%) era superior al de la SPECT, y que ello se debía en parte a la mayor sensibilidad para detectar afección de la coronaria principal izquierda y enfermedad multivaso36. Según los datos del CORE320, al combinarlo con angio-TC, el análisis de la TCP miocárdica aumentó sustancialmente la especificidad y la exactitud general en la identificación de estenosis limitante del flujo (EC ≥ 50%) determinada mediante angiografía coronaria invasiva y SPECT35,38. Estos resultados fueron uniformes entre los pacientes con y sin antecedentes de EC, tanto en los análisis de los datos por paciente como en los análisis por vaso sanguíneo35,38. En otro estudio aleatorizado multicéntrico que empleó TCP de múltiples proveedores y utilizó regadenosón en un total de 110 participantes en 11 centros de Estados Unidos que emplearon seis escáneres de TC diferentes, se ha demostrado la no inferioridad del protocolo de TCP estático en la detección de los defectos de perfusión, en comparación con la SPECT, que fue la técnica utilizada como patrón de referencia. El estudio mostró altas sensibilidad y especificidad, del 90 y el 82% respectivamente39. Por otra parte, al igual que en el ensayo CORE320, la TCP con regadenosón para la detección de isquemia miocárdica aporta una mejora en la exactitud diagnóstica respecto a la angio-TC sola39.
El cociente de perfusión transmural obtenido con un programa informático y otros parámetros como el índice de reserva miocárdica (diferencia de atenuación entre las fases de estrés y de reposo) se han introducido también como medidas semicuantitativas útiles para la TCP miocárdica estática; sin embargo, estos parámetros han mostrado menos exactitud diagnóstica que los análisis cualitativos visuales estándares, sobre todo cuando se añade la perfusión visual a la información de la angio-TC coronaria32,38.
Por lo que respecta a la exactitud diagnóstica de la TCP de estrés dinámica, los datos obtenidos en estudios basados en modelos animales son muy alentadores y muestran buena correlación con las mediciones de microesferas fluorescentes y con la histopatología (tabla 4). Los estudios preliminares en seres humanos confirmaron el buen rendimiento diagnóstico de la TCP dinámica en comparación con los métodos funcionales no invasivos ya establecidos, como la SPECT y la RM de perfusión, y con el patrón de referencia, la RFF determinada de manera invasiva (tabla 3). De hecho, las imágenes de TCP añadieron la posibilidad de mejorar la exactitud diagnóstica general de la angio-TC coronaria, en especial por lo que respecta a la interpretación de la estenosis de grado intermedio47,48.
Imágenes de perfusión por tomografía computarizada dinámica en estudios realizados en animales
| Autor | Año | n | Escáner | Protocolo | Dosis (mSv) | Agente estresante | Referencia | Análisis |
|---|---|---|---|---|---|---|---|---|
| Bamberg et al52 | 2012 | 7 cerdos | DS 2G | Estrés: TCP dinámica | 10,60 | Adenosina (0,14 mg/kg/min) | FSM con microesferas | FSM cuantitativo |
| Rossi et al53 | 2013 | 7 cerdos | DS 2G | Estrés: TCP dinámica | 17,10 | Adenosina (0,50 mg/kg/min) | FSC y RFF | FSM cuantitativo |
| Schwarz et al54 | 2013 | 6 cerdos | DS 2G | Estrés: TCP dinámica + flash | 11,30 + 0,88 | Adenosina (0,14 mg/kg/min) | FSM con microesferas | FSM cuantitativo + valores de atenuación (UH) |
| Bamberg et al55 | 2014 | 12 cerdos | DS 2G | Estrés: TCP dinámica | NE | Adenosina (0,14 mg/kg/min) | Histopatología, FSM con microesferas | FSM cuantitativo, VSM, Ktrans |
2G: segunda generación; DS: escáner de doble fuente; FSC: flujo sanguíneo coronario; FSM: flujo sanguíneo miocárdico; Ktrans: constante de permeabilidad; NE: no evaluable; RFF: reserva fraccional de flujo; TCP: tomografía computarizada de perfusión; UH: unidades de Hounsfield; VSM: volumen sanguíneo miocárdico.
Usando TCP dinámica, se ha propuesto emplear diferentes valores de corte del FSM absoluto, que van de 75 a 103,1 ml/100 ml/min con un sistema de escáner de TCDF y hasta 164 ml/100 ml/min con un escáner de TC de 256 cortes, con objeto de diferenciar entre miocardio isquémico y no isquémico, en comparación con la técnica de RFF invasiva26,44,48,56,57. Se puede atribuir la falta de uniformidad a las diferencias existentes entre los protocolos de estudio, el empleo de escáneres diferentes y los algoritmos matemáticos26,48,56. Más recientemente, un estudio de Meinel et al58 ha mostrado también la utilidad de la TCP dinámica con la TCDF en la evaluación cuantitativa de la perfusión ventricular izquierda total. La perfusión cardiaca general fue inferior en los pacientes con defectos de perfusión y se redujo con el aumento del grado de EC obstructiva, lo cual pone de manifiesto la viabilidad clínica de diferenciar a los pacientes con perfusión normal de los que presentan EC obstructiva de tres vasos que da lugar a una isquemia equilibrada58.
Además, un estudio reciente ha puesto de manifiesto que una determinación del FSM relativo (el cociente del FSM absoluto respecto al FSM en un lugar distante) puede tener un rendimiento superior al de las determinaciones de los valores absolutos, con mejor correlación con la RFF determinada de manera invasiva, en la detección de lesiones coronarias hemodinámicamente relevantes56. Algunos resultados se han confirmado recientemente en un registro multicéntrico retrospectivo de 137 pacientes, en el que el cociente del FSM permitió obtener una discriminación de la EC obstructiva detectada mediante angio-TC superior a la que aporta el FSM absoluto57.
Aunque un FSM relativo puede corregir las variaciones sistémicas intraindividuales que se producen en el FSM, se conocen otros muchos factores que modifican el FSM interindividual e individual: edad, sexo, índice de masa corporal, mecanismos hemodinámicos (como las diferencias en la capacidad de respuesta a los vasodilatadores), anatómicos, metabólicos, miógenos, endoteliales y nerviosos que actúan a diferentes niveles del árbol vascular y aspectos metabólicos (diferencias en la dosis de contraste y en la técnica de inyección, así como en los protocolos de examen y diferentes tipos de escáner)11,48,56. Serán necesarios nuevos estudios para confirmar la superioridad de la determinación estandarizada del FSM u otros posibles parámetros fisiológicos respecto a los parámetros cuantitativos absolutos.
Aunque un estudio en seres humanos ha mostrado gran exactitud diagnóstica para la predicción de la isquemia y similar a la detección mediante la RFF con la TCP de un solo disparo y el parámetro de FSM derivado de la TCP dinámica26, un estudio amplio llevado a cabo en animales muestra un rendimiento del FSM cuantitativo significativamente mejor que el valor de la atenuación miocárdica de una sola fase estática54. Concretamente, se observó una notable diferencia de exactitud a menor grado de estenosis (50%), lo cual proporciona mejor capacidad de discriminación de la TCP dinámica frente a la estática en la detección de miocardio isquémico54.
Los resultados de los metanálisis iniciales han confirmado la gran exactitud de la TCP, si bien la importante heterogeneidad existente es una posible limitación de estos análisis59,60. Concretamente, un metanálisis de Takx et al59, en el que se evaluó la exactitud de diferentes técnicas de perfusión miocárdica en comparación con la RFF, indicó que la TCP tiene un rendimiento similar al de la RM y la tomografía por emisión de positrones y superior al de la SPECT y la ecocardiografía. El análisis de los resultados combinados de otro metanálisis que incluyó 22 estudios (1.507 pacientes) para comparar la TCP con patrones de referencia —como angiografía coronaria invasiva, SPECT y RM— mostró un rendimiento diagnóstico aceptable con todas las técnicas de TCP miocárdica (TCP estática y dinámica), con una sensibilidad que osciló entre el 75 y el 89% y una especificidad de entre el 78 y el 95%60.
PUNTOS FUERTES Y LIMITACIONESLa TCP de estrés continúa teniendo numerosas limitaciones, algunas de las cuales se acabará por superar a medida que se perfeccione la tecnología de TC. Los parámetros óptimos para la adquisición de las imágenes y los métodos de reconstrucción, posprocesado e interpretación estandarizada de la TCP de estrés están aún en fase de investigación. Los artefactos de movimiento y endurecimiento del haz pueden limitar la exactitud diagnóstica de la TCP de estrés, pero se dispone ya de algoritmos de corrección que pueden atenuar estos efectos. Además, también es probable que la exposición a la radiación se reduzca a medida que progrese la tecnología de TC, por ejemplo empleando métodos de reconstrucción iterativos para las imágenes de TCP dinámica, sin que ello afecte a la calidad de la imagen50. Se han realizado estudios de TCP de estrés con y sin bloqueo beta, y ello puede haber influido en la evaluación de la perfusión miocárdica. Por último, la mayor parte de la evidencia actual sobre la TCP procede de estudios unicéntricos, en los que se ha reclutado a un pequeño número de pacientes. Sin embargo, la TCP tiene mayor resolución espacial que la SPECT, que es la técnica de imagen funcional más ampliamente utilizada en la práctica clínica, y ello puede permitir la detección de defectos de perfusión de menor tamaño, sobre todo subendocárdicos. Por otra parte, la TCP es una técnica de imagen que lo proporciona todo de una sola vez, con la ventaja especial de obtener una evaluación anatómica y funcional en una sola exploración. Estos puntos fuertes podrían hacer de la TCP una puerta de entrada más eficaz como paso a la angiografía coronaria invasiva, con una mejor estratificación de los pacientes para quienes puede ser útil la revascularización.
CONCLUSIONES Y PERSPECTIVAS FUTURASLos rápidos avances tecnológicos en las técnicas de imagen cardiaca han ampliado drásticamente la aplicación de la angio-TC en la evaluación de la miocardiopatía isquémica y han permitido obtener imágenes de TCP miocárdica en estrés farmacológico. Esta modalidad resulta muy atractiva y permite mejorar la exactitud diagnóstica, especialmente en cuanto a la especificidad y el valor predictivo positivo de la angio-TC coronaria.
La TCP de estrés aporta la posibilidad de evaluar un amplio espectro de disfunciones vasculares coronarias: desde la disfunción microvascular relacionada con factores de riesgo cardiovascular y aterosclerosis no obstructiva difusa avanzada hasta la estenosis intermedia o grave o la EC de múltiples vasos. La TCP de estrés puede aumentar la exactitud diagnóstica en la evaluación de la permeabilidad de los stents y la calcificación difusa del árbol coronario61,62.
Parece estar justificada la realización de nuevos estudios para demostrar la no inferioridad del protocolo de una sola fase estática, en comparación con la TCP de estrés dinámica, puesto que las técnicas de resolución temporal dinámicas aportan datos plenamente cuantitativos, pero a costa de una dosis superior debido al mayor tiempo de obtención de imágenes. Es probable que, en un futuro próximo, la elección del protocolo de adquisición óptimo y el patrón de análisis para evaluar con exactitud la perfusión miocárdica del ventrículo izquierdo vengan dados por diversos factores, como los aspectos técnicos (tipo de plataforma de obtención de imágenes utilizada) y las variables dependientes del paciente (estado físico, estado coronario y probabilidad pretest de EC).
Entre las perspectivas futuras pueden estar las nuevas mejoras tecnológicas, tanto en los aparatos (mejor sensibilidad y más amplio alcance del sistema detector, mejor resolución temporal y espacial, y aplicación de ED) como en las actualizaciones de los programas (que permitan la estandarización del posprocesado necesaria para un análisis más exacto y reproducible de los datos y su aplicación clínica con éxito).
Se puede ser positivo respecto a la utilidad futura de la TCP miocárdica. A pesar de que la validación diagnóstica de la TCP esté aún en curso, el posible papel de la TCP como instrumento diagnóstico para detectar EC hemodinámicamente significativa es prometedor y merece más estudio. Los resultados de los primeros estudios controlados son excelentes y alentadores pero, a medida que continúe evolucionando la tecnología, serán precisos nuevos ensayos multicéntricos más amplios para demostrar la utilidad clínica efectiva de la TCP y sus repercusiones económicas en relación con las de otras modalidades de imagen funcionales.
Por último, aunque la perfusión miocárdica es históricamente un potente predictor de los resultados, la repercusión pronóstica de los defectos de perfusión evaluados mediante TCP está aún por definir completamente. Se espera con gran interés los estudios de determinación del valor pronóstico de las imágenes de TCP para la predicción de futuros eventos cardiacos, puesto que ello reforzará su papel diagnóstico en la práctica clínica.
CONFLICTO DE INTERESESNinguno.