Palabras clave
La morfología y la polaridad de la onda P durante la taquicardia auricular (TA) en el electrocardiograma (ECG) de doce derivaciones son útiles para identificar su lugar de origen1-7. Las TA izquierdas focales se originan frecuentemente en las venas pulmonares (VP) y característicamente presentan frecuencias auriculares más rápidas que otras TA1. La estimulación selectiva de VP y las TA-VP que ocurren tras la ablación de venas pulmonares tienen características en el ECG que permiten la identificación exacta de la VP de origen2,3. Sin embargo, el ECG de superficie tiene limitaciones para establecer de manera inequívoca un origen en VP de las TA4-7. Además, no siempre es posible valorar la morfología y la polaridad de la onda P durante la TA, frecuentemente debido a la superposición de la onda T del latido precedente7,8. La identificación de un origen en VP de las TA permite una preparación específica (incluida la previsible necesidad de punción transeptal) del procedimiento de ablación de este tipo de taquicardias, con el añadido riesgo de embolias sistémicas que este tratamiento conlleva9.
Los pacientes con fibrilación auricular paroxística (FAP) y enfermedad del nodo sinusal presentan frecuentemente un tiempo de conducción interauricular e intraauricular alargado10,11. La propagación no homogénea de los impulsos sinusales produce anormalidades morfológicas en la onda P sinusal, con un aumento de la duración y la dispersión. Las melladuras (notch) y ondas P bifásicas, especialmente en las derivaciones inferiores del ECG, son una consecuencia de este proceso12,13.
En el presente estudio se analizan las características clínicas y electrofisiológicas diferenciales asociadas a las TA-VP, incluida la presencia de anormalidades morfológicas en la onda P sinusal, en comparación con otros orígenes de TA.
MÉTODOS
Población de estudio
Los pacientes consecutivos sometidos a cartografía y ablación de TA focales refractarias a fármacos antiarrítmicos sin ablación previa de venas pulmonares fueron considerados para inclusión en el estudio. La selección de los pacientes se realizó desde la consulta externa de la unidad de arritmias y electrofisiología, donde se estableció el diagnóstico de taquicardia auricular refractaria al tratamiento antiarrítmico, y se indicó estudio electrofisiológico y/o ablación por radiofrecuencia. Se recogió a los pacientes consecutivos sometidos a ablación de taquicardia auricular en los hospitales de la Santa Creu i Sant Pau y del Mar, en Barcelona, en colaboración con el Hospital de la Universidad de Pennsylvania, en Filadelfia (Pennsylvania). Antes del estudio se realizó de todos ellos análisis de sangre y ecocardiografía bidimensional (con determinación del diámetro anteroposterior de la aurícula izquierda utilizando el modo M, visión paraesternal, eje largo). Se explicó en detalle los riesgos del procedimiento y todos los pacientes dieron su consentimiento informado, de acuerdo con el protocolo de actuación del hospital correspondiente. Desde enero de 2003 hasta junio de 2006, se incluyó a 87 pacientes sometidos a ablación de 95 TA. Para el análisis comparativo, se los agrupó en pacientes con TA-VP (grupo 1, n = 25/26 TA), TA-VP con FAP documentada asociada (grupo 2, n = 18/18 TA), otras TA izquierdas (grupo 3, n = 7/7 TA) y TA derechas (grupo 4, n = 37/44 TA). Se definió un grupo con TA-VP aislada sin FAP asociada (grupo 1) para excluir la propia FAP como potencial factor de confusión en los resultados obtenidos.
Protocolo de estudio y ablación
Todos los fármacos antiarrítmicos fueron suspendidos antes del procedimiento al menos durante 5 vidas medias, y ningún paciente estaba en tratamiento con amiodarona.
Durante el estudio, se estableció como clínica la taquicardia reproduciblemente inducible mediante estimulación auricular, con sintomatología igual a la clínica y en ausencia de otras taquicardias inducibles que lo justificaran. Las arritmias macrorreentrantes (flutter) fueron excluidas de nuestro análisis; se sospechó este mecanismo en presencia de actividad eléctrica que cubriera la práctica totalidad del ciclo de la taquicardia en la cavidad cardiaca de interés y sin línea isoeléctrica en el ECG de superficie. La identificación de un obstáculo o barrera eléctrica funcional o anatómica y la identificación de un istmo o zona «protegida» del circuito de la taquicardia respaldaron el diagnóstico de macrorreentrada. Finalmente, la documentación de ciclos de retorno similares a los de la taquicardia en regiones auriculares distantes, además de los criterios de fusión constante y progresiva (poco frecuentes en las taquicardias microrreentrantes), orientaron también a un mecanismo macrorreentrante14,15. Se consideró mecanismo arritmogénico el automatismo anormal o la actividad desencadenada si se cumplían al menos dos de los siguientes tres criterios16: a) episodios arrítmicos prolongados o «incesantes», con fenómeno on and off y «calentamiento» (warm up) al inicio o «enfriamiento» (cool down) al final de la TA; b) incapacidad de iniciar o terminar la taquicardia de forma reproducible con estimulación auricular programada, y c) necesidad de utilizar burst pacing o infusión de isoproterenol para la inducción de la taquicardia. Cuando estos criterios no se cumplían y habiéndose descartado un mecanismo macrorreentrante, se sospechó un mecanismo microrreentrante de la arritmia a través de maniobras de encarrilamiento durante taquicardia15.
El origen de la TA se identificó en un mapa de activación electroanatómica (CARTO®, Biosense Webster, Diamond Bar, California, Estados Unidos) sobre la base de la terminación de la taquicardia durante la ablación y/o imposibilidad de reinducir la arritmia con estimulación auricular programada, burst pacing o infusión de isoproterenol, tras la ablación y durante un periodo posterior de observación de 30 min. Se puso especial atención en relacionar la eficacia del procedimiento con la aplicación de radiofrecuencia y no con un posible bloqueo mecánico de la taquicardia durante el estudio. La ablación se realizó mediante un catéter de punta no irrigada de 4 mm en las TA derechas y de 8 mm en las TA izquierdas (NAVISTAR®, Biosense Webster, Diamond Bar), utilizando energías de 30-50 W y temperaturas de 55 °C. En caso de TA-VP, se realizó ablación circunferencial para obtener aislamiento eléctrico de la vena. El ciclo de la TA fue medido digitalmente mediante calipers electrónicos durante el estudio electrofisiológico utilizando las señales intracavitarias, a una velocidad de 100 mm/s. El ECG de doce derivaciones se analizó offline utilizando los polígrafos Prucka® Cardiolab recording system (Houston, Texas, Estados Unidos) y Lab Pro (C.R. Bard Inc., New Jersey, Estados Unidos), con anchura de banda de 0,05-100 Hz. Se midió la duración máxima de la onda P sinusal al inicio del procedimiento (antes de la ablación, para así evitar alteraciones morfológicas debidas a la propia aplicación de radiofrecuencia) en cualquier derivación del ECG, así como la presencia o ausencia de melladuras en dos o más derivaciones ECG, con una distancia pico-pico de la P mellada ≥ 1 mm (0,04 s)11,17,18.
Análisis estadístico
Las variables se describen como media ± desviación estándar. Las variables categóricas fueron comparadas mediante el test de la χ2. Las variables continuas fueron analizadas mediante análisis de varianza (ANOVA). Se consideró estadísticamente significativo un valor de p < 0,05.
RESULTADOS
Población de estudio
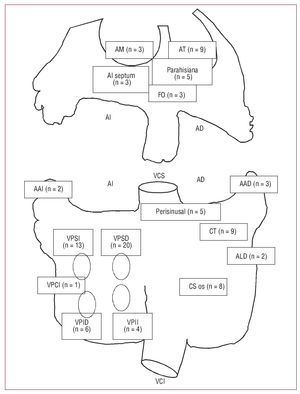
En la tabla 1 y la figura 1 se representan las características demográficas de la población en estudio (media de edad, 52 ± 15 años; 46 mujeres) y distribución del origen de las TA. Los pacientes con TA-VP aislada (grupo 1) eran más jóvenes que los demás (p < 0,05), sin diferencias de sexo entre grupos. Los grupos 1 (TA-VP) y 4 (TA derecha) presentaron menores incidencias de cardiopatía estructural y dilatación auricular (p < 0,05 y p < 0,01 respectivamente) que los grupos 2 y 3 (TA-VP asociada a FAP y otras TA izquierdas).
Fig. 1. Distribución del origen de la taquicardia auricular en la población en estudio. Visión esquemática de las aurículas derecha e izquierda con la distribución del origen de la arritmia en la población en estudio. AAD = Apéndice auricular derecho; AAI = Apéndice auricular izquierdo; AD: aurícula derecha; AI: aurícula izquierda; ALD: aurícula derecha lateral; AM: anillo mitral; AT: anillo tricuspídeo; CT: crista terminalis; FO: fossa ovalis; CS os: ostium del seno coronario; VCI: vena cava inferior; VCS: vena cava superior; VPCI: vena pulmonar común izquierda; VPII: vena pulmonar inferior izquierda; VPID: vena pulmonar inferior derecha; VPSD: vena pulmonar superior derecha; VPSI: vena pulmonar superior izquierda.
Taquicardia auricular de vena pulmonar
Las TA-VP, asociadas o no a FAP, se originaron predominantemente de las venas pulmonares superior derecha y superior izquierda (tabla 1). Asimismo, las TA-VP presentaron longitudes de ciclo más cortos (frecuencias cardiacas más altas) que otras TA izquierdas o derechas (grupos 3 y 4): 289 ± 45 ms (grupo 1) y 280 ± 48 ms (grupo 2) frente a 392 ± 106 ms (grupo 3) y 407 ± 87 ms (grupo 4) (p < 0,05). El mecanismo arritmogénico fue casi uniformemente automatismo anormal o actividad desencadenada en las TA-VP (en 24/25 en el grupo 1 y 17/18 en el grupo 2). Por contra, la reentrada se asoció más frecuentemente a los grupos 3 (4/7) y 4 (16/44) (p < 0,05) (tabla 2).
Onda P sinusal: anomalías morfológicas
Los pacientes con TA izquierdas (grupos 1 a 3) se distinguieron por presentar una onda P sinusal más prolongada que los del grupo 4 (TA derechas): 126 ± 25 ms (grupo 1), 133 ± 23 ms (grupo 2) y 136 ± 37 ms (grupo 3) frente a 106 ± 20 ms (grupo 4) (p < 0,01). La proporción de pacientes con melladura o notch en la onda P sinusal fue igualmente mayor en los grupos de TA izquierdas: 15/25 (60%, grupo 1), 11/18 (61%, grupo 2) y 5/7 (71%, grupo 3) frente a 10/37 (27%, grupo 4) (p < 0,025).
Teniendo en cuenta la edad más joven del grupo de pacientes con TA-VP aislada, se analizó de forma específica el valor diagnóstico de la prolongación y melladura de la onda P sinusal en menores de 50 años sin cardiopatía estructural (n = 37): una duración ≥ 110 ms de la onda P sinusal (sensibilidad, 68%; especificidad, 69%; valor predictivo positivo, 72%; valor predictivo negativo, 65%; p = 0,04) y la presencia de melladura (sensibilidad, 79%; especificidad, 70%; valor predictivo positivo, 61%; valor predictivo negativo, 84%; p = 0,02) fueron marcadores de origen en vena pulmonar de la TA en esta subpoblación (figs. 2 y 3).
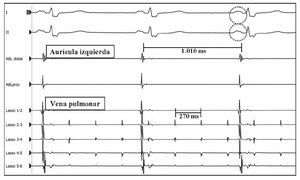
Fig. 2. Taquicardia auricular de vena pulmonar superior izquierda. Ablación efectiva tras aislamiento de la vena. Durante la aplicación de radiofrecuencia, en los registros se observa que la taquicardia permanece dentro de la vena pulmonar (catéter «Lasso»), mientras la aurícula está en ritmo sinusal (catéter de ablación). Destaca la presencia de melladura en la onda P de las derivaciones del ECG representadas. ABL distal: catéter de ablación, polo distal; ABL prox: catéter de ablación, polo proximal.
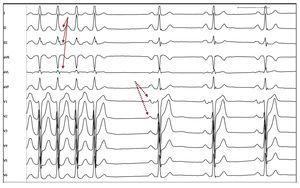
Fig. 3. Identificación de anomalías en la onda P sinusal en paciente con TA-VP. Registro de ECG de una taquicardia auricular de vena pulmonar superior izquierda interrumpida durante la aplicación de radiofrecuencia. La morfología de la onda P durante taquicardia no se puede apreciar debido a su superposición con la onda T precedente (flechas). En ritmo sinusal, fácilmente se puede apreciar la onda P mellada y prolongada característica de estos pacientes (flechas rayadas), ya presente antes de la aplicación de radiofrecuencia.
Resultados de la ablación
Tras la ablación se realizó un seguimiento clínico de 24 ± 14 meses. En los pacientes con TA-VP aislada (grupo 1) el seguimiento fue de 34 ± 10 meses. La eficacia aguda del procedimiento se alcanzó en 24/26 casos del grupo 1, con 2 recurrencias clínicas en el seguimiento. Durante el seguimiento sólo se documentó FAP en 1 paciente de este grupo. En el grupo 2, la eficacia aguda se obtuvo en 17/18 procedimientos, con 4 recurrencias y recidiva de FAP en 6. La ablación de TA izquierdas (grupo 3) fue eficaz en 6/7 pacientes, con 1 recurrencia. Finalmente, la ablación de las TA derechas fue eficaz en 39/44 pacientes, con 5 recurrencias adicionales en el seguimiento.
DISCUSIÓN
El presente estudio demuestra que, cuando se establece la sospecha clínica de taquicardia auricular en un paciente menor de 50 años sin cardiopatía ni dilatación auricular, la presencia de prolongación (≥ 110 ms) y melladura en la onda P sinusal predice un origen en vena pulmonar (sensibilidad, 68-79%; especificidad, 69-70%), con la consiguiente potencial necesidad de punción transeptal para la ablación de la VP de origen. A más edad, presencia de cardiopatía o asociación a FAP, estas anomalías morfológicas de la P sinusal no son tan específicas de TA-VP. Asimismo, una frecuencia auricular rápida (> 200/min: ciclos auriculares de 289 ± 45 y 280 ± 48 ms en los grupos 1 y 2) está característicamente asociada a las TA-VP y no a otras TA izquierdas o derechas.
Este estudio confirma que las TA-VP se originan predominantemente por focos arritmogénicos no reentrantes (automatismo anormal/actividad desencadenada) si no hay antecedentes de ablación de VP19.
La TA-VP está considerada una entidad independiente, y no necesariamente precede a la fibrilación auricular paroxística, pese a que compartan un origen común predominante en venas pulmonares superiores20. En el presente estudio se documentó un único episodio de FAP en nuestra población con TA-VP aislada durante un seguimiento de 34 ± 10 meses tras la ablación, aunque el diseño del estudio y la influencia de una ablación circunferencial de la VP de origen imposibilitan evaluar la relación etiopatogénica entre TA-VP y FAP.
Las anomalías en la onda P sinusal observadas en los pacientes con TA-VP son la manifestación de un aumento del tiempo de conducción intraauricular e interauricular de los impulsos sinusales. Modelos experimentales de estimulación auricular rápida reproducen un remodelado eléctrico que origina un aumento de la duración y la dispersión en la conducción del impulso sinusal. Sin suficiente evidencia científica que lo confirme, la TA-VP, una forma de TA especialmente rápida, por este mecanismo puede inducir los cambios morfológicos identificados en la onda P sinusal21. Este incremento en el tiempo de conducción intraauricular e interauricular sí tiene firme relación con la FAP, especialmente en presencia de disfunción sinusal añadida10,11. Por último, la actividad eléctrica dentro de la vena pulmonar (a través de las denominadas sleeves) puede prolongar la duración de las porciones media y distal de la onda P sinusal, lo cual queda demostrado al reducirse la duración de la onda P sinusal tras el aislamiento de VP para tratamiento de la fibrilación auricular22-24. Estas anomalías en la onda P sinusal son menos pronunciadas en las TA derechas. Las frecuencias auriculares más bajas de estas TA pueden haber favorecido un menor grado de «remodelado» auricular. Finalmente, una enfermedad miocárdica oculta subyacente (miocarditis, necrosis y fibrosis miocárdica), más relacionada con el origen de la fibrilación auricular «aislada», puede estar implicada en la etiopatogenia de la prolongación/melladura de la P sinusal y de la propia TA-VP25.
En este estudio observamos también que los pacientes con TA-VP asociada a FAP presentan un incremento del tamaño auricular y mayor edad que los pacientes con TA-VP aislada. La posibilidad de que el «remodelado» auricular en estos pacientes sea un proceso evolutivo que desemboque en la dilatación auricular y la degeneración a fibrilación auricular tras un tiempo crítico no está demostrada.
Limitaciones
En ocasiones fue necesario infundir isoproterenol para la inducción de TA-VP, y el ciclo de la TA puede haberse influido por este hecho. Sin embargo, datos previos confirman que las TA-VP son más rápidas que otras TA.
El presente estudio no analiza específicamente la variabilidad entre observadores en el reconocimiento y la medición de las anomalías morfológicas de la onda P en pacientes con TA. Además, la utilización de fármacos antiarrítmicos puede contribuir a estas anomalías de la P sinusal, aunque fueron interrumpidos 5 vidas medias antes del procedimiento y ningún paciente se trataba con amiodarona.
En este estudio no se analizó de forma específica la influencia de un origen más alto o más bajo en la aurícula derecha del impulso sinusal en los tiempos de conducción intraauricular e interauricular y, en consecuencia, en duración y presencia de melladura en la onda P sinusal. Por último, el número de pacientes con TA izquierdas (grupo 3), pese a ser estadísticamente suficiente, puede no ser representativo de esta subpoblación de pacientes con TA izquierdas no originadas en VP.
CONCLUSIONES
Las TA-VP se deben casi uniformemente a un mecanismo de automatismo anormal/actividad desencadenada y se presentan con frecuencias más rápidas que otras TA. La identificación de prolongación (≥ 110 ms) y melladura en la onda P sinusal, especialmente a edad joven (< 50 años) sin cardiopatía de base, es un marcador sensible y específico de un origen en VP de las TA. Estos hallazgos tienen importantes implicaciones en la estrategia de abordaje para la ablación de las taquicardias auriculares.
ABREVIATURAS
ECG: electrocardiograma.
FAP: fibrilación auricular paroxística.
TA: taquicardia auricular.
VP: venas pulmonares.
Full English text available from: www.revespcardiol.org
VÉASEEDITORIALENPÁGS. 134-6
Correspondencia: Dr. V. Bazán.
Unidad de Electrofisiología. Servicio de Cardiología. Hospital del Mar, IMAS, UAB.
Pg. Marítim, 25-29. 08003 Barcelona. España.
Correo electrónico: vbazan@imas.imim.es
Recibido el 16 de octubre de 2008.
Aceptado para su publicación el 6 de julio de 2009.