Palabras clave
INTRODUCCIÓN
La integración de la información procedente de diversas pruebas diagnósticas es una tarea habitual en la práctica diaria del médico. Esta información, que puede provenir de diversos orígenes (imágenes, datos cuantitativos, representaciones esquemáticas) y presentarse en diversos formatos (placa radiográfica, foto en color, imagen digital), debe integrarse adecuadamente para llegar a una correcta conclusión.
El motivo de este trabajo es dar a conocer una metodología de integración de la información anatómica relativa a las arterias coronarias epicárdicas, que proviene de la coronariografía, con la información fisiológica de perfusión tisular proporcionada por los estudios tomogammagráficos de perfusión miocárdica. Con esta metodología el árbol arterial coronario, obtenido con el cateterismo, se fusiona sobre la superficie tridimensional epicárdica extraída de las imágenes tomográficas del estudio de perfusión miocárdica. Esta integración permite ver en la misma imagen el árbol coronario y la perfusión miocárdica de forma tridimensional, con la posibilidad de visualizarla en cualquier proyección posible, dada la movilidad de la imagen integrada obtenida.
Aunque algunos estudios previos han desarrollado este formato de presentación1,2, hasta la actualidad no se disponía de la información obtenida mediante la inyección del radiotrazador durante la oclusión de una arteria coronaria en el curso de una angioplastia. Esta metodología permite comparar el área del defecto de perfusión y la coronaria ocluida, situación que permite validar la unificación de esta información3. Este procedimiento se basa en la ausencia de redistribución de los compuestos tecneciados (99mTc-tetrofosmina), que permite obtener de forma demorada las imágenes de la situación miocárdica del momento de la inyección.
MÉTODOS
Pacientes
Para poder realizar la validación metodológica de la unificación y asociar correctamente cada vaso coronario con un territorio concreto, y así evaluar la correcta superposición entre vaso y territorio, se seleccionaron 3 pacientes sin infarto previo, con angina estable y prueba de esfuerzo positiva, en tratamiento médico, programados para revascularización mediante angioplastia y/o stent a criterio clínico, previo consentimiento informado, y con enfermedad única de un solo vaso: a) varón de 68 años con estenosis proximal del 95% de la descendente anterior; b) varón de 46 años con estenosis proximal del 75% de la coronaria derecha dominante, y c) varón de 54 años con coronaria derecha dominante y estenosis del 90% de la circunfleja. Todos ellos tenían una función sistólica ventricular izquierda normal (fracción de eyección del 58, 65 y 63%, respectivamente).
Coronariografía
Para su realización fue necesaria la obtención en formato digital de las imágenes de la coronariografía y de la tomogammagrafía de perfusión miocárdica. El estudio coronariográfico se llevó a cabo en un equipo Philips Optimus M200 biplanar, con un campo visual de 7", con calibración previa de la distancia entre el emisor y el intensificador (precisa para el ajuste del factor de magnificación), y con un registro digital de las imágenes angiográficas en disco compacto (CD) usando un software de archivo DICOM.
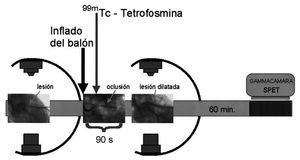
Una vez localizada la lesión en la arteria afectada, se introdujo el catéter con el balón para situarlo en la zona estenótica, y a los 10-15 s del inflado del balón se realizó la administración intravenosa de 22 mCi de 99mTc-tetrofosmina, manteniendo hinchado el balón un tiempo total de 90 s (fig. 1).
Fig. 1. Esquema del procedimiento coronariográfico y gammagráfico, con la administración de la dosis de 99mTc-tetrofosmina durante la oclusión.
Una vez finalizada la dilatación, se repitieron las imágenes biplanares, no necesariamente ortogonales, para comprobar el resultado de la dilatación. Estas imágenes biplanares se almacenaron con sus valores angulares y azimutales para su posterior ubicación espacial.
SPET miocárdica de perfusión
Una vez finalizado el estudio angiográfico (aproximadamente 60 min después de la administración de la dosis de radiotrazador), se trasladó al paciente al Servicio de Medicina Nuclear para la obtención de las imágenes tomogammagráficas correspondientes al momento de la oclusión. El estudio gammagráfico se efectuó en una gammacámara Elscint SP-4 de un cabezal. Para la adquisición se utilizó un colimador de baja energía y alta resolución, adecuando la ventana de detección al 99mTc, y obteniendo 60 imágenes en matriz de 642, con un factor de ampliación de 1,2, realizando una órbita semicircular de 180° iniciada en la posición oblicua anterior derecha 30°, a razón de 22 s por imagen.
Los pacientes fueron citados dos días más tarde para realizar una tomogammagrafía (SPET) de perfusión miocárdica de reposo basal, administrándose una nueva dosis de 99mTc-tetrofosmina (22 mCi) en reposo; se efectuó la detección a los 60 min de la administración y se empleó la misma metodología para la adquisición. Los estudios tomográficos fueron procesados en una estación de trabajo, con la reconstrucción tomográfica por retroproyección filtrada (filtro Butterworth, frecuencia 0,4 y orden 5), y la obtención de los cortes coronales reorientados (cortes de eje corto). Estos cortes fueron almacenados en formato Interfile 3.3 con inclusión de los parámetros de órbita, ángulo de detección, intervalo y tiempo por imagen.
Reconstrucción tridimensional, identificación de las estructuras e integración
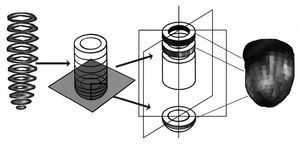
Las imágenes provenientes de la coronariografía (formato DICOM) y las procedentes de la SPET (formato Interfile) se importaron a una estación de trabajo para proceder a su reconstrucción tridimensional y posterior unificación. Los cortes de eje corto fueron superpuestos desde la base hacia el ápex, aislando el casquete apical. En la zona apical se realizaron los perfiles circunferenciales de cuentas máximas basadas en coordenadas esféricas (asumiéndose inicialmente que la zona apical es semiesférica), y en el resto del miocardio los perfiles se realizaron a partir de coordenadas cilíndricas4,5 (fig. 2). Una vez efectuados los perfiles, se generó un modelado tridimensional basado en pequeños triángulos (fig. 3), que se adaptan a la distancia real medida en los cortes de eje corto, para ajustar la morfología del modelo tridimensional a la morfología real del miocardio del sujeto, y además cada triángulo fue coloreado con el nivel de color representativo de las cuentas máximas halladas en el perfil de cuentas máximas de la zona.
Fig. 2. Esquema de la reconstrucción tridimensional de las imágenes de perfusión miocárdica a partir de los cortes de eje corto.
Fig. 3. Modelo tridimensional basado en pequeños triángulos, previo a la renderización.
Este modelado se efectuó también para los contornos epicárdico y endocárdico. A tal efecto se realizó una asunción inicial de un grosor estándar de 1 cm6, y se calculó para cada corte de eje corto, a partir del perfil de cuentas máximas y siguiendo una curva gausiana de densidad de cuentas, el contorno epicárdico (del perfil de cuentas máximas hacia el exterior) y el contorno endocárdico (del perfil de cuentas máximas hacia el interior) ajustando el grosor inicial al grosor real observado en cada corte de eje corto, y generando el modelo tridimensional epicárdico y endocárdico7.
Finalmente el modelo basado en pequeños triángulos se «renderizó» para conseguir una transición suave y continua entre cada triángulo, lo que generó la imagen volumétrica sólida final que expresa en su superficie la perfusión del miocardio subyacente7. Sobre el modelo epicárdico se identificó la estructura del surco interventricular anterior (definido por la unión ventricular derecha e izquierda en la cara anterior), que sirvió de referencia para la orientación de las imágenes del cateterismo.
Las imágenes coronariográficas biplanares de la arteria coronaria izquierda y derecha se presentaron simultáneamente, y sobre esta presentación bidimensional se trazaron por triangulación los vectores de superposición a las arterias coronarias, de forma automática o asistida por el operador, de manera que pudieran dibujarse a la vez sobre las dos imágenes los vasos coronarios8 (fig. 4). Una vez aislados estos vectores, pudo realizarse la generación tridimensional de los vasos coronarios. A fin de verificar la correcta realización de esta imagen en 3D, se generaron unas visualizaciones bidimensionales de la imagen 3D en los mismos ángulos en que se habían obtenido las imágenes del cateterismo, superponiéndose para su comprobación9.
Fig. 4. Proceso de digitalización del árbol coronario; a la izquierda, la imagen angiográfica de la coronaria izquierda; en el centro se delimitaron los contornos de los vasos (en rojo) marcando las superposiciones (azul claro), y a la derecha, la imagen tridimensional del árbol coronario seleccionado.
Los modelos tridimensionales epicárdico y de vasos coronarios se escalaron a la misma proporción y se ajustaron a su correcta ubicación en la superficie epicárdica. Para ello se utilizó el algoritmo ICP (iterative closest point)10, que de forma iterativa, para cada segmento de los vasos coronarios, ajusta la posición de los mismos a la zona de la superficie epicárdica más cercana al vaso (fig. 5). En esquema, y para cada segmento, se realizó un muestreo de la superficie epicárdica, se delimitó un cono de interacción desde el centro de masa miocárdica y el segmento de vaso, se delimitó una esfera de interacción centrada en el vaso y que corta la superficie epicárdica, y dentro de la zona de intersección se buscó iterativamente la zona epicárdica más cercana al vaso.
Fig. 5. Esquema funcional del algoritmo ICP (iterative closest point). Dentro del cono de interacción desde el centro del corte (O), con una abertura de ± theta grados, que abarca la esfera centrada en el vaso (A), marcando los posibles puntos de interacción o candidatos (línea roja) y definiendo el más probable (punto rojo), como la interacción esfera/línea roja más cercana a la línea de unión OA. EC: eje corto.
Una vez moldeados los vasos sobre la superficie epicárdica se ajustó la textura de la superficie y se generó la imagen conjunta unificada (fig. 6). Finalmente se comparó la perfusión miocárdica tridimensional de cada paciente con una base de datos de normalidad para tetrofosmina (ECT), sombreando en negro (blackout) las zonas del miocardio con una perfusión inferior a las desviaciones estándar definidas en la base de datos de normalidad para cada sector11,12.
Fig. 6. A: modelo tridimensional de la descendente anterior (el mismo de la fig. 4). B: modelo 3D de epicardio con la marca del surco interventricular anterior y el árbol coronario 3D aislado. C: superposición del primer tramo de la descendente anterior con el surco interventricular anterior y ajuste de los vasos coronarios a la superficie epicárdica mediante el algoritmo ICP (iterative closest point). D: imagen final unificada.
RESULTADOS
Ningún paciente presentó complicaciones durante el cateterismo. Sólo uno de ellos refirió una ligera molestia precordial al final del hinchado del balón, con ligero descenso del segmento ST (0,5 mm), que cedió al primer minuto posdilatación.
En los 3 pacientes seleccionados se pudo realizar correctamente la reconstrucción tridimensional del contorno epicárdico, así como del árbol coronario completo (figs. 7-9). En todos los casos se observó una correcta delineación de los vasos coronarios (línea perfilada de color azul marino para el vaso ocluido y rojo para el vaso sano) sobre la imagen coronariográfica. Las zonas de superposición se colorearon de azul claro para identificarlas mejor en las imágenes ortogonales. El punto de oclusión se perfiló en verde. En la imagen de unificación tridimensional los vasos coronarios se colorearon en rojo, mientras que el tramo distal del vaso coronario ocluido se coloreó en verde. Esta coloración permite observar la concordancia entre la zona amenazada en el epicardio (extensión del defecto de perfusión en negro) y la distribución anatómica del vaso ocluido.
Fig. 7. Paciente con oclusión de la descendente anterior. A la izquierda, el proceso de digitalización, selección de los vasos coronarios e imagen tridimensional del árbol coronario izquierdo (en azul el vaso distal a la oclusión). A la derecha, imagen tridimensional unificada, con el árbol coronario derecho e izquierdo (en verde el vaso distal a la oclusión) en la superficie epicárdica coloreada con la perfusión miocárdica. En negro se indica la zona de hipoperfusión correspondiente a la arteria ocluida.
Fig. 8. Paciente con oclusión de la coronaria derecha. A la izquierda, el proceso de digitalización, selección del vaso coronario a partir de la angulación del surco interventricular posterior e imagen tridimensional del árbol coronario derecho seleccionado (en azul). A la derecha, imagen tridimensional unificada, con el árbol coronario derecho e izquierdo (en verde el vaso distal a la oclusión) en la superficie epicárdica coloreada con la perfusión miocárdica. En negro se indica la zona de hipoperfusión correspondiente a la arteria ocluida.
Fig. 9. Paciente con oclusión de la circunfleja. A la izquierda, el proceso de digitalización, selección de las ramas coronarias e imagen tridimensional del árbol coronario izquierdo (en azul el vaso distal a la oclusión). A la derecha, imagen tridimensional unificada, con el árbol coronario derecho e izquierdo (en verde el vaso distal a la oclusión) en la superficie epicárdica coloreada con la perfusión miocárdica. En negro se indica la zona de hipoperfusión correspondiente a la arteria ocluida.
En la figura 7 se ilustran el proceso y los resultados de la fusión tridimensional obtenidos durante la oclusión de la descendente anterior. A la izquierda se observan la digitalización, aislamiento y selección de los vasos de la coronaria izquierda, y la imagen tridimensional aislada del árbol coronario izquierdo marcando el punto de oclusión, en las dos proyecciones biplanares realizadas. A la derecha se observa la imagen tridimensional de perfusión miocárdica, con el área de hipocaptación debida a la oclusión coronaria expresada en negro, y el resto del miocardio con su perfusión correspondiente expresada en superficie. Se observa una muy buena concordancia entre la zona ocluida (en negro) y la distribución epicárdica del vaso ocluido (en verde).
En la figura 8 se representan el proceso y los resultados obtenidos en el paciente con oclusión de la coronaria derecha, donde también se observa una buena concordancia entre la zona amenazada (en negro) y la distribución epicárdica del vaso ocluido (en verde). En este caso solamente se representa el tramo interventricular posterior de la coronaria derecha, ya que es el único superponible al contorno epicárdico.
En la figura 9 se observan el proceso y los resultados obtenidos en el paciente con oclusión de la circunfleja, donde también se aprecia la excelente concordancia entre la zona ocluida (en negro) y la distribución epicárdica del vaso ocluido (en verde).
DISCUSIÓN
La progresiva mejoría en la presentación de las imágenes tomogammagráficas de perfusión miocárdica ha comportado, por una parte, una mejor delimitación de los territorios miocárdicos afectados y, por otra, un formato de visualización más optimizado y parecido a la realidad. En la década de los ochenta, los estudios de perfusión miocárdica se realizaban con tecnología planar, y únicamente con presentación de tres proyecciones (anterior, oblicua anterior izquierda 40° y lateral izquierda)13. A principios de los noventa se iniciaron los estudios tomográficos, con presentación bidimensional de los cortes miocárdicos realineados (eje corto, eje largo horizontal y eje largo vertical) siguiendo la normativa de presentación de la American Society of Nuclear Cardiology, el American College of Cardiology y la Society of Nuclear Medicine14. Pero las imágenes tomográficas todavía debían ser valoradas de una en una.
Con la finalidad de resumir la información tomográfica en una única imagen bidimensional se diseñaron las imágenes polares15, las cuales además sirven de base para la cuantificación de los estudios de perfusión miocárdica, ya que resumen en una sola imagen todo el miocardio. El problema principal del mapa polar es su distorsión, producida al expresar información volumétrica en un solo plano. A mediados de los noventa, para evitar precisamente esta distorsión de los mapas polares se iniciaron las presentaciones de modelos tridimensionales de la superficie epicárdica16-18, llegando a las presentaciones actuales con modulación de color en superficie1,19. Paralelamente, los estudios coronariográficos también han evolucionado, no sólo en el formato de adquisición, pasando de la película fotográfica a la imagen digital en CD, sino además con la realización simultánea de imágenes biplanares en equipos de doble arco, y con la introducción de los análisis cuantitativos de las estenosis coronarias.
Todo esto revierte en el cardiólogo, que debe integrar la información proveniente de ambas técnicas de forma precisa para extraer la máxima información resultante20-25. Los formatos actuales de las tomogammagrafías de perfusión miocárdica incluyen las imágenes de los cortes tomográficos, los mapas polares cuantificados y en algunos casos las imágenes tridimensionales con modulación de color. Los formatos actuales de las imágenes del cateterismo incluyen la revisión de la película en formato digital (en el gabinete de hemodinámica) o la exportación de ésta en formato CD, que el cardiólogo puede visualizar con un programa específico en su PC. El resumen de la información que llega al cardiólogo clínico integra una selección de las mejores vistas biplanares de las estenosis coronarias más una imagen general del árbol, acompañado de la valoración cuantitativa, cuando se realiza, de las estenosis coronarias.
La metodología descrita no aumenta el rendimiento diagnóstico de la SPET ni de la coronariografía, ya que las limitaciones de ambas técnicas quedan reflejadas en las imágenes tridimensionales obtenidas, pero sí facilita la localización y asignación del vaso culpable. Con anterioridad se han comunicado resultados que demuestran una aceptable correlación entre la SPET y la coronariografía26, sin necesidad de acudir a las imágenes tridimensionales, pero la unificación de las imágenes de perfusión miocárdica y de la coronariografía podría facilitar, en gran medida, la integración, por parte del cardiólogo, de la información de ambas exploraciones, ya que en una misma imagen quedan condensados los datos de perfusión miocárdica y coronariográficos. Este beneficio no es sólo para el cardiólogo, ya que si el proceso de generación de las imágenes unificadas se integrara en un programa rápido en los equipos de cateterismo y de medicina nuclear, los beneficiados serían también los propios hemodinamistas y médicos nucleares.
Efectuar el cateterismo con las imágenes gammagráficas de un estudio de perfusión miocárdica realizado anteriormente permitiría al hemodinamista evaluar rápida y directamente la lesión culpable, así como poder determinar si un defecto de perfusión corresponde a una arteria o a otra, previamente a la toma de decisiones terapéuticas, o tomar como referencia de posicionamiento del equipo los ángulos de las imágenes coronariográficas tridimensionales que mejor delimiten la lesión.
También para el médico nuclear el beneficio sería importante, ya que al disponer del árbol coronario el propio paciente, cuando la coronariografía se ha practicado con anterioridad, mejoraría enormemente la exactitud de sus resultados, sobre todo en los territorios conflictivos limítrofes entre dos vasos coronarios. Además le permitirá disponer de estos datos coronariográficos para futuros estudios realizados al mismo paciente en el seguimiento de su enfermedad coronaria, situación que facilita la identificación de la arteria causante de los defectos de perfusión, de forma previa a la realización del cateterismo intervencionista si procediera.
Actualmente ya hay programas de procesado de SPET que incluyen árboles coronarios genéricos (en función de la dominancia) que se superponen fácilmente a las imágenes tridimensionales de perfusión miocárdica, con adaptación del patrón de vaso al tamaño del ventrículo, e incluso con la técnica del gated-SPET, para cada una de las fases del ciclo cardíaco, de sístole a diástole, adaptándose a los cambios volumétricos existentes en la contracción ventricular.
En resumen, la superposición tridimensional de las imágenes de perfusión miocárdica y de la coronariografía es técnicamente posible, a partir de la información de la SPET y de las imágenes coronariográficas no necesariamente ortogonales ni simultáneas. Esto permite integrar una información anatómica (árbol coronario) y funcional (perfusión tisular miocárdica) que mejoraría la toma de decisiones por parte del cardiólogo y el tratamiento del paciente coronario. En el futuro debería trabajarse en potenciar el automatismo y la velocidad de estos programas de integración, así como en su inclusión en los equipos de trabajo habituales de hemodinámica y de medicina nuclear, para que los cardiólogos clínicos, intervencionistas y médicos nucleares puedan disponer de esta información de manera inmediata en sus equipos y la usen en la práctica diaria.
Correspondencia:
Dr. S. Aguadé Bruix.
Servicio de Medicina Nuclear. Hospital Universitari Vall d'Hebron.
P.o de la Vall d'Hebron, 119-129. 08035 Barcelona.
Correo electrónico: santi3@hg.vhebron.es