Full English text available from: www.revespcardiol.org/en
INTRODUCCIÓNEn el último año el número de publicaciones relevantes en los campos de la electrofisiología cardiaca, la arritmología clínica y la estimulación cardiaca ha sido tan elevado que es del todo imposible resumir en este artículo tanta información. Bajo esta premisa, hemos pretendido hacer una selección de las aportaciones que, a nuestro juicio, han tenido mayor trascendencia para el cardiólogo clínico y resumir su contenido tanto como fuera posible. Pedimos disculpas por las omisiones obligadas de muchos estudios de importancia clínica.
NOVEDADES EN EL TRATAMIENTO DE LA FIBRILACIÓN AURICULARAblación con catéterUn registro de la Sociedad Europea de Cardiología da una idea del manejo y los resultados de la ablación de la fibrilación auricular (FA) en Europa1. Tras 1 año de seguimiento, el éxito sin fármacos fue del 41% y con fármacos, del 73%, con un 1,7% de complicaciones mayores.
Diversos estudios intentan demostrar sin éxito que el abordaje del sustrato, más allá del aislamiento de las venas pulmonares, incrementaría estos resultados. Así, la realización de líneas adicionales y la ablación de electrogramas fraccionados o de áreas de frecuencia dominante no aportaron beneficio añadido2,3. Además, los grupos de ablación adicional tuvieron mayores tiempos de procedimiento, con mayor riesgo potencial de complicaciones. Por lo tanto, actualmente el aislamiento de venas pulmonares es el procedimiento más eficaz para el tratamiento de la FA.
Sin embargo, la capacidad para conseguir un aislamiento transmural y permanente con las técnicas actuales es limitada, centrándose los avances tecnológicos en la optimización del procedimiento. Al valorar la fibrosis auricular con resonancia magnética cardiaca, raramente se aprecia una escara completa en las zonas previamente ablacionadas. No parece que este dato se asocie a las recidivas, pero sí la fibrosis basal y la no incluida en las zonas de ablación4. La utilización de catéteres con sensor de fuerza de contacto crea lesiones más eficaces y persistentes y permite obtener mejores resultados en el seguimiento5. La ablación con crioenergía ha mejorado con la incorporación de balones de segunda generación y ha obtenido resultados similares a los de la radiofrecuencia6. La ablación con catéter-balón con energía láser se incorpora con un perfil de eficacia y seguridad aceptables, aunque son necesarios estudios con seguimiento a largo plazo7.
Manejo de los pacientes tras la ablaciónEl estudio AMIO-CAT8 ha demostrado que el uso de amiodarona durante los primeros 3 meses tras la ablación, aunque inicialmente disminuye las hospitalizaciones por recurrencia y cardioversiones, no reduce significativamente las recidivas a largo plazo.
El tratamiento intensivo del sobrepeso y otros factores de riesgo cardiovascular son claros predictores del éxito y la mejoría clínica tras la ablación9,10, por lo que es fundamental su control antes y después de la ablación. Esto se debe en parte a la influencia en el sustrato auricular9.
La reducción de las complicaciones embólicas periprocedimiento sigue acaparando mucho interés. El uso continuo de warfarina frente a la terapia puente con heparina se propone como una estrategia eficaz y segura para pacientes con alto riesgo embólico y disminuye las embolias y las hemorragias menores11.
Novedades en el tratamiento anticoagulante oralUna de las principales aportaciones durante el pasado año en el campo de los nuevos anticoagulantes orales ha sido la disponibilidad del idarucizumab, primer fármaco que revierte rápida y completamente el efecto del dabigatrán12.
Un subanálisis del estudio ARISTOTLE evaluó el efecto del apixabán y la warfarina en pacientes con enfermedad valvular moderada-grave (excepto aquellos con estenosis mitral grave o con prótesis mecánica). No se encontraron diferencias en cuanto a la tasa de accidente cerebrovascular y embolia sistémica, pero el apixabán redujo tanto la incidencia de hemorragia como la mortalidad13.
En pacientes en hemodiálisis, tanto el rivaroxabán como el dabigatrán se asociaron con más riesgo de hospitalización o muerte debida a hemorragia mayor que el tratamiento con warfarina14.
El estudio ORBIT-AF15 ha demostrado que la terapia puente con heparina para pacientes con FA no valvular que vayan a someterse a procedimientos quirúrgicos se asocia a mayor tasa de hemorragia y eventos mayores que la suspensión temporal sin terapia puente.
En cuanto al riesgo embolígeno y hemorrágico y el tratamiento anticoagulante, un registro de Taiwán16 (n=12.935) puso de manifiesto el beneficio de la anticoagulación oral en el subgrupo de pacientes de bajo riesgo: CHA2DS2-VASc (insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75 [doble], diabetes, ictus [doble], enfermedad vascular y categoría de sexo [mujeres])= 1 (varón), 2 (mujer). Un registro danés17 (n=39.400) respalda la evidencia de que los pacientes con menor puntuación en la escala CHA2DS2-VASc (0 [varón], 1 [mujer]) tienen bajo riesgo embolígeno, pero coincide con el registro taiwanés en que la presencia de un factor adicional supone un incremento significativo en la tasa de eventos embólicos. Por otra parte, el tratamiento con anticoagulantes orales en pacientes con antecedentes de hemorragia intracraneal, en comparación con el abandono de ese tratamiento, no solo disminuye la recurrencia de eventos isquémicos, sino que no se asocia a un incremento en la tasa de hemorragias recurrentes18.
Finalmente, hay que reseñar que se ha publicado un documento de consenso para el manejo del tratamiento antitrombótico para pacientes con FA y síndrome coronario agudo o intervencionismo percutáneo coronario o valvular19. En él se hace una llamada de atención a la triple terapia, se aconseja acortarla todo lo posible y se señala la posibilidad de doble terapia temprana y monoterapia para pacientes con enfermedad coronaria estable sin otro factor de riesgo.
Dieta y tratamiento farmacológico antiarrítmicoSe está demostrando la importancia del tipo de alimentación en el campo de la prevención de la FA. En un subánalisis20 del estudio PREDIMED, la dieta mediterránea suplementada con una cantidad determinada de aceite de oliva virgen extra redujo la incidencia de FA en pacientes con riesgo cardiovascular intermedio-alto.
Con respecto a los fármacos antiarrítmicos, persiste la controversia sobre el papel de la digoxina en el tratamiento de la FA. En un reciente estudio21 (n=2.267), esta tuvo un efecto neutro en el tiempo hasta el comienzo de los síntomas y en la hospitalización. En cuanto a la mortalidad, no aumentó entre los pacientes con insuficiencia cardiaca, pero sí entre los pacientes sin ella. También es reseñable el estudio RAFFAELO22, en el que la ranolazina tras la cardioversión de FA no prolongó el tiempo hasta la recurrencia, pero sí redujo la tasa.
AVANCES EN TRATAMIENTO Y PREVENCIÓN DE ARRITMIAS VENTRICULARESNuevas guías de práctica clínicaMuy recientemente, la Sociedad Europea de Cardiología ha publicado las nuevas guías de manejo de pacientes con arritmias ventriculares y prevención de la muerte súbita cardiaca (MSC), concebidas como una actualización de las publicadas conjuntamente con la American Heart Association y el American College of Cardiology en 2006, con mayor énfasis en la prevención de la MSC. Las tablas 1 y 2 recogen las recomendaciones de las principales opciones terapéuticas antiarrítmicas en prevención secundaria de MSC y las de implante de desfibrilador automático implantable (DAI) en prevención primaria23.
Indicaciones de las principales opciones terapéuticas antiarrítmicas en prevención secundaria de muerte súbita cardiaca para pacientes con arritmias ventriculares sostenidas
| Tratamiento | I | E |
|---|---|---|
| DAI | ||
| Con o sin cardiopatía estructural | ||
| Pacientes con FV o TVS mal tolerada hemodinámicamentea | I | A |
| Pacientes sometidos a ablación con catéter con criterios de implante de DAI | I | C |
| Pacientes con cardiopatía congénita y TVS sintomática, tras una evaluación hemodinámica y electrofisiológica | I | B |
| Pacientes con TVS recurrente independientemente de la función ventriculara | IIa | C |
| Pacientes con MAVD y TVS bien tolerada hemodinámicamente, con adecuado balance entre el riesgo de complicaciones a largo plazo y el beneficio del DAI | IIa | B |
| Pacientes con TVS mal tolerada hemodinámicamente tras la resolución de un episodio de miocarditis agudaa | IIa | C |
| Precozmente en pacientes con miocarditis de células gigantes o sarcoidosis con TVS mal tolerada hemodinámicamente o FVa | IIb | C |
| Canalopatías | ||
| Pacientes supervivientes a parada cardiaca abortada | I | C |
| Pacientes con SQTC o síndrome de Brugada con TVS espontánea documentada | I | C |
| Pacientes con TVPC y TVP o TV bidireccional a pesar de tratamiento óptimo | I | C |
| Pacientes con SQTL con TV en tratamiento con BB a dosis adecuada | IIa | B |
| Ablación con catéter | ||
| De forma urgente, en pacientes con escara relacionada con su cardiopatía, que presentan TV incesante o tormenta arrítmica | I | B |
| De forma urgente en pacientes con disfunción ventricular, portadores de DAI con TV incesante o tormenta eléctrica que causa descargasb | I | B |
| Ablación de EV precipitantes de FV recurrente que originan descargas del DAI o tormenta arrítmicab | I | B |
| En pacientes con cardiopatía isquémica o disfunción ventricular, portadores de DAI con descargas recurrentes del DAI debidas a TVS | I | B |
| Primera opción de tratamiento para pacientes con TVS por reentrada rama-rama | I | C |
| Como alternativa al DAI en pacientes con cardiopatía congénita y TVS monomórfica recurrente o portadores de DAI con terapias apropiadas que no se controlan mediante reprogramación del DAI o tratamiento médico | I | C |
| Después de un primer episodio de TVS en pacientes con cardiopatía isquémica o disfunción ventricular portadores de DAI | IIa | B |
| En pacientes con MAVD y episodios de TVS refractaria a tratamiento médico para prevenir descargas del DAIb | IIa | B |
| Como alternativa al tratamiento médico para pacientes con cardiopatía congénita y DAI con TV monomórfica sintomática | IIa | B |
| Para pacientes con miocardiopatía dilatada y TV refractaria a tratamiento médico (exceptuando TV por reentrada rama-rama) | IIb | C |
| Para pacientes con TV idiopática o extrasistolia ventricular sintomáticas o tras fracaso de tratamiento o EV con sospecha de taquimiocardiopatía | IIb | B |
| Amiodarona | ||
| Después de un primer episodio de TVS en pacientes con disfunción ventricular portadores de DAI | IIa | B |
| En pacientes portadores de DAI con descargas apropiadas recurrentes a pesar de programación óptima del dispositivo | IIa | C |
| Pacientes con FV o TV e indicación de DAI cuando este no esté disponible o esté contraindicado por razones médicas concurrentes o el paciente lo rechace | IIb | C |
| Otros fármacos antiarrítmicos | ||
| Quinidina para pacientes con síndrome de Brugada con indicación de DAI y alguna contraindicación o rechazo del implante o que requieran tratamiento de arritmias supraventriculares | IIa | C |
| Flecainida junto con BB para pacientes con TVPC con TVP o TV bidireccional recurrente en tratamiento con BB, cuando tengan contraindicaciones para DAI o este no esté disponible o el paciente lo rechace, así como en portadores de DAI para reducir las descargas apropiadas | IIa | C |
| Quinidina o sotalol para pacientes con SQTC e indicación de DAI y alguna contraindicación o rechazo del implante | IIb | C |
| Ablación quirúrgica | ||
| Para pacientes con TVS refractaria a fármacos antiarrítmicos y ablación con catéter por un electrofisiólogo expertob | I | B |
| Durante cirugía cardiaca (revascularización coronaria, cirugía valvular o cirugía de cardiopatías congénitas) en pacientes con TVS documentada clínicamente | IIb | C |
| Dispositivo de asistencia ventricular | ||
| Para pacientes hemodinámicamente inestables, con TVS o FV recurrente a pesar de tratamiento óptimo | IIa | B |
| Denervación simpática cardiaca izquierda | ||
| Para pacientes con SQTL sintomático e indicación de DAI que esté contraindicado o el paciente rechace o pacientes que tengan descargas apropiadas en tratamiento con BB | IIa | C |
| Para pacientes con TVPC y TVP o TV bidireccional o descargas del DAI en tratamiento con BB o BB+flecainida o que tengan intolerancia o contraindicación | IIb | C |
BB: bloqueadores beta; DAI: desfibrilador automático implantable; E: nivel de evidencia; EV: extrasístoles ventriculares; FV: fibrilación ventricular; I: indicación; MSC: muerte súbita cardiaca; MAVD: miocardiopatía arritmogénica del ventrículo derecho; SQTC: síndrome de QT corto; SQTL: síndrome de QT largo; TV: taquicardia ventricular; TVP: taquicardia ventricular polimórfica; TVPC: taquicardia ventricular polimórfica catecolaminérgica; TVS: taquicardia ventricular sostenida.
En ausencia de causas reversibles y no dentro de las primeras 48 h tras el infarto agudo de miocardio, en tratamiento médico óptimo y con expectativa de vida en buen estado funcional>1 año.
En centros especializados o con experiencia.
Basada en datos de la guía de la Sociedad Europea de Cardiología de 2015 sobre el manejo de pacientes con arritmias ventriculares y prevención de la muerte súbita cardiaca23.
Indicaciones de implante de desfibrilador automático implantable en prevención primaria
| Tipo de cardiopatía | I | E |
|---|---|---|
| Cardiopatía isquémica | ||
| Pacientes con CI sintomática (NYHA II-III) y FEVI ≤ 35%, al menos 6 semanas después de un infarto y después de al menos 3 meses de tratamiento óptimoa | I | A |
| En los primeros 40 días después de un IM en pacientes seleccionados: revascularización incompleta o disfunción del VI preexistente | IIb | C |
| Miocardiopatía dilatada | ||
| Pacientes con CI sintomática (NYHA II-III) y FEVI ≤ 35% después de al menos 3 meses de tratamiento óptimoa | I | B |
| Secundaria a una mutación en el gen LMNA y factores de riesgo clínicos: TVNS en Holter, FEVI<45%, sexo masculino y mutaciones sin cambio de sentido | IIa | B |
| Miocardiopatía hipertrófica | ||
| Pacientes con un riesgo de MSC estimado a 5 años ≥ 6%b | IIa | B |
| Pacientes con un riesgo de MSC estimado a 5 años ≥ 4-6%b | IIb | B |
| Pacientes con un riesgo de MSC estimado a 5 años<4%, si hay factores clínicos de probada importancia pronósticab | IIb | B |
| Miocardiopatía arritmogénica del VD | ||
| Pacientes adultos con 1 o más factores reconocidos de riesgo de arritmias ventriculares: síncope de etiología desconocida, disfunción grave del VI o el VD y antecedentes familiares de MSCb | IIb | C |
| Miocardiopatía chagásica | ||
| Pacientes con miocardiopatía chagásica y FEVI<40%a | IIa | C |
| Valvulopatías | ||
| Pacientes que después del tratamiento quirúrgico reúnen los criterios de implante por prevención primaria de MSC | I | C |
| Cardiopatías congénitas del adulto | ||
| Pacientes adultos con FEVI ≤ 35%, fisiología biventricular, IC sintomática a pesar de tratamiento médico óptimo y NYHA II-III | I | C |
| Pacientes con síncope de etiología desconocida en presencia de disfunción ventricular grave o TVS o FV inducible en el estudio electrofisiológico | IIa | B |
| Pacientes con tetralogía de Fallot y múltiples factores de riesgo de MSC, incluida disfunción del VI, TVNS, QRS ≥ 180 ms o TVS inducible en el estudio electrofisiológico | IIa | B |
| Pacientes con disfunción grave de un solo ventrículo o ventrículo derecho sistémico en presencia de otros factores de riesgo de MSC como TVNS, NYHA II-III o insuficiencia grave de la válvula AV sistémica | IIb | B |
| Canalopatías | ||
| Pacientes con torsades de pointes con acoplamiento corto | I | B |
| Pacientes con TVPC en pacientes con síncope recurrente a pesar de tratamiento óptimo (bloqueadores beta±flecainida) | I | C |
| Pacientes con SQTL y síncope en tratamiento con bloqueadores beta a dosis adecuada | IIa | B |
| Pacientes con SQTL asintomáticos, portadores de una mutación patogénica en KCNH2 o SCN5A con QTc>500 ms (asociado a tratamiento con bloqueadores beta) | IIb | C |
| Pacientes con síndrome de Brugada con patrón tipo I espontáneo y antecedentes de síncope | IIa | C |
| Pacientes con síndrome de Brugada e inducción de FV durante estimulación ventricular programada (con 2 o 3 extraestímulos desde 2 puntos) | IIb | C |
| Pacientes pediátricos | ||
| En combinación con tratamiento médico para pacientes de alto riesgo con canalopatías, miocardiopatías hereditarias o cardiopatías congénitas | I | B |
| Otras | ||
| Pacientes en lista de espera de trasplante cardiaco, independientemente de la etiología de su cardiopatía | IIa | C |
AV: auriculoventricular; CI: cardiomiopatía isquémica; DAI: desfibrilador automático implantable; E: nivel de evidencia; FEVI: fracción de eyección izquierdo; FV: fibrilación ventricular; I: indicación; IC: insuficiencia cardiaca; IM: infarto de miocardio; MSC: muerte súbita cardiaca; NYHA: New York Heart Association; SQTC: síndrome de QT corto; SQTL: síndrome de QT largo; TV: taquicardia ventricular; TVP: taquicardia ventricular polimórfica; TVPC: taquicardia ventricular polimórfica catecolaminérgica; TVNS: taquicardia ventricular no sostenida; TVS: taquicardia ventricular sostenida; VD: ventrículo derecho; VI: ventrículo izquierdo.
Con una expectativa de supervivencia de al menos 1 año, siguiendo una valoración clínica detallada que tenga en cuenta el riesgo de complicaciones a lo largo de la vida, el impacto del desfibrilador automático implantable en el estilo de vida, el estado socioeconómico y la salud psíquica e indique un beneficio neto del desfibrilador automático implantable.
Basada en datos de la guía de la Sociedad Europea de Cardiología de 2015 sobre el manejo de pacientes con arritmias ventriculares y prevención de la muerte súbita cardiaca23. En esta guía no se considera el implante de desfibrilador automático implantable para pacientes con fracción de eyección del ventrículo izquierdo<30% en clase funcional I de la New York Heart Association ni las indicaciones tipo Multicenter Automatic Defibrillator Implantation Trial o Multicenter Unsustained Tachycardia Trial.
Dada la dificultad de realizar estudios aleatorizados que demuestren un aumento en la supervivencia con la ablación de la taquicardia ventricular (TV), se buscan signos indirectos de dicho beneficio en grandes registros. Se ha publicado un metanálisis de 998 pacientes con cardiopatía isquémica y TV sometidos a ablación con catéter. La no inducibilidad tras la ablación se asoció con mayor supervivencia24. Dicha asociación podría estar matizada por la fracción de eyección del ventrículo izquierdo (FEVI) y darse únicamente en los pacientes con FEVI>30%25.
En los últimos años, el objetivo de esta técnica ha evolucionado hacia una ablación más extensa que consiga la no inducibilidad de cualquier TV. Recientemente, se han publicado 2 series, principalmente de pacientes isquémicos, en busca de dichos objetivos. La primera utiliza la técnica de dechanneling, que aborda los puntos de salida y entrada de los canales dentro de la escara acompañada de técnicas clásicas de cartografía de TV inducibles a posteriori26. La segunda aborda directamente todos los potenciales retrasados dentro de la escara27. Ambos trabajos incluyen muestras de alrededor de 100 pacientes con buenos resultados a 20 meses: recidiva de TV en el 28 y el 32% respectivamente.
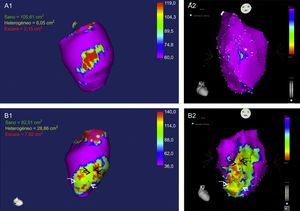
Siguiendo el objetivo de una ablación extensa, el acceso sistemático endoepicárdico en pacientes isquémicos no seleccionados se relaciona con menor tasa de ingresos por TV y reablación si se compara con un abordaje únicamente endocárdico28. Sin embargo, hay un pequeño porcentaje de pacientes que no tienen escara o no tienen sustrato abordable en el epicardio28. En el último año, se publicó un estudio29, realizado en cerdos con infarto crónico, en el que se muestra la potencial utilidad de la resonancia magnética cardiaca para detectar a dichos pacientes. En él, se comprobó que la detección mediante perfusión de gadolinio de «zonas grises heterogéneas» en la capa más externa epicárdica predice la inducibilidad de TV de origen epicárdico en el estudio electrofisiológico (figura 1)29.
A1 y A2: ejemplo de cerdo sin taquicardia ventricular inducible; escara epicárdica de pequeño tamaño con mínima extensión de tejido heterogéneo (A1: resonancia magnética, A2: mapa de voltaje, sistema CARTO). B1 y B2: ejemplo de cerdo con taquicardia ventricular inducible epicárdica (escara epicárdica con patrón parcheado, con al menos 3 islotes de escara densa rodeados de tejido heterogéneo). Las flechas señalan los canales. Cortesía de los Dres. Angel Arenal y Ester Pérez David. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
En relación con las arritmias ventriculares del tracto de salida, una distancia a la válvula pulmonar>1cm del electrograma más precoz en el tracto de salida derecho predice un origen izquierdo30. Por otro lado, se confirma la dificultad en la ablación de este tipo de arritmias ventriculares cuando el origen se encuentra próximo al denominado summit ventricular con una eficacia aguda en torno al 50%31.
Desfibrilador automático implantableLos datos del Registro Español de Desfibrilador Automático Implantable del año 201332 muestran un aumento en el número de implantes respecto al año previo (4.772 y 4.216), de tal manera que supera a los de 2010, que marcaban el mayor número anual (4.627 implantes) en este registro desde su inicio. La tasa de implantes por millón de habitantes en España sigue estando a la cola de los países europeos y tiene la mayor diferencia respecto a la media, según los datos de EUCOMED (European Confederation of Medical Suppliers Associations) (120 frente a 289 de media en Europa).
Los avances tecnológicos y la experiencia acumulada cuestionan la necesidad de realizar una prueba de desfibrilación durante el implante. El SIMPLE33 es un estudio multicéntrico de no inferioridad en el que se aleatorizó 1:1 a 2.500 pacientes con indicación de DAI a que se les realizara o no una prueba de umbral de desfibrilación. Tras un seguimiento medio de 3,1 años, no se encontraron diferencias entre los grupos respecto al objetivo combinado de descarga apropiada fallida o muerte arrítmica, lo que aporta evidencia firme sobre la seguridad de no realizar esta prueba.
Dicha prueba se sigue realizando de manera mayoritaria en el implante de DAI subcutáneo, con el que la experiencia es más reducida. Arias et al34 comunicaron la mayor experiencia nacional con esta terapia, con buenos resultados. Un análisis combinado de datos de 852 pacientes con DAI subcutáneo35 refleja la excelente eficacia del dispositivo, sin casos de fallos del electrodo y con una tasa de terapias inapropiadas del 5% en el último cuartil de inclusión de los pacientes.
Un subanálisis del estudio ADVANCE III36 ha demostrado que programar tiempos largos de detección en los DAI transvenosos evita tratar arritmias autolimitadas, incluso en los pacientes de prevención secundaria, sin que aumenten los episodios sincopales.
Estratificación de riesgo de muerte súbita en pacientes con cardiopatía estructuralEn la miocardiopatía hipertrófica, se ha desarrollado y validado un nuevo modelo de predicción de riesgo de MSC37 en el que se estima el riesgo individual a 5 años utilizando variables clínicas, de ayuda a la hora de tomar decisiones terapéuticas, como el implante de DAI, y de limitar el bajo valor predictivo positivo de MSC de modelos previos, como queda bien evidenciado en el trabajo de Sarrias et al38.
Identificar a los pacientes que más puedan beneficiarse de un DAI es un problema complejo sin resolver en el perfil de paciente mayoritario que recibe un DAI. En este sentido, probablemente el análisis y la cuantificación de biomarcadores séricos ayuden a identificar a pacientes con alto riesgo de muerte antes de que tengan arritmias ventriculares, como se refleja en el estudio PROSE-ICD39.
También es muy relevante conocer los predictores de morbimortalidad tras el recambio de un DAI, especialmente en ancianos y pacientes con importantes comorbilidades, para quienes el riesgo del recambio podría superar el beneficio clínico esperado. La escala de riesgo REPLACE DARE40 se ha elaborado para identificar a los pacientes con alto y bajo riesgo de muerte a los 6 meses del recambio de un dispositivo electrónico cardiaco implantable, incluido el DAI.
CanalopatíasEl estudio FIVI-Gen41 es un registro multicéntrico español de pacientes con fibrilación ventricular idiopática sometidos a un algoritmo diagnóstico secuencial que incluye tests farmacológicos y estudio familiar y genético. En él se apunta por primera vez a la utilidad del test genético a gran escala en ausencia de fenotipo en probandos, así como la utilidad diagnóstica de estudiar a los familiares41.
Respecto al síndrome de QT largo, un estudio que analiza la utilidad de diferentes bloqueadores beta en función del genotipo subyacente, indica que el propranolol podría ser el menos eficaz en casos con eventos clínicos previos. El nadolol se utilizaría preferentemente en el tipo 2, pero no se observaron diferencias significativas entre los 4 bloqueadores beta analizados en el tipo 142.
El conocimiento de los efectos a largo plazo de la simpatectomía cardiaca ha supuesto un avance en la estrategia terapéutica en la TV catecolaminérgica polimórfica. De Ferrari et al43 han realizado el seguimiento medio más prolongado hasta la fecha (37 meses) a 63 pacientes con dicha canalopatía sometidos a simpatectomía cardiaca, con o sin terapia médica óptima. Los datos indican un efecto beneficioso a largo plazo, con reducción significativa de la tasa de síncopes, descarga apropiada del DAI y MSC en los pacientes intervenidos en prevención secundaria.
En cuanto a la predicción del riesgo de MSC en pacientes con síndrome de Brugada, continúa la controversia acerca del valor de la estimulación programada en la estratificación de riesgo arrítmico, a la luz de datos de seguimiento muy prolongado, que nuevamente indican que la inducibilidad de fibrilación ventricular mediante estimulación programada es un predictor de MSC44.
AVANCES EN EL MANEJO DE PACIENTES CON SÍNCOPEImportancia de las unidades de síncopeHay cada vez más evidencia respecto a la necesidad de protocolizar la atención de pacientes con síncope en unidades especializadas, ya que conlleva menor morbimortalidad, mayor rentabilidad diagnóstica y reducción de costes. En este sentido, la European Heart Rhythm Association (EHRA) ha publicado un documento de consenso que propone un abordaje sistemático del paciente con síncope en unidades específicas45.
Infrautilización del registrador de eventos insertableA pesar de que la evidencia clínica hasta la fecha demuestra el papel esencial del registrador de eventos insertable en el manejo del síncope recurrente de origen desconocido, una encuesta retrospectiva de la EHRA demuestra que este recurso está infrautilizado en Europa respecto a lo recomendado en las guías de práctica clínica46.
Aspectos pronósticos: predictores de la necesidad de implante de marcapasos y de mortalidadBrignole et al47 han comprobado que la demostración de asistolia mediante masaje de seno carotídeo, mesa basculante o registrador de eventos insertable en sujetos mayores de 40 años predice un beneficio futuro del implante de marcapasos. En esta misma línea, un estudio realizado en pacientes con síncope o presíncope inexplicado, portadores de registrador de eventos insertable, demuestra que la historia de traumatismo atribuible al síncope es el principal predictor independiente de implante48.
Pérez-Rodon et al49 demuestran el valor pronóstico independiente de mortalidad de varios parámetros electrocardiográficos en pacientes con síncope como la FA, los trastornos de conducción intraventricular, la hipertrofia ventricular o el ritmo estimulado.
NOVEDADES EN ESTIMULACIÓN CARDIACAMarcapasos sin cableActualmente existen 2 modelos de dispositivos monocamerales (Nanostim® de St. Jude Medical® y Micra® de Medtronic®) que se fijan directamente a la pared del ventrículo derecho en ápex o septo bajo, a través de una vaina percutánea introducida por vena femoral y dotada de un sistema de liberación (figura 2 y tabla 3)50.
Características de los marcapasos sin cables
| Características | Micra® | Nanostim® |
|---|---|---|
| Tamaño | 24 mm | 42 mm |
| Volumen y peso | 1 ml; 1,75 g | 1 ml; 2 g |
| Modo de estimulación | VVIR | VVIR |
| Introductor | 23 Fr | 18 Fr |
| Vida media | 10 años | 10 años |
| Fijación | Anzuelo | Hélice |
| Compatible con resonancia magnética | Cuerpo entero | Aún no compatible |
Ritter et al51 han presentado los resultados de un estudio prospectivo, no controlado y multicéntrico sobre la seguridad y la eficacia del dispositivo Micra®, que incluyó a 140 pacientes. La tasa de éxito en el implante fue del 100%, con una duración media del procedimiento de 37±21 min y un tiempo de escopia de 9±7 min. En un seguimiento medio de 1,9±1,8 meses, no se produjeron eventos adversos graves.
Manejo de la anticoagulación en los implantes de dispositivosUn nuevo metanálisis refuerza la evidencia sobre la seguridad de continuar la anticoagulación oral frente a la terapia puente con heparina en pacientes que requieran un implante o recambio de sistemas de estimulación cardiaca. Sus resultados reflejan menor incidencia de hemorragia, sin diferencias en el riesgo tromboembólico52.
Cano et al53 han evaluado la estrategia de no suspender la anticoagulación oral con independencia del riesgo tromboembólico en 278 pacientes con INR (razón internacional normalizada) 2-4 a los que se realizó un primoimplante o recambio de dispositivo, y se documentó baja incidencia de hematoma en bolsa (2,9%) y sin desarrollo de eventos tromboembólicos.
Seguimiento remoto en estimulación cardiacaEn el último año, la mayoría de los trabajos publicados se centran en la disminución de morbimortalidad de la que se benefician los pacientes en seguimiento remoto. El ensayo clínico IN-TIME54 demostró mejoría clínica y pronóstica de los pacientes portadores de DAI con o sin terapia de resincronización cardiaca (TRC) en seguimiento remoto. Tras un seguimiento de 1 año, se redujo significativamente el objetivo primario de una puntuación clínica que combinaba, entre otros, la mortalidad por cualquier causa, el ingreso hospitalario por insuficiencia cardiaca y el cambio en la clase funcional. El estudio observacional publicado por Varma et al55, sobre una cohorte de 269.471 pacientes portadores de marcapasos con o sin TRC y DAI con o sin TRC, refuerza estos resultados.
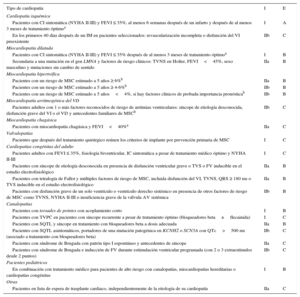
TERAPIA DE RESINCRONIZACIÓN CARDIACANueva guía de práctica clínicaLa nueva guía de manejo de pacientes con arritmias ventriculares y prevención de MSC de la Sociedad Europea de Cardiología actualiza las indicaciones de TRC (figura 3)23.
Indicaciones de terapia de resincronización cardiaca ± desfibrilador automático implantable según la guía de la Sociedad Europea de Cardiología23. BiV: biventricular; BRI: bloqueo de rama izquierda; CF: clase funcional; DAI: desfibrilador automático implantable; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; NAV: nódulo auriculoventricular; NYHA: New York Heart Association; TRC: terapia de resincronización cardiaca. aEn buen estado funcional. bSi se prevé estimulación biventricular próxima al 100%. cIndependientemente de morfología de QRS y para reducir ingresos por insuficiencia cardiaca.
El uso de cables cuadripolares en el ventrículo izquierdo en la TRC se asocia a una reducción del tiempo de procedimiento y escopia, y menor incidencia de estimulación frénica y de desplazamientos. Behar et al56 han demostrado recientemente su efecto beneficioso en la mortalidad total.
En cuanto a la estimulación multipunto del ventrículo izquierdo, 2 estudios demuestran sus mejores resultados con respecto a la estimulación biventricular convencional, tanto en parámetros hemodinámicos agudos (gasto cardiaco y FEVI)57 como en los de remodelado del ventrículo izquierdo (FEVI y volumen telesistólico)58.
Predictores de respuesta a la terapia de resincronización cardiacaLos resultados de un metanálisis confirman el efecto deletéreo de la TRC en pacientes con QRS<130 ms, con un aumento de la mortalidad total que es incluso significativo en los pacientes con asincronía ecocardiográfica59.
Otro metanálisis, que incluye a más de 4.000 pacientes en clase funcional II de la New York Heart Association aleatorizados a DAI con o sin TRC, demuestra una mayor disminución de la mortalidad y la insuficiencia cardiaca en pacientes con DAI-TRC. Este beneficio se observa principalmente en pacientes con bloqueo de rama izquierda, en mujeres con QRS ≥ 130 ms y varones con QRS ≥ 150 ms60.
Se ha demostrado que la presencia de extrasistolia auricular y ventricular se asocia a un porcentaje de estimulación biventricular subóptimo. En un estudio reciente, un porcentaje ≥ 0,1% de extrasístoles se relacionó con peor remodelado ventricular y aumento de la mortalidad total y aparición de insuficiencia cardiaca61.
También se ha publicado información novedosa sobre el tiempo de activación en el electrodo como predictor de respuesta a la TRC. De Riva-Silva et al62 observaron que un tiempo ≥ 72 ms puede diferenciar entre respondedores y no respondedores, con una sensibilidad del 83% y una especificidad del 71%.
Arritmias ventriculares en pacientes con terapia de resincronización cardiacaDos estudios ponen de manifiesto que, aunque la incidencia de terapias apropiadas es menor en pacientes respondedores, siguen produciéndose incluso en los superrespondedores. García-Lunar et al63 observaron, en un seguimiento medio de 30 meses, que el riesgo de terapias apropiadas era del 24,2% para los no respondedores, el 22,2% para los respondedores y el 5,9% para los superrespondedores. En un subestudio del MADIT-CRT64 se han obtenido resultados superponibles, con un riesgo de terapias apropiadas, en un seguimiento medio de 3 años, del 6% en pacientes con FEVI>50% tras la TRC.
CONFLICTO DE INTERESESNinguno.