La fragilidad es un síndrome clínico que ocurre durante el envejecimiento, que se caracteriza por una disminución de la reserva fisiológica ante una situación de estrés y constituye un estado de vulnerabilidad que conlleva mayor riesgo de un resultado adverso. Su prevalencia en España es alta, especialmente en ancianos con comorbilidad y enfermedades crónicas. En el caso de la enfermedad cardiovascular, la fragilidad determina peores resultados clínicos, con mayor morbimortalidad en todos los escenarios, agudos y crónicos; por lo tanto, puede condicionar el diagnóstico y el tratamiento de los pacientes. A pesar de todo ello, se trata de un problema que con frecuencia no se aborda ni se incluye al planificar la atención al paciente mayor con cardiopatía. En este trabajo se repasa la evidencia científica disponible y se destacan las escalas más adecuadas para la medición y la valoración de la fragilidad, algunas con mayor utilidad y mejor capacidad predictiva según el contexto clínico en que se apliquen, y se resalta también la importancia de evaluarla para identificar su presencia e incluirla en el plan individualizado de tratamiento y cuidados que mejor se adapte a cada paciente.
Palabras clave
El concepto de fragilidad se ha ido incluyendo cada vez más en el estudio y el tratamiento del paciente mayor con enfermedad cardiovascular (ECV), aunque no siempre de manera uniforme1. El creciente número de ancianos en las sociedades desarrolladas y los avances en el tratamiento de las principales cardiopatías hacen que la mayoría de los ingresos hospitalarios por ECV sean de personas mayores de 65 años y que la principal causa de muerte a partir de los 75 años sea la ECV. Paralelamente, y debido a que la mayoría de los ensayos clínicos no han incluido a los ancianos, y cuando los incluyen no evalúan la fragilidad, la evidencia científica para el mejor tratamiento y cuidado del paciente mayor frágil con cardiopatía es escasa. Por ello, distintas sociedades científicas han considerado la fragilidad en el anciano con cardiopatía un área prioritaria de investigación2 para dilucidar su papel pronóstico y las mejores intervenciones para su tratamiento, en distintos contextos clínicos.
¿QUÉ ES LA FRAGILIDAD Y POR QUÉ ES IMPORTANTE EVALUARLA?La fragilidad es un síndrome caracterizado por una disminución de la reserva biológica que ocurre durante el envejecimiento. Resulta del declinar en la función de los distintos sistemas fisiológicos, que deja a la persona en una situación de especial vulnerabilidad frente a cualquier situación de estrés y se considera un marcador de la edad biológica del individuo3. La prevalencia de la fragilidad entre los sujetos de 65 o más años sin discapacidad que viven en la comunidad (no institucionalizados) oscila entre el 4 y el 14% en los distintos países europeos, y llega hasta el 21% en España4. La fragilidad es más común entre los pacientes con ECV, asociación que es bidireccional: los pacientes frágiles tienen mayor riesgo de ECV y quienes tienen ECV clínica y subclínica están en mayor riesgo de deterioro de su función física5.
Los individuos con fragilidad tienen riesgo de peores resultados clínicos de la ECV6, con mayor morbimortalidad en todos los escenarios clínicos, agudos y crónicos, como se revisa detalladamente en este documento. En el Canadian Study of Health and Aging, el riesgo ajustado de mortalidad a 5 años fue 4,8 (intervalo de confianza del 95%, 3,7-6,2) para los sujetos con fragilidad moderada y 7,3 (intervalo de confianza del 95%, 4,7-11,4) para aquellos con fragilidad avanzada7. En las personas con ECV, el estudio Cardiovascular Health Study encontró una asociación similar de los estados de prefragilidad y fragilidad con las caídas, la pérdida funcional, la hospitalización y la mortalidad a los 3-7 años de seguimiento8.
Finalmente, el efecto de la fragilidad es mucho mayor que la contribución de la comorbilidad en los modelos predictivos de nueva discapacidad, especialmente al aumentar la edad9.
La fragilidad es un concepto distinto de la comorbilidad y la discapacidad8. La comorbilidad se define como la concomitancia de enfermedades que pueden modificar el tratamiento o el curso evolutivo de una enfermedad índice. La comorbilidad no implica necesariamente fragilidad, aunque la fragilidad es más frecuente en los pacientes con alto grado de comorbilidad, por lo que siempre hay que evaluar su causa. La discapacidad se entiende como la dificultad para realizar actividades de la vida diaria. La fragilidad (fragilidad física) puede entenderse como un estado previo a la discapacidad o como un conjunto de déficit (fragilidad multidimensional) que definen una situación de vulnerabilidad. Por todo ello, la fragilidad se debe considerar como uno de los principales factores asociados con resultados adversos, de modo que puede ser de gran utilidad en la toma de decisiones clínicas y el diseño de un plan de cuidados individualizado.
¿CÓMO SE MIDE LA FRAGILIDAD?Existen 2 aproximaciones principalmente utilizadas para caracterizar la fragilidad. La primera considera la fragilidad como un fenotipo de mala función física, y se apoya fundamentalmente en 2 medidas objetivas: la fuerza de prensión y la velocidad de la marcha (fragilidad física). La escala más utilizada en este modelo es la Fried, descrita y validada en el Cardiovascular Health Study8, que define fragilidad por la presencia de 3 o más de las siguientes características (la presencia de 1 o 2 factores se considera un estado de prefragilidad):
- 1.
Pérdida de peso:> 4,5kg o> 5% en el último año y no intencionada.
- 2.
Autopercepción de agotamiento: es declarada y se identifica según 2 preguntas del cuestionario del Center for Epidemiological Studies-Depression (CES-D):
- –
¿Sintió usted la mayor parte del tiempo que todo lo que hacía le suponía un esfuerzo?
- –
¿Sintió que no podía seguir adelante?
Las respuestas pueden ser: a) raramente o nunca; b) 1 o 2 días; c) 3 o 4 días; d) la mayor parte del tiempo. Se considera criterio positivo de fragilidad una respuesta ≥ 2.
- –
- 3.
Debilidad: fuerza máxima de prensión digital con dinamómetro ajustado por sexo e índice de masa corporal (IMC). El paciente tiene que estar sentado, preferiblemente con la mano dominante y el codo a 90°. Se considera el valor más alto de 3 mediciones separadas 1min (varones, IMC ≤ 24: fuerza ≤ 29; IMC ≤ 28: fuerza ≤ 30; IMC> 28: fuerza ≤ 32; mujeres, IMC ≤ 23: fuerza ≤ 17; IMC 23,1-26: fuerza ≤ 17,3; IMC 26,1-29: fuerza ≤ 18; IMC> 29: fuerza ≤ 21).
- 4.
Velocidad de la marcha (tiempo para recorrer 4,57 m a paso habitual, ajustado por sexo y estatura): varones de estatura ≤ 173cm, ≥ 7 s; estatura> 173cm, ≥ 6 s; mujeres de estatura ≤ 159cm, ≥ 7 s; estatura> 159cm, ≥ 6 s.
- 5.
Bajo nivel de actividad física (gasto energético semanal en actividad física): varones, <383kcal/semana; mujeres, <270kcal/semana (se corresponde con un número de horas semanales de paseo o el equivalente a nadar, bicicleta, tenis, etc.; pasear: varones, <2,30 h/semana; mujeres, <2h/semana).
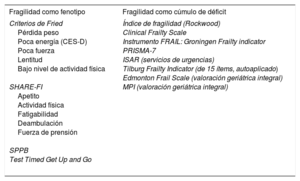
Se han propuesto otras escalas derivadas del fenotipo de fragilidad o algunos de sus dominios para conseguir una mejor aplicabilidad a escenarios clínicos específicos10 (tabla 1). La escala SHARE-FI, basada en los criterios de Fried, incorpora 5 ítems consistentes en preguntas que responde el paciente y la valoración de la fuerza de agarre manual con el dinamómetro.
Instrumentos para la evaluación de la fragilidad más utilizados en cardiología, según las 2 aproximaciones conceptuales principales
| Fragilidad como fenotipo | Fragilidad como cúmulo de déficit |
|---|---|
| Criterios de Fried Pérdida peso Poca energía (CES-D) Poca fuerza Lentitud Bajo nivel de actividad física SHARE-FI Apetito Actividad física Fatigabilidad Deambulación Fuerza de prensión SPPB Test Timed Get Up and Go | Índice de fragilidad (Rockwood) Clinical Frailty Scale Instrumento FRAIL: Groningen Frailty indicator PRISMA-7 ISAR (servicios de urgencias) Tilburg Frailty Indicator (de 15 ítems, autoaplicado) Edmonton Frail Scale (valoración geriátrica integral) MPI (valoración geriátrica integral) |
CES-D: Center for Epidemiological Studies-Depression; MPI: Multidimensional Prognostic Index; SPPB: Short Physical Performance Battery.
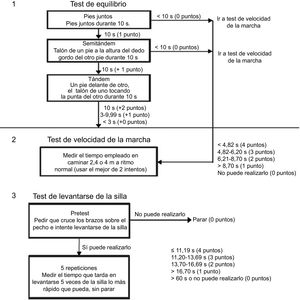
El test de rendimiento físico propuesto para los ensayos clínicos de fragilidad es la Short Physical Performance Battery (SPPB) (Comité para los Productos Medicinales de Uso Humano, Agencia Europea del Medicamento, 2015), que consta de 3 pruebas: equilibrio, velocidad de la marcha y levantarse/sentarse en una silla 5 veces (figura 1).
A diferencia del anterior enfoque, que entendía la fragilidad como un estadio previo a la dependencia, el segundo considera la fragilidad como la consecuencia del déficit acumulado de comorbilidades, discapacidades, síntomas y datos de laboratorio asociados con malos resultados (fragilidad multidimensional), así que su medición incluye la comorbilidad y la dependencia. El Frailty Index, que entiende la fragilidad como un continuo, incluye más de 70 ítems y permite cuantificarla como un cociente (déficit presentes/total de déficit considerados) que va de 0 a 111. Derivada de esta, la Clinical Frailty Scale (CFS) es un instrumento de cribado que se basa en el juicio clínico del profesional sanitario12 (figura 2). Esta aproximación a la fragilidad como acumulación de déficit se ha utilizado también en el Electronic Frailty Index, incluido en la historia clínica electrónica en Reino Unido, mediante el cual se evalúa a todo paciente anciano que va a someterse a cirugía13. También desarrollada como instrumento de cribado en la población general, se encuentra la escala FRAIL, que es la más fácil de aplicar, menos de 2min, con preguntas que responde el paciente, y no incorpora pruebas físicas ni parámetros de laboratorio14 (tabla 2).
Clinical Frailty Scale. Reproducido con permiso de Rockwood et al.12.
Escala FRAIL (fragilidad con 3 o más de los siguientes 5 puntos)
| Ítem | Valoración | Respuesta | |
|---|---|---|---|
| Fatiga | ¿Se siente cansado la mayor parte del tiempo? | Sí | No |
| Resistencia | ¿Puede subir un piso de escaleras sin hacer pausas y sin ayuda? | Sí | No |
| Ambulación | ¿Es capaz de caminar 100 m sin hacer pausas y sin ayuda? | Sí | No |
| Imperativo tener más de 5 de los siguientes síntomas | Artritis, diabetes, angina/infarto, hipertensión, accidente cerebrovascular, asma, bronquitis crónica, enfisema, osteoporosis, cáncer colorrectal, cáncer cutáneo, depresión/ansiedad, demencia, úlceras en las piernas | Sí | No |
| La pérdida de peso | Pérdida de peso> 5% en el último año | Sí | No |
La escala ISAR (Identification of Seniors at Risk), que tiene 6 preguntas respondidas por el paciente, se ha utilizado como instrumento de cribado de fragilidad en el ámbito de los servicios de urgencias, y puede ser de ayuda a la hora de seleccionar qué pacientes se benefician de una valoración geriátrica15 (tabla 1). En algunos contextos clínicos específicos, se han desarrollado escalas predictivas de evolución que incluyen aspectos clínicos y analíticos y parámetros de función física. Este es el caso de la escala de Green (tabla 3), desarrollada para la valoración de los pacientes con estenosis aórtica (EAo) o la Essential Frailty Toolset, que predice mala evolución en los pacientes con EAo grave sometidos a implante percutáneo de válvula aórtica (TAVI). Estos instrumentos, aunque no han sido validados como escalas de fragilidad propiamente frente a un patrón de referencia para valoración geriátrica en la población general, se han mostrado útiles en contextos clínicos específicos, como se describe a continuación.
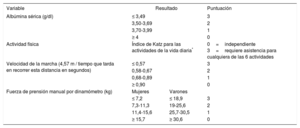
Escala de Green
| Variable | Resultado | Puntuación | |
|---|---|---|---|
| Albúmina sérica (g/dl) | ≤ 3,49 | 3 | |
| 3,50-3,69 | 2 | ||
| 3,70-3,99 | 1 | ||
| ≥ 4 | 0 | ||
| Actividad física | Índice de Katz para las actividades de la vida diaria* | 0=independiente 3=requiere asistencia para cualquiera de las 6 actividades | |
| Velocidad de la marcha (4,57 m / tiempo que tarda en recorrer esta distancia en segundos) | ≤ 0,57 | 3 | |
| 0,58-0,67 | 2 | ||
| 0,68-0,89 | 1 | ||
| ≥ 0,90 | 0 | ||
| Fuerza de prensión manual por dinamómetro (kg) | Mujeres | Varones | |
| ≤ 7,2 | ≤ 18,9 | 3 | |
| 7,3-11,3 | 19-25,6 | 2 | |
| 11,4-15,6 | 25,7-30,5 | 1 | |
| ≥ 15,7 | ≥ 30,6 | 0 | |
El índice de Katz es una escala sencilla que consta de 6 elementos y evalúa las actividades básicas de la vida diaria proporcionando un índice de autonomía-dependencia. Permite evaluar el estado funcional general del paciente, comparar individuos y grupos y detectar también cambios a lo largo del tiempo.
La implementación del uso de estas escalas en la práctica clínica diaria no es fácil, algunas consumen mucho tiempo o no son factibles en una situación aguda. De modo resumido, las escalas basadas en la fragilidad física (fenotipo de fragilidad) deben aplicarse a pacientes sin discapacidad establecida, mientras que las fundamentadas en la fragilidad multidimensional (acumulación de deficiencias) pueden aplicarse a pacientes con cualquier estadio de discapacidad, aunque son más apropiadas en situaciones de discapacidad moderada-avanzada. En caso de situaciones agudas, son preferibles escalas autoaplicables o basadas en el juicio clínico subjetivo del personal sanitario16. Múltiples estudios han demostrado la utilidad de estos instrumentos en diferentes contextos, pero ninguno tiene la sensibilidad y la especificidad suficientes para utilizarlo para la identificación individual de fragilidad en un paciente concreto y en una situación clínica específica17.
La valoración más ampliamente validada en la práctica clínica y con mayor grado de evidencia de beneficio es la Valoración Geriátrica Integral (Comprehensive Geriatric Assessment)18, que requiere una evaluación clínica, funcional, cognitiva, social y nutricional por diferentes profesionales para diseñar un plan de tratamiento y seguimiento. Es la mejor herramienta diagnóstica de la fragilidad, y permite tener una visión global y un diagnóstico situacional completo. Se ha demostrado que su utilización sistemática aumenta la probabilidad de que un anciano frágil esté vivo y en su domicilio a largo plazo tras la hospitalización18. La principal limitación es que requiere tiempo y personal especializado. Por ello, se han desarrollado escalas derivadas de la valoración geriátrica con el fin de que médicos no geriatras puedan llevar a cabo una valoración abreviada, como por ejemplo el MPI (Multidimensional Prognostic Index) y la EFS (Edmonton Frail Scale).
CONSIDERACIONES SOBRE LA FRAGILIDAD PREVIAS A SU EVALUACIÓN EN LOS DISTINTOS ESCENARIOSEn cuanto a la fragilidad, hay que resaltar los siguientes aspectos:
- •
La fragilidad debe distinguirse de la comorbilidad y la discapacidad.
- •
Idealmente la fragilidad debería medirse en la comunidad, de modo que esa evaluación estuviera disponible cuando el paciente acudiera al hospital o experimentara un evento agudo.
- •
La fragilidad en pacientes sin discapacidad avanzada es una situación potencialmente prevenible y/o tratable que podría mejorar controlando determinadas enfermedades, revisando la polifarmacia, mediante algunas intervenciones nutricionales o el ejercicio físico adaptado, que previenen la fragilidad o incluso la revierten en cierto grado.
- •
Que la fragilidad no conlleve discapacidad avanzada no contraindica ninguna intervención. El anciano frágil con ECV es un paciente con alto riesgo de mortalidad, morbilidad y complicaciones médicas. Las decisiones diagnósticas y terapéuticas deberían ser multidisciplinarias y tener en cuenta los valores y las preferencias del paciente. La detección de fragilidad siempre identifica a pacientes que precisarán una monitorización estrecha e intervención precoz en los aspectos potencialmente modificables con el fin de disminuir los resultados adversos.
El 80% de los pacientes con insuficiencia cardiaca (IC) tienen más de 65 años, y a menudo en el momento del diagnóstico exceden los 8019. En el paciente mayor, además de la edad, hay que considerar la presencia de otros factores que empeoran el pronóstico, como las comorbilidades y los síndromes geriátricos6,8,20, la depresión21 y el deterioro cognitivo22. Estos pacientes tienen, además, altas tasas de dependencia para las actividades de la vida diaria.
La fragilidad en la IC tiene gran prevalencia20,23; entre los pacientes ancianos con IC del Cardiovascular Health Study, se describe una prevalencia de fragilidad que es 7,5 veces mayor que en la población general24, se asocia con un mayor riesgo de empeoramiento de la clase funcional y duplica el riesgo de reingreso y mortalidad hospitalaria25.
Los criterios más comúnmente utilizados para identificar la presencia de fragilidad en el paciente con IC son los introducidos por Fried (tabla 1). Se ha demostrado que la CFS (figura 2) predice institucionalización y mortalidad a medio plazo, incluso en pacientes hospitalizados12,26. Dados su sencillez y su valor pronóstico, se recomienda su utilización para la evaluación de la fragilidad en el paciente mayor con IC ambulatoria.
La evaluación de fragilidad puede guiar decisiones clínicas importantes a través de una mejor comprensión de la vulnerabilidad y el riesgo del paciente27. También hay evidencia emergente de que se puede modular la fragilidad, hasta el punto de que el fenotipo de fragilidad en pacientes con IC más jóvenes podría ser en parte consecuencia de la propia enfermedad y podría revertirse con terapias avanzadas como dispositivos de asistencia circulatoria o trasplante cardiaco28. Aunque no está claro hasta qué punto es posible tal mejora en pacientes ancianos frágiles, estos datos subrayan la importancia de optimizar la terapia de IC, por un lado, y realizar una evaluación multidimensional del anciano con IC abordando los síndromes geriátricos que sí pudieran revertirse al menos parcialmente.
Insuficiencia cardiaca agudaLa prevalencia de fragilidad entre los pacientes con IC aguda oscila entre el 50 y el 70%29–32 y su presencia se asocia con resultados adversos a corto y largo plazo29,31,33,34. No se ha establecido cuál es la mejor herramienta ni el mejor momento para diagnosticarla en los pacientes ancianos con IC aguda previamente no caracterizados como frágiles35. La identificación de la fragilidad durante la fase aguda podría ser de ayuda para la estratificación del riesgo, la toma de decisión de ingreso hospitalario y el diseño de un plan de atención individualizado36. Este último aspecto es importante, ya que 1 de cada 4 pacientes atendidos por IC aguda en los servicios de urgencias españoles es dado de alta a domicilio37. El problema de valorar la fragilidad en la fase aguda surge de la dificultad para aplicar ciertas escalas, especialmente las que incluyen pruebas de rendimiento físico, y de la falta de tiempo y de un entorno adecuado para poder llevarla a cabo apropiadamente. Teniendo en cuenta estos aspectos, parece más conveniente el uso de escalas basadas en preguntas autoaplicadas o en el juicio clínico del personal sanitario durante esta fase y posponer las medidas objetivas de rendimiento físico hasta alcanzar la estabilización clínica36. Se han publicado diversas escalas que podrían ser aplicables en fase aguda por su brevedad y sencillez, aunque su evidencia en el proceso de la IC aguda es escasa. Se ha propuesto una escala que consta de una serie de preguntas autoaplicadas con base en los criterios de Fried, que se ha mostrado útil para identificar un mayor riesgo de mortalidad a 30 días en pacientes de 65 o más años sin discapacidad grave establecida y atendidos por IC aguda en urgencias38.
Por otro lado, existen escalas que combinan preguntas autoaplicadas de los criterios de Fried con el grado de comorbilidad, como la FRAIL39 (tabla 2), y otras basadas en el cúmulo de deficiencias, como las escalas ISAR, CFS12,15 o TFI (Tilburg Frailty Indicator)40.
Se han evaluado también la prevalencia de la fragilidad y su repercusión en el pronóstico durante la hospitalización por IC e inmediatamente tras ella, y hasta la fecha no hay consenso sobre cuál es el mejor instrumento para medir la fragilidad en este escenario. La mayoría de los estudios han utilizado la aproximación al fenotipo de fragilidad con los criterios de Fried31,32,41 o con pruebas de función física como el SPPB29,34, y algunos autores la han diferenciado claramente de la discapacidad excluyendo a los pacientes con dependencia moderada o grave para hacer posible la evaluación del valor independiente de la fragilidad como marcador de riesgo31. La fragilidad medida con dichos instrumentos se ha asociado con un aumento del riesgo de mortalidad al año, y también de reingresos y discapacidad incidente o deterioro funcional31,41, asociación que se mantiene tras ajustar por discapacidad asociada, comorbilidad y gravedad de la IC.
El valor pronóstico independiente de los distintos componentes del fenotipo de fragilidad también se ha analizado en los pacientes con IC. Entre ellos, la poca actividad física31,41 y la marcha lenta31,42, con una media <0,6 m/s en el grupo de pacientes frágiles, se han demostrado predictores independientes de muerte y rehospitalización por IC.
En los últimos días de hospitalización o tras el alta una vez estabilizados los síntomas, se puede medir la fragilidad utilizando el fenotipo de Fried, que es el que mejor refleja el concepto propio de fragilidad como estadio de riesgo previo a la discapacidad, ya que el paciente puede realizar de manera segura las pruebas de rendimiento físico. También la utilización de escalas más generales, como la CFS, o instrumentos basados en la valoración geriátrica integral como el MPI43 pueden ser útiles en poblaciones que incluyen a pacientes con dependencia moderada o grave y a la hora de organizar recursos asistenciales, especialmente para las fases avanzadas de la enfermedad.
Síndrome coronario agudoValoración de la fragilidad en la fase aguda del síndrome coronario agudoLa fragilidad conlleva mayor incidencia de complicaciones, mortalidad hospitalaria y necesidad de reingreso, y para los pacientes con criterios de fragilidad también se usan menos los tratamientos recomendados y estrategias invasivas43-54. Sin embargo, no se conoce en qué sentido la presencia de fragilidad debe modificar el tratamiento del paciente con síndrome coronario agudo (SCA) y si es posible modificar el pronóstico asociado con la fragilidad. Por este motivo, el impacto pronóstico de la estrategia invasiva en pacientes ancianos con SCA sin elevación del segmento ST y criterios de fragilidad es controvertido. Aunque se ha señalado que los pacientes frágiles con SCA sin elevación del segmento ST podrían beneficiarse especialmente de la revascularización percutánea55, la evidencia existente es muy escasa, ya que estos pacientes están sistemáticamente excluidos de los ensayos clínicos y actualmente no se dispone de ensayos aleatorizados en pacientes frágiles56. Por otro lado, aunque se ha descrito una asociación independiente entre fragilidad y aparición de complicaciones hemorrágicas durante la hospitalización por SCA57, estas complicaciones podrían explicarse por el mayor grado de comorbilidad de los pacientes frágiles, por lo que la contribución general de la valoración geriátrica a la predicción de riesgo hemorrágico parece ser escasa58.
En el paciente con SCA, la enfermedad aguda, la posible inmovilización y los dispositivos (cables de monitorización, vías, sondas, etc.) interfieren con la valoración de la fragilidad, que teóricamente sería lo que el paciente tenía antes del episodio agudo. Por lo tanto, al ingreso deberían utilizarse instrumentos sencillos, de aplicación rápida, que no incorporen pruebas físicas. Las escalas FRAIL14 y CFS44 probablemente sean las más prácticas para emplearlas en este escenario. La escala FRAIL (tabla 2) predice un peor pronóstico de manera independiente de la escala GRACE y la edad cronológica52. La CFS (figura 2) ha mostrado una asociación consistente con mortalidad a corto y medio plazo y con un tratamiento más conservador44,45.
Valoración de la fragilidad tras la fase aguda del síndrome coronario agudoTras las primeras 24-48h de presentación del SCA y en pacientes estables, se puede realizar una valoración de la fragilidad más completa, incluyendo parámetros que requieren deambulación. Esta debería permitir una predicción más precisa de la fragilidad y del pronóstico a medio plazo, lo que puede ayudar a tomar decisiones para intervenciones electivas (revascularización, rehabilitación, etc.). Escalas utilizables en esta fase son:
- 1.
El índice SHARE-FI, que se asocia con la incidencia de complicaciones precoces, mortalidad a corto y medio plazo y un tratamiento inicial más conservador48,57. Puede ser una escala alternativa a las ya descritas para la valoración precoz si se dispone de un dinamómetro.
- 2.
Criterios de Fried, escala muy utilizada en los pacientes con SCA y pacientes con cardiopatía isquémica sometidos a revascularización coronaria, muestra una adecuada capacidad para predecir la mortalidad a corto y medio plazo47.
- 3.
Escala de Green, que muestra un mejor rendimiento predictivo que los criterios de Fried en pacientes con SCA46,53.
- 4.
Velocidad de la marcha. Se considera que es de complejidad intermedia, al ser una prueba física cuya realización requiere del paciente estabilidad clínica y autonomía. Es uno de los criterios del fenotipo de Fried con importante valor predictivo cuando se utiliza solo. Se asocia de manera independiente con la mortalidad a medio plazo en pacientes con infarto de miocardio49.
- 5.
La EFS es una escala multidimensional de complejidad intermedia, que se puede realizar en unos 5min. Existe una aplicación gratuita para tablet (compatible con iOS) que ayuda en la recogida de información. Se asocia con la mortalidad a medio y largo plazo en pacientes con SCA50,51.
Las principales características y la aplicabilidad de estas escalas de valoración se recogen en la tabla 4. En general, las escalas de fragilidad más complejas suelen tener mayor capacidad predictiva que las de mayor sencillez. Así, en el paciente que ha pasado la fase aguda, la utilización de escalas que incorporan pruebas físicas (o algún parámetro de laboratorio) puede tener mayor utilidad. No obstante, se desconoce cuándo es más oportuno evaluar la fragilidad: si al ingreso, antes o después del alta, o si evaluarla en varios momentos ofrece información adicional.
Características, requisitos y evidencia del uso de diferentes escalas de valoración de fragilidad en pacientes con síndrome coronario agudo
| Fase y escala | Sencillez | Pruebas físicas | Parámetros de laboratorio | Evidencia en SCA |
|---|---|---|---|---|
| Fase aguda | ||||
| Escala FRAIL | +++ | – | – | ++ |
| Clinical Frailty Scale | ++ | – | – | +++ |
| SHARE-FI | ++ | +* | – | ++ |
| Fase estable | ||||
| Criterios de Fried | ++ | + | – | +++ |
| SHARE-FI | ++ | + | – | ++ |
| Escala de Green | + | + | + | ++ |
| Edmonton Frail Scale | ++ | + | – | ++ |
| Velocidad de la marcha | ++ | + | – | + |
SCA: síndrome coronario agudo.
Aunque no se ha validado en ancianos con EAo, en nuestra opinión la escala FRAIL (tabla 2), tiene una potencial utilidad como valoración inicial. Los criterios de Fried (tabla 1) han mostrado impacto en la mortalidad de los pacientes con EAo59 y en la necesidad de ingreso en centros de rehabilitación tras el TAVI60. La CFS (figura 2) predice mortalidad tras el TAVI61, si bien su reproducibilidad genera dudas (componente subjetivo del evaluador), por lo que requiere un correcto entrenamiento. El Essential Frailty Toolset (tabla 5), más reciente, incluye una prueba física breve, el Mini Mental State Examination y valores de hemoglobina/albúmina; aunque tiene mayor complejidad, se ha demostrado mayor capacidad predictiva que con otras escalas de fragilidad (Fried, Fried+, Rockwood, SPPB, Bern, Columbia) en ancianos con EAo grave que se someten a recambio de válvula aórtica62. La escala de Green (tabla 3) es más compleja, ya que incluye 2 pruebas físicas, el índice de Katz y un parámetro de laboratorio; con esta escala se ha demostrado un importante impacto en la mortalidad de los pacientes con EAo sometidos a TAVI63.
Essential Frailty Toolset
| Variable | Resultado | Puntuación |
|---|---|---|
| Tiempo empleado en levantarse de una silla 5 veces | <15 s | 0 puntos |
| > 15 s | 1 punto | |
| Imposibilidad de completar la tarea | 2 puntos | |
| Deterioro cognitivo evaluado por cualquiera de estas 2 escalas | Mini Mental Test Examination> 24 o Mini-Cog Test> 3 | 0 puntos |
| Mini Mental Test Examination <24 o Mini-Cog Test <3 | 1 punto | |
| Hemoglobina | Varones,> 13; mujeres,> 12 | 0 puntos |
| Varones, <13; mujeres, <12 | 1 punto | |
| Albúmina sérica | > 3,5 g/dl | 0 puntos |
| <3,5 g/dl | 1 punto |
Las escalas centradas en un componente de la fragilidad más estudiadas en pacientes con EAo grave son la velocidad de la marcha y la prueba SPPB (figura 1); ambas tienen complejidad baja-intermedia, son objetivas y reproducibles y se realizan en menos de 5min. La SPPB, además, se ha estudiado en ancianos con EAo grave y se ha relacionado con la presencia de disfunción sistólica y enfermedad coronaria y cerebrovascular64. La velocidad de la marcha recorriendo 5 m se ha correlacionado con la mortalidad tras el TAVI65. La comorbilidad, que tiene una importante asociación con la fragilidad, se asocia con peor pronóstico en ancianos con EAo grave66 y a menor beneficio derivado de un tratamiento intervencionista sobre la válvula aórtica67,68.
La tabla 6 resume las ventajas y los inconvenientes de cada una de las escalas y su capacidad pronóstica en ancianos con EAo grave. De entre ellas, la evidencia más sólida respaldaría la utilización de las escalas de Fried, el Essential Frailty Toolset y las pruebas físicas SPPB y velocidad de la marcha.
Ventajas e inconvenientes de las distintas escalas de fragilidad en pacientes con estenosis aórtica
| Escala | Complejidad | Tests físicos | Parámetros de laboratorio | Capacidad predictiva en EAo |
|---|---|---|---|---|
| FRAIL | + | – | – | ? |
| Escala de Fried | ++ | + | – | + |
| Clinical Frailty Scale | + | – | – | + |
| Essential Frailty Toolset | +++ | + | + | ++ |
| Escala de Green | +++ | + | + | + |
| Velocidad de la marcha | ++ | + | – | + |
| SPPB | ++ | + | – | + |
EAo: estenosis aórtica; SPPB: Short Physical Performance Battery.
Existe evidencia del impacto pronóstico de la fragilidad en los distintos escenarios de enfermedad cardiológica. Además, se dispone de escalas adecuadas para medirla, aunque en los distintos escenarios clínicos, de algunas se ha demostrado mayor utilidad o capacidad predictiva. La presencia de fragilidad puede condicionar el abordaje diagnóstico y terapéutico de los pacientes, por lo que es fundamental que los profesionales implicados en su atención sean capaces de identificar su presencia y establecer un plan individualizado y específico de cuidados y medidas que mejor se adapten a cada paciente. Esto último es especialmente relevante en el caso de los servicios de cardiología, por las características de la población atendida.
En resumen, la presencia de fragilidad asocia peor pronóstico en los pacientes mayores con cardiopatía, y se debe evaluar sistemáticamente. Que tanto el personal sanitario como sus familiares y cuidadores entiendan la fragilidad es esencial para planificar los cuidados del paciente mayor.
CONFLICTO DE INTERESESNo se declara ninguno.