El cierre del apéndice auricular izquierdo puede ser una opción terapéutica atractiva para pacientes con fibrilación auricular no valvular y contraindicación para tomar anticoagulantes orales, siempre que se obtengan buenos resultados durante la implantación y en el seguimiento.
MétodosSe analizó a 35 pacientes consecutivos y no elegibles para los estudios aleatorizados con anticoagulantes orales a los que se implantó el dispositivo oclusor Amplatzer. Tras los primeros 5 casos, se incorporó una técnica de imagen 3D. Se analizaron los resultados de la implantación y de seguimiento durante 1 año.
ResultadosLa media de edad era 74,65 ± 7,61 años, con un CHADS2 de 2,41 ± 1,53 y un CHA2DS2-VASc de 3,17 ± 1,60. No se pudo implantar el dispositivo en 1 caso y en 5 fue necesario cambiar la medida seleccionada. No hubo ninguna complicación cardiaca durante la implantación ni durante la estancia hospitalaria. Hubo una complicación vascular (fístula arteriovenosa). Se realizó seguimiento con ecocardiografía transesofágica a las 24 h y tras 1, 3, 6 y 12 meses; se documentaron 5 trombos, que se resolvieron con heparina. En el seguimiento de 21,14 ± 10,09 meses, hubo 3 muertes de pacientes mayores de 80 años, ninguna de ellas cardiológica, y un accidente isquémico transitorio sin secuelas.
ConclusionesEl cierre del apéndice auricular izquierdo por un operador con cierta experiencia puede ser una opción terapéutica con pocas complicaciones y con resultados a más de 1 año eficaces en la reducción de complicaciones tromboembólicas y hemorrágicas, incluso en poblaciones de muy alto riesgo.
Palabras clave
La fibrilación auricular (FA) de origen no valvular es una arritmia frecuente cuya incidencia aumenta con la edad, y llegan a padecerla más de un 10% en los pacientes de más de 80 años1,2.
Aparte de la repercusión hemodinámica, la importancia de la FA radica en que origina más del 20% de los ictus isquémicos3, y el impacto de los ictus atribuibles a FA es mayor que el debido a otras causas1,3.
Hasta ahora los anticoagulantes orales (ACO) son la principal herramienta para reducir los eventos cardioembólicos4. Sin embargo, su riesgo aparejado de hemorragias hace que hasta un tercio de los pacientes no puedan usarlos5,6. Aunque la aparición de nuevos ACO (dabigatrán, rivaroxabán, apixabán) puede mejorar algunas de las limitaciones de los clásicos (como la warfarina), especialmente reduciendo las hemorragias intracraneales o evitando los controles de INR, el porcentaje de hemorragias mayores (2,15-3,6% por año) y menores (15-20% por año) sigue siendo aproximadamente el mismo7–9.
Con la aparición de los dispositivos oclusores de orejuela izquierda o apéndice auricular izquierdo (AAI)10–12 se presenta una nueva posibilidad de tratamiento para los pacientes con contraindicación a los ACO o con alta probabilidad de sangrado por un score HAS-BLED (hipertensión, función renal/hepática anormal, ictus, antecedentes de hemorragia o predisposición a ella, labilidad del INR, edad superior a 65 años y toma concomitante de fármacos o alcohol) alto13, y con unos resultados al menos tan eficaces como con aquellos11. Tiene interés conocer los resultados de series de pacientes a los que no se hubiera podido incluir en los últimos estudios aleatorizados de los nuevos ACO o del PROTECT AF, ya que estos pacientes tienen más riesgo total, tanto en la intervención como en el seguimiento, en cuanto a complicaciones tromboembólicas y hemorrágicas.
El objetivo de nuestro trabajo es presentar los resultados de nuestros primeros 35 pacientes a los que se implantó un dispositivo oclusor ACP (Amplatzer Cardiac Plug, St. Jude Medical; Minnesota, Estados Unidos), tanto en la intervención como en el seguimiento a más de 1 año.
MÉTODOSSe realizó cierre de orejuela izquierda con el dispositivo ACP a 35 pacientes reclutados desde marzo de 2009 a noviembre de 2011. Se consideraron criterios de inclusión presentar alguna de las siguientes condiciones: haber sufrido hemorragia grave durante tratamiento con acenocumarol, tener alguna enfermedad o evento clínico previo que contraindicara el uso de ACO, imposibilidad repetida de controlar adecuadamente el INR, con indicación de su hematólogo de suspender el acenocumarol. El protocolo de estudio fue aceptado por el comité ético de investigación clínica del hospital y todos los pacientes firmaron previamente el consentimiento informado. El objetivo principal del estudio es analizar los resultados iniciales de la técnica en cuanto a la seguridad de implantación del dispositivo ACP y la evolución clínica a largo plazo de los pacientes, con especial atención a la aparición de eventos embólicos o hemorrágicos, la formación de trombos en el dispositivo y su evolución y la persistencia de la eficacia en la oclusión de la orejuela izquierda o reducción de algún shunt residual inicial.
A todos los pacientes se les realizó una ecografía transesofágica (ETE) 24-48 h antes de la intervención para descartar la presencia de trombo dentro del AAI. Tras los primeros 5 casos, se realizó además resonancia magnética (RM) en 10 casos y tomografía computarizada (TC) en los últimos 20 unos días antes de la intervención. Una hora antes se administró un antibiótico de amplio espectro (cefalosporina). El procedimiento se realizó con anestesia general. Se administraban 100 U/kg de heparina tras realizar la punción transeptal. El acceso transeptal a la aurícula izquierda se realizó mediante un abordaje por la vena femoral derecha, seguido de angiografía selectiva del AAI con un volumen similar al de una coronaria izquierda y, generalmente, en oblicua anterior derecha (OAD) (20-30) caudal (15-25) y también en OAD craneal (15-20). El sistema de referencia para corrección de la amplificación fue una bola radioopaca en el plano de la línea axilar media. Se tomaron medidas con ETE durante la intervención en dos planos. El estudio de la anatomía de la orejuela se realizó con la sonda en posición medioesofágica mediante un barrido entre 0 y 135° para obtener los diámetros menor (45-70°) y mayor del ostium de la orejuela (aproximadamente 135°). Estas medidas se suelen realizar en el ostium, encima del punto correspondiente a la arteria circunfleja y unos 5-10 mm más interna, teniendo en cuenta variaciones en la forma y la orientación del eje de algunas orejuelas. La ETE intraoperatoria permitía, además, valorar la posición de la vaina de liberación del dispositivo tras la punción transeptal, confirmar la adecuada orientación del dispositivo en la orejuela y comprobar la correcta exclusión de esta antes de liberarlo mediante el modo Doppler-color. Se usó ecocardiograma 3D en los últimos 14 pacientes para comprobar el sellado de los márgenes del ostium y descartar que el dispositivo pudiera afectar a estructuras anatómicas adyacentes, como la implantación de la válvula mitral o la vena pulmonar superior izquierda, y excluir complicaciones como el derrame pericárdico.
Los estudios de RM se realizaron con un escáner de General Electric modelo Signa 1,5-T. Los cortes se obtuvieron en apnea a través de una secuencia de angio-RM con gradientes rápidos (para obtener la mayor resolución espacial) y en diferentes planos (coronal, sagital y transversal). La TC cardiaca se realizó utilizando un escáner de 64 cortes (General Electric Light Speed VCT Healthcare Inc.; Milwaukee, Wisconsin, Estados Unidos).
Para mejorar las imágenes obtenidas en el servicio de radiología, y ante la ausencia de software específico, ideamos la posibilidad de exportar esas imágenes sin procesar al software de un sistema CARTO (Carto MergeTM Image Integration Module, Biosense Webster, Inc.). Mediante procesamiento de reconstrucción en 3D del corazón y segmentación, se obtuvo exclusivamente la imagen 3D de la aurícula izquierda con su AAI y las venas pulmonares para su análisis detallado interno y externo, con lo que se puede obtener medidas de distancias muy precisas en cualquier dirección del espacio. Esto ha sido validado en trabajos publicados previamente14,15.
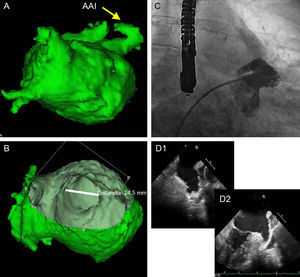
Se compararon las medidas de ETE y angiografía con las obtenidas por CARTO-TC/RM, con especial atención al eje mayor, que en la mayoría de los casos es el superoinferior (SI). Si las medidas diferían del tamaño del ACP que correspondería al intervalo (según la tabla de equivalencias de medidas-tamaño del dispositivo aportada por el fabricante), se volvió a medir tanto la ETE como la angiografía, con especial atención al ostium y la zona de anclaje-implantación (landing zone), aproximadamente 1 cm dentro del ostium y desde la angulación inferior, justo en el nivel superior de la arteria circunfleja. En caso de que no coincidiera tras una nueva reevaluación, se comprobaba que las medidas fueran coherentes y la calidad de las imágenes, dando mayor peso a la medida tridimensional del CARTO-TC/RM en su eje mayor (fig. 1).
Sistema de trabajo en nuestra serie. A: imagen en CARTO/tomografía computarizada de la orejuela izquierda o apéndice auricular izquierdo. B: corte interno para medidas del ostium del apéndice auricular izquierdo. C: imagen angiográfica con similitud a la forma de la orejuela vista en la imagen A. D: cortes perpendiculares con ecografía transesofágica bidimensional del apéndice auricular izquierdo. AAI: apéndice auricular izquierdo.
Se realizaron ETE de control al día siguiente y tras 1, 3, 6 y 12 meses para comprobar la buena colocación del dispositivo, la presencia o ausencia de shunt en el tabique interauricular y la ausencia de flujo al AAI, prestando especial atención a la posible presencia de trombo en el dispositivo. Se investigaron los eventos adversos de posible origen embólico o hemorrágico, así como las necesidades de ingreso por enfermedades concomitantes.
Se administró una dosis de carga (600 mg) de clopidogrel como tratamiento anticoagulante/antiagregante tras la implantación, y se inició tratamiento con 300 mg de ácido acetilsalicílico el primer día y 100 mg diarios a partir del día siguiente a la intervención. El clopidogrel se mantuvo 3 meses, salvo complicaciones hemorrágicas, y el ácido acetilsalicílico, 6 meses. En caso de trombo, se añadió enoxaparina subcutánea a dosis terapéutica durante 2 semanas, se prolongó el clopidogrel y se repitió el ETE para comprobar la desaparición. En caso negativo, se valoró prolongar el tratamiento 1 semana más o ingresar al paciente e iniciar tratamiento con heparina intravenosa.
El mismo operador realizó todos los procedimientos y en ningún caso hubo problemas en la punción transeptal, por lo que no tuvo influencia en otras variables.
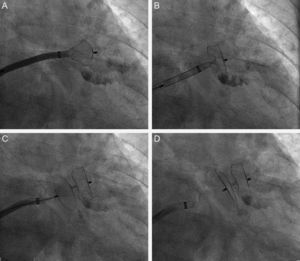
Se definió éxito en la implantación siempre que se cumplieran los siguientes criterios: a) colocación del dispositivo con una distancia satisfactoria entre el cuerpo y el disco exterior, es decir, que el cuerpo estuviera en el cuello de la orejuela y el disco cubriera el ostium, con una clara separación entre ambos en las dos proyecciones angiográficas habituales (OAD craneal y OAD caudal) o en la de eje corto del ETE; b) imagen de ligera compresión del cuerpo (tipo neumático) pero sin el efecto «frambuesa» indicativo de compresión excesiva; c) ausencia de flujo entre la aurícula izquierda y el AAI peridispositivo o, en todo caso, < 3 mm visualizado con el Doppler-color, y d) test de anclaje firme del dispositivo en el AAI tras realizar la maniobra de «empujar y tirar», similar a la conocida como Minnesota wiggle (fig. 2).
Fases de la implantación y liberación del dispositivo Amplatzer Cardiac Plug en la orejuela izquierda. A: salida parcial del cuerpo o lobe del dispositivo Amplatzer Cardiac Plug hacia el interior de la orejuela izquierda. B: salida completa del lobe. C: salida completa del lobe y el disco del Amplatzer Cardiac Plug. D: dispositivo Amplatzer Cardiac Plug tapando la orejuela tras ser totalmente liberado de la vaina.
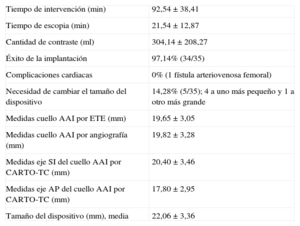
En la tabla 1 se presentan las características basales de los 35 pacientes. Ninguno de los 35 pacientes hubiera podido entrar en los estudios aleatorizados con ACO, al no poder tomar anticoagulantes por distintas razones (tabla 1).
Características basales de los pacientes (n = 35)
| Edad (años) | 74,65 ± 7,61 |
| Edad ≥ 75 años | 20 (57,14) |
| Mujeres (%) | 57,14 |
| FA permanente/paroxística | 26/9 (74,3%/25,7%) |
| CHADS2 | 2,41 ± 1,53 |
| CHA2DS2-VASc | 3,94 ± 1,89 |
| HAS-BLED | 4,42 ± 1,43 |
| Hipertensión arterial | 25/35 (71,42%) |
| Diabetes | 12/35 (34,28%) |
| Ictus previo | 9/35 (25,71%) |
| Insuficiencia cardiaca | 6/35 (17,14%) |
| Enfermedad vascular o coronaria | 5/35 (14,28%) |
| Complicaciones hemorrágicas por ACO | 16/35 (45,7%) |
| Hemorragia digestiva | 9 |
| Hemorragia intracraneal | 4 |
| Hemorragia ginecológica | 1 |
| Epistaxis de repetición | 1 |
| Hemorragia retiniana | 1 |
| Contraindicaciones por historia clínica | 13/35 (37,15%) |
| Hemorragia digestiva | 7 |
| Hemorragia intracraneal | 2 |
| Hemorragia variada | 4 |
| Mal control con INR entre 5-12 | 6/35 (17,14%) |
ACO: anticoagulantes orales; FA: fibrilación auricular; HAS-BLED: hipertensión, función renal/hepática anormal, ictus, antecedentes de hemorragia o predisposición a ella, labilidad del cociente internacional normalizado, edad superior a 65 años y toma concomitante de fármacos o alcohol; INR: cociente internacional normalizado.
Los datos expresan n (%) y media ± desviación estándar.
Se calcularon los scores CHADS2 (2,41 ± 1,53), CHA2DS2-VASc (3,17 ± 1,60) y HAS-BLED13 (4,42 ± 1,43).
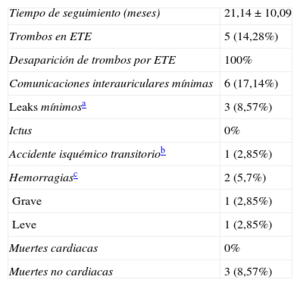
Resultados sobre la intervenciónEn la tabla 2 se presentan los tiempos de intervención, la cantidad de contraste y el tiempo de escopia, junto con las medidas obtenidas por ETE intraoperatorio, angiografía y CARTO-RM o CARTO-TC, junto con la medida final del dispositivo ACP elegido y la necesidad de un cambio de tamaño, que sólo se produjo en 5 casos (en 4 por uno menor y en 1 por uno mayor). El tamaño medio del dispositivo fue de 22,06 ± 3,36 (intervalo, 16-28).
Variables de la intervención y medidas
| Tiempo de intervención (min) | 92,54 ± 38,41 |
| Tiempo de escopia (min) | 21,54 ± 12,87 |
| Cantidad de contraste (ml) | 304,14 ± 208,27 |
| Éxito de la implantación | 97,14% (34/35) |
| Complicaciones cardiacas | 0% (1 fístula arteriovenosa femoral) |
| Necesidad de cambiar el tamaño del dispositivo | 14,28% (5/35); 4 a uno más pequeño y 1 a otro más grande |
| Medidas cuello AAI por ETE (mm) | 19,65 ± 3,05 |
| Medidas cuello AAI por angiografía (mm) | 19,82 ± 3,28 |
| Medidas eje SI del cuello AAI por CARTO-TC (mm) | 20,40 ± 3,46 |
| Medidas eje AP del cuello AAI por CARTO-TC (mm) | 17,80 ± 2,95 |
| Tamaño del dispositivo (mm), media | 22,06 ± 3,36 |
AAI: apéndice auricular izquierdo; AP: anteroposterior; ETE: ecografía transesofágica; SI: superoinferior; TC: tomografía computarizada.
Salvo otra indicación, los datos expresan media ± desviación estándar.
El éxito en la implantación fue del 97,14%; sólo en 1 caso no se pudo implantar el dispositivo. No tuvimos ninguna complicación cardiaca y sólo 1 caso con complicación de origen vascular, al haberse pinchado la arteria y producirse después una fístula arteriovenosa, a pesar de una compresión prolongada.
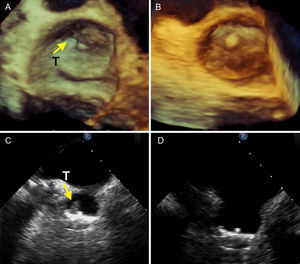
Eventos en el seguimiento de 1 añoLa tabla 3 resume los resultados de seguimiento. Hubo 3 muertes no cardiacas en pacientes de 85, 83 y 81 años, que fueron por obstrucción y perforación intestinal, adenocarcinoma intestinal y neumonía que motivaron ingreso, con resultado de muerte. Hubo una hemorragia grave en un paciente con pólipos sangrantes. Se suspendió el clopidogrel y quedó sólo con ácido acetilsalicílico; lo trató el servicio de digestivo, y evolucionó bien. Se documentó una hemorragia leve por epistaxis en un paciente que olvidó suspender el clopidogrel. Se detectaron trombos en el dispositivo en 5 casos (14,28%). Uno se produjo en la primera semana (paciente en que se generó una fístula), y se suspendió el tratamiento antiagregante antes de la intervención vascular. Tras esta se pautó el tratamiento antiagregante y enoxaparina 2 semanas. El trombo desapareció sin eventos clínicos. Dos se produjeron al segundo y el tercer mes y desaparecieron en 2 semanas al añadir enoxaparina. Un paciente que había sido cardiovertido por flutter antes del alta presentó imagen de trombo de 14 mm al tercer mes, pero no recibió enoxaparina por caída y hematoma facial. Además, fue el único paciente que sufrió también accidente isquémico transitorio típico (amaurosis fugax), con recuperación total. Este paciente se ingresó para tratamiento con heparina intravenosa, y el trombo se redujo progresivamente. El quinto fue un trombo laminar mural al sexto mes y desapareció tras 2 semanas con enoxaparina (fig. 3). Sólo hubo 3 leaks mínimos periprotésicos en la zona posterosuperior, sin criterios de significación, y shunts mínimos de pequeñas comunicaciones interauriculares en 6 casos, que fueron desapareciendo en los controles. En un caso con doble septo, donde se producía efecto humo protrombótico, decidimos cerrar con un dispositivo de foramen oval. El paciente ya tenía esta característica antes de la intervención.
Seguimientos clínicos y ecocardiográficos
| Tiempo de seguimiento (meses) | 21,14 ± 10,09 |
| Trombos en ETE | 5 (14,28%) |
| Desaparición de trombos por ETE | 100% |
| Comunicaciones interauriculares mínimas | 6 (17,14%) |
| Leaks mínimosa | 3 (8,57%) |
| Ictus | 0% |
| Accidente isquémico transitoriob | 1 (2,85%) |
| Hemorragiasc | 2 (5,7%) |
| Grave | 1 (2,85%) |
| Leve | 1 (2,85%) |
| Muertes cardiacas | 0% |
| Muertes no cardiacas | 3 (8,57%) |
ETE: ecografía transesofágica.
Imágenes de ecografía transesofágica tridimensional (A y B) y bidimensional (C y D) con trombo mural típico (T) en el ángulo superior del dispositivo (A y C, flechas) y desaparición del trombo (B y D), al seguimiento tras añadir al doble tratamiento antiplaquetario 2 semanas con enoxaparina a dosis terapéuticas.
Las primeras publicaciones sobre esta técnica fueron con el dispositivo PLAATO, que se abandonó por diversas razones. Sin embargo, en los seguimientos de los pacientes en los que se implantó con éxito, se observó que había un porcentaje de complicaciones tromboembólicas menor que lo esperado en esos pacientes según su score CHADS210. Posteriormente, el estudio aleatorizado PROTECT AF, que comparaba la warfarina con el dispositivo oclusor Watchman, mostró resultados mejores con el dispositivo que se mantenían pasado más de 1 año, con reducción significativa en los ictus hemorrágicos11. En Europa se publicó el primer registro de ACP12, en el que se mostraron porcentajes de efectividad y complicaciones muy similares a los del estudio PROTECT AF, animando a seguir con dicha técnica para este subgrupo de pacientes. En estas dos series de cierre de AAI que son las más grandes publicadas, los eventos adversos bajaron a la mitad con la experiencia de los operadores. Así, en la serie del estudio PROTECT AF con el dispositivo Watchman (542 pacientes) los eventos adversos pasaron del 7,7 al 3,7% en el registro CAP, que continuaron algunos centros que habían participado previamente en el estudio principal, pero ya con más experiencia. En la serie del Initial European Registry (143 pacientes) con el dispositivo ACP, los eventos adversos bajaron del 7 al 3,4% en el ACP Postmarket Registry (145 pacientes) (los derrames pericárdicos bajaron de 3,5 al 2%; los ictus isquémicos, del 2,1% a 0, y la embolización del dispositivo permaneció en el 1,4%). En el ACP Italian Registry (100 pacientes) (G. Santoro; comunicación en el congreso Progress in Clinical Pacing; Roma, 2010) no se produjo ninguna embolización del dispositivo ni ictus isquémicos y sólo 2 derrames pericárdicos16,17. El Registro Iberia incluye los casos realizados en España y Portugal. Entre 2009 y 2011 se habían incluido 213 casos, 197 con éxito (92,5%) y en 16 no se pudo implantar el dispositivo (datos no comunicados en el artículo y sólo parcialmente en la comunicación18). Se produjeron 12 complicaciones mayores (5,6%) y 6 menores (2,81%). Las complicaciones mayores fueron 3 muertes, 4 embolizaciones del dispositivo, 3 taponamientos cardiacos resueltos, 1 ictus y 1 cuadro de elevación del ST en cara anterior. Es importante reseñar que este registro recoge las curvas de aprendizaje de varios centros a la vez y que, a medida que los diferentes hospitales van aumentando la casuística, estas complicaciones van en claro descenso.
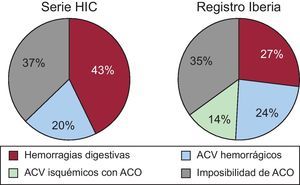
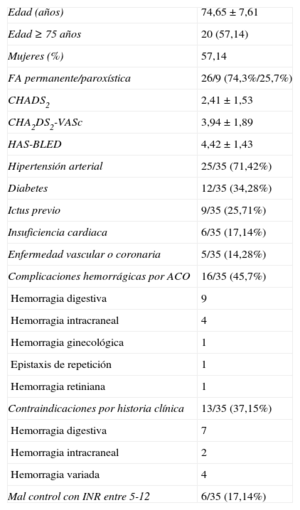
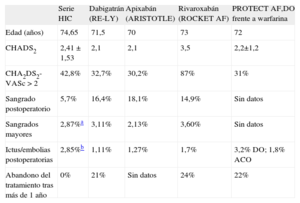
Existen importantes estudios sobre nuevos ACO con posibles ventajas sobre la warfarina o el acenocumarol7–9. Sin embargo, los pacientes incluidos en series como la nuestra serían excluidos de esos estudios y del PROTECT AF por las razones ya mencionadas. Esta técnica en principio no compite con los nuevos ACO o el acenocumarol, sino que es un complemento para ese 40% de pacientes que, debiendo recibir tratamiento anticoagulante, lo tienen contraindicado6. En nuestra serie la edad de los pacientes es mayor que en los estudios aleatorizados publicados, y en pacientes de 80 o más años las tasas de sangrado son del 13%, diferentes que en los estudios publicados con pacientes de menor edad (3-4%)19. En el estudio RE-LY, el dabigatrán no resultó ser más efectivo que la warfarina en la prevención de tromboembolias ni en la reducción de hemorragias en los pacientes de 75 o más años ni en pacientes con bajo aclaramiento de creatinina, cosa frecuente en este grupo de edad7. Por otro lado, la tasa de abandono es mayor en este subgrupo de edad y alcanza el 26% el primer año7,8,19. En la tabla 4 se presentan algunas características de los pacientes de nuestra serie en comparación con las de los principales estudios. Puntuaciones CHADS2 ≥ 3 identifican a los pacientes que más se pueden beneficiar de la reducción de tromboembolias, pero al tiempo también pueden sangrar más con los ACO, incluidos los de nueva generación. Sea con warfarina o con dabigatrán, estos pacientes tienen un 2-3% anual de riesgo de tromboembolias, casi un 5% de sangrados mayores y casi un 6% de muerte20. Por todo ello, estos pacientes obtendrían máximo beneficio con el cierre de orejuela. Se acepta que un HAS-BLED ≥ 3 es de alto riesgo de sangrado, con incidencias de hemorragias mayores > 4% año21, y nuestra serie presenta, como era de esperar por las características de los pacientes, un HAS-BLED alto (4,42 ± 1,43). En la figura 4 se muestran las indicaciones clínicas para el cierre de la AAI de nuestra serie y se comparan con las del registro en España. Las hemorragias digestivas suponían un 43% de las indicaciones (una cifra algo mayor que la del registro español, pero muy acorde con las cifras de hemorragias digestivas en pacientes con ACO)22, seguidas de pacientes con imposibilidad de tomar acenocumarol y seguida de pacientes con ictus hemorrágicos por acenocumarol.
Comparación de algunos datos de interés clínico entre los principales estudios con nuevos anticoagulantes orales y dispositivos y nuestra serie
| Serie HIC | Dabigatrán (RE-LY) | Apixabán (ARISTOTLE) | Rivaroxabán (ROCKET AF) | PROTECT AF,DO frente a warfarina | |
| Edad (años) | 74,65 | 71,5 | 70 | 73 | 72 |
| CHADS2 | 2,41 ± 1,53 | 2,1 | 2,1 | 3,5 | 2,2±1,2 |
| CHA2DS2-VASc > 2 | 42,8% | 32,7% | 30,2% | 87% | 31% |
| Sangrado postoperatorio | 5,7% | 16,4% | 18,1% | 14,9% | Sin datos |
| Sangrados mayores | 2,87%a | 3,11% | 2,13% | 3,60% | Sin datos |
| Ictus/embolias postoperatorias | 2,85%b | 1,11% | 1,27% | 1,7% | 3,2% DO; 1,8% ACO |
| Abandono del tratamiento tras más de 1 año | 0% | 21% | Sin datos | 24% | 22% |
ACO: anticoagulantes orales; ARISTOTLE: Apixaban for Reduction In STroke and Other ThromboemboLic Events in atrial fibrillation; DO: dispositivo oclusor; HIC: Hospital Infanta Cristina; PLAATO: Percutaneous Left Atrial Appendage Transcatheter Occlusion; PROTECT AF: PROTECTion in patients with Atrial Fibrillation; RE-LY: Randomized Evaluation of Long term anticoagulant therapY; ROCKET AF: Rivaroxaban Once daily oral direct factor Xa inhibition Compared with vitamin K antagonist for the prevention of stroke and Embolism Trial in Atrial Fibrillation.
Indicaciones de cierre del apéndice auricular izquierdo en el registro nacional y nuestra serie (HIC). La imposibilidad de ACO se refiere a contraindicaciones por historia clínica (tabla 1). ACO: anticoagulantes orales; ACV: accidente cerebrovascular; HIC: Hospital Infanta Cristina.
A la espera de seguimientos más largos, es razonable pensar que los pocos eventos trombóticos que puedan producirse en los pacientes con el dispositivo se reducirán o se eliminarán una vez endotelizado el dispositivo a los 6 meses, así como el riesgo de hemorragias por la doble antiagregación22, que se limita a los primeros 3-6 meses.
Gracias a nuestro estricto protocolo en la búsqueda de formación de trombo en el dispositivo, pudimos observar su formación en cualquier periodo entre el primer día y el sexto mes, pero no aparecieron pasado ese tiempo, según comprobamos a los 12 meses. Las series que realizan protocolos más laxos refieren menor incidencia o incluso ausencia de trombos23. Nuestro protocolo puede resultar algo exhaustivo en este sentido, pero pensamos que es procedente, al menos hasta que se conozca mejor el periodo en que pueden formarse los trombos. Salvo situaciones que obliguen a la suspensión de la antiagregación, podría ser razonable realizarlo únicamente a 1, 3 y 6 meses. Es importante detectarlos, ya que responden muy bien a la adición de enoxaparina, seguramente por estar en un periodo incipiente de formación durante la reendotelización24. Aunque el efecto humo y el tamaño de la aurícula izquierda podrían influir en nuestra serie, no hubo claros predictores tras analizar estos aspectos.
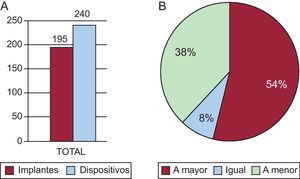
Finalmente, es importante una adecuada selección de la medida del dispositivo. Las medidas obtenidas con el ETE intraoperatorio eran ligeramente inferiores a las medidas angiográficas y estas, algo menores que las del eje SI obtenido por la medida en CARTO-TC/RM; la medida del eje corto era la menor de las cuatro mediciones (tabla 2). La utilización de una tercera técnica de medida con RM o TC puede haber influido en que en nuestra serie la incidencia de necesidad de cambio del dispositivo oclusor fuera aceptablemente baja (14,28%), frente a medias en otras series entre el 17 y el 24%12,25. En la figura 5 se aprecia una incidencia de cambio en el registro Iberia de un 20%, habitualmente de uno menor a otro mayor, aunque no siempre. En nuestra serie fue a la inversa, más frecuentemente de uno mayor a otro menor. Posiblemente influyera el peso decisivo otorgado al eje mayor (SI) del ostium en el CARTO-TC que, aunque muy eficaz en general (la medida del eje SI del CARTO-TC acertaba en la elección del tamaño correcto en el 76,6%; la angiografía, en el 66,6%; el ETE, en el 46,6%, y el eje corto o AP del CARTO-TC, en el 26,6%), en algún caso supuso la elección de un tamaño mayor, especialmente en medidas de ostium más grandes (y en esos casos es más fiable la angiografía). La posibilidad de utilizar estas técnicas como las de referencia se ha propuesto en algunos interesantes trabajos, que las han comparado con otras como el ecocardiograma 3D. Sin embargo, tenían la limitación de no ir seguidas de implantación del dispositivo en sus pacientes26–30. De todas formas, esta tercera técnica no es necesaria en la mayoría de los casos, y se debe reservar para investigaciones más profundas o casos en que no se haya podido implantar el dispositivo en un primer intento. Nuestro grupo ha observado que un subtipo de orejuelas con salidas bajas y más cercanas al vestíbulo de la válvula mitral es más complejo y podría requerir una estrategia más delicada31.
LIMITACIONESNo incorporamos en los análisis los datos del ecocardiograma 3D porque se dispuso de este sólo para los últimos 14 pacientes. Sin embargo, no aportó cambios en las decisiones de las medidas que presentamos, aunque sí fue de utilidad durante el procedimiento para ver la relación con estructuras adyacentes y forma de la orejuela.
Nuestro estudio tiene un número de pacientes pequeño para poder establecer resultados de eficacia clínica, pero es una de las series unicéntricas más amplias, dado el lento reclutamiento de pacientes. Por otro lado, presenta la realidad de los pacientes ingresados en los principales hospitales de España y, posiblemente, del resto de Europa. Los tiempos de procedimiento y escopia pueden estar ligeramente por encima de la media, lo que puede estar relacionado con que nuestro centro es referencia para el aprendizaje de esta técnica. Para evaluar la eficacia clínica de esta técnica en estos pacientes de alto riesgo de sufrir tanto tromboembolias como complicaciones hemorrágicas, son necesarios los resultados de series más amplias y con seguimientos a más largo plazo.
CONCLUSIONESEl cierre del AAI puede ser una alternativa útil al tratamiento con ACO en pacientes con FA no valvular pero, sobre todo, es una opción complementaria para los pacientes que no pueden tomar ACO por haber sufrido complicaciones hemorrágicas o ictus recientes que contraindiquen su uso. Tiene baja incidencia de complicaciones durante la implantación y resultados muy satisfactorios en el seguimiento clínico si lo realizan intervencionistas con cierta experiencia en dicha técnica, sobre todo teniendo en cuenta el alto perfil de riesgo tromboembólico y hemorrágico de los pacientes a los que se interviene. No cabe duda que, a medida que se vaya aumentando la experiencia de los operadores, se irán reduciendo las complicaciones en las distintas series, lo que puede asentar las indicaciones de esta técnica.
CONFLICTO DE INTERESESNinguno.