Las células madre de médula ósea pueden regenerar el miocardio infartado por distintos mecanismos. La relación entre la recuperación de la función muscular y microvascular después del tratamiento regenerativo ha sido poco estudiada. El objetivo es analizar la relación entre los cambios en función ventricular y función microvascular en pacientes con infarto agudo que reciben la terapia.
MétodosSe analizó a 88 pacientes con infarto anterior revascularizado incluidos en 2 ensayos clínicos y 1 estudio piloto que evaluaban la eficacia de la terapia celular. El estudio de la reserva coronaria y la función ventricular se analizaron con la misma metodología en todos ellos. Se administraron células mononucleares derivadas de médula ósea autóloga (n = 40), factor estimulante de colonias granulocíticas (n = 14) o la combinación de ambos (n = 10). Hubo un grupo control (n = 24) que solo recibió revascularización convencional.
ResultadosLa media de fracción de eyección se incrementó del 37 ± 8% al 46 ± 12% (p < 0,05). La media de incremento de la reserva de flujo coronario fue de 1,6 ± 0,5 a 2,3 ± 0,9 (p < 0,05). No hubo correlación entre los parámetros de función muscular y los parámetros de función microvascular al seguimiento.
ConclusionesHay cambios favorables en el miocardio tras el tratamiento con terapia regenerativa después de un infarto, aunque no se ha encontrado correlación entre los cambios de función muscular y microvascular.
Palabras clave
La capacidad para incrementar el flujo coronario se denomina reserva de flujo coronario (RFC) y permite autorregular y mantener un aporte de oxígeno constante al miocardio satisfaciendo las demandas de este en cada momento. Se sabe que aquellos sujetos que presentan una función sistólica ventricular izquierda deprimida muestran anomalías en la función de la microvasculatura, incluso en ausencia de estenosis significativas en las arterias coronarias epicárdicas1. No obstante, tras el infarto agudo de miocardio es cuando dicha funcionalidad puede verse más alterada y se observa que los cambios en la microcirculación coronaria que tienen lugar el primer día tras realizar la angioplastia primaria están relacionados con el grado de recuperación de la fracción de eyección en los 6 meses posteriores al procedimiento2.
La terapia regenerativa se emplea como tratamiento coadyuvante de la insuficiencia cardiaca, sobre todo en casos de origen isquémico, desde hace más de una década, con resultados prometedores3-15.
Hasta donde se sabe, la relación que hay entre los cambios producidos en la función miocárdica y la función microvascular —valorada mediante la RFC tras la administración de células madre— se ha estudiado poco. Se ha investigado dicha asociación en una serie de pacientes que recibieron células mononucleares derivadas de médula ósea autóloga (CMNMO) administradas tras la revascularización percutánea exitosa de un infarto de miocardio de localización anterior.
MÉTODOSDiseño del estudioEste trabajo se ha diseñado a partir del análisis de 2 ensayos clínicos16,17 y 1 estudio piloto que evaluaban la eficacia de la terapia regenerativa en pacientes con infarto de miocardio anterior revascularizado.
Criterios de inclusión y de exclusión del estudioLos criterios de inclusión fueron los siguientes: a) función ventricular izquierda deprimida (< 45%), y b) pacientes con infarto agudo de miocardio anterior y reperfusión precoz de la arteria descendente anterior, mediante la administración de un fibrinolítico intravenoso o intervención coronaria percutánea y posterior implante de stent en dicha arteria. Los criterios de exclusión fueron: a) edad > 80 años; b) enfermedad hematológica; c) neoplasias malignas o enfermedades sistémicas relevantes, y d) complicaciones mecánicas del infarto o shock cardiogénico.
ProcedimientoEl estudio hemodinámico, tanto de la función ventricular izquierda como de la función microvascular, se realizó en el momento basal y 3 meses más tarde en todos los sujetos. Se administró CMNMO (n = 40), factor estimulante de colonias granulocíticas (G-CSF) (n = 14) o la combinación de ambos (n = 10). Hubo un grupo control (n = 24) que solo recibió revascularización.
Protocolo de terapia regenerativaExtracción e infusión intracoronaria de células mononucleares derivadas de médula ósea autólogaEl protocolo de estudio se ha publicado previamente16. Los pacientes que recibieron CMNMO se sometieron a un segundo cateterismo entre 5 y 12 días después del infarto agudo (7 ± 2 días) con la infusión intracoronaria del caldo celular en la arteria descendente anterior. Un hematólogo había obtenido la médula ósea autóloga 4h antes. La médula ósea del paciente se obtuvo mediante aspiraciones repetidas sobre la cresta ilíaca posterior bajo anestesia local (un volumen aproximado de 100ml). El procesamiento consistía únicamente en la eliminación de plasma, hematíes y granulocitos y solo se obtuvieron células mononucleares. El procedimiento se realizaba mediante una centrifugación en gradiente de densidad sobre Ficoll-Hypaque de 1,077g/ml, en una procesadora de células semiautomática COBE-2991 y, finalmente, las células se resuspendían en 10ml de cloruro de sodio al 0,9% con un 1% de heparina sin conservantes. Una vez filtradas a través de un filtro de 150μ, se concentraban en una jeringa destinada a la arteria descendente anterior. Se obtenían muestras para recuento celular, viabilidad y control microbiológico; así como para fines de investigación. La suspensión celular final se transportaba hasta la unidad de hemodinámica para su inmediata administración mediante cateterismo. Toda la manipulación se realizaba bajo estrictas condiciones de esterilidad en cabina de flujo laminar ubicada en el laboratorio de terapia celular.
De los 88 pacientes seleccionados que aceptaron el protocolo y firmaron el consentimiento informado, 50 recibieron el tratamiento propuesto: CMNMO. La dosis media de CMNMO administrada fue de 22 × 106 CD34+. La infusión selectiva en la arteria descendente anterior (durante 2-4min) se hizo con un catéter-balón colocado en su segmento proximal (a nivel del stent implantado), mediante infusión continua y con el balón inflado; la medida de este se estableció en función del tamaño del vaso, consiguiendo así condiciones de estancamiento de flujo para favorecer el anidamiento celular y evitar la pérdida sistémica. Después, con el fin de vigilar posibles eventos arrítmicos, se trasladaba a los pacientes a planta para una monitorización continua durante 24h y se les determinaba la concentración plasmática de creatincinasa y troponina para observar un posible daño miocárdico.
Movilización del factor estimulante de colonias granulocíticasLos 24 pacientes que recibieron la administración subcutánea durante 10 días de G-CSF recombinado (Neupogen; Amgen, Thousand Oaks, California, Estados Unidos) comenzaron el tratamiento el quinto día después del infarto con una dosis de 5μg/kg cada 12h. Durante los días 0, 3, 5 y 10 de la administración se obtuvieron muestras de sangre periférica para determinar el recuento de leucocitos y células CD34+ circulantes; así como de sus derivados inmunofenotípicos. Para cuantificar las células CD34+ y los progenitores presentes en sangre periférica, se utilizó la citometría de inmunofluorescencia de 3 colores.
Cateterismos diagnósticos y terapéuticosLas evaluaciones angiográficas se realizaron en el momento basal, antes de la infusión y a los 3 meses del infarto en los 88 pacientes y con idéntica metodología. Durante cada ventriculograma (realizado en proyección oblicua anterior derecha de 30°) se intentaba obtener un latido sinusal y otro posextrasistólico, con vistas a estudiar la reserva contráctil del ventrículo izquierdo. Los cálculos y medidas se efectuaron en el laboratorio del hospital, donde 2 angiografistas dibujaron las siluetas telediastólica y telesistólica mediante el sistema CASS. Se obtuvieron tanto los volúmenes ventriculares como la función ventricular, además de analizar la motilidad regional. Se utilizó el método de Sheehan FH18 para el estudio de la asinergia mediante la división de las siluetas superimpuestas en 100 radios de acortamiento sistólico de la pared, desde telediástole a telesístole, y se definió el segmento de contracción anormal como el porcentaje de radios que mostraran acinesia o discinesia. El grado de recuperabilidad funcional o «ganancia» obtenida al seguimiento se calculaba como la diferencia funcional obtenida en dicho seguimiento menos la condición basal. La valoración de dichos parámetros se obtuvo tanto en el latido sinusal como en el posextrasistólico, así como la presión de llenado ventricular izquierda.
Medida de la velocidad de flujo y reserva de flujo coronarioSe realizó una valoración invasiva de las velocidades de flujo y de la reserva coronaria en la arteria coronaria descendente anterior, medida tras la inyección intracoronaria de adenosina. Se utilizó el sistema FloMap (Cardiometrics, Mountain View, California, Estados Unidos). Se introducía una guía Doppler de 0,014 pulgadas, cuya punta se ubicaba en el tercio proximal del recorrido epicárdico de la arteria, y se registraban velocidades de flujo de forma continua. La velocidad de flujo se obtenía basalmente y tras la administración de un bolo intracoronario de 60μg de adenosina en la arteria descendente anterior; la RFC se calculó como la relación entre la máxima velocidad de flujo durante el efecto máximo de la adenosina y la velocidad de flujo basal. Se analizaron variables globales y por grupos. Se incluyeron las velocidades de flujo, la RFC y la ganancia en RFC (valorada mediante el cálculo de la RFC a los 3 meses menos la RFC basal). Los estudios de reserva coronaria se realizaron antes de la infusión de células y a los 3 meses.
Análisis estadísticoLas variables continuas se expresaron como media ± desviación estándar y las variables categóricas como porcentaje. Las medias de las variables cuantitativas entre los grupos establecidos se compararon mediante el análisis de la varianza. Para obtener las correlaciones lineales se utilizó el coeficiente de correlación de Pearson (r). La población del estudio presentaba, según el test de Kolgomorov-Smirnov con la corrección de Lilliefors, una distribución normal. Los datos se analizaron con el paquete comercial SPSS (versión 15.0) y se consideró estadísticamente significativo un valor de p < 0,05.
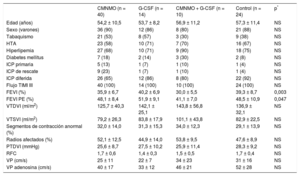
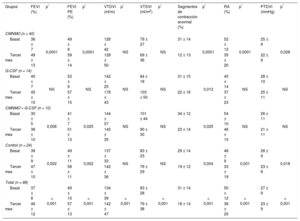
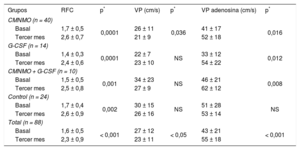
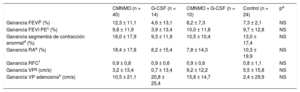
RESULTADOSLa mayoría de los pacientes incluidos eran varones (88%) con una edad media de 55,3 ± 10,4 años. El 16% de los pacientes de la serie global eran diabéticos, el 47% eran fumadores, el 64% tenía hipertensión arterial y el 73% presentaba valores elevados de colesterol unido a lipoproteínas de baja densidad (> 135mg/dl). En un 9% de los pacientes se llevaron a cabo intervenciones coronarias percutáneas primarias, en un 14% de rescate, y en el resto se realizaron intervenciones coronarias percutáneas diferidas. No hubo diferencias significativas en las características basales entre grupos en cuanto a los volúmenes ventriculares o las alteraciones en la contractilidad segmentaria ni en los obtenidos en la ventriculografía en latido sinusal o en el posextrasistólico, a excepción de la fracción de eyección basal sinusal y posextrasistólica, que fue menor en el grupo tratado con CMNMO + G-CSF. Asimismo, no hubo diferencias en cuanto a velocidades de flujo o en el valor basal de la RFC. En la tabla 1 se presentan los datos basales clínicos, de función miocárdica y microvascular. La tabla 2 muestra los cambios obtenidos en la función muscular a los 3 meses de seguimiento, tanto en la serie global como por grupos. Globalmente se observó una mejoría en la fracción de eyección y en la contractilidad segmentaria, con una reducción de los segmentos de contracción anormal; así como una reducción de los radios afectados a los 3 meses. No se encontraron cambios significativos por grupos en los volúmenes ventriculares, salvo en el volumen telediastólico del ventrículo izquierdo en el grupo tratado con G-CSF, en el que se produjo un crecimiento significativo al seguimiento sin cambios en la fracción de eyección. En la tabla 3 se muestran los datos basales y del seguimiento de los parámetros microvasculares en la serie global y por grupos, donde se observa una mejoría en la RFC (la RFC media global pasa de 1,6 ± 0,5 a 2,3 ± 0,9; p < 0,001), así como una disminución de la velocidad máxima con un incremento de la velocidad máxima tras administrar adenosina en la serie global; mientras que por grupos no se han observado diferencias estadísticamente significativas. En la tabla 4 se presenta un nuevo estudio comparativo de la ganancia en función muscular —tanto global como segmentaria— y la ganancia en función microvascular a los 3 meses entre los distintos grupos de tratamiento. Mientras que en la serie global sí se consiguió una ganancia significativa en la fracción de eyección (9,1 ± 11,1% y 8,8 ± 12,3%; p < 0,001) obtenida en la valoración por ventriculografía invasiva en el latido sinusal y posextrasistólico respectivamente, no se obtuvieron diferencias significativas entre grupos. No obstante, en el grupo experimental se observó cierta tendencia a ser mayor dicha ganancia. La ganancia media de RFC en la serie global fue de 0,87 ± 0,87 (p < 0,001), aunque sin diferencias entre grupos. La tabla 5, la tabla 6, la tabla 7 y la tabla 8 contienen las correlaciones obtenidas entre las ganancias de los parámetros angiográficos y los parámetros microvasculares en los grupos tratados con CMNMO, CMNMO + G-CSF, G-CSF y en el grupo control respectivamente. No se han obtenido correlaciones estadísticamente significativas entre la ganancia de función global ni segmentaria con la ganancia en RFC o las velocidades máximas de flujo coronario. No se produjeron eventos adversos relacionados con la terapia administrada ni con el procedimiento utilizado.
Datos basales clínicos y de función ventricular y microvascular por grupos de tratamiento
| CMNMO (n = 40) | G-CSF (n = 14) | CMNMO + G-CSF (n = 10) | Control (n = 24) | p* | |
|---|---|---|---|---|---|
| Edad (años) | 54,2 ± 10,5 | 53,7 ± 8,2 | 56,9 ± 11,2 | 57,3 ± 11,4 | NS |
| Sexo (varones) | 36 (90) | 12 (86) | 8 (80) | 21 (88) | NS |
| Tabaquismo | 21 (53) | 8 (57) | 3 (30) | 9 (38) | NS |
| HTA | 23 (58) | 10 (71) | 7 (70) | 16 (67) | NS |
| Hiperlipemia | 27 (68) | 10 (71) | 9 (90) | 18 (75) | NS |
| Diabetes mellitus | 7 (18) | 2 (14) | 3 (30) | 2 (8) | NS |
| ICP primaria | 5 (13) | 1 (7) | 1 (10) | 1 (4) | NS |
| ICP de rescate | 9 (23) | 1 (7) | 1 (10) | 1 (4) | NS |
| ICP diferida | 26 (65) | 12 (86) | 8 (80) | 22 (92) | NS |
| Flujo TIMI III | 40 (100) | 14 (100) | 10 (100) | 24 (100) | NS |
| FEVI (%) | 35,9 ± 6,7 | 40,2 ± 6,9 | 30,0 ± 5,5 | 39,3 ± 8,7 | 0,003 |
| FEVI PE (%) | 48,1 ± 8,4 | 51,9 ± 9,1 | 41,1 ± 7,0 | 48,5 ± 10,9 | 0,047 |
| VTDVI (ml/m2) | 125,7 ± 40,3 | 142,1 ± 25,1 | 143,8 ± 56,8 | 136,9 ± 32,1 | NS |
| VTSVI (ml/m2) | 79,2 ± 26,3 | 83,8 ± 17,9 | 101,1 ± 43,8 | 82,9 ± 22,5 | NS |
| Segmentos de contracción anormal (%) | 32,0 ± 14,0 | 31,3 ± 15,3 | 34,0 ± 12,3 | 29,1 ± 13,9 | NS |
| Radios afectados (%) | 52,1 ± 12,5 | 44,9 ± 14,0 | 53,8 ± 9,5 | 47,6 ± 8,9 | NS |
| PTDVI (mmHg) | 25,6 ± 8,7 | 27,5 ± 10,2 | 25,9 ± 11,4 | 28,3 ± 9,2 | NS |
| RFC | 1,7 ± 0,6 | 1,4 ± 0,3 | 1,5 ± 0,5 | 1,7 ± 0,4 | NS |
| VP (cm/s) | 25 ± 11 | 22 ± 7 | 34 ± 23 | 31 ± 16 | NS |
| VP adenosina (cm/s) | 40 ± 17 | 33 ± 12 | 46 ± 21 | 52 ± 28 | NS |
CMNMO: células mononucleares derivadas de médula ósea autóloga; FEVI: fracción de eyección del ventrículo izquierdo; G-CSF: factor estimulante de colonias granulocíticas; HTA: hipertensión arterial; ICP: intervención coronaria percutánea; NS: no significativo; PE: posextrasistólica; PTDVI: presión telediastólica del ventrículo izquierdo; RFC: reserva de flujo coronario; TIMI: Thrombolysis in Myocardial Infarction; VP: velocidad máxima de flujo coronario; VP adenosina: velocidad máxima de flujo coronario tras administrar adenosina intracoronaria; VTDVI: volumen telediastólico del ventrículo izquierdo; VTSVI: volumen telesistólico del ventrículo izquierdo.
Salvo otra indicación, los datos expresan n (%) o media ± desviación estándar.
Cambios en los parámetros de función ventricular al seguimiento en la serie global y por grupos de tratamiento
| Grupos | FEVI (%) | p* | FEVI PE (%) | p* | VTDVI (ml/m) | p* | VTSVI (ml/m2) | p* | Segmentos de contracción anormal (%) | p* | RA (%) | p* | PTDVI (mmHg) | p* |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CMNMO (n = 40) | ||||||||||||||
| Basal | 36 ± 7 | 0,0001 | 49 ± 9 | 0,0001 | 126 ± 42 | NS | 79 ± 27 | NS | 31 ± 14 | 0,0001 | 52 ± 12 | 0,0001 | 25 ± 9 | 0,028 |
| Tercer mes | 49 ± 13 | 59 ± 14 | 128 ± 50 | 69 ± 36 | 12 ± 13 | 35 ± 20 | 22 ± 9 | |||||||
| G-CSF (n = 14) | ||||||||||||||
| Basal | 40 ± 7 | NS | 53 ± 9 | NS | 142 ± 25 | NS | 84 ± 18 | NS | 31 ± 15 | 0,012 | 45 ± 14 | NS | 28 ± 10 | NS |
| Tercer mes | 45 ± 15 | 57 ± 15 | 178 ± 43 | 103 ± 50 | 22 ± 16 | 37 ± 23 | 25 ± 11 | |||||||
| CMNMO + G-CSF (n = 10) | ||||||||||||||
| Basal | 30 ± 5 | 0,006 | 41 ± 7 | 0,025 | 144 ± 57 | NS | 101 ± 44 | NS | 34 ± 12 | 0,025 | 54 ± 10 | NS | 26 ± 11 | NS |
| Tercer mes | 38 ± 10 | 51 ± 13 | 145 ± 35 | 90 ± 30 | 23 ± 14 | 46 ± 15 | 21 ± 11 | |||||||
| Control (n = 24) | ||||||||||||||
| Basal | 39 ± 9 | 0,002 | 49 ± 11 | 0,002 | 137 ± 33 | NS | 83 ± 23 | NS | 29 ± 14 | 0,004 | 48 ± 9 | 0,001 | 28 ± 9 | 0,018 |
| Tercer mes | 47 ± 10 | 58 ± 11 | 142 ± 36 | 76 ± 29 | 19 ± 12 | 33 ± 19 | 23 ± 8 | |||||||
| Total (n = 88) | ||||||||||||||
| Basal | 37 ± 8 | < 0,001 | 49 ± 10 | < 0,001 | 134 ± 39 | < 0,001 | 83 ± 28 | < 0,001 | 31 ± 14 | < 0,001 | 50 ± 12 | < 0,001 | 27 ± 9 | < 0,001 |
| Tercer mes | 46 ± 12 | 57 ± 13 | 142 ± 47 | 79 ± 38 | 18 ± 14 | 36 ± 20 | 23 ± 9 | |||||||
CMNMO: células mononucleares derivadas de médula ósea autóloga; FEVI: fracción de eyección del ventrículo izquierdo; G-CSF: factor estimulante de colonias granulocíticas; NS: no significativo; PE: posextrasistólica; PTDVI: presión telediastólica del ventrículo izquierdo; RA: radios afectados (acinéticos/discinéticos); VTDVI: volumen telediastólico del ventrículo izquierdo; VTSVI: volumen telesistólico del ventrículo izquierdo.
Cambios en los parámetros de función microvascular al seguimiento en la serie global y por grupos de tratamiento
| Grupos | RFC | p* | VP (cm/s) | p* | VP adenosina (cm/s) | p* |
|---|---|---|---|---|---|---|
| CMNMO (n = 40) | ||||||
| Basal | 1,7 ± 0,5 | 0,0001 | 26 ± 11 | 0,036 | 41 ± 17 | 0,016 |
| Tercer mes | 2,6 ± 0,7 | 21 ± 9 | 52 ± 18 | |||
| G-CSF (n = 14) | ||||||
| Basal | 1,4 ± 0,3 | 0,0001 | 22 ± 7 | NS | 33 ± 12 | 0,012 |
| Tercer mes | 2,4 ± 0,6 | 23 ± 10 | 54 ± 22 | |||
| CMNMO + G-CSF (n = 10) | ||||||
| Basal | 1,5 ± 0,5 | 0,001 | 34 ± 23 | NS | 46 ± 21 | 0,008 |
| Tercer mes | 2,5 ± 0,8 | 27 ± 9 | 62 ± 12 | |||
| Control (n = 24) | ||||||
| Basal | 1,7 ± 0,4 | 0,002 | 30 ± 15 | NS | 51 ± 28 | NS |
| Tercer mes | 2,6 ± 0,9 | 26 ± 16 | 53 ± 14 | |||
| Total (n = 88) | ||||||
| Basal | 1,6 ± 0,5 | < 0,001 | 27 ± 12 | < 0,05 | 43 ± 21 | < 0,001 |
| Tercer mes | 2,3 ± 0,9 | 23 ± 11 | 55 ± 18 | |||
CMNMO: células mononucleares derivadas de médula ósea autóloga; G-CSF: factor estimulante de colonias granulocíticas; NS: no significativo; RFC: reserva de flujo coronario; VP: velocidad máxima de flujo coronario; VP adenosina: velocidad máxima de flujo coronario tras administrar adenosina intracoronaria.
Datos sobre la ganancia en función ventricular y microvascular por grupos de tratamiento al seguimiento
| CMNMO (n = 40) | G-CSF (n = 14) | CMNMO + G-CSF (n = 10) | Control (n = 24) | pa | |
|---|---|---|---|---|---|
| Ganancia FEVIb (%) | 12,3 ± 11,1 | 4,6 ± 13,1 | 8,2 ± 7,3 | 7,3 ± 2,1 | NS |
| Ganancia FEVI PEc (%) | 9,8 ± 11,9 | 3,9 ± 13,4 | 10,0 ± 11,8 | 9,7 ± 12,8 | NS |
| Ganancia segmentos de contracción anormald (%) | 16,0 ± 17,9 | 9,3 ± 11,9 | 10,5 ± 10,4 | 13,0 ± 17,4 | NS |
| Ganancia RAe (%) | 18,4 ± 17,8 | 8,2 ± 15,4 | 7,8 ± 14,3 | 10,3 ± 19,9 | NS |
| Ganancia RFCf | 0,9 ± 0,8 | 0,9 ± 0,6 | 0,9 ± 0,6 | 0,8 ± 1,1 | NS |
| Ganancia VPg (cm/s) | 3,2 ± 13,4 | 0,7 ± 13,4 | 9,2 ± 12,2 | 5,5 ± 15,8 | NS |
| Ganancia VP adenosinah (cm/s) | 10,5 ± 21,1 | 20,8 ± 25,4 | 15,8 ± 14,7 | 2,4 ± 29,9 | NS |
CMNMO: células mononucleares derivadas de médula ósea autóloga; FEVI: fracción de eyección del ventrículo izquierdo; G-CSF: factor estimulante de colonias granulocíticas; NS: no significativo; PE: posextrasistólica; RA: radios afectados (acinéticos/discinéticos); RFC: reserva de flujo coronario; VP: velocidad máxima de flujo coronario.
Correlaciones entre las ganancias de función ventricular y microvascular en el grupo tratado con células mononucleares derivadas de médula ósea autóloga*
| Ganancia RFC | p | Ganancia VP | p | Ganancia VP adenosina | p | |
|---|---|---|---|---|---|---|
| Ganancia FEVI | r = 0,05 | NS | r = 0,24 | NS | r = –0,17 | NS |
| Ganancia segmentos de contracción anormal | r = 0,07 | NS | r = 0,13 | NS | r = 0,06 | NS |
| Ganancia RA | r = 0,13 | NS | r = 0,20 | NS | r = –0,01 | NS |
FEVI: fracción de eyección del ventrículo izquierdo; NS: no significativo; RA: radios afectados (acinéticos/discinéticos); RFC: reserva de flujo coronario; VP: velocidad máxima de flujo coronario; VP adenosina: velocidad máxima de flujo coronario tras administrar adenosina intracoronaria.
Correlaciones entre las ganancias de función ventricular y microvascular en el grupo tratado con células mononucleares derivadas de médula ósea autóloga más factor estimulante de colonias granulocíticas*
| Ganancia RFC | p | Ganancia VP | p | Ganancia VP adenosina | p | |
|---|---|---|---|---|---|---|
| Ganancia FEVI | r = –0,10 | NS | r = 0,63 | NS | r = 0,22 | NS |
| Ganancia segmentos de contracción anormal | r = –0,48 | NS | r = 0,01 | NS | r = –0,33 | NS |
| Ganancia RA | r = –0,24 | NS | r = 0,59 | NS | r = 0,04 | NS |
FEVI: fracción de eyección del ventrículo izquierdo; NS: no significativo; RA: radios afectados (acinéticos/discinéticos); RFC: reserva de flujo coronario; VP: velocidad máxima de flujo coronario; VP adenosina: velocidad máxima de flujo coronario tras administrar adenosina intracoronaria.
Correlaciones entre las ganancias de función ventricular y microvascular en el grupo tratado con factor estimulante de colonias granulocíticas*
| Ganancia RFC | p | Ganancia VP | p | Ganancia VP adenosina | p | |
|---|---|---|---|---|---|---|
| Ganancia FEVI | r = –0,03 | NS | r = 0,26 | NS | r = 0,36 | NS |
| Ganancia segmentos de contracción anormal | r = 0,14 | NS | r = 0,54 | NS | r = 0,51 | NS |
| Ganancia RA | r = 0,25 | NS | r = 0,13 | NS | r = 0,52 | NS |
FEVI: fracción de eyección del ventrículo izquierdo; NS: no significativo; RA: radios afectados (acinéticos/discinéticos); RFC: reserva de flujo coronario; VP: velocidad máxima de flujo coronario; VP adenosina: velocidad máxima de flujo coronario tras administrar adenosina intracoronaria.
Correlaciones entre las ganancias de función ventricular y microvascular en el grupo control*
| Ganancia RFC | p | Ganancia VP | p | Ganancia VP adenosina | p | |
|---|---|---|---|---|---|---|
| Ganancia FEVI | r = –0,07 | NS | r = 0,26 | NS | r = 0,09 | NS |
| Ganancia segmentos de contracción anormal | r = –0,04 | NS | r = 0,22 | NS | r = 0,21 | NS |
| Ganancia RA | r = –0,13 | NS | r = –0,10 | NS | r = –0,25 | NS |
FEVI: fracción de eyección del ventrículo izquierdo; NS: no significativo; RA: radios afectados (acinéticos/discinéticos); RFC: reserva de flujo coronario; VP: velocidad máxima de flujo coronario; VP adenosina: velocidad máxima de flujo coronario tras administrar adenosina intracoronaria.
La RFC refleja la capacidad de incrementar el flujo coronario basal tras máxima hiperemia y se considera un indicador del estado de la circulación coronaria19. Se encuentra alterada sobre todo en pacientes con enfermedad coronaria significativa20 y no se normaliza inmediatamente tras la revascularización percutánea21-24. Algunos autores también han descrito que los sujetos con fracción de eyección deprimida tras un infarto agudo presentan una RFC menor, mientras que en los sujetos con fracción de eyección preservada la RFC es significativamente mayor2,25.
Se desconoce el mecanismo exacto por el cual se produce mejoría o empeoramiento de la RFC después de un infarto agudo sometido a angioplastia, pero se sabe que hay una relación estrecha entre la disfunción microvascular y la recuperación de la función ventricular izquierda26-28. Se ha postulado que la reserva coronaria se comporta como factor predictor independiente de respuesta al remodelado adverso tras la angioplastia29-32; así los sujetos con remodelado adverso en el seguimiento habían presentado baja RFC en la fase aguda. Ello podría ser explicable porque la integridad microvascular es esencial para un resultado favorable después de un infarto reperfundido. En esta serie no hay correlación entre la RFC y la función ventricular, quizás porque los pacientes incluidos parten de un infarto anterior de gran tamaño con fracción de eyección deprimida y —aunque se trata de un grupo bastante homogéneo en cuanto a características basales se refiere— cabe destacar que había diferencias estadísticamente significativas entre grupos respecto a la fracción de eyección basal, obtenida tanto en el latido sinusal como en el posextrasistólico, que fue menor en el grupo tratado con CMNMO + G-CSF.
Diferentes estudios han mostrado que la infusión intracoronaria de CMNMO puede tener un efecto beneficioso en el remodelado, la función ventricular y la reperfusión tras el infarto5-8,12-16. Mientras que los beneficios de la movilización de células madre a través del G-CSF en pacientes con infarto y la recuperación de la función ventricular izquierda se han cuestionado, en nuestra experiencia los sujetos que reciben G-CSF no difieren del grupo control en términos de mejoría de la función ventricular16.
Hay pocos trabajos que hayan valorado la RFC en sujetos después de tener un infarto de miocardio y a los cuales se les ha administrado terapia regenerativa16,17, y solo unos pocos autores han encontrado mejoría de la RFC tras la administración de células madre6,33,34. En algún estudio también se ha obtenido correlación entre los valores circulantes de células madre tras un infarto y el grado de recuperabilidad de la reserva coronaria35. En la serie estudiada en el presente trabajo se produjo mejoría tanto en la función muscular como microvascular. A su vez se observó, entre otros hallazgos, un incremento de la velocidad máxima tras el uso de adenosina a los 3 meses de seguimiento; hecho que pudiera deberse a que en la fase aguda del infarto hay una mayor vasoconstricción de la microvasculatura coronaria que hace que junto a un probable proceso de microembolización distal no se produzca una vasodilatación apropiada tras el uso de adenosina, a diferencia de lo que ocurre durante el seguimiento.
Sin embargo, hasta donde se sabe, la relación entre los cambios encontrados en la función ventricular izquierda y los obtenidos en la reserva coronaria tras el empleo de terapia regenerativa en el infarto agudo de miocardio se ha estudiado poco36. En esta serie no se han encontrado correlaciones estadísticamente significativas entre los parámetros de función ventricular y la ganancia en RFC propiamente dicha, ni en el grupo control ni en los grupos experimentales tratados con células madre o el factor. No obstante, debido al escaso tamaño de la muestra en cada uno de los grupos, los resultados deben interpretarse con cautela. De manera genérica, se puede decir que la tendencia en ganancia en fracción de eyección es mayor en el grupo tratado con células madre con relación al grupo control, especialmente cuando se compara con el grupo tratado con G-CSF16.
Se han postulado diversos mecanismos por los cuales se podría promover la regeneración cardiaca —como la transdiferenciación, la fusión con células residentes, etc.— justificando así la mejoría de la función miocárdica tras el empleo de células madre en el infarto de miocardio, pero quizás sea el efecto paracrino37 (inducido por las células madre infundidas en el miocardio gracias a la liberación de citocinas y factores de crecimiento) el que provoca unos efectos pleiotrópicos primordiales —no solo en términos de neoangiogénesis, sino también por medio de la estimulación directa de las células madre residentes— para promover su diferenciación, la proliferación de los propios cardiomiocitos, así como mediante la reducción de la respuesta inflamatoria y la fibrosis desarrollada tras el daño cardiaco que supone el infarto. Asimismo, parece lógico añadir la contribución incuestionable que supone la recanalización precoz de la arteria responsable del infarto junto al tratamiento médico óptimo farmacológico de reconocida eficacia que contribuye igualmente a contrarrestar el remodelado adverso.
LimitacionesEntre las principales limitaciones cabe citar que es un estudio monocéntrico, con una muestra heterogénea y que presenta un periodo de seguimiento breve; de ahí que los resultados obtenidos se deban interpretar con cautela. Se trata de un estudio no aleatorizado y esto, unido a las limitaciones de los análisis agrupados, puede ser la causa de la falta de significación estadística tanto en las correlaciones establecidas como en la ganancia en función ventricular y RFC entre grupos de tratamiento.
CONCLUSIONESLos cambios favorables obtenidos en la función ventricular izquierda tras la terapia regenerativa en pacientes con infarto agudo de localización anterior no se correlacionan con la mejoría obtenida en la reserva coronaria. El mecanismo exacto de actuación de las células madre sigue siendo conocido solo parcialmente. Es necesario llevar a cabo estudios específicamente diseñados para esclarecer estos mecanismos y así poder optimizar la terapia y mejorar los resultados del tratamiento de los pacientes con infarto agudo de miocardio.
CONFLICTO DE INTERESESNo se declara ninguno.
- –
Diversos trabajos han establecido la relación que parece haber entre los cambios de la función microvascular y la función miocárdica tras un infarto agudo de miocardio revascularizado, y que la RFC se comporta como predictor de recuperabilidad de la función cardiaca a corto-medio plazo. Sin embargo, los cambios que se producen en la RFC tras la infusión de CMNMO en pacientes isquémicos son dispares y no hay consenso sobre su beneficio real; a diferencia de lo que ocurre con la mejoría obtenida en la función miocárdica, donde los estudios son más concluyentes al respecto y en general la muestran como una terapia beneficiosa.
- –
Este trabajo valora si la mejoría en la microcirculación coronaria tras el empleo de terapia regenerativa —uno de los teóricos mecanismos de acción— influye en el grado de recuperación funcional miocárdico. No se ha encontrado correlación entre la mejoría obtenida en los distintos parámetros de función muscular y la mejoría de la RFC, aunque la falta de significación estadística puede deberse a una muestra insuficiente; al tipo de análisis empleado; al corto seguimiento, o al hecho de que se partía de una función ventricular bastante deprimida, un determinante que también influye en el grado de recuperabilidad de la RFC.