La comunicación interauricular tipo seno venoso superior (CIA-SVS) es un defecto infrecuente del tabique interauricular que se suele acompañar de drenaje venoso pulmonar anómalo parcial (DVPAP) de las venas pulmonares lobulares superiores derechas en la vena cava superior (VCS). El tratamiento es la corrección quirúrgica mediante el cierre del defecto con parche y reconexión de las venas pulmonares a la aurícula izquierda (AI). Recientemente se ha descrito el cierre percutáneo mediante la interposición de stent recubierto en la VCS1. Se presenta el primer caso de cierre percutáneo comunicado en nuestro país mediante una técnica modificada de doble stent en chimenea.
Se presenta el caso de un paciente de 58 años con obesidad mórbida que refería disnea de esfuerzo progresiva. El ecocardiograma mostró sobrecarga de volumen en cavidades derechas. La resonancia magnética cardiaca y la tomografía computarizada (TC) confirmaron el diagnóstico de CIA-SVS con DVPAP con Qp:Qs=2,1:1 y presión pulmonar normal (figura 1A-C), además de una VCS izquierda persistente. Debido a la comorbilidad, se decidió realizar el cierre percutáneo. Se imprimió un modelo tridimensional cardiaco con las imágenes de la TC con el softwareITK snap. La geometría final se exportó como un archivo .stl al programa Meshmixer (Autodesk Inc.; Estados Unidos) para su modelado. Se añadió una capa externa de 0,8 mm y se procesó mediante el programa Cura (Ultimaker BV; Países Bajos), para enviarlo a una impresora tridimensional (BQ Witbox; España). Se fabricó mediante tecnología Fused Deposition Modelling con filamento de poliuretano2-4.
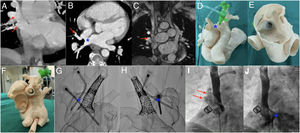
Multimodalidad en la planificación. A y B: tomografía computarizada cardiaca; las flechas muestran las venas lobulares superior y media derechas drenando a nivel de la VCS; el asterisco representa la CIA-SVS. C: resonancia magnética cardiaca en la que se aprecia el DVPAP (flecha) y la CIA. D-F: modelo tridimensional; se observan los introductores a través de las venas pulmonares anómalas y el stent acampanado desde la cara auricular sellando el defecto y el otro stent desde la VCS; el asterisco representa la CIA-SVS. G y H: imagen radiológica del modelo 3D que muestra los stents y los introductores; el asterisco representa el sitio de la CIA. I y J: angiografía desde la VCS en la que se aprecian las venas pulmonares anómalas (flechas) y la CIA-SVS (asterisco). CIA-SVS: comunicación interauricular tipo seno venoso superior; DVPAP: drenaje venoso pulmonar anómalo parcial; VCS: vena cava superior.
El procedimiento se simuló in vitro mediante el implante de 2 stents solapados en la VCS acampanando el stent proximal hasta certificar el sellado de la CIA-SVS en el techo de la aurícula derecha (AD), además de la inserción de 2 introductores desde las venas pulmonares anómalas atravesando la CIA hasta la AI y comprobando mediante radioscopia que había espacio suficiente entre los stents y la pared de la VCS para permitir redirigir el flujo del DVPAP a la AI (figuras 1D–H).
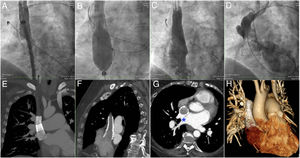
Mediante accesos venosos femoral y yugular derechos y arterial izquierdo, se inició el procedimiento realizando un asa venovenosa entre la vena yugular interna y la vena femoral para facilitar el implante y el acampanado de los stents. Se introdujo retrógradamente un catéter Glidecath (Terumo, Europa) de 4 Fr a través del acceso arterial hasta situarlo en el DVPAP para comprobar su permeabilidad durante el procedimiento. Se realizó angiografía basal para ver el DVPAP y la CIA-SVS (figura 1I–Jy vídeo 1 del material adicional). A través de una vaina de 16 Fr por la vena femoral derecha, se implantó un stent recubierto BeGraft (Bentley; Alemania) de 18×48 mm en la VCS (figura 2A) y posteriormente se solapó otro stent BeGraft de 24×48 mm. Con un balón Z-MED (Numed; Estados Unidos) de 30 mm, se posdilató el stent proximal a nivel de la AD a la vez que se inflaba un balón ATLAS de 18 mm (Bard; Estados Unidos) introducido desde la VCS a nivel del solapamiento de los stents para evitar la migración del stent proximal a la AD durante la maniobra de acampanado (figura 2B). Finalmente se comprobó el adecuado flujo y la ausencia de gradiente entre el DVPAP y la AI (figura 2C-D). Antes del alta, la TC mostró la permeabilidad de los stents desde la VCS a la AD y la reconducción del flujo del DVPAP entre la pared de la VCS y los stents, atravesando la CIA anatómica hasta la AI (figura 2E–Hy vídeo 2 y vídeo 3 del material adicional).
Procedimiento percutáneo. A: implante del stent más distal en la VCS. B: maniobra de acampanar con balón el stent proximal manteniendo otro balón inflado en la zona de solapamiento de los stents para evitar su migración. C: angiografía desde la VCS que muestra el sellado completo de la CIA-SVS. D: inyección desde el catéter retrógrado en el DVPAP que demuestra la permeabilidad de las venas pulmonares anómalas drenando en la AI. E-H: imágenes de la tomografía computarizada que muestran los stents, la reconducción del flujo del DVPAP entre la VCS y los stents y su paso por la CIA-SVS anatómica (asterisco) hasta la AI. AI: aurícula izquierda; CIA-SVS: comunicación interauricular tipo seno venoso superior; DVPAP: drenaje venoso pulmonar anómalo parcial; VCS: vena cava superior.
En primer lugar, se reseña que la planificación con el modelo tridimensional permitió reproducir exactamente lo ocurrido durante el procedimiento real con los mismos stents, por lo que se evitó el test con balón inflado en la VCS que se recomienda para comprobar la ausencia de oclusión del DVPAP2,3. En segundo lugar, es crucial para el sellado completo de la CIA acampanar el stent proximal en el techo de la AD y estudiar con precisión el acortamiento y el diámetro máximo que debe alcanzar el stent. Tercero, para evitar la migración del stent durante la maniobra de acampanado, es importante su fijación con otro balón. En cuarto lugar, en caso de oclusión del DVPAP, el catéter se puede intercambiar por una guía de alto soporte e inflar un balón retrógradamente.
Teniendo en cuenta estos aspectos técnicos y de planificación, y a falta de más experiencia, creemos que el cierre de la CIA-SVS podría ser factible y seguro en pacientes con contraindicación y/o alto riesgo quirúrgico.
CONFLICTO DE INTERESESÁ. Sánchez-Recalde es Editor Asociado de Revista Española de Cardiología.