El propósito de este trabajo es evaluar los cambios cardiacos estructurales y funcionales que se producen tras 1 año de seguimiento de pacientes sometidos a ablación del aleteo auricular típico.
MétodosSe ha analizado de manera consecutiva a 95 pacientes remitidos para ablación del istmo cavotricuspídeo. Se realizó un ecocardiograma en las 6 h posteriores al procedimiento y al cabo de 1 año de seguimiento.
ResultadosCompletaron el estudio 89 pacientes. La cardiopatía hipertensiva fue la asociada más frecuentemente (39%). Presentaban disfunción sistólica ventricular izquierda el 24% de los pacientes. Se observó una reducción estadísticamente significativa en el área de la aurícula derecha, el área de la aurícula izquierda, los diámetros telediastólico y telesistólico del ventrículo izquierdo y el septo interventricular. Hubo una mejoría significativa en la fracción de contracción de la aurícula derecha y la fracción de eyección del ventrículo izquierdo, así como en la reducción de hipertensión pulmonar. Se observó un cambio significativo en el patrón de disfunción diastólica, que pasó de grado III (60% basal) a grado I (el 81% en el seguimiento). No se encontraron diferencias estructurales basales ni en el seguimiento entre los pacientes con aleteo auricular paroxístico o persistente, excepto en la función diastólica basal.
ConclusionesLa ablación con catéter del istmo cavotricuspídeo en el aleteo auricular típico produjo al cabo de 1 año de seguimiento un remodelado cardiaco inverso estructural y funcional, con mejoría de la fracción de eyección del ventrículo izquierdo, la fracción de contracción de la aurícula derecha y el patrón de disfunción diastólica.
Palabras clave
La ablación del istmo cavotricuspídeo (ICT) es una opción de primera línea en el tratamiento del aleteo auricular (AA) o flutter típico recurrente, especialmente en casos de mala tolerancia clínica y en aquellos en que el AA se desarrolla tras el tratamiento farmacológico de la fibrilación auricular (FibA) con fármacos de clase I o III1, 2, 3, 4. Los estudios realizados han descrito mejoría de los síntomas y de la calidad de vida tras la ablación del ICT5, 6, 7, 8, 9; sin embargo, no han abordado los cambios estructurales y funcionales que se producen tras la ablación.
Por lo tanto, este estudio se ha diseñado con el propósito de evaluar los cambios estructurales y funcionales cardiacos que se producen al cabo de 1 año en los pacientes con AA típico tras la ablación de ICT.
MétodosPoblaciónSe ha analizado de manea consecutiva a 95 pacientes remitidos al laboratorio de electrofisiología cardiaca entre los años 2003 y 2005 que cumplían los siguientes requisitos: a) mayores de 18 años; b) 1 o más episodios de AA documentado en electrocardiograma (ECG) de 12 derivaciones en los 6 meses previos; c) historia de AA aislado o predominante si presentaba también FibA concomitante, o AA después de recibir tratamiento antiarrítmico con fármacos tipo I o III para prevención de FibA, y d) confirmación de AA dependiente del ICT en el estudio electrofisiológico o permeabilidad del ICT si se realiza el procedimiento de ablación en ritmo sinusal. En este caso se exigía que el ECG del episodio clínico fuera típico común.
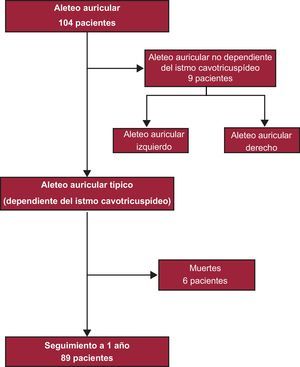
Los criterios de exclusión fueron: a) AA no dependiente del ICT; b) cirugía cardiaca o procedimiento intervencionista cardiaco (angioplastia coronaria o implante de marcapasos) en los 30 días previos; c) portador de desfibrilador implantable; d) expectativa de vida<1 año, y e) imposibilidad de cumplimentar el cuestionario de calidad de vida (Figura).
Figura. Diagrama de flujo de la población del estudio.
DefinicionesTaquicardiomiopatía: disfunción miocárdica de ventrículo izquierdo (VI) secundaria al AA con respuesta ventricular a alta frecuencia y recuperación total al normalizar el ritmo cardiaco. Se consideró disfunción sistólica del VI una fracción de eyección del ventrículo izquierdo (FEVI)<50%. No se consideró taquicardiomiopatía en caso de pacientes que no alcanzaron una FEVI normal en el seguimiento.
Los tipos de AA se han definido por analogía con la FibA:
• Persistente: forma de AA incesante que no termina espontáneamente, que cursa durante más de 1 mes y documentado por varios ECG.
• Paroxístico: forma de AA intermitente con episodios de duración<48 h que ceden espontáneamente.
Se utilizó un catéter tetrapolar estándar (Usci-Bard Inc.) para cartografiar el área de His, un catéter decapolar (Usci-Bard Inc.) para cartografiar el seno coronario y un catéter duodecapolar Halo XP (Cordis-Webster Inc.) para cartografiar la activación de la cara anterolateral de la aurícula derecha (AD). Se aplicó energía de radiofrecuencia durante 60 s a cada punto. Se confirmó la dependencia del ICT por medio de encarrilamiento oculto cuando el ritmo al inicio del estudio electrofisiológico era AA o cuando este se inducía en el laboratorio. Si el paciente estaba en ritmo sinusal, se comprobaba la permeabilidad bidireccional del ICT previa a la ablación. El objetivo del procedimiento era alcanzar el bloqueo bidireccional en la conducción a través del ICT10, 11.
SeguimientoSe programó para seguimiento clínico a todos los pacientes a los 3, 6 y 12 meses desde la ablación. Cualquier visita realizada tanto al cardiólogo como al servicio de urgencias se registró en la historia clínica electrónica. A los 6 meses del procedimiento, se colocó un Holter de arritmias de 7 días para valorar eventos asintomáticos.
Se realizó estudio ecocardiográfico en las primeras 6 h posteriores al estudio electrofisiológico y al cabo de 1 año de seguimiento. Se utilizó un equipo convencional (Siemens Sequoia C 256 AG; Múnich, Alemania). Para las mediciones realizadas en modo M y en modo bidimensional, se siguieron las recomendaciones de la Sociedad Americana de Ecocardiografía12. Las áreas de la AD y de la aurícula izquierda (AI) se calcularon por planimetría de los bordes internos de la aurícula en el plano apical de cuatro cámaras para obtener el tamaño máximo auricular al término de la sístole ventricular. Se calculó siguiendo el mismo método el área mínima de la AD al final de la diástole ventricular y la fracción de contracción de la AD (cfAD) según la fórmula:
El gradiente de presión entre el ventrículo derecho (VD) y la AD durante la sístole se midió usando la ecuación simplificada de Bernoulli. Para valorar la función diastólica se utilizó el Doppler del flujo transmitral con la determinación de la velocidad máxima de las ondas E y A, la relación E/A y los tiempos de deceleración de la onda E (Tdec E) y de relajación isovolumétrica (TRIV). Se tomó la media de cinco determinaciones para minimizar la variación respiratoria de estas variables. Se clasificó la disfunción diastólica en tres grados: grado I, alteración en la relajación de VI (E/A<0,7 y Tdec E>250 ms); grado II, seudonormalización (E/A 0,7-1,5 y Tdec E 150-250 ms), y grado III, alteración restrictiva (E/A>1,5 y Tdec E<150 ms). Para confirmar un patrón de seudonormalización, se utilizó el Doppler tisular de la región posterolateral del anillo mitral (E’/A’<1 y E’<8,5 cm/s)13, 14.
Para cuantificar la gravedad de la insuficiencia mitral (IM) y de la insuficiencia tricuspídea (IT), se utilizó la razón entre el jet regurgitante máximo obtenido de la imagen de flujo por Doppler color y el área auricular:<15% (grado I); 15-30% (grado II); 30-50% (grado III) y>50% (grado IV)15.
La variabilidad interobservador estuvo en un 2,3-4,5% para el área de la AD, el área de la AI, el diámetro de la AI, el diámetro telediastólico (DTD), el diámetro telesistólico (DTS), el septo interventricular (SIV), la pared posterior (PP) y la FEVI, y en un 6-11,5% para las variables onda E, onda A, cociente E/A, Tdec E y TRIV.
La variabilidad intraobservador estuvo en un 0,8-5,5% para el área de la AD, el área de la AI, el diámetro de la AI, el DTD, el DTS, el SIV, la PP y la FEVI, y en un 4-10,4% para las variables onda E, onda A, cociente E/A, Tdec E y TRIV.
Análisis estadísticoPara comparar las variables estructurales, se utilizaron las pruebas de la t de Student y la no paramétrica de Mann-Whitney, según la distribución fuese o no paramétrica. Para verificar la normalidad de las distribuciones y la homogeneidad de las varianzas, se utilizaron las pruebas de Kolmogorov-Smirnov y la prueba de Levene, respectivamente. Para comparar todas las variables estructurales, la función diastólica y las alteraciones valvulares entre el seguimiento y el basal, se utilizó la prueba de Wilcoxon para datos apareados.
Consideraciones éticasEl estudio se ha realizado de acuerdo con los principios de la Declaración de Helsinki de 1975 y fue aprobado por el Comité Ético de Investigación Clínica de Galicia. Todos los pacientes fueron informados y se obtuvo consentimiento por escrito.
ResultadosCaracterísticas clínicas de los pacientesLas características basales de los pacientes se muestran en la Tabla 1. La media de edad de los pacientes era 64 años, con predominio de varones (82%). La cardiopatía asociada más frecuentemente fue la cardiopatía hipertensiva (38%). Se observó una FEVI<50% en el 25% de los pacientes, mientras que el 22% no tenía cardiopatía estructural. Presentaba antecedentes de FibA previa el 45%.
Tabla 1. Características basales de los pacientes (n=89) que han completado 1 año de seguimiento
| Edad (años) | 64,2±10,7 |
| Varones, n (%) | 73 (82) |
| EPOC, n (%) | 16 (18) |
| HTA, n (%) | 43 (48,3) |
| Diabetes, n (%) | 17 (19,1) |
| Obesidad, n (%) | 22 (24,7) |
| FEVI<50%, n (%) | 22 (24,7) |
| Cardiopatía hipertensiva, n (%) | 34 (38,2) |
| Valvulopatía, n (%) | 18 (20,2) |
| Cardiopatía isquémica, n (%) | 13 (14,6) |
| Insuficiencia cardiaca, n (%) | 14 (15,7) |
| Miocardiopatía dilatada, n (%) | 16 (18) |
| Tras cirugía cardiaca, n (%) | 11 (12,4) |
| Sin cardiopatía, n (%) | 20 (22,5) |
| Tipo de AA, n (%) | |
| Paroxístico | 50 (56,2) |
| Persistente | 39 (43,8) |
| Ciclo ventricular (ms) | 664±223 |
| Paroxístico | 640±260 |
| Persistente | 685±192 |
| Primer episodio de AA | 38 (42,7) |
| Duración de AA (meses) | 18 [4-48] |
| Episodios AA (n) | 2 [1-7] |
| CVE, n (%) | 22 (24,7) |
| CVF, n (%) | 14 (15,7) |
| ACO previa, n (%) | 53 (59,6) |
| ACO posterior, n (%) | 61 (68,5) |
| FibA previa, n (%) | 40 (44,9) |
| AA IC o amiodarona, n (%) | 14 (15,7) |
| Amiodarona | 11 (11,6) |
| Flecainida | 3 (3,1) |
| Taquicardiomiopatía, n (%) | 16 (17,9) |
AA: aleteo auricular; AA IC o amiodarona: aleteo auricular relacionado con la administración de fármacos antiarrítmicos I o III; ACO: anticoagulación oral; CVE: cardioversión eléctrica; CVF: cardioversión farmacológica; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; FibA: fibrilación auricular; HTA: hipertensión arterial.
Se presentan los datos de 89 pacientes que han completado el seguimiento de entre los 95 que lo habían iniciado.
Los datos cuantitativos se expresan en media±desviación estándar o mediana [p25-p75].
El procedimiento se realizó en ritmo sinusal en 28 pacientes (29,5%) y en AA en 67 (70,5%). El éxito agudo del procedimiento fue del 100%; se alcanzó bloqueo bidireccional en la conducción del ICT en todos los pacientes. No hubo ninguna muerte intrahospitalaria. Fallecieron 6 pacientes a lo largo del seguimiento y las causas fueron: cáncer de pulmón, estenosis aórtica grave, insuficiencia respiratoria por enfermedad pulmonar obstructiva crónica grave, infección respiratoria y muerte súbita extrahospitalaria en 2 casos (1 de ellos por tromboembolia pulmonar).
Se observaron 13 recurrencias de AA típico (14,6%) al cabo de 12 meses de seguimiento. En 12 de ellas se realizó reablación del ICT y en un caso, cardioversión eléctrica; 24 pacientes (25%) presentaron episodios de FibA durante el seguimiento. A los 12 meses, 82 pacientes (92%) estaban en ritmo sinusal y 7 (8%) en FibA.
Características ecocardiográficasLas características ecocardiográficas basales de los pacientes se muestran en la Tabla 2. Destaca un aumento en las áreas de la AD y la AI, con una cfAD deprimida (0,29). La FEVI media fue del 55% y los diámetros del VI se hallaban dentro de la normalidad. El 28% de los pacientes tenían dilatación del VD. La mayoría de los pacientes (80%) tenían disfunción diastólica basal con predominio de la forma restrictiva (58%). El 58% de los pacientes tenían IT, la mayoría de ellas de leve repercusión (el 72% de grado I). El 20% de los pacientes tenían hipertensión pulmonar (HTP) basalmente y el 67% presentaba IM, la mayoría también de leve repercusión (el 73% de grado I).
Tabla 2. Variables estructurales basales y al cabo de 1 año de seguimiento de la población
| Variables (n=89) | Basal | Seguimiento | p |
| Área AD diástole (cm2) | 23±5,6 | 19,2±4,9 | < 0,01 |
| Área AD sístole (cm2) | 16,9±4,9 | 12,6±4,1 | < 0,01 |
| cfAD | 0,29±0,11 | 0,45±0,1 | < 0,01 |
| Área AI (cm2) | 23,9±5,2 | 22±5,4 | 0,04 |
| dAI (cm) | 4,57±0,7 | 4,53±0,6 | 0,36 |
| FEVI (%) | 55,8±14,2 | 64,3±8,7 | < 0,01 |
| FC (lpm) | 70,6±13,9 | 62±11,6 | 0,07 |
| Función diastólica, n (%) | 0,33 | ||
| Normal | 16 (18) | 23 (25,8) | |
| Anormal | 71 (79,8) | 59 (66,3) | |
| No valorable | 2 (2,2) | 7 (7,9) | |
| Función diastólica anormal, n (%) | < 0,01 | ||
| Grado I | 15 (21,1) | 48 (81,4) | |
| Grado II | 13 (18,3) | 6 (10,2) | |
| Grado III | 43 (60,6) | 5 (8,4) | |
| Dilatación del VD, n (%) | 25 (28) | 14 (16) | < 0,01 |
| E (m/s) | 0,90±0,29 | 0,80±0,23 | 0,01 |
| A (m/s) | 0,52±0,28 | 0,81±0,29 | < 0,01 |
| E/A | 2,42±1,96 | 1,1±0,51 | < 0,01 |
| Tdec E (ms) | 176±44 | 207±49,9 | < 0,01 |
| TRIV (ms) | 90,4±21,9 | 88±22 | 0,55 |
| TIV (cm) | 1,10±0,22 | 1,02±0,21 | 0,02 |
| DTD (cm) | 5,43±0,65 | 5,18±0,57 | 0,01 |
| DTS (cm) | 3,79±0,85 | 3,33±0,52 | < 0,01 |
| PP (cm) | 1,01±0,25 | 0,98±0,18 | 0,17 |
| Insuficiencia tricuspídea, n (%) | 52 (58) | 52 (58) | 1 |
| Insuficiencia tricuspídea, n (%) | 0,02 | ||
| Grado I | 37 (71) | 42 (81) | |
| Grado II | 9 (17) | 10 (19) | |
| Grado III | 4 (8) | 0 | |
| Grado IV | 2 (4) | 0 | |
| HTP, n (%) | 18 (20) | 9 (10) | 0,03 |
| Estenosis mitral, n (%) | 2 (2) | 2 (2) | 1 |
| Insuficiencia mitral, n (%) | 60 (67) | 46 (52) | 0,02 |
| Insuficiencia mitral, n (%) | 0,03 | ||
| Grado I | 44 (73) | 39 (85) | |
| Grado II | 13 (22) | 6(13) | |
| Grado III | 3 (5) | 1 (2) | |
| Estenosis aórtica, n (%) | 2 (2) | 2 (2) | 1 |
| Insuficiencia aórtica, n (%) | 12 (13) | 18 (20) | 0,73 |
| Insuficiencia aórtica, n (%) | 0,91 | ||
| Grado I | 10 (86) | 14 (80) | |
| Grado III | 2 (14) | 4 (20) | |
| Derrame pericárdico, n (%) | 0,76 | ||
| Ligero | 3 (3) | 2 (2) |
A: velocidad máxima de onda A; AD: aurícula derecha; AI: aurícula izquierda; cf: fracción de contracción; dAI: dimensión de la aurícula izquierda; DTD: diámetro telediastólico del ventrículo izquierdo; DTS: diámetro telesistólico del ventrículo izquierdo; E/A: cociente entre E y A; E: velocidad máxima de onda E; FC: frecuencia cardiaca; FEVI: fracción de eyección del ventrículo izquierdo; HTP: hipertensión pulmonar; PP: pared posterior de ventrículo izquierdo; Tdec E: tiempo de deceleración de la onda E; TIV: tabique interventricular; TRIV: tiempo de relajación isovolumétrica; VD: ventrículo derecho.
Los datos cuantitativos se expresan en media±desviación estándar.
Las características ecocardiográficas de los pacientes en el seguimiento al cabo de 1 año se indican en la Tabla 2. Se objetivaron diferencias estadísticamente significativas en la reducción de las áreas de la AD y la AI, del DTD, DTS y SIV. Hubo una mejoría significativa en el cfAD y la FEVI. La mayoría de los pacientes (66%) seguían presentando disfunción diastólica durante el seguimiento; la alteración en la relajación (grado I) fue la forma predominante de disfunción (82%). El 58% de los pacientes tenían IT, la mayoría de ellas (81%) de leve repercusión; el 52% de los pacientes presentaban IM, la mayoría de ellas también de leve repercusión (el 85% de grado I).
Se observó un remodelado inverso también en VD con reducción significativa de los pacientes con dilatación del VD desde 25 (28%) basal hasta 14 (16%) en el seguimiento (p=0,008). Se detectó una reducción en el número de pacientes con HTP, de 18 (20%) basal a 9 (10%) en el seguimiento (p=0,03) (Tabla 2).
Los cambios en la función diastólica consistieron en una disminución significativa en la velocidad máxima de la onda E, un aumento significativo en la velocidad máxima de la onda A, una reducción significativa del cociente E/A y un aumento significativo del Tdec E (Tabla 2).
El 80% de los pacientes tenían alterada la función diastólica basal. Hubo una reducción del número de pacientes con disfunción diastólica en el seguimiento (66%), sin que esta diferencia fuese significativa (p=0,33). El patrón de disfunción diastólica basal más frecuente fue el grado III (60%) y en el seguimiento, el grado I (81%). Se observó una mejoría estadísticamente significativa en la reducción del grado de disfunción diastólica (p<0,001).
No se observaron diferencias en la presencia de IT en el seguimiento respecto al basal. Sin embargo, se objetivó una reducción significativa en el grado de IT en el seguimiento respecto al basal (p=0,02) (Tabla 2).
Se observó una reducción significativa de la presencia de IM en el seguimiento (52%) respecto al basal (67%) (p=0,02). También fue significativa la reducción en el grado de IM en el seguimiento respecto al basal (p=0,03) (Tabla 2).
Los pacientes con la forma persistente de AA presentaban basalmente áreas de AD más grandes que los del tipo paroxístico, aunque esta diferencia no alcanzó significación estadística (p=0,06). La velocidad máxima de la onda E fue más alta; la velocidad máxima de la onda A, más baja y el Tdec E, menor en la forma persistente que en la paroxística (Tabla 3). No hubo diferencias significativas en el seguimiento entre ambos tipos de AA en ninguna de las variables estructurales. Asimismo, desaparecieron las diferencias basales observadas en las variables de función diastólica (Tabla 3).
Tabla 3. Diferencias en las variables estructurales y funcionales entre las formas paroxística y persistente de aleteo auricular
| Variables (n=89) | Basal | Seguimiento | ||||
| Paroxístico (n=50) | Persistente (n=39) | p | Paroxístico (n=50) | Persistente (n=39) | p | |
| Área de la AD en diástole (cm2) | 21,7±5,9 | 24,6±4,8 | 0,06 | 18,3±5,4 a | 19,4±7 | 0,15 |
| Área de la AD en sístole (cm2) | 16,7±5,9 | 17,2±3,4 | 0,68 | 12,3±5,3 a | 13,6±4 | 0,24 |
| cfAD | 0,30±0,11 | 0,27±0,13 | 0,45 | 0,47±0,16 a | 0,47±0,16 | 0,63 |
| Área de la AI (cm2) | 23,5±4,9 | 24±5,7 | 0,77 | 22,8±7,4 b | 22,6±6,9 | 0,83 |
| dAI (cm) | 4,50±0,6 | 4,6±0,8 | 0,69 | 4,46±0,6 b | 4,48±0,6 | 0,87 |
| FEVI (%) | 55,3±12,1 | 56,3±16,6 | 0,82 | 64,9±14,2 a | 64,1±15,7 | 0,81 |
| FC (lpm) | 69,8±15,3 | 73,3±15,5 | 0,42 | 67,2±13,3 b | 68,6±13,2 | 0,62 |
| Dilatación del VD, n (%) | 11 (22) | 14 (35,8) | 0,69 | 6 (12) c | 8 (20,5) | 0,23 |
| HTP, n (%) | 9 (18) | 9 (23,1) | 0,71 | 6 (12) b | 3 (7,7) | 0,69 |
| E (m/s) | 0,75±0,20 | 1,07±0,29 | < 0,01 d | 0,79±0,17 | 0,8±0,19 | 0,78 |
| A (m/s) | 0,62±0,29 | 0,39±0,20 | < 0,01 d | 0,81±0,26 a | 0,85±0,32 | 0,62 |
| E/A | 1,49±0,75 | 3,58±2,36 | < 0,01 d | 1,09±0,8 c | 0,98±2,4 | 0,90 |
| Tdec E (ms) | 193±44 | 154±36 | < 0,01 d | 220±57 c | 204±52 | 0,97 |
| TRIV (ms) | 89±22 | 91±21 | 0,75 | 89±28 b | 85±31 | 0,06 |
| TIV (cm) | 1,07±0,19 | 1,13±0,25 | 0,43 | 1±0,20 b | 1,03±0,28 | 0,22 |
| DTD (cm) | 5,49±0,55 | 5,35±0,74 | 0,14 | 5,30±0,38 c | 5,07±0,70 | 0,18 |
| DTS (cm) | 3,85±0,68 | 3,72±1,03 | 0,13 | 3,45±0,65 a | 3,26±0,90 | 0,44 |
| PP (cm) | 0,99±0,21 | 1,04±0,30 | 0,47 | 0,96±0,2 b | 0,97±0,3 | 0,81 |
| Ciclo ventricular (ms) | 641±260 | 686±192 | 0,87 | |||
| Ciclo AA antihorario (ms) | 260±48 | 244±31 | 0,67 | |||
| Ciclo AA horario (ms) | 250±23 | 245±35 | 0,72 | |||
A: velocidad máxima de onda A; AD: aurícula derecha; AI: aurícula izquierda; cf: fracción de contracción; dAI: dimensión de la aurícula izquierda; DTD: diámetro telediastólico del ventrículo izquierdo; DTS: diámetro telesistólico del ventrículo izquierdo; E/A: cociente entre E y A; E: velocidad máxima de onda E; FC: frecuencia cardiaca; FEVI: fracción de eyección del ventrículo izquierdo; AA: aleteo auricular; HTP: hipertensión pulmonar; PP: pared posterior del ventrículo izquierdo; Tdec E: tiempo de deceleración de la onda E; TIV: tabique interventricular; TRIV: tiempo de relajación isovolumétrica; VD: ventrículo derecho.
a p<0,001 para las diferencias entre el seguimiento y el basal en la forma paroxística.
b No significativo.
c p<0,05.
d p<0,05 para las diferencias entre las formas persistente y paroxística basalmente y al seguimiento.
Se observó taquicardiomiopatía fundamentalmente en pacientes con AA típico persistente y con cardiopatía estructural (Tabla 4). La cardiopatía estructural más frecuente entre los pacientes con taquicardiomiopatía fue la miocardiopatía dilatada (31%), mientras que entre los pacientes que no tuvieron taquicardiomiopatía fue la cardiopatía hipertensiva (43%). No se encontraron diferencias en relación con la duración del AA, el número de episodios o la presencia de FibA previa.
Tabla 4. Diferencias en variables sociodemográficas y relacionadas con el aleteo auricular según concurra taquicardiomiopatía o no
| Variable | Taquicardiomiopatía (n=16) | Sin taquicardiomiopatía (n=73) | p |
| Edad (años) | 63,4±11 | 64,5±10,5 | 0,70 |
| Sexo, n (%) | 0,47 | ||
| Varones | 14 (87,5) | 58 (79,4) | |
| Mujeres | 2 (12,5) | 15 (20,5) | |
| HTA, n (%) | 5 (31,3) | 39 (53,4) | 0,11 |
| Alcohol, n (%) | 3 (18,8) | 8 (10,9) | 0,42 |
| Obesidad, n (%) | 3 (18,8) | 20 (27,4) | 0,45 |
| Cardiopatía hipertensiva, n (%) | 3 (18,8) | 32 (43,8) | 0,07 |
| Cardiopatía isquémica, n (%) | 3 (18,8) | 10 (13,7) | 0,38 |
| Miocardiopatía dilatada, n (%) | 5 (31,2) | 9 (12,3) | 0,06 |
| Insuficiencia renal, n (%) | 3 (18,8) | 5 (6,8) | 0,10 |
| Diabetes, n (%) | 3 (18,8) | 15 (20,5) | 0,89 |
| Tipo de aleteo, n (%) | 0,03 * | ||
| Paroxístico | 5 (31,3) | 44 (60,3) | |
| Persistente | 11 (68,7) | 29 (39,7) | |
| Duración del aleteo (meses) | 48,7±104,7 | 36,9±54,1 | 0,54 |
| Episodios de aleteo, n | 2,50±3 | 3,95±3,8 | 0,15 |
| FibA previa, n (%) | 6 (37,5) | 32 (43,8) | 0,61 |
| Disfunción sinusal, n (%) | 1 (6,3) | 13 (17,8) | 0,25 |
| AA IC o amiodarona, n (%) | 3 (18,8) | 10 (13,7) | 0,62 |
| Ciclo ventricular (ms) | 645±227 | 655±224 | 0,87 |
| Ciclo ventricular+AA persistente (ms) | 623±202 | 691±188 | 0,32 |
| Sin cardiopatía, n (%) | 1 (6,3) | 19 (24,1) | 0,11 |
AA: aleteo auricular; AA IC o amiodarona: aleteo auricular relacionado con la administración de fármacos antiarrítmicos I o III; FibA: fibrilación auricular; HTA: hipertensión arterial.
Los datos cuantitativos se expresan en media±desviación estándar.
* p<0,05.
En este estudio realizado en pacientes con AA típico sometidos a ablación del ICT, el hallazgo más importante es la mejora de las características estructurales y funcionales cardiacas que se observa tanto en cavidades derechas como izquierdas al cabo de 1 año de seguimiento.
Cambios estructuralesLa mejoría de la FEVI (aumento en 9 puntos de media) es un hecho muy importante pues pone de manifiesto que la depresión de la función contráctil del VI en relación con taquiarritmias es más frecuente de lo esperado. Además, indica la presencia de un componente de «taquicardiomiopatía-like» en muchos pacientes que no tienen disfunción sistólica del VI, en los que la interrupción de la taquicardia permite mejorar la función contráctil, y en pacientes con disfunción sistólica del VI, que mejoran significativamente la función sistólica del VI aunque esta no llegue a alcanzar la normalidad. Los cambios estructurales también afectaron al VD con un remodelado inverso y una reducción significativa de HTP.
En nuestra serie, las variables estructurales basales del VI se encontraban dentro de la normalidad. Este hecho concuerda con que la mayor parte presentaba una cardiopatía hipertensiva leve o moderada. Tenían una FEVI<50% previa a la ablación un 24% de los pacientes, por lo que nuestra serie se encuentra en una posición intermedia respecto a otras publicadas (el 19% de Luchsinger et al16 y el 30% de Paydak et al17).
Esta gran mejoría en la FEVI pudo deberse a una mayor prevalencia de taquicardiomiopatía en nuestra serie (17,9%), frente a un 10% descrita en la literatura médica16. La prevalencia de taquicardiomiopatía fue mayor a pesar de que se excluyó a los pacientes en quienes se observó una recuperación parcial de la FEVI pero no se alcanzó la normalidad al cabo de 1 año de seguimiento. En la mayoría de los casos se desconocía la FEVI y la presencia o no de dilatación del VI, previas al inicio de la arritmia, datos importantes para el diagnóstico de taquicardiomiopatía, y la existencia o no de cardiopatía estructural previa concomitante18, lo cual constituye una limitación del estudio.
La mejoría de la FEVI fue similar en ambas formas de AA, a pesar de que 28 de los 50 pacientes con AA paroxístico (56%) estaban en ritmo sinusal en el momento del procedimiento. Esto puede explicarse por la presencia de múltiples episodios autolimitados en la forma paroxística. Se ha observado en un modelo animal alteraciones tanto en la actividad de los canales del calcio como en el transporte en el retículo sarcoplásmico de calcio, tan precozmente como a las 24 h de estimulación auricular rápida y una persistencia de estas alteraciones hasta 4 semanas desde el cese de la estimulación. Las alteraciones del calcio se correlacionan con el grado de disfunción del VI. Este hecho puede explicar también por qué un 31% de los pacientes con taquicardiomiopatía presentaban la forma paroxística de AA19.
No obstante, en nuestra serie, la forma persistente de AA se asoció estadísticamente al desarrollo de taquicardiomiopatía independientemente del ciclo ventricular. Probablemente el desarrollo de taquicardiomiopatía es multifactorial dependiendo del tipo, la frecuencia y la duración de la arritmia, pero también de la edad, la cardiopatía subyacente, los fármacos y las enfermedades concomitantes20.
No se sabe con certeza el tiempo de evolución desde la aparición de la taquiarritmia hasta que se desencadena la disfunción sistólica ventricular izquierda, pero puede variar entre semanas y años20. El tiempo de recuperación de la función del VI tras la normalización del rimo cardiaco es, en general, corto (alrededor de 2 semanas). Pasados 6-8 meses, la recuperación se detiene y el paciente queda con esa FEVI crónicamente20, 21. Se ha señalado estrecha relación entre el tiempo de duración de la arritmia, el daño miocárdico y el tiempo de recuperación de la FEVI, probablemente por una mayor fibrosis cardiaca cuanto mayor sea el tiempo de evolución de la arritmia22. La comparación al cabo de 1 año de seguimiento permite un tiempo razonable para la recuperación de la FEVI tras la supresión de la arritmia.
Cambios en la función diastólicaSe ha observado también un «remodelado inverso» en la función diastólica, consistente en la reducción en el grado de disfunción, que pasa de grado III (restrictivo) predominante en el basal a grado I (alteración en la relajación) en el seguimiento. Este cambio se debe a la presencia de taquicardiomiopatía auricular que lleva al fenómeno del «aturdimiento» auricular tras la ablación del AA con radiofrecuencia. Este hallazgo concuerda con otros trabajos publicados, en los que se objetiva la reversibilidad del aturdimiento tan precozmente como al cabo de 3 semanas de la ablación23, 24. En nuestra serie, la velocidad de onda A basal (0,52 cm/s) fue superior a la publicada en otras series (que describen hasta un 28% de pacientes con ausencia de onda A)25 probablemente por la inclusión de una mayor proporción de pacientes con AA paroxístico (56%) y porque en más de la mitad de ellos se ablacionó en ritmo sinusal. Las diferencias significativas entre las formas paroxística y persistente en las variables de función diastólica basal reflejan un mayor aturdimiento auricular en la forma persistente. Sin embargo, existe también un componente de aturdimiento auricular en la forma paroxística con mejoría significativa de cfAD, de la velocidad de onda A y del Tdec E no descrita en la literatura médica, pues las series se han centrado en el grupo de AA persistente y los pacientes con la forma paroxística han estado escasamente representados.
Diferencias entre los tipos de aleteo auricularNo se encontraron diferencias estructurales basales entre los pacientes con AA paroxístico y aquellos con AA persistente. Sólo se observaron diferencias en la función diastólica basal con un patrón predominante grado III en la forma persistente frente a un patrón predominante grado II en la paroxística. Estas diferencias desaparecieron al cabo de 1 año de seguimiento. Estos resultados discrepan de algunos datos publicados. Así, Da Costa et al26 hallaron diferencias en las características estructurales de cavidades derechas e izquierdas medidos por ecocardiografía entre el AA paroxístico y el persistente. En la forma persistente, el área de la AD, el ICT y los volúmenes del VI fueron mayores y la FEVI más baja que en la paroxística. No se encontraron diferencias en la incidencia de cardiopatía estructural entre ambos. En otro estudio, Cabrera et al27, utilizando la angiografía de contraste como método de medición, observaron que en pacientes con forma persistente el ICT era más largo y la cfAD más baja que en la paroxística. Sin embargo, el diámetro de la AD era semejante en ambas formas de AA. En nuestra cohorte, no se observaron diferencias significativas en las características estructurales de cavidades derechas entre ambas formas de AA, lo que indica que es un mecanismo diferente del remodelado auricular lo que determina una u otra forma de AA. Probablemente, el papel de la cresta terminal sea determinante no sólo en el inicio, sino en la persistencia del AA28, 29. Estos datos se ven refrendados por las observaciones anatómicas de Ohkubo et al30, que ponen de manifiesto diferencias en la cresta terminal entre la forma persistente (cresta terminal gruesa y continua con bloqueo de la conducción transversal en todos los pacientes) y la forma paroxística (cresta terminal fina y discontinua sin bloqueo transversal en la totalidad de pacientes).
También se han descrito diferencias en el remodelado eléctrico en los pacientes con AA respecto a controles31 y entre las formas paroxística y persistente28, consistentes sobre todo en que el tiempo de recuperación del periodo refractario auricular basal tras el cese de la arritmia es mayor en la forma persistente que en la paroxística. No se han detectado diferencias entre ambas formas en la longitud de ciclo del AA ni tampoco en el periodo refractario auricular medido inmediatamente tras el cese del AA32. Por lo tanto, lo realmente distinto parece ser el tiempo de recuperación del remodelado eléctrico, que es menor en la forma paroxística que en la persistente; se especula que esto pueda deberse a mecanismos diferentes. Este trabajo tiene gran concordancia con los datos de nuestra cohorte, que presenta una longitud de ciclo de AA semejante entre las formas paroxística y persistente, tanto en antihorario como horario (Tabla 3). Las características estructurales basales y al seguimiento fueron similares entre ambas formas de AA, como también lo fue el ciclo del AA. Esto apunta a diferencias anatómicas y electrofisiológicas, y no al remodelado estructural, como elementos determinantes en la forma de presentación del AA.
LimitacionesEl carácter observacional del estudio, sin asignación aleatoria de los pacientes al grupo de tratamiento o placebo, impide establecer una relación causal en nuestra observación. El ecocardiograma en el seguimiento se hizo de manera ciega respecto al ecocardiograma basal, si bien el operador conocía el propósito del estudio, lo que pudo influir en la interpretación de los resultados.
ConclusionesLa ablación con catéter del ICT en el AA típico produjo al cabo de 1 año de seguimiento un remodelado cardiaco inverso estructural, tanto en aurícula como en ventrículo, y funcional con mejoría de la FEVI y del patrón de disfunción diastólica. No se detectaron diferencias estructurales significativas, pero sí en el patrón de disfunción diastólica, entre las formas paroxística y persistente del AA.
Conflicto de interesesNinguno.
Recibido 15 Febrero 2012
Aceptado 30 Marzo 2012
Autor para correspondencia: Servicio de Cardiología, Hospital Clínico de Santiago, Travesía Choupana s/n, 15706 Santiago de Compostela, A Coruña, España. Javier.Garcia.Seara@sergas.es