La cuantificación del área miocárdica en riesgo tras el infarto agudo de miocardio tiene repercusiones clínicas importantes y puede determinarse mediante resonancia magnética cardiovascular. Las puntuaciones angiográficas Bypass Angioplasty Revascularization Investigation Myocardial Jeopardy Index (BARI) y Alberta Provincial Project for Outcome Assessment in Coronary Heart Disease (APPROACH) se han utilizado ampliamente para la estimación rápida del área miocárdica en riesgo, pero no han sido validadas de manera directa. Nuestro objetivo es comparar el área miocárdica en riesgo estimada mediante las puntuaciones angiográficas BARI y APPROACH con la determinada mediante resonancia magnética cardiovascular.
MétodosEn un estudio prospectivo, en la primera semana siguiente a la intervención coronaria percutánea, se realizaron exploraciones de resonancia magnética cardiovascular a 70 pacientes con un primer infarto agudo de miocardio con elevación del segmento ST reperfundido con éxito. El área miocárdica en riesgo se determinó mediante el análisis de secuencias T2-short tau inversion recovery y el cálculo del área endocárdica con infarto utilizando secuencias de contraste tardío. Estos resultados se compararon con los de las puntuaciones BARI y APPROACH.
ResultadosLas puntuaciones BARI y APPROACH mostraron una correlación estadísticamente significativa con el T2-short tau inversion recovery para la estimación del área miocárdica en riesgo (BARI, coeficiente de correlación intraclase=0,72; p<0,001; APPROACH, coeficiente de correlación intraclase=0,69; p<0,001). Se observaron correlaciones mejores para el infarto agudo de miocardio de cara anterior que para otras localizaciones (BARI, coeficiente de correlación intraclase, 0,73 frente a 0,63; APPROACH, coeficiente de correlación intraclase, 0,68 frente a 0,50). El área de superficie endocárdica con infarto mostró buena correlación con ambas puntuaciones angiográficas (con BARI, coeficiente de correlación intraclase=0,72; p<0,001; con APPROACH, coeficiente de correlación intraclase=0,70; p<0,001).
ConclusionesLas puntuaciones angiográficas BARI y APPROACH permiten obtener una estimación fiable del área miocárdica en riesgo en la práctica clínica actual, sobre todo en los infartos de cara anterior.
Palabras clave
El área miocárdica en riesgo (AER) se define como el área de hipoperfusión miocárdica durante la oclusión coronaria aguda en ausencia de circulación colateral1, 2, 3. Este parámetro permite calcular la extensión del miocardio rescatado, si se le resta el miocardio necrótico. Ambos parámetros son de gran utilidad, no sólo respecto a la valoración de la efectividad de las terapias de reperfusión, sino también como factores pronósticos en los pacientes con un infarto agudo de miocardio (IAM). Además, pueden desempeñar un papel importante en la toma de decisiones sobre la revascularización miocárdica, puesto que permiten diferenciar el miocardio necrótico del viable4, 5.
Las secuencias T2-short tau inversion recovery (STIR) de la resonancia magnética cardiovascular (RMC) se han validado en animales mediante técnicas de inyección de microesferas, que son el método de referencia para estimar el AER en estudios experimentales6, y se utilizan ampliamente en la práctica clínica habitual para estimar el AER en pacientes con IAM. En los casos de imagen de mala calidad en las secuencias T2-STIR7, 8, 9, el área de superficie endocárdica con infarto (ASE-infarto), obtenida mediante secuencias con contraste tardío10, 11, es un método alternativo.
Se han propuesto las puntuaciones angiográficas Bypass Angioplasty Revascularization Investigation Myocardial Jeopardy Index (BARI) y Alberta Provincial Project for Outcome Assessment in Coronary Heart Disease (APPROACH) como métodos alternativos para la estimación temprana del AER durante la angiografía coronaria, y tienen especial interés cuando no se dispone de RMC10, 12, 13, 14. Además, no se sabe si la localización del IAM influye en la exactitud de las determinaciones del AER calculadas mediante las puntuaciones angiográficas11.
El objetivo de este estudio es validar la estimación del AER obtenida con las puntuaciones angiográficas BARI y APPROACH para establecer su reproducibilidad y su exactitud mediante la comparación con la medida aportada por el T2-STIR, considerado el método de referencia, y con el ASE-infarto.
MétodosPacientesEntre octubre de 2008 y junio de 2010, en un ensayo unicéntrico se estudió prospectivamente a 75 pacientes consecutivos con IAM con elevación del segmento ST reperfundidos con éxito mediante intervención coronaria percutánea (ICP) primaria y examinados mediante RMC durante la primera semana siguiente a la reperfusión. Los criterios para realizar la ICP primaria fueron dolor torácico de duración > 30 min, elevación del segmento ST en el electrocardiograma ≥ 0,1 mV en dos o más derivaciones adyacentes y realización de la ICP en las primeras 24 h siguientes al inicio de los síntomas. No se consideró aptos para la inclusión en el estudio a los pacientes con inestabilidad hemodinámica, edema pulmonar agudo o shock cardiogénico inmediatamente antes de la RMC, antecedentes de IAM previo o cualquier otra contraindicación para la prueba. Se excluyó a 5 pacientes (7%) porque no fue posible realizar la RMC debido a claustrofobia; no hubo ninguna exclusión por otra causa. Se evaluaron los datos de los 70 pacientes restantes. Se identificó la arteria causante del IAM a partir de las observaciones angiográficas y de la información clínica (datos electrocardiográficos). Se obtuvo el consentimiento informado de todos los pacientes y el comité ético local aprobó el estudio.
Resonancia magnética cardiovascularTodas las exploraciones de RMC se realizaron con un equipo de 1,5 T (Siemens Avanto). Las imágenes se obtuvieron de forma sincronizada con el electrocardiograma y en apnea. Se obtuvieron imágenes de cine de eje corto para cuantificar los volúmenes y la fracción de eyección (secuencias SSFP; grosor de corte, 8 mm; espacio entre cortes, 20%; matriz, 256×256; campo de visión, 300-370 mm; resolución temporal<50 ms). Para evaluar el edema, se utilizaron secuencias STIR en la misma proyección que las secuencias de cine, todas ellas en mesodiástole (grosor de corte, 8 mm; espacio entre cortes, 20%; matriz, 256×256; campo de visión, 300-370 mm; resolución temporal<50 ms; tiempo de repetición, dos intervalos R-R; tiempo de eco, 100 ms; tiempo de inversión, 170 ms; ángulo de giro, 160°; ancho de banda, 781 Hz/píxel). Por último, se utilizaron secuencias con contraste tardío para cuantificar el tamaño del IAM, que se obtuvieron 15 min después de la administración intravenosa de 0,2 mmol/kg de gadopentetato de dimeglumina (Magnevist®) (grosor de corte, 8 mm; espacio entre cortes, 20%; matriz, 256×256; campo de visión, 300-370 mm; tiempo de inversión óptimo para la supresión de la señal miocárdica).
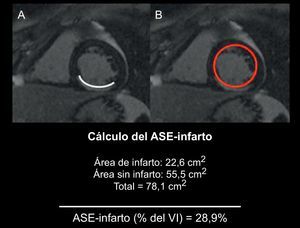
Análisis de las imágenesTodos los estudios se analizaron en una estación de trabajo (QMASS MR 7.1, Medis Medical Imaging Systems, Países Bajos) por dos cardiólogos especializados en diagnóstico por la imagen que no conocían los datos clínicos ni los resultados angiográficos. Se delimitaron los bordes endocárdico y epicárdico en la fase telesistólica y telediastólica, con proyecciones de eje corto, para cuantificar los volúmenes, las funciones y la masa del ventrículo izquierdo (VI). El AER se cuantificó en secuencias T2-STIR que delimitaban las áreas de intensidad, más 2 desviaciones estándar por encima de la media, obtenida en miocardio sano de una posición distante, y se aplicó una normalización según la masa del VI. Se obtuvo la intensidad de señal en el área edematosa, en el miocardio sano contralateral al edema (miocardio distante) y en el área de ruido de fondo para el cálculo de la relación señal-ruido y contraste-ruido5. Las áreas hipointensas situadas dentro de regiones hiperintensas se interpretaron como áreas de hemorragia intramiocárdica15, 16 y, por lo tanto, se incluyeron en el territorio de AER. La cuantificación del miocardio infartado se evaluó delimitando las áreas con captación de contraste en las secuencias con contraste tardío con 5 desviaciones estándar por encima de la media, obtenida en miocardio sano distante y normalizada según la masa del VI. Las áreas con hipocaptación de contraste, que indicaban una obstrucción microvascular, se incluyeron en el volumen del infarto. En caso de mala calidad de las secuencias de T2-STIR, la cuantificación del AER se realizó con la ayuda de las imágenes con contraste tardío, para mejorar la reproducibilidad del método. En estos casos, se exigió un consenso entre los dos cardiólogos especializados en diagnóstico cardiaco por imagen. Se calculó el ASE-infarto de la siguiente forma: (suma de longitud de infarto con hipercaptación de contraste endocárdico / longitud endocárdica del VI total)×10010 (Figura 1). El miocardio rescatado se calculó mediante la diferencia del AER, obtenida con un análisis cuantitativo de las secuencias T2-STIR, menos el tamaño de la necrosis, obtenido a través de las secuencias de captación de contraste tardía.
Figura 1. Cálculo de la puntuación del área de superficie encocárdica con infarto, en la que este (A) se divide por la superficie endocárdica total (B) 10 . ASE-infarto: área de superficie endocárdica con infarto; VI: ventrículo izquierdo.
Angiografía coronariaA todos los pacientes se les realizó una angiografía coronaria según el protocolo establecido por el laboratorio de cateterismo. En todos los casos se implantó al menos un stent, según las características de la lesión. Se evaluó el flujo colateral antes de realizar la ICP y según la clasificación de Rentrop, en la que 0 corresponde a total ausencia de circulación colateral y 3, a un llenado retrógrado completo del territorio isquémico hasta la oclusión17. El flujo anterógrado en la arteria relacionada con el infarto antes de la ICP se describió con el sistema TIMI (Thrombolysis In Myocardial Infarction)18. El AER se estableció usando las puntuaciones BARI y APPROACH modificada.
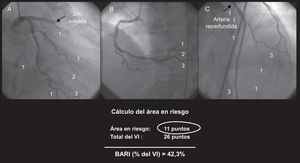
Puntuación Bypass Angioplasty Revascularization Investigation Myocardial Jeopardy IndexEste sistema asigna una puntuación a todas las arterias terminales (parte terminal de la descendente anterior izquierda, la circunfleja izquierda y la arteria coronaria derecha, así como el ramus, las diagonales, las marginales obtusas y las ramas descendente posterior y posterolaterales) en función de su longitud y su calibre, según unos criterios específicos12. Un valor de 0 corresponde a un tamaño del vaso casi insignificante, mientras que un valor de 3 define una arteria de gran tamaño, con una longitud de dos tercios de la distancia entre la base y el vértice cardiaco. No se tiene en cuenta las marginales ventriculares derechas y las ramas septales de la arteria descendente posterior12. La puntuación final se obtiene dividiendo el valor resultante de la arteria relacionada con el infarto por la puntuación total de todas las arterias que irrigan el VI, lo cual permite finalmente la estimación del porcentaje de músculo miocárdico en riesgo (Figura 2). Las arterias estenosadas de áreas no infartadas no se suman al AER.
Figura 2. Cálculo del área en riesgo según la puntuación Bypass Angioplasty Revascularization Investigation Myocardial Jeopardy Index: el valor de la arteria causal se determina mediante su longitud y sus ramas, y se divide por la puntuación total obtenida de todas las arterias 12 . BARI: Bypass Angioplasty Revascularization Investigation Myocardial Jeopardy Index; DAI: arteria descendente anterior izquierda; VI: ventrículo izquierdo.
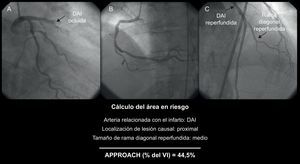
Puntuación Alberta Provincial Project for Outcome Assessment in Coronary Heart Disease modificadaEsta puntuación se basa en la división del VI en varias regiones, en función de los estudios anatomopatológicos realizados en el ser humano, y evalúa la proporción relativa del miocardio perfundida por cada arteria3, 19, 20. La puntuación APPROACH modificada10 proporciona el valor del AER teniendo en cuenta la localización de la lesión causal y el predominio y el tamaño de las ramas secundarias (Figura 3). Al igual que ocurre con la puntuación BARI, las arterias estenosadas en áreas no infartadas no se suman al AER.
Figura 3. Cálculo del área en riesgo según la puntuación Alberta Provincial Project for Outcome Assessment in Coronary Heart Disease modificada: se basa en la arteria causal, la localización de la lesión y el tamaño de algunas de las ramas principales 10 . APPROACH: Alberta Provincial Project for Outcome Assessment in Coronary Heart Disease; DAI: arteria descendente anterior izquierda; VI: ventrículo izquierdo.
Variabilidad interobservadoresCada método de cálculo del AER se valoró sin que el evaluador conociera los resultados obtenidos con las demás técnicas. Evaluaron separadamente todas las exploraciones, tanto angiográficas como de RMC, dos cardiólogos especializados en diagnóstico cardiaco por imagen y dos cardiólogos intervencionistas que no conocían los resultados previos, para obtener la variabilidad interobservadores de cada método de estimación del AER.
Análisis estadísticoLas variables continuas se expresaron en forma de media±desviación estándar y las variables categóricas, en forma de porcentajes. Se utilizó la prueba de Kolmogorov-Smirnov para evaluar la distribución normal de las variables. La variabilidad interobservadores y la correlación entre métodos se calcularon con el coeficiente de correlación intraclase (CCI), que describe el grado de semejanza entre sí de las unidades en el mismo grupo. Finalmente, se utilizó la prueba de la t de Student en los casos de distribución normal y la prueba de la U de Mann-Whitney en caso contrario para calcular la diferencia entre los grupos para los parámetros continuos. Se consideraron estadísticamente significativos los valores de p<0,05. La representación gráfica de los datos utilizada para analizar la coincidencia existente entre los diferentes métodos se realizó con un análisis de Bland-Altman. Se utilizó el programa SPSS versión 13.0 (Chicago, Illinois, Estados Unidos) para el análisis estadístico.
ResultadosLas características clínicas, de RMC y angiográficas de la población se muestran en la Tabla 1. La arteria descendente anterior fue el origen del IAM en 30 pacientes (43%). La media de tiempo transcurrido desde el inicio de los síntomas hasta la obtención de un flujo de grado TIMI 3 durante la ICP fue de 227±69 (intervalo, 97-380) min. Aunque el 44,30% de los pacientes mostraron una enfermedad coronaria multivaso, ninguna de las lesiones no causales del cuadro clínico mostró una oclusión total crónica.
Tabla 1. Características clínicas, de resonancia magnética cardiovascular y angiográficas de los participantes en el estudio (n=70)
| Varones | 62 (88,6) |
| Edad (años) | 57,7±13,9 |
| Hipertensión | 35 (50) |
| Fumadores | 50 (71,4) |
| Dislipemia | 22 (31,4) |
| Diabetes | 10 (14,3) |
| Antecedentes familiares de cardiopatía isquémica | 9 (12,9) |
| VTDVI (ml) | 161,5±37,5 |
| VTSVI (ml) | 84,7±31,7 |
| FEVI | 49±10,5 |
| Masa ventricular izquierda (g) | 127±28,1 |
| Tamaño del infarto (g) | 31,7±21,7 |
| Rentrop ≤ 1 | 60 (85,7) |
| Flujo TIMI antes de ICP | |
| 0 | 65 (92,9) |
| 1 | 3 (4,3) |
| 2 | 2 (2,9) |
| Número de vasos afectados | |
| 1 vaso | 39 (55,7) |
| 2 vasos | 21 (30) |
| 3 vasos | 10 (14,3) |
| Arteria causante del IAM | |
| Arteria descendente anterior izquierda | 30 (43) |
| Circunfleja izquierda | 11 (16) |
| Arteria coronaria derecha | 29 (41) |
FEVI: fracción de eyección del ventrículo izquierdo; IAM: infarto agudo de miocardio; ICP: intervención coronaria percutánea; TIMI: Thrombolysis in Myocardial Infarction; VTDVI: volumen telediastólico ventricular izquierdo; VTSVI: volumen telesistólico ventricular izquierdo.
Los datos expresan n (%) o media±desviación estándar.
La RMC se llevó a cabo al cabo de 4,3±1,5 (2-7) días tras la ICP. En todos los casos, se detectó un aumento de la intensidad de señal en T2-STIR, así como en las secuencias con contraste tardío. La relación señal-ruido del miocardio edematoso respecto al miocardio sano fue de 11,3±3,2 frente a 5,6±2,7, respectivamente (p<0,001). La relación contraste-ruido del miocardio edematoso frente al miocardio sano fue de 5,7±2,1. Sin embargo, en 4 casos (5,7%) las imágenes de T2-STIR eran de mala calidad y fue preciso recurrir al consenso de los dos cardiólogos especializados en diagnóstico cardiaco por imagen.
Comparación del área infartada con las diferentes puntuaciones de estimación del área miocárdica en riesgoEl AER calculada mediante el análisis de T2-STIR osciló entre el 14 y el 79,7% de la masa total del VI (media, 36,9±14,3%). El AER medida con las secuencias T2-STIR fue significativamente mayor que el cálculo del tamaño de la necrosis, que osciló entre el 1,1 y el 69,7% de la masa total del VI (media, 24,2±13,5%) (Tabla 2). La variabilidad interobservadores para el cálculo del tamaño del infarto fue baja (Tabla 3). La masa de miocardio rescatado, definida como la diferencia entre el AER obtenida mediante las secuencias T2-STIR y la masa necrótica determinada con secuencias de contraste tardío, fue de 16±11,5 (1,1-56) g y el índice de miocardio rescatado, el 12,8±8,6%.
Tabla 2. Valor medio de cada uno de los métodos de cuantificación del área miocárdica en riesgo y comparación con el tamaño del infarto
| Parámetros | Media±DE | p * |
| Tamaño del infarto | 24,2±13,5% | — |
| T2-STIR | 36,9±14,3% | < 0,001 |
| BARI | 32,8±10,8% | < 0,001 |
| APPROACH | 30,8±11,3% | < 0,001 |
| ASE-infarto | 32,0±14,5% | < 0,001 |
APPROACH: Alberta Provincial Project for Outcome Assessment in Coronary Heart Disease; ASE-infarto: área de superficie endocárdica con infarto; BARI: Bypass Angioplasty Revascularization Investigation Myocardial Jeopardy Index; DE: desviación estándar; T2-STIR, secuencia T2 en short tau inversion recovery.
* Tamaño del infarto frente al área de miocardio en riesgo evaluada con cada método.
Tabla 3. Variabilidad interobservadores de cada método de cuantificación del área miocárdica en riesgo y tamaño del infarto evaluada con el coeficiente de correlación intraclase
| Parámetros | CCI (IC95%) |
| Tamaño del infarto | 0,89 (0,82-0,93) |
| T2-STIR | 0,81 (0,70-0,89) |
| BARI | 0,91 (0,82-0,96) |
| APPROACH | 0,92 (0,83-0,97) |
| ASE-infarto | 0,86 (0,78-0,90) |
APPROACH: Alberta Provincial Project for Outcome Assessment in Coronary Heart Disease; ASE-infarto: área de superficie endocárdica con infarto; BARI: Bypass Angioplasty Revascularization Investigation Myocardial Jeopardy Index; CCI: coeficiente de correlación intraclase; IC95%: intervalo de confianza del 95%; T2-STIR: secuencia T2 en short tau inversion recovery.
Hubo una correlación excelente entre las puntuaciones BARI y APPROACH (Tabla 4) y ambas mostraron una variabilidad interobservadores muy baja (CCI=0,91 y CCI=0,92 respectivamente) (Tabla 3).
Tabla 4. Coeficientes de correlación intraclase entre los métodos angiográficos y los de resonancia magnética cardiovascular para evaluar el área miocárdica en riesgo
| Parámetros | T2-STIR | APPROACH | BARI |
| ASE-infarto | 0,87 * (0,51-0,94) | 0,72 * (0,58-0,81) | 0,70 * (0,56-0,80) |
| BARI | 0,72 * (0,52-0,83) | 0,91 * (0,83-0,97) | |
| APPROACH | 0,69 * (0,35-0,84) |
APPROACH: Alberta Provincial Project for Outcome Assessment in Coronary Heart Disease; ASE-infarto: área de superficie endocárdica con infarto; BARI: Bypass Angioplasty Revascularization Investigation Myocardial Jeopardy Index; T2-STIR: secuencia T2 en short tau inversion recovery.
Los datos expresan coeficiente de correlación intraclase (intervalo de confianza).
* p<0,001.
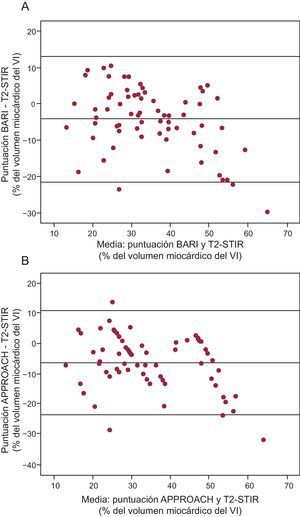
Tanto la puntuación BARI como la APPROACH mostraron buena correlación cuando se obtuvo el AER mediante el análisis de T2-STIR (Tabla 4 y Figura 4). De todos modos, las correlaciones dependían de la localización del infarto. En los infartos de cara anterior, se obtuvo CCI=0,73 (0,13-0,89; p<0,001) para BARI y CCI=0,68 (0,10-0,87; p<0,001) para APPROACH, mientras que en otros territorios fueron CCI=0,63 (0,32-0,81; p=0,001) y CCI=0,50 (0,09-0,75; p=0,004) respectivamente.
Figura 4. Análisis de Bland-Altman en el que se compara la secuencia T2-STIR con BARI (A) y la secuencia T2-STIR con APPROACH (B). APPROACH: Alberta Provincial Project for Outcome Assessment in Coronary Heart Disease; BARI: Bypass Angioplasty Revascularization Investigation Myocardial Jeopardy Index; T2-STIR: secuencia T2 en short tau inversion recovery; VI: ventrículo izquierdo.
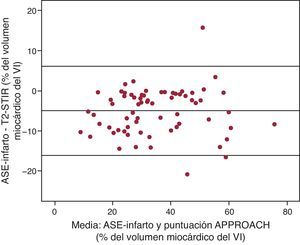
Comparación del análisis cuantitativo de T2-short tau inversion recovery con el área de superficie encocárdica con infartoEl ASE-infarto mostró buena correlación con el AER obtenida mediante las secuencias T2-STIR (Tabla 4 y Figura 5). Además, la variabilidad interobservadores de ambas puntuaciones fue muy baja, en especial para el ASE-infarto (Tabla 3).
Figura 5. Análisis de Bland-Altman en el que se compara el T2-STIR con el área de superficie endocárdica con infarto. APPROACH: Alberta Provincial Project for Outcome Assessment in Coronary Heart Disease; ASE-infarto: área de superficie endocárdica con infarto; T2-STIR: secuencia T2 en short tau inversion recovery; VI: ventrículo izquierdo.
DiscusiónEl presente estudio pone de manifiesto una buena correlación entre el AER definida mediante las puntuaciones angiográficas y las secuencias STIR de RMC en pacientes con infarto de miocardio con elevación del ST tratados con una ICP primaria. La correlación fue mejor en los infartos de cara anterior, y ambas puntuaciones angiográficas tuvieron una variabilidad interobservadores baja. Estos resultados demuestran que las puntuaciones angiográficas aportan una estimación clínicamente útil del AER, en especial en los infartos de cara anterior. Esta observación es relevante para la práctica clínica, ya que el AER es una variable importante en los pacientes con IAM con elevación del segmento ST, y la disponibilidad de la RMC no es universal. Se han propuesto varios métodos para estimar el AER. La inyección de microesferas fluorescentes es la técnica de elección en los estudios realizados en animales y la SPECT (tomografía computarizada de emisión monofotónica) es la más comúnmente utilizada en el ser humano6, 21. No obstante, esta está sujeta a ciertas limitaciones porque se tarda 24 h en disponer de los datos, por la exposición a la radiación y por la baja resolución espacial. Las puntuaciones angiográficas constituyen un método alternativo rápido para estimar el AER y se basan en el concepto del AER anatómica propuesto por Seiler et al22. Esta aproximación se basa en el supuesto de que cada segmento miocárdico es irrigado por una de las arterias coronarias y que la extensión del área irrigada depende de la longitud de las ramas del vaso. En los últimos años, se ha propuesto el empleo de la RMC como método alternativo excelente para la estimación del AER. Diversos estudios han puesto de manifiesto que las secuencias con ponderación T2 obtenidas después de un IAM permiten la identificación retrospectiva del AER tanto en los animales como en el ser humano6, 23.
Correlación entre puntuaciones angiográficas y área miocárdica en riesgo calculada mediante resonancia magnética cardiovascularAunque las puntuaciones angiográficas se han comparado parcialmente con otros métodos de referencia para el cálculo del AER10, 11, 14, el BARI no ha sido validado directamente mediante ninguno de los métodos de referencia (secuencias T2-STIR o SPECT miocárdica) y la correlación entre APPROACH y T2-STIR sólo se ha evaluado en un estudio con importantes limitaciones. Wright et al11 habían mostrado una correlación moderada entre BARI y ASE-infarto (r=0,42), que a su vez tenía una correlación buena con el T2-STIR (r=0,77). No obstante, no se presentaron datos directos sobre la correlación entre BARI y T2-STIR. Anteriormente, Ortiz-Pérez et al10 habían presentado una comparación de ambas puntuaciones angiográficas con el ASE-infarto, en la que obtuvieron una correlación excelente (r=0,9 para BARI y r=0,87 para APPROACH), aunque ninguno de los métodos había sido validado previamente. En otro estudio recientemente publicado, se han presentado datos sobre la correlación entre el AER utilizando secuencias T2-STIR y la puntuación APPROACH, con muy buenos resultados (r=0,78). No obstante, algunas características de ese estudio podrían limitar la validez general de sus conclusiones. El 24% de los 50 pacientes incluidos presentaban un síndrome coronario agudo sin elevación del segmento ST, hasta un 20% tenía antecedentes previos de IAM y hasta un 26% mostraba una circulación colateral con un valor > 1 en la escala Rentrop14.
Nuestro estudio muestra la buena correlación entre ambas puntuaciones angiográficas y todos los índices derivados de la RMC en una muestra homogénea. Los mejores resultados de nuestra serie comparados con los de Wright et al pueden deberse a que todas nuestras exploraciones de RMC se llevaron a cabo a los 2-7 días del IAM, mientras que en el estudio de Wright et al este periodo fue de hasta 20 días.
Puntuaciones de resonancia magnética cardiovascular para el cálculo del área miocárdica en riesgoDadas las limitaciones existentes para delimitar de forma exacta el AER en el T2-STIR7, 8, 9, a veces se necesitan puntuaciones alternativas para estimarla. Se han utilizado diferentes métodos validados mediante anatomía patológica, similares al ASE-infarto, en muestras de animales, con el mismo objetivo y con buenos resultados24, 25. Dado que el cálculo del ASE-infarto no requiere secuencias T2-STIR y puesto que las secuencias con contraste tardío no muestran tantas limitaciones cuando se obtienen imágenes de alta resolución, su empleo puede constituir una alternativa excelente. Esta podría ser una de las principales razones por las que el ASE-infarto muestra una correlación interobservadores (CCI=0,86) mejor que la del cálculo del AER con el T2-STIR (CCI=0,81). Además, la correlación entre puntuaciones angiográficas y ASE-infarto es igual de buena que con el T2-STIR.
Influencia de la localización del infarto agudo de miocardio en la correlación entre las diferentes puntuacionesWright et al11 señalaron que una posible explicación de las discrepancias de T2-STIR y ASE-infarto respecto a la puntuación BARI, en comparación con los resultados obtenidos por Ortiz-Pérez et al10, podría ser que los infartos de pared inferior se extienden ocasionalmente al ventrículo derecho26, un área no evaluada por los primeros dos métodos pero sí parcialmente por el tercero. Sin embargo, a la vista de los datos obtenidos en nuestro estudio, aunque esta explicación podría aplicarse a la puntuación BARI, no es válida para la puntuación APPROACH, que tiene en cuenta únicamente el VI. Una posible razón sería la variabilidad anatómica normal de las arterias coronarias12. El origen más frecuente de la variación es la arteria descendente posterior, que básicamente define el predominio de irrigación del territorio inferior a costa de la arteria coronaria derecha, que es dominante en el 70% de los pacientes, o de la arteria circunfleja12. Además, otras ramas terminales como las posterolaterales, que irrigan un área variable de la pared inferior y lateral, pueden proceder de ambas arterias, lo que explica que estas áreas estén sujetas a una amplia variabilidad anatómica en su irrigación. Pereztol-Valdés et al27 observaron una amplia variabilidad en las paredes inferior y lateral con el uso de gammagrafía de perfusión cardiaca para calcular el área irrigada por cada una de las arterias coronarias, en comparación con el modelo de 17 segmentos estandarizado. Aunque existen diferencias de resultados según la localización del IAM, la correlación entre puntuaciones angiográficas y métodos de RMC en los infartos de pared anterior y no anterior es estadísticamente significativa para cada uno por separado. En consecuencia, la utilidad de las puntuaciones BARI y APPROACH para ambos territorios parece consistente.
Relevancia clínica de nuestro estudioLas AER más grandes se asocian a un mayor tamaño del infarto, menor fracción de eyección, mayor número de segmentos hipoperfundidos y mayor obstrucción microvascular4. Además, la medición del AER y la comparación con el tamaño del infarto permiten estimar el miocardio rescatado, lo que aporta una información adicional clínicamente útil en comparación con el tamaño del infarto solo. Los infartos de miocardio con poco o ningún miocardio rescatado tienen mayor probabilidad de ser transmurales, muestran mayor riesgo de eventos cardiovasculares y desencadenan un remodelado adverso que causa infartos de un tamaño similar pero rodeados de una importante masa de miocardio rescatado28.
La medición del AER es también un instrumento de investigación esencial para evaluar las estrategias de reperfusión y aumentar al máximo el miocardio rescatado en pacientes con IAM con elevación del segmento ST, lo cual aporta un enfoque terapéutico muy necesario29, 30, 31, 32, 33.
LimitacionesLa inclusión tan sólo de pacientes con IAM con elevación del segmento ST y no de otros casos implica que nuestros resultados no pueden extrapolarse a todos los tipos de síndromes coronarios agudos.
ConclusionesLa concordancia entre los métodos utilizados para evaluar el AER mediante RMC y mediante angiografía es buena; estos métodos constituyen una excelente alternativa para la práctica clínica, en especial en el infarto de miocardio de pared anterior. La puntuación ASE-infarto es una alternativa interesante para el cálculo del AER, en especial en pacientes en quienes la señal miocárdica es difícil de delimitar en las secuencias T2-STIR.
FinanciaciónFinanciado parcialmente por la Red Española de Enfermedades Cardiovasculares (RECAVA), RD/006/0014/025 del Instituto de Salud Carlos III, Ministerio de Ciencia e Innovación.
Conflicto de interesesNinguno.
Recibido 15 Noviembre 2011
Aceptado 13 Abril 2012
Autor para correspondencia: Servicio de Cardiología, Hospital Universitario Vall d’Hebron, Universidad Autónoma de Barcelona, Paseo Vall d’Hebron 119-129, 08035 Barcelona, España. moral.sergio@yahoo.es