La hiperoxaluria primaria (HP) es una enfermedad poco frecuente con herencia autosómica recesiva que consiste en una alteración del metabolismo del oxalato, cuyo depósito en forma de sal cálcica en los riñones conduce a deterioro del filtrado glomerular (FG) e insuficiencia renal (IR) progresiva1,2. Existen diferentes tipos de esta metabolopatía, la HP de tipo 1 (HP1) se produce por una alteración enzimática en el hígado y se acompaña frecuentemente de afección cardiaca por depósito de oxalato en el tejido cardiaco2. Se ha descrito miocardiopatía dilatada con grados variables de disfunción ventricular, accidente cerebrovascular por embolización de depósitos miocárdicos y alteraciones de tejido específico de conducción que se manifiesta en forma de trastornos de conducción y arritmias potencialmente mortales2. El tratamiento de la HP1 es el trasplante hepático para recuperar la actividad enzimática deficitaria.
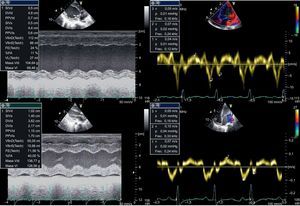
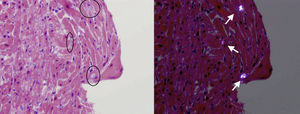
Una niña de 3 años (peso, 10,4kg) de origen paquistaní ingresó para estudio de IR (urea, 543 mg/dl; creatinina, 11,6 mg/dl; FG, 14,3%), se le diagnosticó HP (oxalato plasmático, 12,6 mg/l; ácido oxálico urinario, 540,4 mmol/mol), y el estudio genético detectó homocigosis para una mutación previamente no descrita que consistía en un cambio del codón 164 de glutamina a arginina (p.Q164R), que codificaba una proteína no funcionante demostrada in vitro. Estos hallazgos fueron diagnósticos de HP1. Clínicamente la paciente presentaba episodios de edema agudo de pulmón relacionados con la administración intravenosa de líquidos, y para su estudio se realizó una ecocardiografía, que reveló una dilatación ventricular izquierda (z-score, +4) con disfunción ventricular grave (fracción de eyección del ventrículo izquierdo [FEVI], 23%) (fig. 1). Ante la sospecha de miocardiopatía dilatada secundaria a HP1, se realizó una biopsia miocárdica, que demostró la presencia de cristales con estriaciones radiales visibles en luz polarizada propios de la afección cardiaca por HP (fig. 2).
Dado el elevado riesgo quirúrgico del trasplante hepatorrenal en presencia de disfunción ventricular grave, se realizó un estudio de reserva miocárdica mediante una ecocardiografía de estrés con dobutamina. Se realizó la prueba según el protocolo de la American Heart Association3. La prueba demostró mejoría de la función del ventrículo izquierdo hasta FEVI de un 55-60% con dobutamina a 30μg/kg/min, pero se tuvo que interrumpirla por crisis hipertensiva con clínica neurológica transitoria.
Con estos resultados y a la luz de la literatura médica existente, se decidió inclusión en lista de trasplante hepatorrenal, que se llevó a cabo 1 mes después.
En el postoperatorio inmediato persistía dilatación del ventrículo izquierdo con disfunción (FEVI, 25-30%), pero en controles posteriores se detectó aumento del grosor miocárdico y recuperación progresiva de la FEVI, que a los 6 y a los 18 meses del trasplante era del 68 y el 71,6% respectivamente, con diámetros ventriculares normales para la edad (fig. 1).
La HP1 se debe a una alteración del cromosoma 2, asociada al q36-37, que causa ausencia, disminución o disfunción de la actividad hepática de la enzima glucolato aminotransferasa. Dicha alteración conduce a la síntesis excesiva de oxalato y glucolato, que se depositan en los riñones en forma de sus sales cálcicas y producen el deterioro progresivo del FG y finalmente IR terminal1,4. Cuando el FG disminuye, la concentración de oxalato aumenta, y se desencadena la «oxalosis sistémica» que lleva a la acumulación de depósitos de oxalato en diferentes órganos, como la vasculatura pulmonar, el tejido cardiaco, la retina o el sistema osteoarticular2. Está claramente establecido que un FG <20-40ml/min/m2 produce aumento de oxalato y favorece la oxalosis4.
La HP1 tiene patrones de presentación y evolución muy distintos dentro de una misma mutación genética4, lo que dificulta predecir la evolución. El pronóstico se ensombrece cuando hay afección multisistémica, sobre todo cardiaca y pulmonar2. Los niños son el subgrupo con más alto riesgo de sufrir enfermedad rápidamente progresiva, con IR y oxalosis a edades tempranas de la vida5.
Inicialmente se indicaba el trasplante renal como única opción terapéutica, pero presentaba una alta tasa de recidivas1,4,5. Posteriormente se observó que el trasplante hepático o hepatorrenal (en caso de IR) daba mejores resultados a largo plazo (supervivencia total y del injerto4), atribuible a la corrección del defecto enzimático4–6. La combinación de hemodiálisis y diálisis peritoneal previas al trasplante permite la movilización de depósitos oxálicos con disminución del oxalato y permite mejores resultados de supervivencia del injerto renal a corto y largo plazo5. No hay consenso sobre qué valores de FG establecen la indicación de trasplante hepático exclusivamente, pero hay grupos4,5 que defienden excelentes resultados con FG >50 ml/min/m2.
Aunque son muy escasos los casos descritos de miocardiopatía dilatada secundaria a HP1 sometidos a trasplante hepatorrenal, la mayoría de ellos demuestran la recuperación de la FEVI tras el trasplante.
La opción terapéutica ideal sería realizar un trasplante hepático antes de la IR. No obstante, cuando se establece es necesario el trasplante hepatorrenal. En los casos con afección cardiaca grave, se podría considerar el trasplante cardiohepatorrenal. No obstante la frecuente reversibilidad descrita incluso en casos extremos, indican el trasplante hepatorrenal. En nuestro caso, aunque no se ha descrito previamente, la ecocardiografía de estrés fue de gran utilidad en la toma de decisiones al demostrar la reserva miocárdica previa al trasplante.