El dispositivo NitOcclud Lê VSD Coil, diseñado específicamente para el cierre de la comunicación interventricular (CIV), se comercializó en agosto de 2010. Se propuso describir el empleo de esta técnica en España, analizando su fiabilidad y su eficacia a corto-medio plazo.
MétodosEstudio observacional retrospectivo multicéntrico español sobre pacientes de todas las edades con CIV, de cualquier naturaleza y localización, sometidos a cateterismo para intento de cierre con NitOcclud Lê VSD Coil hasta enero de 2019.
ResultadosCon la participación de 13 instituciones, se registró un total de 117 procedimientos para implantar al menos 1 dispositivo NitOcclud en 116 pacientes. Las medianas (intervalo) de edad y peso fueron 8,6 (0,4-69) años y 27 (5,8-97) kg. En 99 casos (85%), la CIV era un defecto congénito aislado. La localización era perimembranosa en 95 pacientes (81%), 74 (63%) con bolsón aneurismático subtricuspídeo. El tiempo de fluoroscopia fue 34 (11,4-124) min. El implante resultó exitoso en el 89% (104/117), con un tiempo de seguimiento de 31,4 (0,6-59) meses. La tasa de cierre completo o casi completo del defecto en la última revisión era del 92,3% (ausente, 73; shunt trivial, 23). Cuatro pacientes precisaron un nuevo cateterismo para cierre de cortocircuito residual. Hubo que retirar quirúrgicamente 2 dispositivos por hemolisis grave. No hubo muertes ni otras complicaciones mayores.
ConclusionesEl dispositivo NitOcclud puede utilizarse con éxito para cierre de un amplio espectro anatómico de CIV. La persistencia de shunt residual inicial es significativa, pero disminuye con el tiempo. La incidencia de hemolisis es muy baja, y no se detectan alteraciones permanentes de la conducción auriculoventricular.
Palabras clave
La comunicación interventricular (CIV) aislada es la cardiopatía congénita más frecuente, y representa hasta el 20% de los defectos cardiacos al nacimiento (3/1.000 recién nacidos)1. Alrededor del 70% son de localización perimembranosa y pueden presentar extensiones diversas hacia el septo conal o trabecular. En caso de que precisara tratamiento, su abordaje era exclusivamente quirúrgico hasta la introducción en 1988 de las técnicas de cierre percutáneo2. Inicialmente, los dispositivos empleados fueron los diseñados para otros fines (cierre de comunicación interauricular o ductus), pero a finales de la década de los noventa Amplatzer (AGA Medical Corp., Estados Unidos) desarrolló unos específicos, que mejoraban la seguridad y obtenían unos resultados de eficacia comparables a los quirúrgicos3,4. No obstante, la inaceptable tasa de bloqueo auriculoventricular (BAV) (del 3,8 al 22%)5–7 hizo que se abandonara el uso del dispositivo Amplazter perimembranous VSD en muchas instituciones. En los años posteriores, dado que el tratamiento quirúrgico también puede tener riesgo potencial de BAV8,9, se retomaron técnicas fuera de ficha (off-label) para el cierre percutáneo de las CIV con diferentes dispositivos, ninguno de ellos exento de posibles complicaciones.
En agosto de 2010, NitOcclud Lê VSD Coil (PFM AG, Alemania) obtuvo la marca CE. Su diseño específico supuso un cambio de paradigma en el mecanismo de cierre comparado con los dispositivos de doble disco (figura 1). Son todavía pocas las series que informan sobre su uso10–15, la mayoría con un pequeño número de pacientes y seguimientos cortos. El objetivo de este estudio es describir el empleo de esta técnica en España, analizando su fiabilidad y su eficacia a corto-medio plazo.
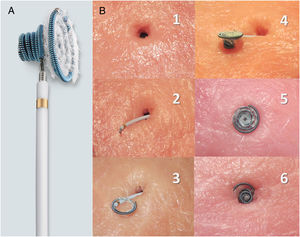
A: descripción del dispositivo; espiras de nitinol con estructura en diábolo, con cintura central de 2,5 mm y espiras de mayor tamaño en el lado izquierdo que en el derecho; recubrimiento de fibras de poliéster en el lado izquierdo para aumentar su capacidad trombogénica; tamaños disponibles: 8×6, 10×6, 12×6, 12×8, 14×8 y 16×8 mm, premontado en catéter de 6-7 Fr con cable transportador que permite su navegación. B: simulación de técnica de cierre in vitro (reproducido por cortesía de N.A. Haas, con permiso); 1: defecto; 2: catéter transportador cruzando el defecto, extremo de la espira izquierda ligeramente exteriorizado; 3: despliegue de las espiras izquierdas; 4: espiras izquierdas y cintura desplegadas (lado izquierdo); 5: dispositivo acomodado en el defecto (lado izquierdo); 6: dispositivo acomodado en el defecto (lado derecho, espiras derechas desplegadas).
Se trata de un estudio observacional retrospectivo multicéntrico a escala nacional, que incluye a todos los pacientes consecutivos, de cualquier edad, con CIV de cualquier naturaleza y localización sometidos a cateterismo para intento de cierre con el dispositivo NitOcclud Lê VSD Coil, desde el inicio de la implantación de esta técnica (septiembre de 2010) hasta enero de 2019.
Se recogieron los datos mediante cuestionario definido, respetando la Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y Garantía de los Derechos Digitales. El estudio contó con la aprobación del comité de investigación del centro coordinador y se obtuvo el consentimiento informado por escrito de los pacientes o sus representantes legales.
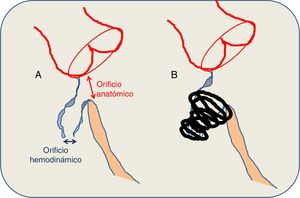
El criterio para la selección de los pacientes fue la presencia de CIV hemodinámicamente significativa, definida indispensablemente como aquella asociada con dilatación de cavidades izquierdas (signo de sobrecarga de volumen mantenida) o con Qp/Qs> 1,5. Otros criterios fueron: síntomas clínicos de hiperaflujo pulmonar, resistencia vascular pulmonar <4-5 UW/m2 y las características anatómicas definidas en la figura 2 (orificio hemodinámico ≤ 8 mm). Para las CIV perimembranosas, se escogió idealmente a los pacientes con peso> 10 kg. Muchos procedimientos se monitorizaron presencialmente por un proctor, según protocolo de entrenamiento recomendado por la compañía. Generalmente se realizaron con anestesia general y administración profiláctica de cefazolina (2 mg/kg) (antes y 8 y 16 h tras el procedimiento), bolo de heparina a 100 UI/kg y control ecocardiográfico (transtorácico o transesofágico) simultáneo (figura 3). Para las CIV perimembranosas o de salida se obtuvo acceso femoral, y para las musculares medias o apicales, acceso yugular derecho. La medición del Qp/Qs no fue obligatoria y se obtuvo en función de los estándares de cada hospital.
A: criterios anatómicos del defecto. B: características del cierre. La medición del defecto se realiza combinando la ecografía transesofágica y la ventriculografía izquierda. La comunicación interventricular perimembranosa tiene una morfología típicamente cónica, de modo que el orificio hemodinámico (el que se abre hacia el ventrículo derecho) es de menor tamaño que el orificio anatómico (el que se observa desde el ventrículo izquierdo). El tamaño del dispositivo se calcula sabiendo que el tamaño de la espira izquierda debe ser el doble que el diámetro del orificio hemodinámico y al menos 1-2mm mayor que el orificio anatómico. Idealmente, el coil queda alojado en el interior del aneurisma, lejos del tejido de conducción y de los velos aórticos, evitando fuerzas de pinzamiento en el tabique interventricular. En ausencia de bolsón aneurismático, se requieren al menos 3-4mm de borde superior.
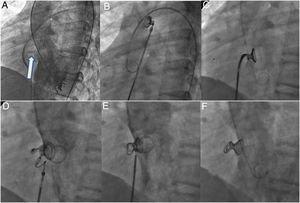
Fases del implante. A: ventriculografía izquierda en vista oblicua anterior izquierda (55°) más craneal (30°) para visualización de comunicación interventricular perimembranosa con tejido aneurismático (flecha). B: espiras izquierdas y de la cintura (1-2cm) desplegadas en la aorta ascendente en el catéter progresado desde el lado derecho del corazón, tras realizar el asa arteriovenosa (colocación de lazo en el tronco de la arteria pulmonar y avance retrógrado del catéter coronario sobre la guía hidrófila desde el lado izquierdo hasta la vena cava inferior, o superior si el acceso es yugular) y avance de la vaina en estrecho contacto con la punta del catéter coronario (kissing technique) hasta el arco aórtico distal. C: dispositivo en el ventrículo izquierdo, posicionado dentro del defecto tras su descenso atravesando el plano valvular aórtico. D: despliegue de las espiras derechas. E: liberacion del coil. F: angiografía final con el coil alojado en el interior del tejido aneurismático sin interferencia con la válvula aórtica ni cortocircuito residual.
El procedimiento se consideró exitoso si el dispositivo se encontraba en posición adecuada y sin complicaciones mayores a las 24 h del implante10,13. Se definieron como complicaciones mayores las que requirieron intervención (quirúrgica/percutánea).
El seguimiento de los pacientes se llevó a cabo regularmente en cada centro según las características específicas de los pacientes, si bien incluyó sistemáticamente la exploración física, el electrocardiograma y la ecocardiografía. Otras pruebas complementarias, como Holter-ECG, se realizaron en función de los hallazgos clínicos. La recogida de datos finalizó en julio de 2019. Se administró ácido acetilsalicílico a 5 mg/kg/día y profilaxis para endocarditis infecciosa durante los primeros 6 meses tras el implante.
Para el análisis de datos se empleó el paquete estadístico Stata 13.1 (Estados Unidos). Las variables continuas se presentan como mediana (intervalo) y las variables categóricas, como frecuencias (porcentajes). Para la comparación de medias de edad, peso y tiempos entre 2 o más de 2 subgrupos, se empleó la prueba de la t de Student o ANOVA respectivamente, y para la comparación de porcentajes de éxito y complicaciones entre subgrupos, la prueba exacta de Fisher; se consideraron significativos los valores con p <0,05.
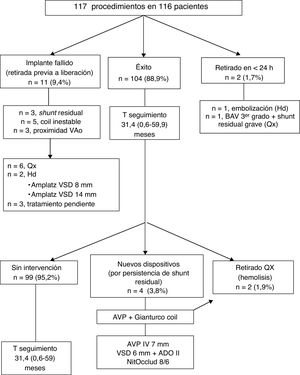
RESULTADOSCon la participación de 13 instituciones, se registraron 117 cateterismos para intentar el implante de al menos 1 dispositivo NitOcclud en un total de 116 pacientes (tabla 1). En la tabla 2 se presentan los resultados en función de los diversos subtipos de CIV. La experiencia por hospital se analiza en la tabla 3. La viabilidad del procedimiento y su evolución se presentan en la figura 4.
Características de los pacientes, de la anatomía de las CIV y generales del procedimiento
| Características de los pacientes (n=116) | Características de la CIV (n=117) | Características del procedimiento (n=117) | |||
|---|---|---|---|---|---|
| Edad (años)Edad <1 año | 8,6 (0,4-69,2)8 (6,8) | NaturalezaCongénitaPosquirúrgicaPosinfarto | 103 (88,0)13 (11,1)1 (0,9) | ETE | 117 (100) |
| Vena femoral | 115 (98) | ||||
| Peso (kg)Peso <10 kg | 27,5 (5,8-97)12 (8,6) | PAPm (mmHg) | 17,5 (10-43) | ||
| Ingreso ≤ 2 días | 89 (76) | ||||
| Talla (cm) | 127 (56-195) | LocalizaciónPM con aneurismaPMMuscularGerbodeResidual quirúrgica | 74 (63,2)21 (18,0)7 (6,0)6 (5,1)9 (7,7) | Tamaño del coil8/610/612/612/814/816/8 | 34 (29,1)29 (24,8)18 (15,4)11 (9,4)14 (12,0)11 (9,4) |
| Tipo de cardiopatíaCIV aisladaCCC | 99 (85,3)17 (14,7) | ||||
| IndicaciónDilatación del VIIC/diuréticoQp/Qs (n=92)EI previaIAo leve | 113 (97,4)22 (19,0)1,57 (1-3)2 (1,7)15 (12,9) | ||||
| OrificiosÚnicoMúltiple | 78 (66,7%)39 (33,3%) | ||||
| Diámetro (mm)En VIEn VD | 8,5 (3-20)4,5 (1,7-11) | Tiempo de fluoroscopia (min) | 34 (11,4-124) | ||
| Tiempo del procedimiento (min) | 133,5 (60-285) | ||||
CCC: cardiopatía congénica compleja; CIV: comunicación interventricular; EI: endocarditis infecciosa; ETE: ecocardiografía transesofágica; IAo: insuficiencia aórtica; IC: insuficiencia cardiaca; PAPm: presión arterial pulmonar media; PM: perimembranosa sin tejido aneurismático dependiente del aparato subvalvular tricuspídeo; VD: ventrículo derecho; VI: ventrículo izquierdo.
Los valores expresan mediana (intervalo) o n (%).
Edad y peso, tiempos y resultado del procedimiento según el tipo de cardiopatía y la naturaleza y la localización de la CIV
| Tipo de cardiopatía | Naturaleza de la CIV | Localización de la CIV | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| n=117 | Simple (n=99) | Compleja (n=18) | p | Congénita (n=103) | Posquirúrgica (n=13) | Posinfarto (n=1) | p | PM con aneurisma (n=74) | PM sin aneurisma (n=21) | Muscular (n=7) | Gerbode (n=6) | Parche quirúrgico (n=9) | p |
| Edad (años) | 9,0 (0,8-69) | 5,1 (0,4-19,3) | 0,11 | 8,6 (0,4-68,3) | 5,2 (0,9-37) | 69,2 | <0,01* | 8,6 (0,4-37) | 11,6 (0,5-28) | 8,7 (0,8-69,2) | 8,6 (11-68,3) | 5,5 (0,9-14,8) | 0,13 |
| Peso (kg) | 34,2 (7-97) | 14 (5,8-46) | <0,01* | 31,5 (58-97) | 16 (7-79,5) | 75 | 0,05 | 31,5 (5,8-97) | 29 (6,9-79,2) | 19,1 (8,9-75) | 31,4 (7-58) | 16 (10-44,5) | 0,68 |
| Fluoroscopia (min) | 33 (11-101) | 41 (17-124) | 0,23 | 31 (11-124) | 48 (17-73) | 100 | <0,01* | 29 (16-80) | 57 (19-124) | 38 (25-100) | 30 (11-90) | 51 (30-73) | <0,01* |
| Tiempo total(min) | 131 (60-285) | 152 (64-240) | 0,73 | 130 (60-285) | 176 (64-240) | 260 | 0,11 | 128 (64-257) | 185 (60-285) | 165 (80-260) | 124 (64-240) | 178 (105-200) | 0,14 |
| Implante con éxito (%), 89 (104/117) | 86,9 (86/99) | 100 (18/18) | 0,21 | 88,3 (91/103) | 100 (13/13) | 0 | 0,05 | 91,9 (68/74) | 71,4 (15/21) | 100 (7/7) | 100 (6/6) | 88,9 (8/9) | 0,11 |
| Complicación mayor (%), 6,9 (7/106) | 5,7 (5/88) | 11,1 (2/48) | 0,34 | 6,4 (6/93) | 7,7 (1/13) | — | 0,87 | 5,8 (4/69) | 6,2 (1/16) | 0 | 16,7 (1/6) | 12,5 (1/8) | 0,47 |
CIV: comunicación interventricular; PM: perimembranosa.
Los valores expresan mediana (intervalo) o % (n/N).
Experiencia en el implante de NitOcclud según centro hospitalario
| Hospital | A | B | C | D | E | F | G | H | I | J | K | L | M |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inicio del programa | 29-5-2014 | 28-9-2010 | 10-4-2015 | 1-12-2015 | 14-7-2015 | 16-4-2015 | 22-6-2017 | 9-3-2018 | 11-2-2016 | 24-4-2016 | 22-3-2017 | 28-3-2017 | 4-4-2016 |
| Total (n=117) | 42 | 37 | 9 | 8 | 5 | 4 | 3 | 2 | 2 | 2 | 1 | 1 | 1 |
| Edad (años) | 5,9 (0,4-15,5) | 5,5 (0,9-22,1) | 16,9 (2,3-37,1) | 13,6 (8,6-17,4) | 6,3 (1,6-13,3) | 5,7 (2,2-11,3) | 11,5 (8,7-14) | 9,8 14,9 | 6,911,6 | 10,318,1 | 11,8 | 69,2 | 68,3 |
| Peso (kg) | 16,9 (5,8-79,2) | 22,6 (7-97) | 55 (8,9-79,5) | 39,2 (21-68) | 22,3 (10-68,5) | 16 (10-38) | 41,5 (32-45) | 5484 | 2132 | 3855 | 51 | 75 | 58 |
| Tamaño del coil | |||||||||||||
| 8/6 | 19 | 10 | 1 | 3 | 1 | — | — | — | 1 | — | 1 | — | — |
| 10/6 | 6 | 15 | — | 2 | — | 2 | — | — | — | 1 | — | — | — |
| 12/6 | 7 | 5 | 1 | 1 | 2 | — | — | — | 1 | — | — | — | — |
| 12/8 | — | 4 | 3 | — | 2 | — | 1 | — | — | 1 | — | — | 1 |
| 14/8 | 3 | 3 | 3 | 2 | — | 2 | 1 | — | — | — | — | 1 | — |
| 16/8 | 7 | — | 1 | — | — | — | 1 | 2 | — | — | — | — | — |
| Casos no implantados (orden, tipo de CIV), 9,4% (11/117) | 7,1 (3/42) Caso 8: Laubry· Caso 26: Laubry· Caso 29: Laubry | 13,5 (5/37) Caso 4: PM con aneurisma. Caso 9: PM con aneurisma· Caso 13: PM con aneurisma· Caso 21: Laubry· Caso 35: PM | 0 | 12,5 (1/8) Caso 4: PM | 0 | 25 (1/4) Caso 3: PM con aneurisma | 0 | 0 | 0 | 0 | 0 | 1· Caso 1: Muscular posinfarto | 0 |
| Complicación mayor, 6,9% (7/106) | 5,1 (2/39) Caso 5: shunt residuala· Caso 17: shunt residuala | 9,4 (3/32) Caso 1: hemolisisb· Caso 8: embolizacióna· Caso 11: hemolisisa,b | 11 (1/9) Caso 8: shunt residual y BAVb | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 100 (1/1) Caso 1: hemolisisa |
| Éxito, 89%(104/117) | 93 (39/42) | 84 (31/37) | 89 (8/9) | 87,5 (7/8) | 100 (5/5) | 75 (3/4) | 100 (3/3) | 100 (2/2) | 100 (2/2) | 100 (2/2) | 100 (1/1) | 0 | 100 (1/1) |
CIV: comunicación interventricular; PM: perimembranosa.
Los valores expresan mediana (intervalo) o % (n/N).
Diagrama de flujo sobre la evolución de los pacientes. ADO: Amplatzer Ductal Occluder; AVP: Amplatzer Vascular Plug; Amplatzer VSD: Amplatzer Ventricular Septal Defect Occluder; AVP: Amplatzer Vascular Plug; BAV: bloqueo auriculoventricular; Hd: hemodinámica; Qx: cirugía/quirúrgico; T: tiempo; VAo: válvula aórtica.
Pese a la variedad de situaciones clínicas, el procedimiento tuvo éxito en el 89% (104/117). Cabe resaltar que el diseño específico del dispositivo permitió el cierre percutáneo de 6 CIV tipo Gerbode16, 9 CIV residuales sobre parche quirúrgico en pacientes con cardiopatía congénita compleja (CCC) y 1 shunt residual en CIV muscular cerrada previamente con dispositivo Amplatzer.
Solo 4 pacientes (2 CIV perimembranosas con aneurisma, 1 Gerbode y 1 CIV posquirúrgica en CCC) precisaron la colocación de 2 dispositivos NitOcclud sobre el mismo defecto por persistencia de shunt residual, y en 3 de estos 4 dobles implantes se realizaron en un único cateterismo. Además, hubo 1 paciente (12kg, heterotaxia y CCC), que precisó durante el procedimiento el implante de un Amplatzer Vascular Plug tipo IV 7 mm sobre NitOcclud 18/6 mm por el mismo motivo.
El tiempo de fluoroscopia fue significativamente superior para las CIV perimembranosas sin aneurisma y las residuales posoperatorias (tabla 2). También fueron mayores el tiempo total del procedimiento y el porcentaje de fracaso en el implante.
En 4 pacientes se realizó conjuntamente el cierre de otros cortocircuitos adicionales: 1 ductus, 2 CIA/foramen oval y 1 CIV muscular anterior (7kg, CCC, Amplatzer Ductal Occluder tipo II 6×4 mm).
De los 11 pacientes en los que no se pudo implantar el dispositivo, 4 tenían síndrome de Laubry (con uno de los velos aórticos en estrecha relación con el cortocircuito)17, 1 CIV posinfarto de localización inferior (tratamiento compasivo por insuficiencia cardiaca y cierre parcial previo del defecto con dispositivo Amplatzer Ventricular Septal Defect Occluder), 4 CIV perimembranosas con tejido aneurismático en las que no se consiguió la estabilidad del coil y 2 CIV perimembranosas sin tejido aneurismático en las que persistía un cortocircuito al menos moderado. En otro paciente con CIV perimembranosa sin tejido aneurismático (8 años, 39kg), el oclusor embolizó a la arteria pulmonar izquierda, y se retiró por vía percutánea a las 24 h del implante.
La mediana del tiempo de seguimiento fue 31,4 (0,6-59,9) meses. No hubo fallecimientos relacionados con el implante ni trastornos del ritmo permanentes. En general, la tasa de complicaciones mayores fue del 6,7% (7/106). Este porcentaje fue superior para las CIV tipo Gerbode o las residuales posquirúrgicas (tabla 2).
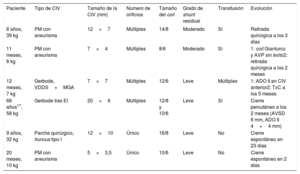
En la evolución, la principal complicación fue la aparición de hemolisis, hasta el 5,8% (6/104), que se produjo en todos los casos en las primeras 24-48 h tras el implante. En 4 pacientes fue grave, 2 de ellos precisaron tratamiento quirúrgico (tabla 4). Un tercer paciente con hemolisis crónica controlada se sometió a trasplante cardiaco por insuficiencia cardiaca secundaria a CCC.
Descripción de pacientes con hemolisis
| Paciente | Tipo de CIV | Tamaño de la CIV (mm) | Número de orificios | Tamaño del coil | Grado de shunt residual | Transfusión | Evolución |
|---|---|---|---|---|---|---|---|
| 8 años, 39 kg | PM con aneurisma | 12×7 | Múltiples | 14/8 | Moderado | Sí | Retirada quirúrgica a los 3 días |
| 11 meses, 8 kg | PM con aneurisma | 7×4 | Múltiples | 8/6 | Moderado | Sí | 1: coil Gianturco y AVP sin éxito2: retirada quirúrgica a los 2 meses |
| 12 meses, 7 kg | Gerbode, VDDS+MGA | 7×7 | Múltiples | 12/6 | Leve | Múltiples | 1: ADO II en CIV anterior2: TxC a los 5 meses |
| 68 años17, 58 kg | Gerbode tras EI | 20×6 | Múltiples | 12/8 y 10/6 | Leve | Sí | Cierre percutáneo a los 2 meses (AVSD 6 mm, ADO II 4×4 mm) |
| 9 años, 32 kg | Parche quirúrgico, truncus tipo I | 12×10 | Único | 16/8 | Leve | No | Cierre espontáneo en 23 días |
| 20 meses, 10 kg | PM con aneurisma | 5×3,5 | Único | 10/6 | Leve | No | Cierre espontáneo en 2 días |
ADO: Amplatzer Ductal Occluder; AVP: Amplatzer Vascular Plug; AVSD: Amplatzer Ventricular Septal Defect Occluder; CIV: comunicación interventricular; EI: endocarditis infecciosa; MGA: mala posición de grandes arterias; PM: perimembranosa; TxC: trasplante cardiaco; VDDS: ventrículo derecho de doble salida.
Cuatro pacientes (3,8%) requirieron un segundo procedimiento percutáneo, 1 por hemolisis y 3 por cortocircuito residual significativo (figura 4).
El 9,6% (10/104) de los pacientes presentaron alteraciones del ritmo cardiaco transitorias: 2 BAV transitorios —1 paciente (21kg, CIV perimembranosa sin aneurisma) con BAV de tercer grado y cortocircuito residual significativo, cuya conducción auriculoventricular se normalizó tras la extracción y el cierre quirúrgico del defecto a las 24 h del implante18, y otro (24kg, síndrome de Down, CIV perimembranosa aneurismática) que requirió administración puntual de atropina y tratamiento con corticoides orales por un BAV de segundo grado Mobitz tipo II en las primeras 48 h, con evolución favorable a ritmo sinusal tras 6 meses de seguimiento—; disociación electromecánica durante la realización del asa arteriovenosa en 1 paciente de 10kg con CCC, remisión tras la administración de adrenalina y volumen, con posterior implante exitoso del coil y seguimiento sin incidencias; ritmo nodular en 1 paciente (56kg, CIV perimembranosa con aneurisma), con sustitución intraprocedimiento del coil inicialmente empleado (8/6) por uno de mayor tamaño (10/6) para minimizar el shunt residual, que cedió a los 4 días con la administración de corticoides; taquicardia ectópica de la unión en la primera semana posimplante en 2 pacientes (12 kg, Gerbode y 16kg, CIV perimembranosa), con remisión tras la administración de corticoides durante 7-14 días y evolución favorable a los 3-5 años del implante; otras autolimitadas a las primeras 48 h: 1 paciente con extrasístoles supraventriculares, 1 paciente con extrasístoles ventriculares y 2 en ritmo nodular intermitente, que cedieron sin tratamiento médico.
En 3 pacientes se registró bloqueo de rama derecha del haz de His de nueva aparición sin retraso en la conducción AV, que persistían tras 2 años de seguimiento.
No se han descrito daños valvulares secundarios al implante que hayan requerido intervención. No obstante, en el 6,7% (7/104) de los pacientes se produjo interferencia valvular: 2 con insuficiencia aórtica, 3 con aparición o agravamiento de insuficiencia tricuspídea, una doble lesión tricuspídea leve, que se resolvió espontáneamente a los 10 meses de seguimiento, e insuficiencia mitral de grado II (sustitución durante el procedimiento del coil 14/8 por otro 12/8).
Otras complicaciones menores fueron: 1 fístula arteriovenosa femoral en la extremidad inferior izquierda, 1 trombosis de arteria femoral (repermeabilizada con heparina) y 1 neuropatía transitoria del plexo braquial derecho.
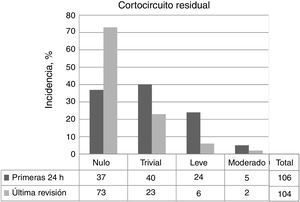
Las tasas de cierre completo o casi completo del defecto a las 48 h del procedimiento y en la última revisión de cada paciente fueron del 72,6% (77/106) y el 92,3% (96/104) respectivamente (figura 5). En la figura 6 se muestra la evolución en el tiempo del posible cortocircuito residual en los pacientes con implante exitoso que no precisaron reintervención.
Desde la primera descripción del cierre percutáneo de las CIV2, se ha extendido su uso y ampliado el ámbito de aplicación debido a la mayor experiencia y a la diversidad de dispositivos disponibles. La singularidad de estos reside en que tienen un diseño específico o readaptado para su uso fuera de ficha13,15,19. Además, en algunas instituciones se ha convertido en el método de elección por sus ventajas respecto a la cirugía9,20 (especialmente en países asiáticos y para CIV musculares)14,21.
En las CIV perimembranosas, el principal problema ha sido la aparición de BAV permanente, incluso años después del implante. La técnica quirúrgica no está exenta de esta complicación22, pero su incidencia actual se espera que sea <1%23. Actualmente, se ha comunicado un 1,6% de incidencia de BAV completo (el 0,8% con marcapasos permanente) tras una técnica de cierre percutáneo con dispositivo de doble disco modificado (n=1.046)24.
Las características ideales que debe tener un oclusor es que sea fácil de utilizar, con bajo perfil, adaptable a múltiples formas de defectos anatómicos, fácil de retirar y reconfigurable, y que cierre el defecto en un periodo de tiempo razonable sin modificar ni interferir las estructuras cardiacas adyacentes para impedir o minimizar el riesgo de alteraciones de la conducción auriculoventricular10.
En nuestro estudio se observó que el NitOcclud Lê VSD Coil cumple con la mayor parte de las características mencionadas, con aplicación a un amplio abanico de situaciones clínicas y con una tasa de éxito general del 89%. La indicación más habitual fue para CIV perimembranosas aneurismáticas de tamaño pequeño-moderado en pacientes asintomáticos en edad escolar con dilatación ecocardiográfica de cavidades izquierdas. Los pacientes con CIV perimembranosas sin tejido aneurismático o CIV residuales posoperatorias fueron los más complejos desde el punto de vista técnico (mayor tiempo de fluoroscopia y menor porcentaje de éxito) (tabla 2).
En relación con los trabajos publicados previamente (tabla 5)10–15, este es el que recoge mayor número de pacientes y mayor variedad de CIV en cuanto a su naturaleza (incluida la isquémica) y su localización (incluido Gerbode)16. Son muy pocos los estudios que refieren cierre de CIV tipo Gerbode por vía percutánea, y muy excepcionalmente con este dispositivo14,25. Asimismo cabe resaltar que se realizaron 3 cateterismos con implante simultáneo y electivo de 2 coils sobre el mismo defecto. Además, hubo pacientes de corta edad o poco peso (el 6,8%, <1 año; el 8,6%, <10 kg), generalmente en el contexto de CIV posquirúrgicas en CCC, donde el procedimiento adquiere especial dificultad26. Esto puede explicar que nuestro porcentaje de éxito global (89%) sea ligeramente inferior y la incidencia de complicaciones mayores (6,7%) y el tiempo de fluoroscopia (37 min), discretamente superiores a los de otros estudios (tabla 4). Además, nuestra definición de complicaciones mayores incluyó las reintervenciones por vía percutánea y no solo quirúrgica, a diferencia de otras series10,13 (en este supuesto, nuestra tasa descendería al 2,8% [3/106]).
Estudios previos sobre uso de NitOcclud® Lê VSD Coil para el cierre de CIV
| Autor | Tipo de CIV | Edad (años)/peso (kg) | Éxito, % | Tiempo de fluoroscopia/tiempo del procedimiento (min) | Complicaciones mayores | Otras complicaciones | Hemolisis | BAVp | BRDHH | Shunt residual | Daño valvular | Seguimiento (meses) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Chungsomprasong et al.12,a (2011; n=33) | PM=11DR=22 | 9,8 (1-29)/34,5 (10,1-83,2) | 93,9 | 21,9 (8,2-75)/88,2 (60-150) | No | — | No | No | — | n=5 (15,2%) a 6 meses | — | 8,1 (3-76,2) |
| Odemis et al.11 (2014; n=20) | PM=20Aneurisma=19 | 7,3 (1,3-17)/25,7 (10-58) | 100 | 29,4 (13,8-67,4)/88,5 (40-180) | n=1 (5%) Qx | — | n=3 (15%) Qx=1 | No | — | n=3 (15%) a 90 días | No | 12,3 (2-22) |
| EUREVECO10 (2017; n=111) | PM=81Aneurisma=48Muscular=31 | 8,4 (0,8-66,9)/28,8 (7,2-109) | 91,9 | 26,3 (7,5-86,3)/121,1 (15-278) | n=2 (1,9%) Qx | n=19 (18,5%) | n=3 (2,9%) Qx=1 | No | n=6 (5,9%) | n=3 (3,1%)al año | IT=5IAo=3 | 31,3 (24-48) |
| Nguyen et al.13,b (2017; n=71) | PM=71Aneurisma=47 | 16,8±14,4/31±18,7 | 97,2 | 27,1±12,4/92,7±36,5 | n=1 (1,4%) Qx | n=11 (14,5%) | n=5 (7,3%)Qx=0 | n=1 (1,4%)Qx=1 | No | n=4 (5,8%)al año | IAo=1 | 57,2±21,3 |
| El Shedoudy et al.14 (2017; n=80) | PM con aneurisma=77Muscular=2Gerbode=1 | 5,3 (1,5-28)/17,2 (7,8-44) | 98,7 | 30,6 (26-39)/105 (86-130) | n=1 (1,3%) Hd | — | No | No | n=1 (1,3%) | n=2 (2,5%)al año | No | 36 |
| Shrestha et al.15 (2017; n=59) | PM=59 | 7,1 (0,8-28)/21,2 (6,4-93) | 97c | 22 (4,8-77,1)/60 (30-260)c | n=1 (1,4%) Qx | n=12 (9%) | No | No | — | n=10 (9,6%)c al año | IAo=1Qx | 12 |
| Solana-Gracia et al. (n=117) | PM=96Aneurisma=74Muscular=7Gerbode=6Residual quirúrgica=9 | 8,6 (0,4-69,2)/27,5 (5,8-97) | 89 | 34 (11,4-124)/133,5 (60-285) | n=7 (6,9%)Qx n=2Hd+Qx n=1Hd n=4 | n=24 (20,5%) | n=6 (5,8%)Qx=2 | No | n=3 (2,9%) | n=8 (grado ≥ leve)(7,7%) a 31 meses | IT=4IAo=2IM=1 | 31,4 (0,6-59,9) |
BAVp: bloqueo auriculoventricular permanente; BRDHH: bloqueo de rama derecha del haz de His; CIV: comunicación interventricular; DR: doble relacionada; Hd: hemodinámica; IAo: insuficiencia aórtica; IT: insuficiencia tricuspídea; PM: perimembranosa; Qx: cirugía.
El principal factor condicionante para conseguir una adecuada adaptación del dispositivo al tabique interventricular evitando el shunt residual y la interferencia con la válvula aórtica es la selección cuidadosa del tipo de defecto y el tamaño del coil. En este sentido, resulta fundamental la ETE, dado que aporta información detallada sobre el orificio hemodinámico: presencia de aberturas múltiples, características del posible tejido aneurismático circundante y relación con el anillo valvular aórtico. La valoración del orificio anatómico, en cambio, es más precisa mediante ventriculografía izquierda en eje largo (oblicua anterior izquierda a 60° más craneal a 20°). La elección del coil tiene la finalidad de «rellenar» la solución de continuidad generada por la CIV (especialmente si existe bolsón aneurismático) mientras se evita interferir con la válvula aórtica. La existencia de cortocircuito residual suele corresponder a una elección subóptima del tamaño del oclusor (generalmente infradimensionado) o a una conformación inadecuada de sus espiras en relación con el defecto anatómico. Conviene recordar que existe cierto grado de variabilidad aleatoria en su adaptación al tabique interventricular.
La existencia de shunt residual hace posible la aparición de hemolisis, sin que se pueda correlacionar la magnitud de aquel con el grado de esta. Por ello y según nuestra experiencia, recomendamos ser poco tolerantes con la presencia de cortocircuito residual, especialmente si es mayor que leve y de localización periprotésica. En esos casos, sería aconsejable intentar reacomodar el dispositivo sobre el defecto o cambiar a uno de tamaño superior. Si esto no fuera posible, habría que valorar la posibilidad de implantar in situ un segundo oclusor.
La aparición de hemolisis generalmente ocurre a partir de las 24 h y muy excepcionalmente transcurridas las primeras 2 semanas tras el implante. La primera medida terapéutica sería la hidratación del paciente y suspender la administración de ácido acetilsalicílico. En segunda línea, existiría la posibilidad de tratamiento percutáneo y, por último, el explante y cierre quirúrgico de la CIV.
Por otro lado, no se ha observado un fenómeno franco de curva de aprendizaje en el análisis de la experiencia por centros (los primeros procedimientos por lo general han sido tutorizados por un proctor) (tabla 3). El fracaso en el implante y la aparición de complicaciones se han relacionado más bien con el tipo de CIV y las características propias de los pacientes. Consideramos que la anatomía del defecto tipo síndrome de Laubry17 no es adecuada para realizar esta técnica, puesto que la estrecha relación del velo coronariano (generalmente derecho) con el defecto interfiere en la conformación del coil sobre este.
En esta serie se describe por primera vez la aparición de taquicardia ectópica de la unión tras el implante de este dispositivo. Su aparición fue subaguda y su evolución, benigna.
La gran ventaja es la drástica disminución de la tasa de BAV permanente/necesidad de implantar marcapasos, al no ejercer fuerza de pinzamiento en el tejido alrededor del defecto, a diferencia de los sistemas de doble disco autoexpandibles. En nuestra serie no hubo ningún caso y solo hay un paciente descrito en la literatura con esta complicación13.
Del mismo modo, no se hallaron casos de endocarditis infecciosa posimplante, que se ha descrito como una complicación excepcional27.
LimitacionesDada la metodología de nuestro estudio, se desconoce el número total real de pacientes candidatos a beneficiarse de este tratamiento y que, en cambio, se han sometido a otras opciones terapéuticas (percutáneas/quirúrgicas), lo cual imposibilita la comparación de resultados entre diferentes técnicas.
CONCLUSIONESLa singularidad y el escaso número de pacientes con cardiopatía congénita hacen necesaria la colaboración multiinstitucional para poder aportar resultados sobre la evolución de las técnicas de tratamiento tan específicas28,29. Este trabajo refleja que el NitOcclud Lê VSD Coil puede utilizarse con éxito para un amplio espectro anatómico de CIV sin que se produzcan alteraciones permanentes de la conducción AV. La incidencia de hemolisis es muy baja y no condiciona la indicación del procedimiento. Sin embargo, se debe minimizar la persistencia del cortocircuito residual y revisar periódicamente en su búsqueda a los pacientes que lo mantengan.
- –
El dispositivo NitOcclud Lê VSD Coil se introdujo en el año 2010 con un diseño novedoso y específico para el cierre de CIV.
- –
Surgió con la finalidad de minimizar la aparición de BAV (principal y fatídica complicación de los sistemas de doble disco empleados hasta aquel momento).
- –
Las series publicadas sobre su uso son limitadas en volumen y en tiempo de evolución.
- –
Destacan, no obstante, su seguridad y la disminución significativa de las alteraciones permanentes de la conducción AV.
- –
Sin embargo, conviene señalar el riesgo de hemolisis en pacientes con cortocircuito residual.
- –
Nuestro estudio recoge la experiencia nacional sobre esta técnica.
- –
Representa la serie de mayor volumen y variedad en cuanto a las características de los pacientes (peso <10 kg, n=12) y la naturaleza y la localización anatómica de las CIV.
- –
El cierre de CIV perimembranosas sin tejido aneurismático o CIV residuales posoperatorias es el que requiere de mayor complejidad técnica.
- –
Desaconsejamos realizar esta técnica en pacientes con síndrome de Laubry, por interferencia del velo aórtico prolapsado con el despliegue del coil.
- –
Recomendamos evitar la persistencia de cortocircuito residual cuando su grado es superior a leve o cuando se encuentra localizado entre el dispositivo y los márgenes de la CIV.
J.L. Zunzunegui Martínez y J.M. Velasco Bayón son proctors de PFM Medical.
Nuestro agradecimiento al Grupo de Trabajo de Hemodinámica Infantil de la Sociedad Española de Cardiología Infantil y Cardiopatías Congénitas.