En la práctica diaria, el clínico se enfrenta a preguntas con respecto a los beneficios y los riesgos comparativos entre las diversas intervenciones sanitarias disponibles para tratar a los pacientes. Cuando se realiza bien y se comunica de una manera completa, el ensayo clínico aleatorizado y controlado (y su revisión sistemática) es el diseño de mayor rigor científico para determinar si existe una relación causal entre una intervención y un resultado dado. El principal inconveniente del ensayo clínico es que por lo general suele centrarse en la comparación de no más de 2 o 3 alternativas a la vez (tratar frente a no tratar, tratar con una opción A frente a B y A frente a C, etc.). Para una toma de decisiones más informada, a menudo es necesario conocer la evidencia establecida sobre las múltiples alternativas disponibles en la práctica clínica, así como sintetizar cuantitativamente esta información para generar estimaciones sobre la efectividad y la seguridad comparadas. Idealmente, ello implicaría disponer de ensayos clínicos con tantas ramas de tratamiento como alternativas disponibles y que permitieran establecer diversas comparaciones de una opción A frente a B, B frente C, C frente a D, etc., y no solo si A es simplemente mejor (o no peor) que B. También sería conveniente guiar la toma de decisiones clínicas con base en revisiones sistemáticas y guías de práctica clínica que evaluaran rigurosamente la evidencia y expresaran claramente cuáles son las mejores elecciones para tratar a un paciente concreto. Sin embargo, en muchas ocasiones esta información está disponible solo parcialmente y/o con importantes incertidumbres al respecto.
La limitación de recursos y la necesidad de conocer en términos relativos los efectos beneficiosos o potencialmente perjudiciales de los múltiples tratamientos ha hecho que, conscientemente o no, la propiedad transitiva siempre esté presente en el razonamiento clínico a la hora de elegir un tratamiento, la planificación y el diseño de un nuevo ensayo clínico o, más recientemente, en el desarrollo de nuevos métodos de síntesis de la evidencia clínica que consideran comparaciones indirectas, como el metanálisis en red1–3.
En este editorial se presenta el concepto de transitividad ilustrándolo a través de ejemplos de ensayos clínicos publicados en los que se examinó el efecto de distintos tratamientos antihipertensivos para la prevención cardiovascular en pacientes de alto riesgo.
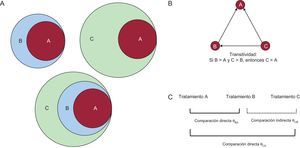
CONCEPTO DE TRANSITIVIDADBásicamente, se considera que una relación binaria sobre un conjunto de elementos es transitiva si cumple que «si un elemento se relaciona con otro y este segundo, con un tercero, el primero se relaciona con el tercero»4. De manera ilustrativa, esto se puede representar gráficamente mediante diagramas en que A se encuentra dentro B y B se encuentra dentro de C (figura 1A). Por lo tanto, la extensión de este razonamiento lógico lleva a plantear que, si en un ensayo clínico el tratamiento B es mejor que el tratamiento A y en otro el tratamiento C es mejor que B, es posible concluir que C será mejor que A (figura 2)5–8. Sin embargo, ¿esto es cierto siempre?
Propiedad transitiva. A: supuesto en el que se cumple la propiedad transitiva, es decir, el elemento A se relaciona con B (B > A), A se relaciona con C (C > A), C se relaciona con B (C > B). B: red en tríada (ciclo cerrado), en la que cada nodo es un tratamiento y cada línea indica la existencia de ensayos clínicos que comparan cada tratamiento directamente entre sí (comparación directa); se cumple la propiedad transitiva cuando el tratamiento B es mejor que A, el tratamiento C es mejor que B y el tratamiento C es mejor que A. C: dos comparaciones directas (B frente al comparador común A y C frente al comparador común A); asumiendo que se cumple la propiedad transitiva, se puede estimar indirectamente el efecto del tratamiento C frente a B.
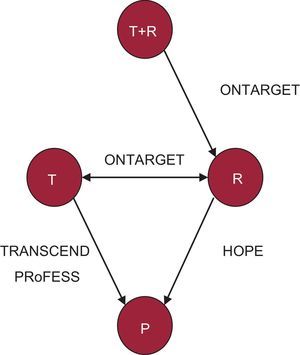
Red de comparaciones directas, compuesta por los ensayos HOPE, ONTARGET, TRANSCEND y PRoFESS5–8, en la que cada nodo es un tratamiento y cada línea indica la existencia de estudios que comparan cada tratamiento directamente entre sí (comparación directa). P: placebo; R: ramipril; T: telmisartán; T+R: combinación de telmisartán y ramipril.
Generalmente, se habla de comparación directa cuando la evaluación de 2 tratamientos los ha comparado el uno con el otro (p. ej., en un ensayo clínico o metanálisis) y de comparación indirecta cuando la evaluación entre 2 tratamientos no los ha comparado directamente pero se puede compararlos a través de un comparador común. Así, la transitividad puede formularse de una manera sencilla, de modo que una comparación indirecta entre tratamientos estima válidamente una comparación directa no observada. Aunque la transitividad no se puede probar estadísticamente, su plausibilidad se puede evaluar conceptualmente desde una perspectiva más clínica o epidemiológica cuando hay comparaciones directas entre los diferentes tratamientos que conforman un ciclo cerrado en una red de ensayos clínicos (figura 1B)3. Cuando no hay comparaciones directas, una de las hipótesis establecidas cuando se pretende calcular el efecto de C frente a B es que uno puede utilizar el conocimiento de C frente a B a través de un comparador común A (figura 1C). Esta aplicación del supuesto de transitividad permite decir que el comparador común A permite establecer una comparación válida entre los tratamientos. Sin embargo, es conveniente saber que se trata de un enfoque de naturaleza observacional. De hecho, aunque se utilicen ensayos clínicos controlados y aleatorizados para establecer cualquier comparación (directa o indirecta), la elección de las comparaciones en cada estudio no ha sido aleatorizada.
FACTORES QUE PUEDEN AFECTAR A LA PROPIEDAD TRANSITIVAEn epidemiología clínica, se suele utilizar el término interacción para describir una situación en la que dos o más factores modifican el efecto que cada cual tiene en la ocurrencia o la magnitud de un desenlace dado9. Este fenómeno también se conoce como modificación de efectos.
Para que se cumpla el supuesto de transitividad, no deben presentarse diferencias en relación con la distribución de factores modificadores del efecto entre los ensayos considerados. Por ejemplo, la violación de la propiedad transitiva puede producirse cuando se comparan tratamientos «antiguos» frente a alternativas terapéuticas más recientes debido a que puede haber variables no observadas que pueden diferir entre las comparaciones (p. ej., cambios en los tratamientos concomitantes utilizados a lo largo del tiempo, cambios en la gravedad de las poblaciones tratadas debido a cambios en los criterios diagnósticos o la práctica clínica, calidad de los estudios, etc.)3. En la tabla 1 se presenta un resumen con ejemplos de posibles factores modificadores del efecto en el ensayo clínico, distinguiendo aspectos relacionados con el paciente (población), la intervención, el comparador (o la alternativa) y el resultado (el acontecimiento o enfermedad que se quiere prevenir o tratar)10. Clínicos e investigadores pueden examinar la transitividad revisando cuidadosamente los aspectos metodológicos de los estudios y las características clínicas de las poblaciones de pacientes.
Resumen de posibles factores modificadores del efecto
| Niveles | Posibles factores modificadores del efecto |
| Paciente o población diana | • Edad• Sexo• Gravedad (riesgo basal)• Duración de la enfermedad• Comorbilidad(es)• No responde al tratamiento previo• Proveedor o ámbito* |
| Intervención y comparador | • Tipo de intervención (preventiva, terapéutica, etc.)• Dosis o intensidad• Duración• Vía de administración• Tratamientos concomitantes• Complejidad• Proveedor o ámbito* |
| Resultado | • Definición de la variable de resultado (outcome)• Herramientas para medir o monitorizar• Métodos y procedimientos• Duración del seguimiento |
*Proveedor (público o privado) o ámbito (atención primaria u hospitalaria).
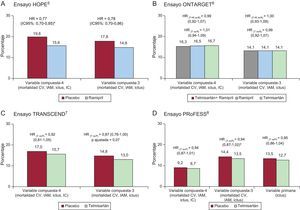
Durante la última década, se han publicado diversos ensayos clínicos en los que se ha examinado el efecto del bloqueo del sistema renina-angiotensina mediante bloqueo de la angiotensina II con inhibidores de la enzima de conversión de la angiotensina (IECA) o el bloqueo selectivo del receptor AT1 con antagonistas de los receptores de la angiotensina II (ARA–II) en la reducción de la morbilidad y la mortalidad cardiovasculares, más allá del impacto en las cifras de presión arterial. Concretamente, el ensayo ONTARGET6, que examinó los posibles beneficios del bloqueo dual con IECA y ARA–II en más de 25.000 pacientes (tabla 2), estableció que un ARA–II (telmisartán) era tan efectivo como un IECA (ramipril) en la reducción de la morbimortalidad cardiovascular de pacientes de alto riesgo. Específicamente, los resultados del seguimiento a 4,7 años mostraron un resultado de no inferioridad entre un ARA-II y un IECA en el objetivo primario combinado de mortalidad cardiovascular, infarto agudo de miocardio, ictus u hospitalización por insuficiencia cardiaca (hazard ratio [HR] = 1,01; intervalo de confianza del 95% [IC95%], 0,94-1,09; p = 0,83). En este mismo ensayo, combinar IECA y ARA-II no ofreció beneficio adicional respecto a la monoterapia con IECA (HR = 0,99; IC95%, 0,92-1,07; p = 0,38). La evaluación del efecto del ARA–II telmisartán se completó con otros dos estudios: TRANSCEND7 y PRoFESS8. El ensayo TRANSCEND examinó el efecto de un ARA–II respecto a placebo en la reducción de la morbimortalidad cardiovascular en casi 6.000 pacientes de alto riesgo con enfermedad coronaria, periférica, cerebrovascular o diabetes mellitus con afección de órganos diana, pero sin macroalbuminuria ni insuficiencia cardiaca, y con antecedentes de intolerancia a IECA (tabla 2). En el ensayo, tras un seguimiento de 4,7 años, no se observó un efecto significativo con un ARA-II (telmisartán) frente a placebo en el objetivo primario de mortalidad cardiovascular, infarto agudo de miocardio, ictus u hospitalización por insuficiencia cardiaca (HR = 0,92; IC95%, 0,81-1,05; p = 0,22). El objetivo secundario, que no incluía la hospitalización por insuficiencia cardiaca, tampoco mostró un claro efecto beneficioso (HR = 0,87; IC95%, 0,76-1,00; p ajustada por multiplicidad = 0,07). Según los autores de la publicación7, los pacientes tratados con placebo recibieron significativamente más diuréticos (el 40 frente al 34%; p < 0,0001) y antagonistas del calcio (el 46 frente al 38%; p < 0,0001) que los tratados con ARA–II. Por otro lado, el ensayo PRoFESS, llevado a cabo en más de 20.000 pacientes, comparó el ARA–II telmisartán frente a placebo, con el objetivo de examinar la reducción de la recurrencia de ictus (tabla 2). Tras un seguimiento de 2,5 años, no se observaron diferencias significativas entre grupos para la variable principal (HR = 0,95; IC95%, 0,86-1,04; p = 0,23). Tampoco se observaron diferencias significativas en la variable secundaria de mortalidad cardiovascular, infarto agudo de miocardio, ictus e insuficiencia cardiaca (HR = 0,94; IC95%, 0,87-1,01; p = 0,11) ni en la variable terciaria de mortalidad cardiovascular, infarto agudo de miocardio o ictus (HR = 0,94; IC95%, 0,87-1,02; p = 0,13).
Diseño de los ensayos HOPE, ONTARGET, TRANSCEND y PRoFESS5–8
| Principales características | HOPE5 | ONTARGET6 | TRANSCEND7 | PRoFESS8 |
| Periodo de ejecución (publicación) | 1993-1999 (2000) | 2001-2008 (2008) | 2001-2008 (2008) | 2003-2008 (2008) |
| Tamaño muestral | 9.297 pacientes | 25.620 pacientes | 5.926 pacientes | 20.332 pacientes |
| Pacientes o población diana | Pacientes de alto riesgo con enfermedad coronaria, periférica, cerebrovascular o DM y al menos otro factor de riesgo cardiovascular | Pacientes de alto riesgo con enfermedad coronaria, periférica, cerebrovascular o DM | Pacientes de alto riesgo con enfermedad coronaria, periférica, cerebrovascular o DM que no toleraran IECA | Pacientes que han sufrido recientemente un ictus isquémico (mediana, 15 días desde la aleatorización) que ya reciben tratamiento antihipertensivo y al menos tienen dos factores de riesgo cardiovascular |
| Exclusiones (selección de los principales) | Insuficiencia cardiaca, FEVI < 40%HTA tratada no controladaNefropatía manifiestaTratamiento con IECA o vitamina EAITIAM o ictus en 4 semanas previas | Insuficiencia cardiacaHTA no controlada tratadaEnfermedad vascular renalIntolerancia/hipersensibilidad a IECA o ARA-IIInsuficiencia hepáticaIctus hemorrágicoCirugía cardiaca programada en < 3 meses desde consentimiento informado | Insuficiencia cardiacaHTA no controlada tratadaEnfermedad vascular renalProteinuriaIntolerancia/hipersensibilidad a ARA-IIInsuficiencia hepáticaIctus hemorrágicoCirugía cardiaca programada en < 3 meses desde consentimiento informado | Ictus hemorrágicoHTA no controladaDiscapacidad grave después del ictusEnfermedad coronaria en 3 meses previosTratamiento con ARA-II, con anticoagulantes no permitidosDemenciaInsuficiencia renal o hepáticaÚlcera pépticaContraindicación |
| Intervención y comparador | R 10 mg/díaPlacebo | T 80 mg/díaR 10 mg/díaT 80 mg/día + R 10 mg/día | T 80 mg/díaPlacebo | T 80 mg/díaPlacebo |
| Seguimiento | 4,5 años | 4,7 años | 4,7 años | 2,5 años |
| Variables primarias | 1. Combinación de 3: mortalidad CV, IAM o ictus | 1. Combinación de 4: mortalidad CV, IAM, ictus u hospitalización por IC | 1. Combinación de 4: mortalidad CV, IAM, ictus u hospitalización por IC | 1. Ictus recurrente (cualquier tipo) |
| Variables secundarias | 2. Mortalidad por cualquier causa, necesidad de revascularización, hospitalización por IC o angina inestable, complicaciones de la DM3. Otras | 2. Combinación de 3: mortalidad CV, IAM o ictus (igual que HOPE)3. Otras | 2. Combinación de 3: mortalidad CV, IAM o ictus (igual que HOPE)3. Otras | 2. Combinación de 4: mortalidad CV, IAM, ictus o IC3. DM |
| Comparaciones (hipótesis) | Superioridad de R sobre P (R > P) | Superioridad de T+R sobre R (T+R > R)No inferioridad de T y R (T no < R) | Superioridad de T sobre P (T > P) | Superioridad de T sobre P (T > P) |
AIT: accidente isquémico transitorio; ARA-II: antagonista de los receptores de angiotensina II; CV: cardiovascular; DM: diabetes mellitus; FEVI: fracción de eyección del ventrículo izquierdo; HTA: hipertensión arterial; IAM: infarto agudo de miocardio; IC: insuficiencia cardiaca; IECA: inhibidor de la enzima de conversión de la angiotensina; P: placebo; R: ramipril; T: telmisartán.
Es importante destacar que algunos de estos datos parecen contradecir o no concuerdan con los de estudios previos como los del ensayo HOPE5 en los que se observó un claro beneficio del tratamiento antihipertensivo con IECA en la reducción de acontecimientos cardiovasculares (esquema de la red en la figura 2). Concretamente, en el ensayo HOPE se estableció el beneficio del bloqueo del sistema renina-angiotensina mediante un IECA (ramipril) respecto a placebo en pacientes de alto riesgo con enfermedad coronaria, periférica, cerebrovascular o diabetes mellitus y al menos otro factor de riesgo cardiovascular. Los resultados del seguimiento a más de 4 años mostraron un resultado de superioridad de un IECA (ramipril) respecto a placebo en el objetivo primario combinado de mortalidad cardiovascular, infarto agudo de miocardio e ictus (HR = 0,78; IC95%, 0,70-0,86; p < 0,001).
A modo de resumen, en las tablas 2 y 3 se presentan las características de los estudios y de los pacientes en cada uno de los ensayos comentados. En la figura 3 se presenta un resumen de los principales resultados observados en los diferentes ensayos5–8,11.
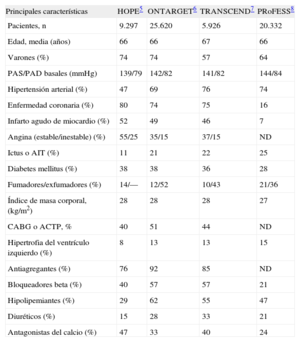
Cabe señalar que hasta la publicación del ensayo ONTARGET no se disponía de datos comparativos entre ARA–II e IECA en pacientes de alto riesgo cardiovascular más allá de la insuficiencia cardiaca. Cuando se comparan las poblaciones incluidas en los ensayos ONTARGET, TRANSCEND y PRoFESS con las del ensayo HOPE, parece que los pacientes presentaban mayor prevalencia de hipertensión, ictus e hipertrofia del ventrículo izquierdo (tabla 3). En todos estos ensayos destaca que las cifras de presión arterial reflejan que los pacientes estaban relativamente bien controlados, y además la mayoría de los pacientes estaban recibiendo tratamientos efectivos como antiagregantes, hipolipemiantes (estatinas) y bloqueadores beta (tabla 3). De hecho, los pacientes incluidos en el ensayo HOPE recibieron estatinas en un porcentaje inferior probablemente por el momento en que se realizó el estudio. Por otra parte, cuando se comparan los resultados del ensayo ONTARGET con los del HOPE (figura 3), puede argumentarse que los pacientes de alto riesgo con enfermedad coronaria que ya han sido revascularizados (más del 40% de los pacientes en los ensayos HOPE, ONTARGET y TRANSCEND) y siguen un tratamiento con antiagregantes y estatinas no presentan mal pronóstico, por lo que puede resultar difícil obtener un claro beneficio clínico adicional tras la introducción de un nuevo tratamiento12. Por otro lado, observar la ocurrencia de los acontecimientos cardiovasculares en el grupo control (riesgo basal) y en el grupo de intervención en cada ensayo puede orientar de modo general sobre el posible impacto de las características de los estudios y los pacientes en los resultados de interés (figura 3).
Características basales de los pacientes y tratamientos en los ensayos de los ejemplos
| Principales características | HOPE5 | ONTARGET6 | TRANSCEND7 | PRoFESS8 |
| Pacientes, n | 9.297 | 25.620 | 5.926 | 20.332 |
| Edad, media (años) | 66 | 66 | 67 | 66 |
| Varones (%) | 74 | 74 | 57 | 64 |
| PAS/PAD basales (mmHg) | 139/79 | 142/82 | 141/82 | 144/84 |
| Hipertensión arterial (%) | 47 | 69 | 76 | 74 |
| Enfermedad coronaria (%) | 80 | 74 | 75 | 16 |
| Infarto agudo de miocardio (%) | 52 | 49 | 46 | 7 |
| Angina (estable/inestable) (%) | 55/25 | 35/15 | 37/15 | ND |
| Ictus o AIT (%) | 11 | 21 | 22 | 25 |
| Diabetes mellitus (%) | 38 | 38 | 36 | 28 |
| Fumadores/exfumadores (%) | 14/— | 12/52 | 10/43 | 21/36 |
| Índice de masa corporal, (kg/m2) | 28 | 28 | 28 | 27 |
| CABG o ACTP, % | 40 | 51 | 44 | ND |
| Hipertrofia del ventrículo izquierdo (%) | 8 | 13 | 13 | 15 |
| Antiagregantes (%) | 76 | 92 | 85 | ND |
| Bloqueadores beta (%) | 40 | 57 | 57 | 21 |
| Hipolipemiantes (%) | 29 | 62 | 55 | 47 |
| Diuréticos (%) | 15 | 28 | 33 | 21 |
| Antagonistas del calcio (%) | 47 | 33 | 40 | 24 |
ACTP: angioplastia coronaria percutánea; AIT: accidente isquémico transitorio; CABG: cirugía de bypass coronario; FEVI: fracción de eyección del ventrículo izquierdo; ND: no disponible; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
En el ensayo HOPE, el 16% de los pacientes requirió un inhibidor de la enzima de conversión de la angiotensina no cegado (abierto) además del tratamiento objeto del estudio. En el ensayo PRoFESS, se trató al 37% de los pacientes con un inhibidor de la enzima de conversión de la angiotensina (bloqueo dual) además del tratamiento objeto del estudio.
La interpretación de los resultados de un ensayo clínico (y su posterior utilización para establecer una comparación indirecta informal o en un metanálisis) puede resultar compleja si no se consideran y se valoran críticamente aspectos relacionados con las características del estudio y de los pacientes que pueden actuar como factores modificadores del efecto. En el ejemplo presentado, a partir de grandes ensayos clínicos publicados, si se consideran los resultados de un ensayo clínico de C (ARA-II) frente a B (el IECA), los resultados de un ensayo clínico de A (placebo) frente a B (IECA) no garantizaría la correcta inferencia de los ensayos clínicos de A (placebo) frente a C (ARA-II), ya que la transitividad no se cumple. No es de extrañar que la heterogeneidad13 se siga percibiendo como un problema que se debe tratar de controlar y explicar. Al mismo tiempo, la realidad de la práctica clínica es que se realiza sobre poblaciones diversas con características demográficas, clínicas y epidemiológicas que difieren entre sí. Las complejidades que resultan de esta situación deben ser aceptadas para asegurar que la investigación clínica alcanza el mayor impacto clínico posible14. Por la misma razón, con la información disponible en cada momento se debe tratar de diseñar estudios rigurosos que evalúen exhaustivamente los efectos de diversas intervenciones o tratamientos que compiten entre sí para la misma indicación clínica, no solo para comprobar si uno de ellos es en general superior o no inferior que los demás, sino también explorar qué pacientes pueden ser candidatos a un tratamiento o si un tratamiento puede ser mejor en diferentes subgrupos de pacientes.
Cabe reconocer que las comparaciones indirectas de tratamientos basadas en ensayos clínicos individuales pueden conllevar importantes sesgos de selección que cuestionen seriamente la validez de los resultados obtenidos. De hecho, cualquier comparación indirecta entre tratamientos siempre debería establecerse en el marco de revisiones sistemáticas y metanálisis rigurosos teniendo en cuenta una «red completa» de estudios que garanticen su calidad. Además, una de las ventajas de las revisiones sistemáticas es que permiten determinar y cuantificar posibles fuentes de variabilidad en los resultados de los estudios. Para ello, en una primera etapa es importante que el clínico o investigador realice un análisis cualitativo de las características del estudio y de los pacientes, con especial énfasis en aquellas que puedan actuar como factores modificadores del efecto. Como se ha comentado anteriormente, las características del estudio y de los pacientes pueden influir en los resultados. Concretamente, el efecto o la respuesta en el grupo control (riesgo basal) puede captar el impacto de algunas de estas características en los resultados de interés. Por ejemplo, si un tratamiento solo funciona en pacientes que toleran o responden a un tratamiento previo (respondedores) y no en aquellos que no responden (refractarios o resistentes), un ensayo entre los respondedores demostrará un efecto positivo del tratamiento en relación con el control (placebo), mientras que un ensayo solo entre los refractarios o resistentes no lo hará. Otro ejemplo, si el resultado de interés (mejora en mortalidad cardiovascular, infarto de miocardio o ictus) es superior para un tratamiento en un ensayo realizado hace una década, es posible que, debido a las diferencias en la práctica clínica (p. ej., mayor intensidad, uso de otras terapias concomitantes, etc.) o los diseños, el periodo de realización del estudio pueda actuar como otro factor modificador del efecto.
Por último, las tablas de evidencia con las características basales y los criterios de inclusión de los pacientes en cada estudio pueden proporcionar información relevante para valorar críticamente aspectos que puedan afectar a la propiedad transitiva. Para ello, el lector debe basarse en su experiencia, en el conocimiento de la enfermedad de interés, de los tratamientos evaluados y de los diseños de los estudios de los que se parte. Actualmente se están desarrollando y aplicando análisis que utilizan técnicas sofisticadas que permiten tener en cuenta algunos de estos factores1–3. Algunas de estas técnicas permiten establecer comparaciones indirectas ajustando los efectos de los tratamientos con diversos factores que pueden actuar como modificadores del efecto, lo que podría reducir potenciales fuentes de sesgos. Como alternativa no exenta de limitaciones, se puede utilizar la respuesta en el grupo control (riesgo basal) o el año de estudio como variable de ajuste en los modelos de análisis15,16. Sin embargo, estas metodologías siempre deben apoyarse en valoraciones exhaustivas y basadas en fundamentos clínico-epidemiológicos.
FINANCIACIÓNLos Dres. Hutton y Moher han recibido financiación por CIHR/DSEN (Canadian Institutes of Health Research/Drug Safety and Effectiveness Network). El Dr. Moher ha recibido financiación de la Cátedra de Investigación de la Universidad de Ottawa, Canadá.
1CONFLICTO DE INTERESESNinguno.
Full English text available from: www.revespcardiol.org/en
Las opiniones expresadas en este editorial son responsabilidad de los autores, y no reflejan necesariamente el punto de vista de los organismos en los que trabajan.