La pandemia producida por la infección del nuevo coronavirus SARS-CoV-2, que da lugar a una enfermedad altamente contagiosa (COVID-19), ha producido un colapso de los sistemas sanitarios de todo el mundo. Se ha descrito que estos pacientes sufren un estado inflamatorio que condiciona un alto riesgo trombótico. Sin embargo, apenas hay información sobre cómo abordar el riesgo trombótico, la coagulopatía y el tratamiento anticoagulante de estos pacientes. Por otra parte, incluso los pacientes no infectados por COVID-19 sufren una tremenda influencia en su abordaje habitual por la situación sanitaria actual. El objetivo del presente documento, elaborado por el Grupo de Trabajo de Trombosis Cardiovascular de la Sociedad Española de Cardiología, es presentar la información disponible y dar unas pautas sencillas de tratamiento con fármacos antitrombóticos.
Palabras clave
La pandemia producida por la infección del nuevo coronavirus (severe acute respiratory syndrome coronavirus-2 [SARS-CoV-2]), que produce un grave síndrome respiratorio (coronavirus infectious disease-19 [COVID-19]), se ha extendido por todos los países. El espectro de la enfermedad es muy amplio, desde pacientes asintomáticos o con síntomas leves respiratorios a una neumonía viral grave, insuficiencia respiratoria, disnea, fracaso multiorgánico y muerte1. Se ha descrito que estos pacientes sufren un estado inflamatorio que condiciona un alto riesgo trombótico. Los fármacos utilizados en el tratamiento de la infección viral y sus complicaciones producen interacciones con otros tratamientos, en particular con los fármacos antitrombóticos, lo que dificulta su prescripción y conlleva dudas inherentes a la actuación en la práctica clínica diaria. Sin embargo, apenas hay información sobre cómo abordar el riesgo trombótico, la coagulopatía y el tratamiento anticoagulante de estos pacientes.
Debemos destacar que es una enfermedad altamente contagiosa que ha producido un colapso de los sistemas sanitarios de todo el mundo. Recientemente se ha observado una reducción importante de la actividad asistencial durante la epidemia de COVID-19 en nuestro país, y en especial una gran disminución en el número de pacientes tratados mediante angioplastia primaria2. El retraso en la solicitud de atención médica, así como la dificultad en el traslado, y la atención en muchas ocasiones en hospitales colapsados probablemente tengan una repercusión pronóstica, con un riesgo de que se incremente la morbimortalidad. También se están viendo afectados los servicios de atención primaria y las consultas ambulatorias por especialistas. Por ello, incluso los pacientes no infectados por SARS-CoV-2 están sufriendo el efecto de la pandemia, lo que condiciona una gran influencia en la optimización del tratamiento antitrombótico por la situación sanitaria actual.
El objetivo del presente documento, elaborado por el Grupo de Trabajo de Trombosis Cardiovascular de la Sociedad Española de Cardiología, es presentar la información disponible y dar unas pautas sencillas de uso de los fármacos antitrombóticos, para garantizar una atención óptima tanto a los pacientes infectados por el virus SARS-CoV-2 como a los no infectados cuyo abordaje, sin embargo, puede verse influido por la situación actual.
MECANISMOS QUE PARTICIPAN EN EL ESTADO PROTROMBÓTICO DE LA INFECCIÓN POR SARS-COV-2La mayoría de los pacientes afectados por SARS-CoV-2 sufren un cuadro seudogripal con síntomas leves como fiebre, tos y cierto grado de disnea; sin embargo, en un bajo porcentaje de pacientes se desarrolla un cuadro neumónico que, en algunos de los casos, acaba por producir un síndrome de distrés respiratorio, shock séptico, acidosis metabólica y una coagulopatía que puede desembocar en un cuadro que comparte algunas características con la coagulación intravascular diseminada (CID) y el fracaso multiorgánico3.
En pacientes con shock séptico, el desarrollo de una coagulopatía generalmente suele implicar peor pronóstico, y en el caso concreto que nos compete, varias publicaciones de series de pacientes afectados por COVID-19 así lo han corroborado. Así, se ha descrito en estos pacientes una elevación del dímero D, que se asocia con un peor pronóstico e incluso predice la mortalidad4,5. Por lo tanto, se debe tener en cuenta una elevación de 2-3 veces el valor normal, incluso en presencia de síntomas leves6,7. Junto a ello, se ha detectado un discreto alargamiento del tiempo de protrombina en los pacientes con síntomas graves. Por otro lado, la trombocitopenia, que se considera un indicador de mortalidad por sepsis, no se suele hallar en estos pacientes, aunque su presencia es un indicador claro de mal pronóstico y multiplica por 5 el riesgo de que la enfermedad sea grave8. En el estudio de Tang et al., el 71% de los pacientes fallecidos cumplirían los criterios de la International Society of Thrombosis and Haemostasis (ISTH) de una CID5.
La fisiopatología de la coagulopatía es compleja y obedece a la interrelación entre elementos celulares y plasmáticos del sistema hemostático con componentes de la respuesta inmunitaria innata. La respuesta del huésped a la infección da lugar a la activación de los componentes celulares del sistema inmunitario e induce la producción de citocinas junto con la expresión de factor tisular9. El aumento de citocinas puede ser la causa de la inflamación pulmonar y el deterioro del intercambio gaseoso, que a su vez estimularía la fibrinolisis pulmonar y produciría el incremento del dímero D10. Además, el aumento de la expresión de factor tisular es un importante activador del sistema hemostático. Finalmente, la activación del endotelio, las plaquetas y otros elementos leucocitarios también van a producir un desequilibrio en la producción de trombina, con el consiguiente depósito de fibrina que produce una microangiopatía y daño tisular11.
Por otra parte, es lógico pensar que los pacientes hospitalizados por COVID-19 presenten un aumento del riesgo de enfermedad tromboembólica venosa (ETEV), especialmente los ingresados en una unidad de cuidados intensivos. Estos pacientes presentan una reducción del flujo venoso debido al prolongado reposo en cama, los cambios protrombóticos y un daño endotelial posiblemente secundario a la unión del virus al receptor de la enzima de conversión de la angiotensina II, con lo cual se cumplen los 3 brazos de la tríada de Virchow12. Por lo tanto, estos pacientes son candidatos a recibir tromboprofilaxis con heparina de bajo peso molecular (HBPM) y/o medios físicos, en función del riesgo hemorrágico.
La ISTH propone la determinación y la monitorización de 4 parámetros: dímero D, tiempo de protrombina, cifra de plaquetas y fibrinógeno, para estratificar a los pacientes e identificar a aquellos con mal pronóstico, con objeto de someterlos a una monitorización más intensiva e incluso modificar su tratamiento. Es interesante que se considere que las hemorragias no son infrecuentes en estos pacientes, y en caso de que se produzcan, el tratamiento debe ser sustitutivo y mantener cifras de plaquetas> 50× 109/l, el fibrinógeno> 2 g/l y un cociente del tiempo de protrombina< 1,57.
INTERACCIONES ENTRE FÁRMACOS ANTITROMBÓTICOS Y FÁRMACOS PARA TRATAR LA COVID-19Aunque actualmente no se dispone de tratamientos específicos contra el SARS-CoV-2, una serie de fármacos se encuentran en investigación y, de hecho, tienen uso compasivo en la práctica clínica13. La tabla 1 resume las interacciones de los fármacos antitrombóticos con los principales tratamientos utilizados contra el SARS-Cov-2.
Interacciones farmacológicas entre fármacos antitrombóticos y fármacos utilizados contra la COVID-19*,**
Los fármacos antirretrovirales como lopinavir/ritonavir son potentes inhibidores del citocromo CYP3A4, por lo que pueden aumentar la concentración de los anticoagulantes orales de acción directa (ACOD), fundamentalmente rivaroxabán y apixabán, así como de ticagrelor, lo que desaconseja su uso14. El uso concomitante con dabigatrán, edoxabán y fármacos antagonistas de la vitamina K (AVK) exige precaución. Algunos estudios han observado que las concentraciones del metabolito activo del clopidogrel pueden verse reducidas en pacientes con tratamiento antirretroviral concomitante15. Otro antirretroviral, danuravir/cobicistat, también potente inhibidor del citocromo CYP3A4, es además inhibidor de la glucoproteína G, y por ello se recomienda no combinarlo con ninguno de los ACOD ni con ticagrelor. Dado que el metabolismo de los antiagregantes intravenosos es independiente de la función hepática, no habría problemas para su uso. Los datos preliminares con remdesivir y con fármacos inmunomoduladores no muestran interacciones significativas.
La cloroquina y la hidroxicloroquina son inhibidores moderados del CYP2D6 y de la glucoproteína G. La interacción con el apixabán y el rivaroxabán es muy leve, pero debe tenerse precaución en su concomitancia con el dabigatrán y el edoxabán16. Por último, la metilprednisolona puede interactuar con los AVK, por lo que se desaconseja prescribirla con ellos.
TRATAMIENTO ANTICOAGULANTE PARA PACIENTES INGRESADOS CON COVID-19Los pacientes que sufren una infección por SARS-CoV-2 tienen un aumento del riesgo de eventos tromboembólicos, especialmente ETEV, relacionado con la situación crítica y de inmovilización que conlleva esta entidad. Dichos pacientes en situación crítica presentan un aumento del riesgo tromboembólico, por lo que las estrategias de prevención efectiva de la ETEV son cruciales17. Estudios realizados en la población de Wuhan mostraron una alta incidencia de ETEV (de hasta el 20% de los pacientes ingresados en las unidades de cuidados intensivos) asociada con una elevada mortalidad18,19. Sin embargo, las estrategias óptimas de anticoagulación profiláctica y terapéutica durante el ingreso hospitalario no están claramente establecidas20.
Los estudios de Thachil et al.7 proponen que se debe considerar dosis profilácticas de HBPM para todos los pacientes que precisen ingreso hospitalario, en ausencia de contraindicaciones (como hemorragia activa o recuento plaquetario <25×109/l), con ajuste de dosis para los pacientes con elevación franca de dímero D y aquellos que presentan criterios de gravedad. Estudios derivados del SARS concluyen que el tratamiento inicial con HBPM reduce la mortalidad un 48% a los 7 días y un 37% a los 28 días y logra una mejoría significativa del cociente presión arterial de oxígeno/fracción inspirada de O2 (PaO2/FiO2) al mitigar la formación de microtrombos y la coagulopatía pulmonar asociada21. Además, en estudios de pacientes críticos, el uso de HBPM disminuyó la afección inflamatoria22. Por ello, los estudios derivados del COVID-19 utilizan en todos los casos HBPM durante el ingreso en dosis profilácticas (enoxaparina 40-60mg/día) durante al menos 7 días. El uso de HBPM reduce la generación de trombina y la aparición de un evento tromboembólico venoso (ya sea una trombosis venosa profunda y/o una tromboembolia pulmonar). Además, es conocido que tiene propiedades antiinflamatorias, lo cual puede ayudar en el control de esta enfermedad, en la que se produce un marcado aumento de citocinas proinflamatorias. Con base en la relación bidireccional entre la inflamación y la trombosis o «inmunotrombosis», el bloqueo de la trombina por la HBPM puede amortiguar la respuesta inflamatoria23 y reducir el daño endotelial24. Tang et al.25, en un reciente estudio con 449 pacientes, observaron una reducción de la mortalidad con la HBPM en los pacientes que adquirían criterios de CID o elevación de dímero D> 6 veces el límite superior de la normalidad. Liny et al.26 observaron que los pacientes en que aumentaba el dímero D> 4 veces el límite superior de la normalidad con criterios de CID presentaban cambios isquémicos distales, por lo que proponían una pauta de HBPM de 100 UI/kg/12 h durante 5 días26.
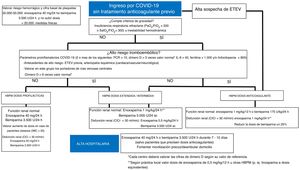
En la figura 1 se propone un algoritmo de abordaje de estos pacientes. El primer paso del algoritmo es prescribir HBPM a todos los pacientes que precisen ingreso hospitalario, con dosis ajustadas al peso para los pacientes con índice de masa corporal> 35 y tras valorar el riesgo hemorrágico y la cifra basal de plaquetas. Asimismo se debe evaluar el riesgo tromboembólico del paciente y la gravedad de la enfermedad por COVID-19, con lo que se pautará una dosis de HBPM intermedia/extendida o terapéutica; sin embargo, no hay evidencia al respecto, ya que la serie que comunica una reducción de la mortalidad con la HBPM utilizó dosis intermedias24. Se propone también monitorizar los parámetros proinflamatorios y hemostáticos cada 24-48h (dependiendo de la gravedad clínica del paciente), según los cuales se revaluará el riesgo del paciente y, por consiguiente, la dosis de HBPM. Cuando los pacientes estén en una situación de estabilidad que permita su alta hospitalaria, muchas veces pasarán también una importante fase de convalecencia en domicilio, que puede aumentar los eventos tromboembólicos y la mortalidad que esa inmovilización conlleva, por lo que se considera prudente prolongar el uso de la HBPM en dosis profilácticas durante 7-10 días tras el alta. Si se establece el diagnóstico de ETEV, se debe administrar HBPM a dosis terapéuticas; podría ser interesante una determinación de anti-Xa a las 48 h del inicio de la anticoagulación, para asegurar la eficacia y minimizar el riesgo hemorrágico.
Abordaje antitrombótico de los pacientes ingresados por COVID-19 sin tratamiento anticoagulante previo. ClCr: aclaramiento de creatinina. ETEV: enfermedad tromboembólica venosa; HBPM: heparina bajo peso molecular; IL-6: interleucina 6; IMC: índice de masa corporal; PCR: proteína C reactiva.
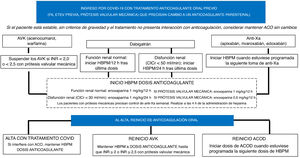
Los pacientes con indicación de anticoagulación previa a la infección por SARS-CoV-2 suelen tener fibrilación auricular o ETEV y ser portadores de una prótesis valvular mecánica. En la figura 2 se presenta un algoritmo de abordaje de los pacientes con anticoagulación oral previa ingresados por infección por COVID-19, en el que se propone el cambio a anticoagulación parenteral (fundamentalmente por la situación de gravedad o por interacciones medicamentosas con fármacos para tratar la COVID-19). No hay evidencia clara sobre el mantenimiento de la anticoagulación oral de los pacientes que ingresan por infección por SARS-CoV-2, aunque a priori se podría mantener en los pacientes estables y que no toman ningún fármaco potencialmente causante de una interacción. Por todo ello, se debe valorar detenidamente las interacciones posibles y la gravedad del paciente, para proceder según los diferentes algoritmos al cambio de anticoagulación oral a HBPM en dosis anticoagulantes, y así minimizar los eventos tromboembólicos y hemorrágicos de un tratamiento puente incorrecto. Dicho cambio deberá hacerse también cuando concluya el tratamiento antiviral y sea posible administrar de nuevo la anticoagulación oral.
Abordaje antitrombótico de los pacientes ingresados por COVID-19 con tratamiento anticoagulante previo. ACO: anticoagulación oral; ACOD: anticoagulante oral de acción directa; AVK: antagonistas de la vitamina K; ClCr: aclaramiento de creatinina; ETEV: enfermedad tromboembólica venosa; FA: fibrilación auricular; HBPM: heparina bajo peso molecular; INR: razón internacional normalizada.
Durante la pandemia actual debida a la infección por SARS-CoV-2, se ha reducido claramente el abordaje invasivo de los pacientes con un síndrome coronario agudo, y desde las sociedades científicas se recomienda demorar los procedimientos no urgentes con la intención de evitar contagios y prevenir el colapso del sistema sanitario27. Además, en pacientes con infarto agudo de miocardio con elevación del segmento ST, pese a que la angioplastia primaria es la estrategia de reperfusión preferida, se puede considerar la fibrinolisis para los pacientes con un tiempo estimado desde el diagnóstico a la intervención coronaria> 120min, o los pacientes infectados con mala situación clínica que dificulte el traslado o que tengan bajo riesgo hemorrágico y síntomas de evolución <3 h27. Pese a estas consideraciones, evidentemente continúa existiendo un número relevante de pacientes, con o sin infección por SARS-CoV-2, que ingresan tras un síndrome coronario agudo y se someten a intervención coronaria.
En los pacientes no infectados, las indicaciones sobre el tratamiento antiagregante deben continuar siendo las habituales recomendadas en las actuales guías de práctica clínica28,29. Sin embargo, en los pacientes con infección por SARS-CoV-2 existen 2 factores que pueden llevar a que se plantee la modificación de la estrategia de tratamiento antiagregante. Por un lado, el elevado componente inflamatorio y protrombótico que al parecer tiene esta infección y, por otro, las potenciales interacciones medicamentosas entre los fármacos que se están utilizando para el tratamiento específico de la enfermedad y los agentes antiagregantes.
Como se ha comentado en el apartado previo, se ha comunicado la interacción (en el CYP3A4) de algunos de los fármacos utilizados para el tratamiento antiviral (particularmente lopinavir/ritonavir y darunavir/cobicistat) con clopidogrel (que reduce la formación de su metabolito activo y, por lo tanto, su eficacia antiagregante) y ticagrelor (que aumenta su concentración y, por ende, su eficacia antiagregante). De hecho, estas combinaciones de fármacos están contraindicadas. Por ello se ha llegado a proponer la utilización preferente de prasugrel para estos pacientes, aunque se debe matizar este aspecto. Actualmente la eficacia de estos fármacos antivirales está en controversia30 y, por consiguiente, parece razonable individualizar la necesidad de mantenerlos si ello implica cambiar la estrategia antiagregante que se aplicaría habitualmente, lo que podría conllevar, por ejemplo, un aumento del riesgo hemorrágico de los pacientes que normalmente tendrían prescrito el clopidogrel (por el balance entre riesgo isquémico y hemorrágico) si se decide usar por sistema el prasugrel. Si se considera imprescindible emplear alguno de los tratamientos antivirales que condicionan una interacción con clopidogrel o ticagrelor, entonces sí sería razonable prescribir prasugrel durante el tiempo que se administren dichos fármacos, aunque siempre hay que tener presentes las contraindicaciones (ictus previo) y las precauciones (edad> 75 años, peso <60kg, antecedente de hemorragia). Después, una vez se suspendan los mencionados antivirales (depende de los protocolos locales, pero se suele pautar pocos días y no más de 1-2 semanas) y el riesgo de interacción farmacológica desaparezca, lo razonable sería proceder al cambio del antagonista del P2Y12, caso de ser preciso, por el que se hubiera seleccionado en circunstancias normales31. Cabe recordar que dicho cambio, si es en la fase aguda de un evento, se debe realizar administrando dosis de carga del fármaco28.
Es interesante comentar también que, en caso de un síndrome coronario agudo con una gran carga trombótica (situación que puede darse en el contexto de una infección con gran potencial inflamatorio y protrombótico), se puede plantear perfectamente el uso de antiagregantes parenterales potentes como los inhibidores de la glucoproteína IIb/IIIa o cangrelor, este último particularmente si no ha habido un pretratamiento adecuado con inhibidores orales del receptor P2Y12, aunque siempre teniendo en cuenta el balance entre riesgo y beneficio. Estos fármacos antiagregantes parenterales no presentan interacciones farmacológicas con los fármacos empleados actualmente para el tratamiento de la infección por COVID-19.
TRATAMIENTO ANTITROMBÓTICO PARA PACIENTES NO INFECTADOS POR COVID-19El tratamiento antiagregante para el paciente no infectado por COVID-19 no ha sufrido modificación alguna ni debería sufrirla. Las indicaciones son las mismas que antes de la pandemia, si bien lo que cambia es la forma de estar conectados a nuestros pacientes y que las indicaciones y modificaciones del tratamiento que estos requieran pueden hacerse de manera menos presencial. Hay que distinguir entre nuevas indicaciones de antiagregación y prolongaciones de tratamiento. La pandemia actual ha llevado a la cancelación de la mayoría de los procedimientos electivos y a recomendar un tratamiento conservador de los pacientes crónicos.
Para el paciente diagnosticado de angina estable que no requiere tratamiento invasivo, el ácido acetilsalicílico (AAS) es el fármaco antitrombótico electivo. Y para quienes la revascularización percutánea sea la opción, la doble antiagregación con AAS y clopidogrel debe ser lo indicado. Por otra parte, el síndrome coronario agudo debe abordarse mediante cateterismo y alta precoz para reducir la posibilidad de contagio en entornos con alta prevalencia de infección por COVID-19, como es el hospital27. El tratamiento antiagregante de este paciente negativo a COVID-19 no debe variar. Se debe indicar la doble antiagregación con AAS y un inhibidor del P2Y12, priorizando prasugrel y ticagrelor sobre clopidogrel.
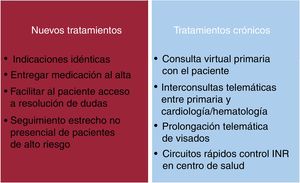
Se debe implementar medidas destinadas a que el paciente no deje de disponer de los fármacos pautados (figura 3) y tener en cuenta que la situación de pandemia puede motivar retrasos en la firma de visados, problemas para salir a la farmacias, farmacias saturadas y falta de suministros. Todo esto en un momento en el que se debe recomendar a nuestros pacientes que no acudan al hospital o los centros sanitarios salvo por causa grave. Para los pacientes estables con negatividad a COVID-19, cualquier modificación del tratamiento antiagregante debe estar determinada por los riesgos isquémico y hemorrágico. Por lo tanto, se debe promover actuaciones dirigidas a evitar la presencia física del paciente en cualquier tipo de recinto sanitario con el objeto de reducir el riesgo de infección.
Salvo que este paciente ingresara para un procedimiento invasivo y/o quirúrgico, no hay motivos para suspender el tratamiento anticoagulante oral. La suspensión por dichos motivos debe hacerse siguiendo las recomendaciones del documento de la Sociedad Española de Cardiología sobre tratamiento antitrombótico y procedimientos invasivos32.
Con vistas al abordaje al alta de los pacientes anticoagulados, el paciente continuará con su tratamiento habitual. Si se le hubiera retirado el tratamiento anticoagulante durante el ingreso, en el informe de alta debe consignarse con precisión las instrucciones para su reintroducción. Durante el periodo de alarma, el gobierno debería prolongar el visado de los ACOD y se debe favorecer la interconsulta no presencial de los médicos de familia con hematología y cardiología para resolución de cuestiones, ajustes de dosis o reintroducción del tratamiento en caso de proceso quirúrgico.
En el caso del tratamiento con AVK, la situación es más compleja. Durante el ingreso hospitalario, si no hay un proceso quirúrgico/invasivo o interacciones farmacológicas importantes, el paciente seguirá con dicho tratamiento, sin terapia puente, con control de la razón normalizada internacional (INR) cada 4-5 días según sea necesario. Muchos pacientes que toman AVK se suelen desajustar durante el ingreso hospitalario, lo cual requiere un seguimiento estrecho de la INR al alta. El espaciamiento de los controles a 7-8 semanas solo debe considerarse para pacientes con buen control terapéutico. Para minimizar la necesidad de controles en la actual situación, si el paciente es subsidiario de tratamiento con ACOD, se debe favorecer el cambio durante el ingreso, con lo que se evitará el desplazamiento al centro de salud para controles sucesivos tras el alta. Distintas consejerías de salud de algunas comunidades autónomas (Andalucía, Comunidad de Madrid, Región de Murcia, Comunidad Valenciana, etc.) han aprobado el inicio de la anticoagulación con ACOD para los pacientes con reciente diagnóstico de fibrilación auricular para evitar los controles necesarios y frecuentes en el inicio del tratamiento con AVK. El gobierno debería favorecer la ampliación de indicaciones financiadas para los ACOD, así como la prolongación de los visados. Es necesario subrayar la importancia de una relación estrecha entre atención primaria y hematología/cardiología.
En caso de la ETEV (si este fuera el motivo de ingreso), el paciente seguirá con HBPM hasta finalizar el periodo de confinamiento. Si el tratamiento anticoagulante por tromboembolia venosa era previo al ingreso y el paciente tenía buen control terapéutico, se debe hacer un control de la INR previo al alta con objeto de retrasar lo máximo posible el siguiente control. En caso de mal control terapéutico, el paciente pasará a HBPM. Hay que recordar que hoy en día el Sistema Nacional de Salud no financia los ACOD para tratar la ETEV.
Un tipo de pacientes a quienes se debe prestar especial atención en estas circunstancias son aquellos con prótesis valvulares mecánicas, ya que son especialmente vulnerables. El cambio a HBPM solo debería hacerse durante periodos cortos33. En estos pacientes, el centro de salud debería asegurar un circuito específico para que el control de la INR fuera lo más rápido posible y el paciente se llevara su pauta de tratamiento en la misma visita. Otra opción es que el paciente pueda recibir la pauta de tratamiento anticoagulante por vía telemática. Si se opta por cambiar el AVK por HBPM, hay que recordar que es una indicación fuera de ficha técnica y que la administración debe ser cada 12h con control anti-Xa.
CONCLUSIONES Y LIMITACIONES DEL DOCUMENTOPor desgracia, no hay evidencia científica sólida que respalde un tratamiento antitrombótico en este específico tipo de pacientes infectados por COVID-19. Nos movemos en un escenario cambiante, en el que incluso no se ha demostrado de manera clara el beneficio clínico el tratamiento antiviral específico. La mayoría de las recomendaciones que se presentan en este documento de consenso se basa en la opinión de los autores o en series muy escasas de pacientes. Además, casi toda la información disponible se basa en series de pacientes de China y, por lo que se está viendo, la pandemia se comporta en el mundo occidental de una forma bastante diferente de lo que se había comunicado desde aquel país asiático. Por todo ello, siempre se debe tener en cuenta la situación clínica del paciente y la presencia de comorbilidades para valorar tanto el riesgo trombótico como el hemorrágico.
Por último, invitamos a la reflexión sobre cómo hemos actuado en esta primera fase de la pandemia, ahora que parece reducirse su virulencia, pues es necesario identificar los aciertos y los errores para estar preparados ante una posible segunda ola, tal y como auguran muchos expertos. Abordar adecuadamente a los pacientes infectados para evitar sucesos fatales, así como asegurar la salud de la población no infectada, ahora mismo es prioritario.
CONFLICTO DE INTERESESD. Vivas ha recibido honorarios por ponencias de Eli Lilly & Co., Daiichi Sankyo, AstraZeneca, Bayer, Pfizer, Boehringer Ingelheim y Bristol-Myers-Squibb y ha realizado labores de consultoría para AstraZeneca, Eli Lilly & Co., Bayer, Pfizer, Boehringer Ingelheim, Daiichi Sankyo y Bristol-Myers-Squibb. V. Roldán ha recibido honorarios por ponencias de Pfizer-BMS, Daiichi Sankyo y Boehringer Ingelheim y ha realizado labores de consultoría para AstraZeneca, Daiichi Sankyo y Boehringer Ingelheim. I. Roldán ha recibido honorarios por ponencias de Eli Lilly, Daiichi Sankyo, AstraZeneca, Bayer, Pfizer, Boehringer Ingelheim y Bristol-Myers-Squibb y ha realizado labores de consultoría para AstraZeneca, Eli Lilly & Co., Bayer, Pfizer, Boehringer Ingelheim, Daiichi Sankyo y Bristol-Myers-Squibb. A. Tello-Montoliú ha recibido honoraros por labores de consultoría y un proyecto de investigación de AstraZeneca. J.M. Ruiz-Nodar ha recibido honorarios por ponencias de AstraZeneca, Biosensor, Boston Scientific, Medtronic y Terumo. J. Cosín-Sales ha recibido honorarios por ponencias de Daiichi Sankyo, Bayer, Pfizer-BMS y Boehringer-Ingelheim. L. Consuegra ha recibido honorarios por ponencias de Daiichi Sankyo, Abbott, Esteve y AstraZeneca. J. Luis Ferreiro ha recibido honoraros por ponencias de Eli Lilly & Co., Daiichi Sankyo, AstraZeneca, Roche Diagnostics, Pfizer, Abbott, Boehringer Ingelheim y Bristol-Myers-Squibb, ha realizado labores de consultoría para Astra Zeneca, Eli Lilly & Co., Ferrer, Boston Scientific, Pfizer, Boehringer Ingelheim, Daiichi Sankyo y Bristol-Myers-Squibb y ha obtenido becas de investigación de AstraZeneca. F. Marín ha recibido honorarios por ponencias de Daiichi Sankyo, AstraZeneca, Pfizer-BMS, ha realizado labores de consultoría para Astra Zeneca, Daiichi Sankyo y Boehringer Ingelheim y ha obtenido becas de investigación de AstraZeneca. Los demás autores declaran no tener conflictos de intereses.