La relación entre los puentes miocárdicos y el dolor torácico todavía no está bien definida. El objetivo de nuestro estudio es evaluar la relación entre los puentes miocárdicos detectados mediante tomografía computarizada multidetectores y los síntomas de una población de pacientes evaluados por dolor torácico.
MétodosSe incluyó a 393 pacientes consecutivos sin enfermedad coronaria previa, estudiados por dolor torácico y remitidos para tomografía computarizada multidetectores entre enero de 2007 y diciembre de 2010. Se les realizó una coronariografía no invasiva mediante tomografía computarizada multidetectores. Se definió puente miocárdico como una parte de una arteria coronaria completamente rodeada por el miocardio en las imágenes axiales y las reconstrucciones multiplanares.
ResultadosLa media de edad fue 64,6±12,4 años; el 44,8% de los pacientes eran varones. La tomografía computarizada multidetectores mostró 86 puentes miocárdicos en 82 de los 393 pacientes (20,9%). La descendente anterior izquierda fue la arteria coronaria afectada con mayor frecuencia (87,2%). La prevalencia de puente miocárdico fue significativamente superior entre los pacientes sin estenosis coronaria aterosclerótica significativa según la tomografía computarizada multidetectores (el 24,9 frente al 15,0%; p=0,02). Los pacientes con puente miocárdico eran más jóvenes (60,3±13,8 frente a 65,8±11,9 años; p < 0,001), tenían menor prevalencia de hiperlipemia (el 29,3 frente al 41,8%; p=0,03) y mayor prevalencia de miocardiopatía (el 6,1 frente al 1,6%; p=0,02) que los pacientes sin puente miocárdico observado en la tomografía computarizada multidetectores.
ConclusionesLa tomografía computarizada multidetectores es una herramienta fácil y fiable para diagnosticar los puentes miocárdicos in vivo. Los resultados del presente estudio indican que los puentes miocárdicos son la causa del dolor torácico en un subgrupo de pacientes más jóvenes, con menor prevalencia de hiperlipemia y mayor prevalencia de miocardiopatía que los pacientes en que se observa ateroesclerosis coronaria significativa en la tomografía computarizada multidetectores.
Palabras clave
Se define puente miocárdico (PM) como un segmento de una arteria coronaria epicárdica principal con un trayecto intramural a través del miocardio y que puede causar diferentes grados de obstrucción sistólica. La arteria coronaria descendente anterior izquierda es el vaso afectado en la mayoría de los casos. La incidencia de PM varía sustancialmente entre series angiográficas en la población general (0,5-4,5%)1, 2, 3 y en las autopsias (15-85%)4, 5. Aunque el PM suele ser asintomático y tiene una evolución favorable a largo plazo6, esta anomalía se ha asociado con diversas manifestaciones clínicas como angina inestable, infarto de miocardio, arritmias y muerte súbita7, 8, 9, 10, 11. Sin embargo, la asociación entre los síntomas isquémicos y el PM no se ha constatado rigurosamente y todavía no está clara. Las consecuencias clínicas del PM son difíciles de evaluar y la opinión sigue dividida sobre si tiene consecuencias patológicas o no es más que un epifenómeno. Se requieren estudios que justifiquen la relación entre los síntomas y el PM como principal causante y superen el actual enfoque empírico para el tratamiento de esta anomalía coronaria tan frecuente. La coronariografía invasiva es el método de referencia para detectar PM, pero es invasiva y puede que no sea lo suficientemente sensible para detectar puentes finos. La tomografía computarizada multidetectores (TCMD) es una técnica no invasiva con la ventaja de que permite ver la placa y la pared del vaso y, además, es capaz de evaluar el curso, el diámetro luminal y la relación anatómica de las arterias coronarias12, 13, 14, 15, 16, 17, 18. Por lo tanto, nos ofrece una oportunidad única para evaluar in vivo la morfología, la localización y la incidencia real del PM (Figura 1).
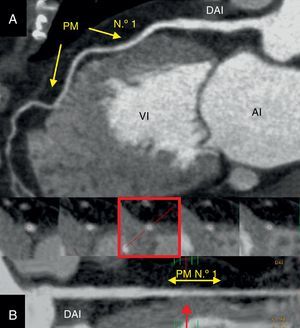
Figura 1. Caso demostrativo de una paciente de 65 años con puente intramiocárdico y arteria coronaria normal examinados mediante tomografía computarizada multidetectores. A: reconstrucción multiplanar posprocesada con máxima intensidad del píxel, en la que se ve la arteria coronaria descendente anterior izquierda; dos segmentos de la arteria coronaria descendente anterior izquierda presentan puentes miocárdicos; uno más proximal (n.o 1) y el otro más distal (flechas). B: reconstrucción multiplanar curvada que representa la arteria coronaria descendente anterior izquierda proximal y media a lo largo de su eje principal; en la parte inferior, imágenes de corte transversal del segmento afectado por el puente intramiocárdico proximal n.o 1 (doble flecha amarilla); obsérvese que la sección proximal (izquierda) se encuentra incluida totalmente en la grasa epicárdica, a diferencia del casi total revestimiento miocárdico (cuadro y flecha rojos) del puente intramiocárdico n.o 1 (20 mm de longitud y 3 mm de profundidad). AI: aurícula izquierda; DAI: arteria coronaria descendente anterior izquierda; PM: puente miocárdico; VI: ventrículo izquierdo. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
El objetivo de nuestro estudio es evaluar, utilizando la TCMD, la relación entre los PM y los síntomas de una población de pacientes sin historia de enfermedad coronaria pero con síntomas de dolor torácico. También se compararon las características clínicas entre los sujetos con y sin PM.
MétodosPacientes y diseño del estudioEntre enero de 2007 y diciembre de 2010, se incluyó consecutivamente en el estudio a 393 pacientes estudiados por dolor torácico, a los que se realizó una TCMD por sospecha de enfermedad coronaria. Se identificaron las características clínicas y demográficas como edad, sexo, factores de riesgo cardiovascular (hipertensión, diabetes, hiperlipemia y tabaquismo), insuficiencia renal, arteriopatía periférica, miocardiopatía previa y valvulopatía previa. Se definió diabetes como cifras de glucemia en ayunas > 126 mg/dl o tratamiento con medicamentos antidiabéticos. Se definió hipertensión como cifras de presión arterial sistólica > 140mmHg o presión arterial diastólica > 90mmHg (o ambos) o tratamiento antihipertensivo en curso. Se definió hiperlipemia como valores de colesterol total > 200 mg/dl o tratamiento hipolipemiante en curso. Se definió insuficiencia renal como cifras de creatinina sérica > 1,3 mg/dl (115 μmol/l). Se excluyó a los pacientes con fibrilación auricular, insuficiencia renal significativa o antecedentes de alergia significativa a contrastes yodados. También se excluyó a los pacientes con historia documentada de arteriopatía coronaria obstructiva. Todos los pacientes dieron su consentimiento informado por escrito para que les realizara la TCMD según un protocolo aprobado por la junta de evaluación institucional. En todos los casos, el médico del paciente fue quien tomó la decisión de realizar la TCMD según edad, riesgo y gravedad o persistencia de los síntomas. La población de estudio se dividió en dos grupos según la presencia de estenosis coronaria significativa observada en la TCMD.
Imágenes de tomografía computarizada multidetectoresLa coronariografía no invasiva se llevó a cabo mediante TCMD con el equipo Brilliance™ 64 (Philips Medical Systems, Best, Países Bajos). Antes de la exploración por TCMD, se comprobaron la frecuencia cardiaca (FC) y la presión arterial. En ausencia de contraindicaciones, se administró a los sujetos propranolol (5-15 mg vía intravenosa) si la FC en reposo superaba los 65 lpm. Todos los sujetos estaban en ritmo sinusal normal. La FC de todos los sujetos oscilaba entre 48 y 70 lpm (media, 60±7,5 lpm), con o sin medicación previa. Se les practicó la prueba en decúbito supino, se les ordenó que mantuviesen una apnea inspiratoria durante la cual se adquirió la TCMD y el electrocardiograma (ECG). La exploración se realizó desde la bifurcación de la tráquea hasta 1 cm por debajo de la cara diafragmática del corazón. Tras una pasada exploratoria, se inyectaban 80-120 ml de contraste (iopamidol 370 mg de I/ml, Bracco) vía intravenosa a través de un catéter de calibre 18 G colocado en la vena antecubital, a una velocidad de 4-5 ml/s, controlado con la técnica de seguimiento del bolo de contraste, seguido por un bolo de 40 ml de solución salina. La exploración se iniciaba automáticamente con un retraso de 5 s tras alcanzar un umbral predefinido de 140 UH en la aorta ascendente. La exploración se realizó a 120 kV, con un tubo de corriente de 600-1.000mA, colimación de corte de 64×0,625 mm, tiempo de rotación del gantry de 0,4 s y pitch de 0,2. La reconstrucción de la imagen se realizó sistemáticamente de forma retrospectiva con sincronización con el ECG. El conjunto de datos se adquiró en las fases del 40 y el 75% del ciclo RR. La dosis efectiva de TCMD se calculó a partir del producto dosis-longitud y de un factor de ponderación del órgano [k=0,014 mSv×(mGy×cm)–1] para el tórax, la región anatómica estudiada19.
Análisis y procesamiento de las imágenesEl análisis de los estudios se realizó en una estación de trabajo para tal fin (Philips Extended Brilliance Workspace), donde se analizaron los 15 segmentos de las arterias coronarias definidos según las directrices de la American Heart Association20. Para cada caso, se determinó el score de calcio con el método de Agatston et al21. La cuantificación de calcio coronario se realizó sin contraste, utilizando un software semiautomático (HeartBeat CS, Philips Medical Systems) que representa el calcio con zonas coloreadas. El operador las marca manualmente, y la cuantificación de calcio total en función de todas esas zonas coloreadas se lleva a cabo de manera automática. Se examinaron las TCMD con contraste para evaluar la presencia de PM en todos los segmentos disponibles utilizando los cortes axiales originales y las reconstituciones multiplanares y planares curvadas en al menos dos planos, uno paralelo y otro perpendicular al curso del vaso. También se llevaron a cabo reconstrucciones de corte fino con máxima intensidad del píxel e imágenes volumétricas. Las exploraciones se evaluaron mediante el consenso de un cardiólogo y un radiólogo con experiencia que desconocían la historia clínica. Las discrepancias se resolvieron tras una revisión conjunta adicional y el intercambio de opiniones. Ambos observadores clasificaron la calidad de la imagen de cada segmento de la arteria coronaria como diagnóstica (sin artefactos o con artefactos moderados, aceptable para su evaluación) o no evaluable (artefactos extensos que perjudican su evaluación). Se definió PM como una parte de una arteria coronaria completamente rodeada por el miocardio en las imágenes axiales y la reconstrucciones multiplanares. Se observó la localización del segmento tunelizado y se midieron la longitud y la profundidad del segmento. La profundidad del PM se determinó midiendo perpendicularmente el espesor del músculo suprayacente en la imagen de eje corto en la que se observaba el mayor grosor del PM. Se evaluó cada segmento para comprobar si había cambios ateroscleróticos (placa calcificada y no calcificada). Se examinaron todos los segmentos coronarios en las TCMD con contraste para comprobar si había estenosis luminal coronaria. Se definió estenosis coronaria significativa como una reducción del diámetro luminal de más del 50%.
Análisis estadísticoTodos los análisis estadísticos se llevaron a cabo utilizando el SPSS versión 15.0 (SPSS Inc.; Chicago, Illinois, Estados Unidos). Las variables continuas se presentan como media±desviación estándar y los datos categóricos, en porcentajes y frecuencias absolutas. Las diferencias entre los grupos se analizaron utilizando la prueba de la t de Student para las variables continuas o la prueba para las variables categóricas. Se consideró estadísticamente significativa una prueba bilateral con resultado de p < 0,05.
ResultadosDatos de los pacientesLa media de edad fue 64,6±12,4 años; el 44,8% eran varones. La Tabla 1 muestra los datos demográficos y las características iniciales de la población. Todas las exploraciones de TCMD se llevaron a cabo sin complicaciones. La calidad de las imágenes fue buena y se consideró evaluables todos los segmentos estudiados. Se pudo identificar claramente un patrón normal en la arteria coronaria epicárdica o la presencia de un segmento intramuscular tanto en las imágenes axiales como en las reconstrucciones multiplanares. El promedio estimado efectivo de exposición a la radiación fue de 1,2±0,2 mSv para la cuantificación de calcio y 12,4±5,1 mSv para la coronariografía no invasiva.
Tabla 1. Datos demográficos y características basales de la población. Diferencias entre pacientes con y sin estenosis coronaria significativa observada en tomografía computarizada multidetectores
| Total (n=393) | Estenosis coronaria significativa en TCMD (n=160) | Sin estenosis coronaria significativa en TCMD (n=233) | p | |
| Edad (años) | 64,6±12,5 | 69,6±9,5 | 61,1±13,7 | < 0,001 |
| Varones | 176 (44,8) | 87 (54,4) | 89 (38,2) | 0,002 |
| IMC (kg/m2) | 27,6±4,9 | 28,6±3,6 | 27,4±5,2 | 0,19 |
| Hipertensión | 211 (53,7) | 104 (65) | 107 (45,9) | < 0,001 |
| Diabetes | 84 (21,4) | 45 (28,1) | 39 (16,7) | 0,007 |
| Hiperlipemia | 154 (39,2) | 66 (41,3) | 88 (37,8) | 0,48 |
| Tabaquismo | 66 (16,8) | 25 (15,6) | 41 (17,6) | 0,60 |
| Insuficiencia renal | 6 (1,5) | 2 (1,3) | 4 (1,7) | 0,71 |
| Arteriopatía periférica | 9 (2,3) | 6 (3,8) | 3 (1,3) | 0,11 |
| Miocardiopatía | 10 (2,5) | 5 (3,1) | 5 (2,1) | 0,53 |
| Valvulopatía | 10 (2,5) | 7 (4,4) | 3 (1,3) | 0,06 |
| Score de calcio | 274±616,4 | 536,4±776,1 | 110,2±416,4 | < 0,001 |
| Puente miocárdico | 82 (20,9) | 24 (15) | 58 (24,9) | 0,02 |
IMC: índice de masa corporal; TCMD: tomografía computarizada multidetectores.
Los datos expresan media±desviación estándar o n (%).
La TCMD detectó 86 PM en 82 (20,9%) de los 393 sujetos. Las arterias coronarias afectadas se indican en la Tabla 2. La mayoría se encontraba en la arteria coronaria descendente anterior izquierda media (87,2%), seguida de la rama intermedia (4,7%). En 79 pacientes se observó PM en un solo lugar. Tres pacientes tenían más de una arteria coronaria implicada: la rama intermedia y la descendente anterior izquierda (paciente 1); la descendente anterior izquierda, la coronaria derecha y la arteria obtusa marginal (paciente 2), y la arteria descendente anterior izquierda y la obtusa marginal (paciente 3). La longitud media total y el grosor máximo (profundidad) del PM fueron 20,5±5,2 (intervalo, 8-29) y 2,3±0,7 (1-3,3) mm respectivamente. En todos los casos, en las reconstrucciones volumétricas se pudo identificar también el segmento intramuscular, lo que permitió la evaluación anatómica tridimensional de su localización.
Tabla 2. Localización e incidencia de puente miocárdico en las arterias coronarias
| Arteria coronaria | Puente miocárdico (n=86) |
| Arteria descendente anterior izquierda | 75 (87,2) |
| Rama intermedia | 4 (4,7) |
| Ramas diagonales | 3 (3,5) |
| Arteria obtusa marginal | 3 (3,5) |
| Arteria coronaria derecha | 1 (1,1) |
Los datos expresan n (%).
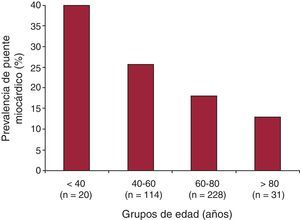
La Tabla 1 muestra las características de la población en función de la presencia de estenosis coronaria significativa en la TCDM. La prevalencia de PM fue significativamente mayor entre los pacientes sin estenosis coronaria significativa en la TCMD (el 24,9 frente al 15,0%; p=0,02). Además, se clasificó a los pacientes en dos grupos según presencia o ausencia de PM (Tabla 3). Los pacientes con PM eran más jóvenes (60,3±13,8 frente a 65,8±11,9 años; p < 0,001) y tenían menor prevalencia de hiperlipemia (el 29,3 frente al 41,8%; p=0,03) y mayor prevalencia de miocardiopatía (el 6,1 frente al 1,6%; p=0,02) que los pacientes que no tenían PM en la TCMD. La prevalencia de PM por grupos de edad se muestra en la Figura 2. Las miocardiopatías en el grupo sin PM eran miocardiopatías dilatadas idiopáticas en 4 casos y miocardiopatías hipertróficas en 1 caso, mientras que en el grupo con PM eran miocardiopatías dilatadas idiopáticas en 3 casos y miocardiopatías hipertróficas en 2 casos.
Tabla 3. Diferencias en las características clínicas entre pacientes con y sin puente miocárdico
| Grupo con PM (n=82) | Grupo sin PM (n=311) | p | |
| Edad (años) | 60,3±13,8 | 65,8±11,9 | < 0,001 |
| Varones | 40 (48,8) | 136 (43,7) | 0,41 |
| IMC (kg/m2) | 26,5±4,1 | 27,9±5,1 | 0,20 |
| Hipertensión | 44 (53,7) | 167 (53,7) | 0,99 |
| Diabetes | 16 (19,5) | 68 (21,9) | 0,64 |
| Hiperlipemia | 24 (29,3) | 130 (41,8) | 0,03 |
| Tabaquismo | 10 (12,2) | 56 (18) | 0,21 |
| Insuficiencia renal | 0 (0) | 6 (1,9) | 0,20 |
| Arteriopatía periférica | 2 (2,4) | 7 (2,3) | 0,91 |
| Miocardiopatía | 5 (6,1) | 5 (1,6) | 0,02 |
| Valvulopatía | 3 (3,7) | 7 (2,3) | 0,47 |
| Estenosis coronaria significativa observada en TCMD | 24 (29,3) | 136 (43,7) | 0,023 |
IMC: índice de masa corporal; PM: puente miocárdico; TCMD: tomografía computarizada multidetectores.
Los datos expresan media±desviación estándar o n (%).
Figura 2. Prevalencia de puente miocárdico según los grupos de edad.
DiscusiónEste estudio constata que la TCMD es una herramienta fácil y fiable para un adecuado diagnóstico in vivo del trayecto intramuscular de las arterias coronarias. La incidencia de PM en nuestro estudio fue del 20,9% y afectaba principalmente a la arteria coronaria descendente anterior izquierda, tal y como se había observado en estudios previos22, 23. Nuestros datos indican que el PM probablemente sea la causa del dolor torácico en un subgrupo de pacientes más jóvenes y con menor prevalencia de hiperlipemia que los pacientes en que se observa estenosis coronaria significativa en la TCMD. Además, se observó mayor prevalencia de miocardiopatía previa en el grupo de PM, lo que coincide con estudios previos24.
Normalmente, las arterias coronarias tienen una localización epicárdica y recorren la superficie del miocardio. Se cree que el PM es una anomalía congénita, aparentemente debida a un fallo en la exteriorización de la primitiva red arterial intratrabecular coronaria. Se describió por primera vez en 1737, cuando Reyman se percató de esta anatomía particular en los corazones de los seres humanos25. En 1961, Polacek fue la primera persona en utilizar el término puente miocárdico26. Con el desarrollo y la frecuencia cada vez mayor de la coronariografía, ha surgido un creciente interés por esta entidad. Las consecuencias clínicas del PM son difíciles de evaluar, y sigue sin estar claro que haya que considerar que la presencia de PM es causa de isquemia miocárdica. Normalmente, durante la sístole sólo se lleva a cabo un 15% de la circulación sanguínea coronaria y, como el PM produce deterioro sistólico en la angiografía, se ha cuestionado su relevancia y su importancia clínica. Mayoritariamente, el PM es una afección congénita benigna con evolución favorable a largo plazo. No obstante, se han constatado casos de PM como única anomalía en la angiografía de pacientes con angina de pecho, infarto de miocardio, disfunción ventricular izquierda, arritmias y muerte súbita cardiaca7, 8, 9, 10, 11. Sin embargo, teniendo en cuenta la prevalencia de PM, estas complicaciones son poco comunes y no siempre se puede demostrar los signos objetivos de isquemia. Los ECG en reposo a menudo son normales; las pruebas de estrés pueden inducir signos inespecíficos de isquemia6, 27. Se puede observar defectos de perfusión en una gammagrafía miocárdica28, pero ni siquiera son obligatorios en puentes profundos con compresión sistólica significativa o tras estimulación vasoactiva27, 29. A pesar de que esta malformación está presente al nacer, los síntomas no suelen aparecer antes de la tercera década. Tampoco hay clara relación entre los síntomas y la longitud del segmento tunelizado o el grado de compresión sistólica. Existe una serie de estudios que no han conseguido probar que el puente cause una estenosis crítica30, 31, 32. Por lo tanto, puede ser un hallazgo casual en pacientes sin otra explicación cardiaca para el dolor torácico que padecen. Según nuestro conocimiento, hasta la fecha no hay estudios que hayan confirmado en una población de pacientes evaluados por dolor torácico una relación estadísticamente significativa entre el PM y los síntomas.
Hasta ahora, el método de referencia para el diagnóstico de PM era la coronariografía con comprensión sistólica de un segmento coronario (el característico efecto milking) inducido mediante compresión sistólica del segmento tunelizado. No obstante, se reconoce que la coronariografía convencional subestima la prevalencia de PM, pues ofrece una visualización que se limita a la luz del vaso, lo que exige que los investigadores se basen en signos indirectos que son bastante insensibles a variantes superficiales de PM con una compresión sistólica mínima o sin compresión sistólica4. En pacientes con puentes finos, se puede pasar por alto el efecto milking y pueden requerir el uso de técnicas de imagen adicionales y pruebas de provocación33, 34, 35. A diferencia de la coronariografía invasiva convencional, la TCMD permite la visualización no sólo de la luz de las arterias coronarias, sino también de sus paredes, el miocardio vecino y las cavidades cardiacas en cualquier plano, lo que facilita la representación de los segmentos tunelizados incluso cuando sólo hay una compresión sistólica mínima o en ausencia de compresión sistólica y de cambios en el curso del vaso36, 37, 38. Por lo tanto, la TCMD puede visualizar el PM de una forma más completa y sensible que la coronariografía, en la que se realiza el diagnóstico por el descubrimiento casual de la compresión sistólica de la arteria coronaria que nos indica el efecto milking. Asimismo, las reconstrucciones multiplanares de la TCMD proporcionan los espesores y las direcciones de los haces musculares del PM. Conocer preoperatoriamente el PM mediante la TCMD, en teoría, puede ayudar a los cirujanos a evitar complicaciones durante la cirugía coronaria, como puede ser la perforación de la pared ventricular en un intento de aislar la arteria intramuscular39, 40. Además, la TCMD puede delinear las lesiones calcificadas y no calcificadas en la pared de la arteria coronaria que no causan estenosis luminal41, 42. La prevalencia de PM constatada en series angiográficas con TCMD oscila entre el 3,5 y el 30,5% en pacientes con dolor torácico o con sospecha de arteriopatía coronaria o con arteriopatía coronaria conocida22, 23. Basándonos en nuestros datos, creemos que la TCMD puede ser una herramienta útil para pacientes con síntomas parecidos a la angina de pecho o con isquemia establecida, pero con bajo riesgo de arteriopatía coronaria, porque no sólo permite el diagnóstico de la arteriopatía coronaria obstructiva, sino también la detección del PM, que es una causa común del dolor torácico en este subgrupo de pacientes.
Limitaciones del estudioEl presente estudio tiene ciertas limitaciones. Se trata de un estudio descriptivo de carácter retrospectivo realizado en un único centro. No se excluyó a los pacientes con otros factores de riesgo que pueden causar dolor torácico (valvulopatía, enfermedad pulmonar, enfermedad gastrointestinal). Los resultados de la TCMD no se correlacionaron con la coronariografía, y no se pudo confirmar en la autopsia el tejido suprayacente descrito en la TCMD. No se evaluó la presencia de compresión sistólica de la arteria coronaria intramuscular o su grado ni se pudo reproducir el signo de milking observado en la coronariografía. La falta de correlación con isquemia en las pruebas de estrés limita la relevancia clínica de los hallazgos del presente estudio. Por último, este estudio no correlacionó los resultados de la TCMD con los efectos del tratamiento ni con los resultados del seguimiento.
ConclusionesLa coronariografía por TCMD es una herramienta de exploración no invasiva alternativa que permite una evaluación fácil y precisa del PM. Los resultados de este estudio indican que el PM probablemente sea la causa del dolor torácico en un subgrupo de pacientes más jóvenes y con menor prevalencia de hiperlipemia. Basándonos en estos datos, se debe tener en cuenta el PM, sobre todo, en pacientes jóvenes con bajo riesgo de aterosclerosis coronaria y un dolor torácico similar al de la angina de pecho o isquemia miocárdica establecida. En estos pacientes, la TCMD puede convertirse en la técnica de elección para el diagnóstico in vivo del PM.
Conflicto de interesesNinguno.
Agradecimientos
Estamos en deuda con nuestros compañeros radiólogos (Dres. Ana Bustos, Iñigo de la Pedraja y Joaquín Ferreirós), el equipo de enfermería y los asistentes técnicos de radiología por su experiencia y su compromiso a trabajar en conjunto para conseguir un servicio de tomografía computarizada cardiaca de excelencia.
Recibido 9 Diciembre 2011
Aceptado 2 Febrero 2012
Autor para correspondencia: Instituto Cardiovascular, Hospital Universitario San Carlos, Prof. Martín Lagos s/n, 28040 Madrid, España. albertutor@hotmail.com