La endocarditis con hemocultivos negativos se ha asociado a retraso en el diagnóstico, mayor número de complicaciones y necesidad de cirugía; en definitiva, a un peor pronóstico. Nuestro objetivo es revisar la situación actual de la endocarditis con hemocultivos negativos.
MétodosAnalizamos 749 casos consecutivos de endocarditis izquierda recogidos en tres hospitales terciarios entre junio de 1996 y 2011, y los dividimos en dos grupos: grupo I (n = 106), episodios con hemocultivos negativos; grupo II (n = 643), episodios con hemocultivos positivos. El diagnóstico de endocarditis se realizó según los criterios de Duke hasta 2002 y utilizando la versión modificada por Li et al desde esa fecha.
ResultadosLa edad, el sexo y la presencia de comorbilidades fueron similares en ambos grupos. No hubo diferencias significativas en la proporción de sujetos que habían recibido tratamiento antibiótico antes de la extracción de los hemocultivos. El periodo desde el inicio de los síntomas hasta el diagnóstico fue similar en ambos grupos. No hubo diferencias significativas respecto a aparición de insuficiencia cardiaca, insuficiencia renal o shock séptico. No se encontraron diferencias en la necesidad de cirugía (el 57,5 frente al 55,5%; p = 0,697) ni tampoco en la mortalidad (el 25,5 frente al 30,6%; p = 0,282).
ConclusionesActualmente, la administración previa de antibióticos no es más frecuente en la endocarditis con hemocultivos negativos. Tampoco supone un retraso en el diagnóstico ni en el inicio del tratamiento adecuado. La evolución clínica intrahospitalaria, la necesidad de cirugía y la mortalidad son similares a las de los pacientes con hemocultivos positivos.
Palabras clave
Los hemocultivos son una herramienta fundamental en el diagnóstico y el tratamiento de la endocarditis infecciosa (EI). La negatividad de los hemocultivos implica la pérdida de una referencia microbiológica que guíe el proceso diagnóstico-terapéutico de la enfermedad. La endocarditis con hemocultivos negativos (ECN) se ha asociado a retraso en el diagnóstico, mayor número de complicaciones intrahospitalarias, mayor necesidad de cirugía y, en definitiva, un peor pronóstico1, 2, 3, 4, 5, 6. Según los datos publicados, la administración previa de antibióticos ha sido, clásicamente, la causa principal de la ECN5, 7, 8, 9, 10, 11, 12.
En la última década se han producido una serie de cambios en los factores epidemiológicos y los microorganismos causantes de la EI (mayor edad de los pacientes, predominio de Staphylococcus aureus, elevada incidencia de EI nosocomial, etc.)8, 13, 14, 15, 16, 17. Además, en los últimos años, la utilización del ecocardiograma transesofágico (ETE) en los pacientes con sospecha de EI es cada vez más frecuente y precoz. Todo ello modifica algunos aspectos diagnósticos y pronósticos de la enfermedad. El objetivo de nuestro trabajo es revisar la situación actual de la ECN.
MétodosSe han analizado todos los casos de EI recogidos consecutivamente en tres hospitales terciarios entre junio de 1996 y junio de 2011. Los episodios se registraron en una hoja de recogida de datos común y se incorporaron prospectiva y consecutivamente a una base de datos general, de manera ordenada, siguiendo unas mismas directrices definidas por el grupo de investigadores participantes y evaluadas en reuniones anuales. De 896 episodios de EI incluidos durante este periodo, se seleccionó sólo a los pacientes con endocarditis izquierda (n=749), y ellos constituyen nuestro grupo de estudio. Se excluyeron los episodios de endocarditis derecha por tener un perfil epidemiológico, microbiológico, clínico y pronóstico distinto.
Atendiendo al resultado de los hemocultivos, los episodios de endocarditis izquierda se clasificaron en dos grupos: grupo I (n=106), episodios con hemocultivos negativos; grupo II (n=643), episodios con hemocultivos positivos (ECP). El diagnóstico de endocarditis se realizó según los criterios clásicos de la Universidad de Duke18 hasta 2002. A partir de esa fecha, utilizamos la versión modificada por Li et al19. De los episodios del grupo I, el 74,5% (n=79) alcanzó criterios de EI definitiva y el 25,5% (n=27), los de EI posible. Dentro de este último grupo, la gran mayoría de los episodios (n=24) presentaban un criterio mayor determinado por los hallazgos ecocardiográficos y dos criterios menores. Tan sólo tres episodios fueron diagnosticados de EI posible con tres criterios menores.
Se introdujo de manera prospectiva la información obtenida de cada paciente en nuestra base de datos siguiendo un protocolo estandarizado para los tres centros participantes, que incluía la realización de al menos tres hemocultivos en el momento del ingreso y 48 h tras el inicio del tratamiento antibiótico. En la mayoría de los episodios, el tratamiento antibiótico se inició de forma empírica tras la extracción de hemocultivos y siguiendo las recomendaciones de las guías de práctica clínica20, 21. Posteriormente, el tratamiento antibiótico se ajustó según el resultado de los hemocultivos. Se extrajeron tres pares de hemocultivos en cada una de las tomas y se incubaron hasta 4 semanas. El material obtenido durante la cirugía (tejido valvular, material protésico, abscesos, embolias periféricas, etc.) se remitió a microbiología en todos los casos. En los episodios de ECN, y también en muchos otros casos, parte de este material se remitió a anatomía patológica para estudio histológico con tinciones especiales (Gram, plata, etc.). En los episodios cuyos hemocultivos persistían negativos a las 72 h del ingreso, se solicitó sistemáticamente serología para Brucella, Legionella, Coxiella, Mycoplasma, Chlamydia y, en los últimos años, Bartonella.
Para estudiar la evolución temporal de la EI dentro de nuestra serie y determinar el posible efecto del factor tiempo en el perfil microbiológico y su influencia en el comportamiento de la enfermedad, realizamos un subanálisis en el que dividimos el periodo de estudio en tres intervalos de duración similar (periodo 1: 1996-2001; periodo 2: 2002-2005; periodo 3: 2006-2011) y estudiamos el perfil microbiológico dentro de cada uno de los intervalos definidos.
Se consideró como posible puerta de entrada las situaciones o los procedimientos con riesgo de bacteriemia que tuvieron lugar dentro de los 2 meses previos al inicio de los síntomas. El tratamiento previo con antibióticos se consideró relevante en los casos en que tuvo lugar dentro de los 15 días previos a la extracción de hemocultivos.
Se realizó un ecocardiograma transtorácico y un ETE a todos los pacientes. Los criterios ecocardiográficos utilizados para definir la presencia de vegetaciones, abscesos, seudoaneurismas y fístulas se han descrito en otras publicaciones22, 23. Se determinó el tamaño de la vegetación midiendo su diámetro mayor, y en los casos en que hubo más de una vegetación, se consideró la de mayor tamaño.
Las indicaciones de cirugía durante la fase activa de la enfermedad se establecieron al inicio del estudio mediante el consenso de los investigadores e incluyeron insuficiencia cardiaca refractaria al tratamiento médico, signos de infección persistente definido como persistencia de bacteriemia o fiebre más allá de siete días tras el inicio del tratamiento antibiótico adecuado y habiéndose descartado otros focos secundarios o metastáticos de la infección, infección por hongos y embolia recurrente a pesar de un tratamiento antibiótico adecuado. En los casos en que existiendo una indicación de cirugía esta no se llevó a cabo, los motivos fueron el rechazo del paciente o el riesgo quirúrgico excesivo según la escala EuroSCORE a partir de 1999 y de acuerdo con las decisiones tomadas por un equipo multidisciplinario que incluía al menos un cardiólogo clínico y un cirujano cardiaco con anterioridad a esa fecha.
Se registró un total de 62 variables epidemiológicas, clínicas, electrocardiográficas, radiológicas, ecocardiográficas, microbiológicas y pronósticas.
Análisis estadísticoLos datos se expresan como frecuencias absolutas o porcentajes en el caso de las variables cualitativas. Las variables cuantitativas se describen mediante media±desviación estándar, y utilizando la mediana [intervalo intercuartílico] en caso de asimetría. Para comparar variables cualitativas, se utilizó el test de la χ2 o la prueba exacta de Fisher según fuera oportuno. Las variables cuantitativas se compararon mediante el test de la t de Student y su equivalente no paramétrico U de Mann-Whitney. Para la significación estadística se consideró como punto de corte un valor de p<0,05. El paquete informático utilizado para el análisis fue el SPSS versión 15.0 para Windows (SPSS, Inc.; Chicago, Illinois, Estados Unidos).
ResultadosEpidemiología y presentación clínicaLa media de edad de nuestra población (n=749) era 61±16 años. El 63,2% eran varones y el 38,5% procedía de otros centros. En el 40% de los casos la infección tuvo lugar en una prótesis valvular (EI protésica precoz, 34%; EI protésica tardía, 65,6%). En la Tabla 1 se comparan las variables demográficas. No hubo diferencias estadísticamente significativas entre los dos grupos en lo que respecta a la comorbilidad y la cardiopatía predisponente. El periodo desde el inicio de los síntomas hasta el diagnóstico de la EI fue similar en ambos grupos. En el 48% de los casos la enfermedad se presentó de forma aguda (< 15 días), mientras que en el 16% la presentación fue crónica (> 3 meses). No se encontraron diferencias significativas en la proporción de sujetos que habían recibido tratamiento antibiótico dentro de los 15 días previos al ingreso entre los dos grupos (Tabla 1).
Tabla 1. Variables demográficas, factores predisponentes, comorbilidades, puerta de entrada y periodo sintomático hasta el diagnóstico
| Características epidemiológicas | Grupo I, HC negativos (n=106) | Grupo II, HC positivos (n=643) | OR (IC95%) | p |
| Edad (años) | 61±16 | 62±14 | 1,01 (0,99-1,02) | 0,283 |
| Síntomas hasta ingreso (días) | 34±41 | 42±83 | 1 (0,99-1,01) | 0,544 |
| Origen referido | 40,6% (43) | 37,8% (241) | 1,12 (0,74-1,71) | 0,584 |
| Sexo (varones) | 65,1% (69) | 63,1% (406) | 1,09 (0,71-1,67) | 0,699 |
| Adquirida en la comunidad | 70,2% (73) | 65,6% (417) | 0,86 (0,54-1,36) | 0,330 |
| Nosocomial | 24,8% (26) | 27,1% (173) | 0,26 (0,03-1,93) | 0,664 |
| Cardiopatía previa | 68,9% (73) | 66,1% (425) | 1,12 (0,72-1,74) | 0,658 |
| Periodo de síntomas hasta el diagnóstico | ||||
| > 3 meses | 17% (18) | 15% (95) | Referencia | 0,808 |
| 2-3 meses | 8,5% (9) | 6,6% (42) | 0,92 (0,39-2,21) | 0,858 |
| 1-2 meses | 16% (17) | 14% (89) | 1,04 (0,51-2,12) | 0,922 |
| 15 días-1 mes | 14,2% (15) | 15,6% (99) | 1,29 (0,62-2,69) | 0,492 |
| < 15 días | 44,3% (47) | 48,7% (309) | 1,30 (0,73-2,32) | 0,374 |
| Comorbilidades | ||||
| Diabetes | 15,1% (16) | 22,1% (142) | 0,63 (0,36-1,10) | 0,102 |
| Alcohol | 2,9% (3) | 6,9% (44) | 0,40 (0,12-1,30) | 0,116 |
| Tratamiento inmunosupresor | 6,7% (7) | 6,3% (40) | 1,07 (0,47-2,46) | 0,871 |
| Anemia crónica | 13,3% (14) | 19,8% (127) | 0,62 (0,34-1,13) | 0,114 |
| Insuficiencia renal crónica | 11,4% (12) | 10,5% (67) | 1,10 (0,57-2,12) | 0,767 |
| Diálisis | 4% (2) | 2,1% (6) | 1,99 (0,39-10,13) | 0,331 |
| Cáncer | 6,7% (7) | 9,7% (62) | 0,67 (0,30-1,15) | 0,322 |
| EPOC | 7,6% (8) | 8,3% (53) | 0,92 (0,42-1,98) | 0,820 |
| Colagenopatía | 1,9% (2) | 1,7% (11) | 1,10 (0,24-5,02) | > 0,999 |
| Inmunodepresión | 5,7% (6) | 7,7% (49) | 0,73 (0,30-1,75) | 0,481 |
| Profilaxis antibiótica | 16,2% (11) | 16,5% (67) | 0,98 (0,49-1,96) | 0,947 |
| Tratamiento antibiótico previo | 40% (36) | 35,2% (192) | 1,23 (0,78-1,94) | 0,375 |
| Puerta de entrada | ||||
| Infección local | 5,7% (6) | 12% (77) | 0,44 (0,19-1,04) | 0,054 |
| Cirugía previa | 10,4% (11) | 12,8% (82) | 0,79 (0,4-1,54) | 0,485 |
| Manipulación dentaria | 11,3% (12) | 6,9% (44) | 1,73 (0,88-3,40) | 0,107 |
| Tracto genitourinario | 0% | 3,7% (24) | 0,85 (0,83-0,88) | 0,037 |
| Aparato digestivo | 2,8% (3) | 3,1% (20) | 0,90 (0,26-3,09) | > 0,999 |
| Catéter intravenoso | 2,8% (3) | 10,1% (65) | 0,26 (0,08-0,84) | 0,016 |
| Presentación clínica | ||||
| Fiebre | 67,9% (72) | 82,6% (530) | 0,45 (0,28-0,71) | < 0,001 |
| Cardiológica | 53,8% (57) | 40,1% (257) | 1,74 (1,15-2,63) | 0,008 |
| Neurológica | 16% (17) | 17,5% (112) | 0,90 (0,52-1,57) | 0,717 |
| Pulmonar | 6,7% (7) | 9% (58) | 0,72 (0,32-1,62) | 0,422 |
| Reumatológica | 8,5% (9) | 12,8% (82) | 0,63 (0,31-1,3) | 0,210 |
| Renal | 5,7% (6) | 6,9% (44) | 0,81 (0,34-1,96) | 0,646 |
| Cutánea | 3,8% (4) | 7,3% (47) | 0,50 (0,17-1,40) | 0,178 |
| Síndrome constitucional | 25,7% (27) | 32,4% (208) | 0,72 (0,45-1,15) | 0,168 |
| Abdominal | 8,5% (9) | 7,8% (50) | 1,09 (0,52-2,30) | 0,811 |
| Signos/síntomas al ingreso | ||||
| Nuevo soplo | 44,3% (47) | 46,5% (298) | 0,92 (0,61-1,39) | 0,681 |
| Tiritona | 36,3% (33) | 47,4% (270) | 0,63 (0,40-0,99) | 0,048 |
| Insuficiencia cardiaca | 48,6% (51) | 37,8% (242) | 1,55 (1,03-2,35) | 0,036 |
| Fiebre al ingreso | 57,5% (61) | 73,4% (470) | 0,49 (0,32-0,75) | 0,001 |
| Fiebre previa al ingreso | 59,2% (58) | 72,3% (431) | 0,55 (0,36-0,86) | 0,008 |
| Disnea | 50,5% (53) | 43,2% (277) | 1,34 (0,89-2,02) | 0,165 |
| Insuficiencia renal | 16% (17) | 15,3% (98) | 1,06 (0,60-1,86) | 0,838 |
| Shock séptico | 0,9% (1) | 6,4% (41) | 0,14 (0,02-1,03) | 0,024 |
| Dolor torácico | 15,1% (16) | 14,2% (91) | 1,08 (0,60-1,91) | 0,802 |
| Dolor abdominal | 9,4% (10) | 10,9% (70) | 0,85 (0,42-1,71) | 0,650 |
| Abdomen agudo | 1,9% (2) | 1,1% (7) | 1,74 (0,36-8,51) | 0,372 |
| Cefalea | 7,5% (8) | 7,2% (46) | 1,06 (0,48-2,31) | 0,888 |
| Hemoptisis | 2,8% (3) | 1,7% (11) | 1,67 (0,46-6,08) | 0,433 |
| Lumbalgia | 13,2% (14) | 9,1% (58) | 1,53 (0,82-2,85) | 0,181 |
| Esplenomegalia | 3,8% (4) | 10,3% (66) | 0,34 (0,12-0,96) | 0,034 |
| Mialgia | 17% (18) | 13,7% (88) | 1,29 (0,74-2,24) | 0,371 |
| Artralgia | 15,1% (16) | 16,2% (104) | 0,92 (0,52-1,63) | 0,769 |
| Confusión | 10,4% (11) | 12,5% (80) | 0,81 (0,42-1,58) | 0,543 |
| Meningitis | 1% (1) | 1,6% (10) | 0,61 (0,08-4,80) | > 0,999 |
| ACV | ||||
| Hemorrágico | 1,9% (2) | 3,4% (22) | 1,82 (0,42-7,86) | 0,528 |
| Isquémico | 14,2% (15) | 11,4% (73) | 0,80 (0,44-1,46) | 0,528 |
| Coma | 1,9% (2) | 2,8% (18) | 0,67 (0,15-2,92) | > 0,999 |
| Número de hemocultivos extraídos (media) | 5,2±3,89 | 5,5±3,58 | 0,98 (0,93-1,03) | 0,425 |
ACV: accidente cerebrovascular; EPOC: enfermedad pulmonar obstructiva crónica; HC: hemocultivo; IC95%: intervalo de confianza del 95%; OR: odds ratio.
Los números en negrita hacen referencia a los valores de p de las variables en las que se encontraron diferencias estadísticamente significativas entre los dos grupos.
En lo que respecta a la puerta de entrada de la infección, las infecciones locales, los catéteres intravenosos y la infección urinaria fueron más frecuentes en los episodios del grupo II (Tabla 1). Fiebre, tiritona, esplenomegalia y shock séptico fueron más frecuentes en los episodios del grupo II. Por el contrario, la presentación cardiológica y concretamente la insuficiencia cardiaca fueron más frecuentes en los episodios con hemocultivos negativos. No hubo diferencias estadísticamente significativas en otras formas de presentación clínica (Tabla 1).
Con el objeto de estudiar el efecto que pudiera ocasionar el tratamiento antibiótico en los episodios de ECN y diferenciar los casos de ECN «verdadera» (sin tratamiento antibiótico previo) de los episodios de ECN «amputada» (con tratamiento antibiótico previo), se analizaron las diferencias existentes entre los episodios de ECN que habían recibido antibiótico (n=36) y los que no (n=54). Se excluyó del análisis a 16 pacientes por desconocerse si habían recibido o no tratamiento antibiótico previo a la extracción de los hemocultivos. No se encontraron diferencias significativas en la mayor parte de las variables analizadas, con excepción de una mayor presencia de diabéticos y de EI adquirida en la comunidad en el grupo de pacientes que no habían recibido antibióticos. La fiebre previa al ingreso fue más frecuente en el grupo de pacientes con ECN «amputada» (Tabla 2, Tabla 3, Tabla 4).
Tabla 2. Variables demográficas, factores predisponentes, comorbilidades, puerta de entrada y periodo sintomático hasta el diagnóstico. Diferencias dentro del grupo de endocarditis con hemocultivos negativos en función del tratamiento antibiótico previo a la extracción de los hemocultivos
| Caracteríasticas epidemiológicas | ECN con antibiótico previo (n=36) | ECN sin antibiótico previo (n=54) | OR (IC95%) | p |
| Edad (años) | 60±14 | 59±17,8 | 1 (0,98-1,03) | 0,805 |
| Síntomas hasta ingreso (días) | 33,4±35,5 | 39,7±49 | 1 (0,98-1,01) | 0,661 |
| Origen referido | 47,2% (17) | 33,3% (18) | 1,79 (0,75-4,25) | 0,185 |
| Sexo (varones) | 61,1% (22) | 66,7% (36) | 0,79 (0,33-1,89) | 0,590 |
| Adquirida en la comunidad | 57,1% (20) | 79,2% (42) | 0,35 (0,14-0,90) | 0,026 |
| Nosocomial | 31,4% (11) | 20,4% (11) | 2,86 (1-7,14) | 0,266 |
| Cardiopatía previa | 69,4% (25) | 64,8% (35) | 1,23 (0,50-3,04) | 0,648 |
| Comorbilidades | ||||
| Diabetes | 5,6% (2) | 24,1% (13) | 0,19 (0,04-0,88) | 0,021 |
| Insuficiencia renal crónica | 13,9% (5) | 9,3% (5) | 1,58 (0,42-5,91) | 0,513 |
| Diálisis | 16,7% (2) | 0% | Indeterminado | 0,077 |
| Cáncer | 8,3% (3) | 7,4% (4) | 1,14 (0,24-5,41) | > 0,999 |
| EPOC | 8,3% (3) | 7,4% (4) | 1,14 (0,24-5,41) | > 0,999 |
| Inmunodepresión | 8,3% (3) | 5,6% (3) | 1,54 (0,29-8,12) | 0,680 |
| Puerta de entrada | ||||
| Infección local | 11,1% (4) | 3,7% (2) | 3,25 (0,36-20) | 0,213 |
| Cirugía previa | 11,1% (4) | 9,3% (5) | 1,22 (0,30-5) | > 0,999 |
| Manipulación dentaria | 11,1% (4) | 13% (7) | 0,84 (0,23-3,12) | > 0,999 |
| Presentación clínica | ||||
| Fiebre | 77,8% (28) | 66,7% (36) | 1,75 (0,6-4,61) | 0,255 |
| Cardiológica | 52,8% (19) | 55,6% (30) | 1,89 (0,38-2,08) | 0,795 |
| Neurológica | 8,3% (3) | 20,4% (11) | 0,35 (0,09-1,38) | 0,123 |
| Renal | 8,3% (3) | 5,6% (3) | 1,54 (0,29-8,12) | 0,680 |
| Síndrome constitucional | 37,1% (13) | 24,1% (13) | 1,86 (0,74-4,71) | 0,185 |
| Signos/síntomas al ingreso | ||||
| Nuevo soplo | 44,4% (16) | 46,3% (25) | 0,93 (0,40-2,17) | 0,863 |
| Tiritona | 40,7% (11) | 40% (20) | 1,03 (0,40-2,68) | 0,950 |
| Insuficiencia cardiaca | 54,3% (19) | 44,4% (24) | 1,48 (0,63-3,49) | 0,364 |
| Fiebre al ingreso | 69,4% (25) | 51,9% (28) | 2,11 (0,87-5,13) | 0,097 |
| Fiebre previa al ingreso | 78,8% (26) | 54% (27) | 3,16 (1,16-8,63) | 0,021 |
| Insuficiencia renal | 22,2% (8) | 13% (7) | 1,92 (0,63-5,86) | 0,248 |
| Shock séptico | 0% | 1,9% (1) | Indeterminado | > 0,999 |
| Lumbalgia | 16,7% (6) | 14,8% (8) | 1,15 (0,36-3,65) | 0,812 |
| Esplenomegalia | 8,3% (3) | 1,9% (1) | 4,73 (0,47-47,4) | 0,299 |
| Mialgia | 25% (9) | 16,7% (9) | 1,67 (0,60-4,71) | 0,333 |
| Artralgia | 19,4% (7) | 13% (7) | 1,62 (0,52-5,10) | 0,406 |
| Confusión | 2,8% (1) | 14,8% (8) | 0,16 (0,02-1,37) | 0,080 |
| Meningitis | 0% | 1,9% (1) | Indeterminado | > 0,999 |
| ACV isquémico | 8,3% (3) | 18,5% (10) | 0,39 (0,10-1,54) | 0,217 |
ACV: accidente cerebrovascular; ECN: endocarditis con hemocultivos negativos; EPOC: enfermedad pulmonar obstructiva crónica; IC95%: intervalo de confianza del 95%; OR: odds ratio.
Los números en negrita hacen referencia a los valores de p de las variables en las que se encontraron diferencias estadísticamente significativas entre los dos grupos.
Tabla 3. Hallazgos ecocardiográficos y curso clínico. Diferencias dentro del grupo de endocarditis con hemocultivos negativos en función del tratamiento antibiótico previo a la extracción de los hemocultivos
| Hallazgos | ECN con antibiótico previo (n=36) | ECN sin antibiótico previo (n=54) | OR (IC95%) | p |
| Válvula afecta | ||||
| Nativa | 57,1% (20) | 63% (34) | Referencia | 0,592 |
| Protésica | ||||
| Metálica | 31,4% (11) | 31,5% (17) | 1,10 (0,43-2,81) | |
| Biológica | 11,4% (4) | 5,6% (3) | 2,26 (0,46-11,19) | |
| Insuficiencia valvular ≥ moderada | 75% (27) | 74,1% (40) | 1,05 (0,40-2,77) | 0,921 |
| Complicaciones perianulares | 33,3% (12) | 33,3% (18) | 1 (0,41-2,45) | > 0,999 |
| Vegetación presente (ETE) | 72,2% (26) | 77,8% (42) | 0,74 (0,28-1,96) | 0,548 |
| Tamaño de la vegetación (mm), media | 14,7±7,22 | 14,6±12,5 | 0,96 (0,41-2,27) | 0,930 |
| Curso clínico | ||||
| Embolia sistémica SNC | 8,3% (3) | 27,8% (15) | 0,24 (0,06-0,89) | 0,024 |
| Insuficiencia renal | 13,9% (5) | 18,5% (10) | 0,71 (0,22-2,28) | 0,058 |
| Shock séptico | 5,9% (1) | 14,3% (2) | 0,37 (0,03-4,63) | 0,576 |
| Insuficiencia cardiaca en cualquier momento | 68,4% (13) | 50% (9) | 2,17 (0,57-8,25) | 0,254 |
| Infección persistente | 15,8% (3) | 17,2% (5) | 0,90 (0,19-4,30) | > 0,999 |
| Cirugía | 55,6% (20) | 55,6% (30) | 1 (0,43-2,34) | > 0,999 |
| Muerte | 30,6% (11) | 24,1% (13) | 1,39 (0,54-3,57) | 0,496 |
ECN: endocarditis con hemocultivos negativos; ETE: ecocardiograma transesofágico; IC95%: intervalo de confianza del 95%; OR: odds ratio; SNC: sistema nervioso central.
Los números en negrita hacen referencia a los valores de p de las variables en las que se encontraron diferencias estadísticamente significativas entre los dos grupos.
Tabla 4. Análisis de las principales variables diagnósticas y pronósticas, excluyendo del grupo de endocarditis con hemocultivos negativos los casos de endocarditis infecciosa posible según los criterios de Li et al 19
| Variables | HC negativos (n=80) EI definitivas | HC positivos (n=643) | OR (IC95%) | p |
| Tratamiento antibiótico previo | 35,4% (28) | 30% (192) | 1,36 (0,81-2,29) | 0,634 |
| Síntomas hasta el ingreso (días) | 31,8±38,9 | 41,5±80,1 | 1 (0,99-1) | 0,252 |
| Signos y síntomas hasta el ingreso | ||||
| Insuficiencia cardiaca | 44,3% (35) | 38% (243) | 1,30 (0,81-2,08) | 0,275 |
| Fiebre previa al ingreso | 59,5% (44) | 72,1% (430) | 0,57 (0,34-0,93) | 0,024 |
| Fiebre al ingreso | 60% (48) | 73,3% (469) | 0,55 (0,34-0,88) | 0,013 |
| Insuficiencia renal | 18,8% (15) | 15,3% (98) | 1,28 (0,70-2,34) | 0,419 |
| Hallazgos ecocardiográficos | ||||
| Vegetaciones | 75% (60) | 83,7% (538) | 0,59 (0,34-1,01) | 0,053 |
| Complicaciones perianulares | 37,5% (30) | 33,1% (213) | 1,21 (0,75-1,96) | 0,435 |
| Curso clínico | ||||
| Insuficiencia cardiaca | 56,3% (18) | 52,1% (139) | 1,18 (0,57-2,48) | 0,654 |
| Insuficiencia renal | 10% (8) | 19,8% (127) | 0,45 (0,21-0,96) | 0,035 |
| Infección persistente | 18,8% (9) | 29,8% (105) | 0,54 (0,25-1,16) | 0,127 |
| Cirugía | 61,3% (49) | 55,5% (357) | 1,27 (0,79-2,04) | 0,33 |
| Muerte | 26,3% (21) | 30,8% (198) | 0,80 (0,47-1,35) | 0,404 |
EI: endocarditis infecciosa; HC: hemocultivos; IC95%: intervalo de confianza del 95%; OR: odds ratio.
Los números en negrita hacen referencia a los valores de p de las variables en las que se encontraron diferencias estadísticamente significativas entre los dos grupos.
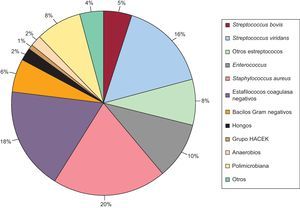
Durante la hospitalización, se consiguió identificar el germen causal de la EI en 21 episodios (19,8%) del grupo I. En la mayor parte de los casos, el germen se aisló del material procedente de cirugía. La eficacia de los tests serológicos fue baja; hubo un 2% de casos de fiebre Q y un 1% de Brucella. El perfil microbiológico de los episodios del grupo II queda reflejado en la Figura 1. No hubo diferencias entre los dos grupos en la media de hemocultivos extraídos (Tabla 1).
Figura 1. Perfil microbiológico de los episodios de endocarditis infecciosa en el grupo II.
Con respecto al subanálisis realizado para estudiar la evolución temporal del perfil microbiológico en la EI dentro de nuestra serie, no hubo diferencias con respecto a la distribución de ECP y ECN con el paso del tiempo (periodo 1: ECN, 12,4%; ECP, 87,6%; periodo 2: ECN, 15,4%; ECP, 84,6%; periodo 3: ECN, 15%; ECP, 85%; p=0,599). Con respecto al perfil microbiológico dentro del grupo ECP, no se observaron diferencias entre los tres periodos, con la excepción de tres grupos de microorganismos (estafilococos coagulasa negativos, hongos y otros estreptococos distintos de viridans y bovis) (Tabla 5).
Tabla 5. Evolución temporal del perfil microbiológico de la endocarditis infecciosa
| Microorganismo | Periodo 1 (n=217) | Periodo 2 (n=181) | Periodo 3 (n=172) | p |
| Streptococcus bovis | 10 (4,6%) | 9 (5%) | 11 (6,4%) | 0,799 |
| Streptococcus viridans | 40 (18,4%) | 30 (16,6%) | 24 (13,9%) | 0,508 |
| Enterococcus | 23 (10,6%) | 13 (7,2%) | 22 (12,8%) | 0,212 |
| Otros estreptococos | 23 (10,6%) | 7 (3,9%) | 15 (8,7%) | 0,042 |
| Staphylococcus aureus | 40 (18,4%) | 39 (21,5%) | 32 (18,6%) | 0,685 |
| Estafilococos coagulasa negativo | 35 (16,1%) | 44 (24,3%) | 24 (14%) | 0,026 |
| Bacilos Gram negativos | 13 (6%) | 12 (6,6%) | 7 (4,1%) | 0,555 |
| Hongos | 6 (2,8%) | 0 (0%) | 7 (4,1%) | 0,031 |
| Grupo HACEK | 0 (0%) | 3 (1,7%) | 1 (0,6%) | 0,138 |
| Anaerobios | 3 (1,4%) | 5 (2,8%) | 4 (2,3%) | 0,611 |
| Polimicrobiana | 16 (7,4%) | 16 (8,8%) | 16 (9,3%) | 0,761 |
| Otros | 8 (3,7%) | 3 (1,7%) | 9 (5,2%) | 0,186 |
Los números en negrita hacen referencia a los valores de p de las variables en las que se encontraron diferencias estadísticamente significativas entre los dos grupos.
La presencia de vegetaciones detectadas por ETE fue menos frecuente en el grupo I (el 72,6 frente al 83,8%; p=0,005). No hubo diferencias significativas entre los dos grupos en el porcentaje de complicaciones perianulares ni en la presencia y la gravedad de la insuficiencia valvular. Tampoco hubo diferencias en la localización de la infección (Tabla 6).
Tabla 6. Hallazgos ecocardiográficos
| Hallazgos | HC negativo (n=106) | HC positivo (n=643) | OR (IC95%) | p |
| Válvula afecta | ||||
| Nativa | 56,2% (59) | 61,3% (387) | Referencia | 0,606 |
| Protésica | 44,3% (47) | 39,2% (251) | 0,313 | |
| Metálica | 34,3% (36) | 30,4% (192) | 0,83 (0,53-1,29) | 0,606 |
| Biológica | 9,5% (10) | 8,2% (52) | 0,82 (0,40-1,70) | 0,606 |
| FEVI | ||||
| Normal | 79,5% (66) | 82,6% (403) | Referencia | 0,213 |
| Levemente deprimida | 6% (5) | 9,4% (46) | 1,51 (0,58-3,94) | |
| Moderadamente deprimida | 9,6% (8) | 5,7% (28) | 0,58 (0,25-1,32) | |
| Severamente deprimida | 4,8% (4) | 2,3% (11) | 0,45 (0,14-1,46) | |
| Insuficiencia valvular ≥ moderada | 69,8% (74) | 68,1% (438) | 1,08 (0,69-1,69) | 0,728 |
| Complicaciones perianulares | 32,1% (34) | 32,8% (211) | 0,97 (0,62-1,50) | 0,880 |
| Abscesos | 21,7% (23) | 21% (135) | 1,04 (0,63-1,72) | 0,869 |
| Seudoaneurisma | 14,2% (15) | 17,6% (113) | 0,77 (0,43-1,38) | 0,386 |
| Fístula | 3,8% (4) | 4,2% (27) | 0,89 (0,31-2,61) | > 0,999 |
| Vegetación presente (ETE) | 72,6% (77) | 83,8% (539) | 0,51 (0,32-0,82) | 0,005 |
| Tamaño de la vegetación (mm), media | 15,4±10,9 | 13,5±7,2 | 0,87 (0,54-1,40) | 0,575 |
ETE: ecocardiograma transesofágico; FEVI: fracción de eyección del ventrículo izquierdo; HC: hemocultivos; IC95%: intervalo de confianza del 95%; OR: odds ratio.
Los números en negrita hacen referencia a los valores de p de las variables en las que se encontraron diferencias estadísticamente significativas entre los dos grupos.
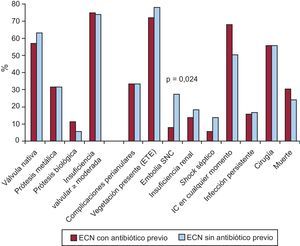
No se encontraron diferencias en ninguno de los parámetros ecocardiográficos analizados entre los casos de ECN, con independencia de haber recibido o no tratamiento antibiótico antes de la extracción de los hemocultivos (Figura 2, Tabla 3).
Figura 2. Hallazgos ecocardiográficos y curso clínico. Diferencias dentro del grupo de endocarditis con hemocultivos negativos en función del tratamiento antibiótico previo a la extracción de los hemocultivos. ECN: endocarditis con hemocultivos negativos; ETE: ecocardiograma transesofágico; IC: insuficiencia cardiaca; SNC: sistema nervioso central.
Curso clínicoDurante la hospitalización, el curso clínico de ambos grupos fue similar. No hubo diferencias significativas con respecto al desarrollo de insuficiencia cardiaca, insuficiencia renal, presencia de signos de infección persistente o shock séptico (Tabla 7). El porcentaje de embolias en el SNC fue similar en ambos grupos, pero el número de embolias en el eje hepatorrenal y el bazo fue más frecuente en los episodios del grupo II. Se intervino a un número similar de casos en los dos grupos; la insuficiencia cardiaca fue la indicación más frecuente en ambos grupos. No se encontraron diferencias en la mortalidad ni tampoco en sus causas entre los dos grupos de estudio.
Tabla 7. Curso clínico
| Evolución hasta cirugía | HC negativos (n=106) | HC positivos (n=643) | OR (IC95%) | p |
| Embolia sistémica | ||||
| SNC | 19,8% (21) | 20,5% (132) | 0,96 (0,57-1,6) | 0,865 |
| Eje hepatorrenal | 1,9% (2) | 10,7% (69) | 0,16 (0,04-0,66) | 0,004 |
| Bazo | 1,9% (2) | 10,3% (66) | 0,17 (0,04-0,70) | 0,005 |
| Hígado | 0% (0) | 0,8% (5) | Indeterminado | > 0,999 |
| Riñón | 0% (0) | 2,3% (15) | Indeterminado | 0,147 |
| Insuficiencia renal | 17% (18) | 19,6% (126) | 0,84 (0,49-1,44) | 0,527 |
| Muerte | 25,5% (27) | 30,6% (197) | 0,77 (0,48-1,24) | 0,282 |
| Cirugía | 57,5% (61) | 55,5% (357) | 1,09 (0,72-1,64) | 0,697 |
| Shock séptico | 8,6% (3) | 8,5% (21) | 1 (0,28-3,56) | > 0,999 |
| Insuficiencia cardiaca en cualquier momento | 57,1% (24) | 52,1% (139) | 1,23 (0,64-2,37) | 0,540 |
| Infección persistente | 20% (6/30) | 23,9% (50) | 0,79 (0,31-2,05) | 0,635 |
HC: hemocultivos; IC95%: intervalo de confianza del 95%; OR: odds ratio; SNC: sistema nervioso central.
Los números en negrita hacen referencia a los valores de p de las variables en las que se encontraron diferencias estadísticamente significativas entre los dos grupos.
Con el objeto de evitar cualquier sesgo en los resultados del estudio, se repitió el análisis una vez retirados los episodios diagnosticados como ECN «posible». En este subanálisis los resultados sobre el curso clínico y pronóstico entre los grupos fueron, de nuevo, similares (Tabla 4).
Dentro del grupo de episodios con hemocultivos negativos, se observó mayor frecuencia de embolias en el SNC en el grupo de pacientes que no habían recibido tratamiento antibiótico previo a la extracción de los hemocultivos. El número de pacientes intervenidos en cada grupo fue similar y no se hallaron diferencias con respecto a la mortalidad (Figura 2).
DiscusiónEl propósito de este trabajo es dar a conocer la situación actual de la ECN y su pronóstico.
Los casos de ECN suponen entre un 2,5 y un 31% del total de episodios de EI según las series24, 25. En la nuestra, la prevalencia de episodios con hemocultivos negativos fue del 14%. Tres son las razones principales que justifican la existencia de hemocultivos negativos en los pacientes con EI izquierda: cuando el microorganismo causal tiene un crecimiento lento (Propionibacterium acnes, etc.) o requiere medios especiales de cultivo (Coxiella, Bartonella, Tropheryma whipplei, etc.), la endocarditis por hongos (Aspergillus, etc.) y la administración de antibióticos en los días previos a la extracción de los hemocultivos. Para muchos autores, esta última es la causa más importante de ECN5, 7, 8, 9, 10, 11, 12. En algunas series, el porcentaje de casos de ECN que recibieron tratamiento antibiótico 1 semana antes de la extracción de hemocultivos oscila entre el 61,9 y el 66%8, 9. En nuestra serie este porcentaje fue mucho menor y no hubo diferencias en la administración previa de antibióticos entre el grupo de ECN y los casos con ECP (el 34,3 frente al 30%; p=0,812). Dos hechos pueden explicar estas notorias diferencias: un mejor conocimiento de la EI en la medicina extrahospitalaria y que con menos frecuencia los médicos prescriben antibióticos sin antes haber extraído hemocultivos, además de un cambio en el perfil microbiológico de la enfermedad. Actualmente, S. aureus es el germen más frecuente en la EI, por delante de los estreptococos, que clásicamente ocupaban ese lugar13, 26. El primero suele crecer en los hemocultivos a pesar del tratamiento antibiótico; sin embargo, los microorganismos de baja y media virulencia son muy sensibles a los antibióticos bactericidas, y con frecuencia los cultivos son negativos tras la administración de antibióticos. En nuestra serie, el 29,9% de los episodios con hemocultivo positivo a S. aureus habían recibido tratamiento antibiótico antes de la extracción de hemocultivos.
Por otro lado, algunos autores sostienen que la cantidad de sangre y paralelamente el número de hemocultivos recogidos podrían tener influencia e incrementar la probabilidad de aislar el microorganismo causal27, especialmente en los casos ocasionados por microorganismos de baja virulencia. En nuestra serie no hubo diferencias entre los dos grupos en la media de hemocultivos extraídos.
En nuestra serie se realizó un ETE a todos los pacientes, situación que no se daba en otras series históricas y que sin duda ha contribuido al diagnóstico de la enfermedad. Además, es importante destacar que, tal y como se recoge en otras series9, el juicio clínico tuvo una elevada sensibilidad en el diagnóstico de la ECN. Los criterios de Duke han demostrado tener altas sensibilidad y especificidad en el diagnóstico de la EI28. No obstante, en algunas situaciones como en la ECN, pierden precisión diagnóstica, y por este motivo se han propuesto algunas modificaciones que aumentan su sensibilidad sin perder especificidad19. Kupferwasser et al observaron que, en comparación con los criterios de Duke, el criterio exclusivamente clínico mostró una sensibilidad idéntica para el diagnóstico de ECN, pero menos especificidad29.
En lo que respecta al retraso en el diagnóstico de la EI, los datos de nuestra serie muestran un periodo sintomático hasta el diagnóstico de la enfermedad similar en los dos grupos (34 días de media en el grupo I frente a 42 días en el grupo II; p=0,544). Además, en el subanálisis realizado dentro del grupo de ECN, tampoco se encontró mayor demora en el diagnóstico en el grupo de pacientes que habían recibido tratamiento antibiótico previo. Es importante destacar que los pacientes incluidos en nuestra base de datos pertenecen a áreas de salud de zonas urbanas, con fácil acceso a los servicios sanitarios, lo que supone menos demora en la demanda de asistencia sanitaria y la realización de exámenes y pruebas complementarias (ecocardiograma transtorácico) y conduce a diagnosticar la enfermedad con mayor celeridad.
La menor frecuencia de fiebre, tanto previa como al ingreso, tiritona y shock séptico en la población de ECN sugiere que hay mayor proporción de microorganismos causales de EI de baja virulencia. Sin embargo, esta menor frecuencia de manifestaciones infecciosas no se acompaña de menor daño valvular, como queda reflejado en la mayor frecuencia de presentación cardiológica. Quizá el diagnóstico de EI en estos pacientes se realice más por las manifestaciones cardiológicas que por las infecciosas. Ello conlleva la realización de un ecocardiograma que, dadas la disponibilidad y la sensibilidad de esta técnica, evita demoras diagnósticas.
En este estudio, el ETE detectó vegetaciones con menor frecuencia en el grupo de ECN que en el grupo con ECP. Otros autores han obtenido resultados similares30. La administración de antibióticos antes de la extracción de los hemocultivos impide en algunos casos de ECN el crecimiento del microorganismo causal de la EI y, por lo tanto, también podría «amputar» la aparición o disminuir el tamaño de la máxima expresión ecocardiográfica de la enfermedad, la vegetación. Por otro lado, algunos de los gérmenes causantes de la ECN, como Propionibacterium acnes o Coxiella burnetii, tienen menos vegetaciones y son más pequeñas31, 32. Todo ello contribuiría a menos detección de vegetaciones en este grupo de pacientes con ECN. De todos modos, en nuestro estudio no hubo diferencias significativas entre los dos grupos de ECN (con o sin tratamiento antibiótico) en la detección de vegetaciones ni en su tamaño. Por lo tanto, quizá sean otras las razones que expliquen por qué los episodios de ECN tienen menos vegetaciones.
Al contrario que en publicaciones previas1, 2, 3, 4, 5 en las que se asocia la ECN a una mayor tasa de complicaciones perianulares4, mayor grado de insuficiencia cardiaca, mayor necesidad de cirugía3, 4, 5, 12 y mayor mortalidad intrahospitalaria y a largo plazo1, 2, 4, en nuestro estudio el porcentaje de eventos clínicos adversos fue similar entre ambos grupos con independencia del resultado de los hemocultivos. Tampoco hubo diferencias en la proporción de pacientes intervenidos ni en la mortalidad. Estos resultados se reiteran en el subanálisis del que se excluyeron las EI posibles dentro del grupo de ECN y coinciden con los de algunas series recientes12, 32, 33. La demostración de que no existe demora en el diagnóstico y el tratamiento de los pacientes con ECN y el hecho de que este tipo de EI se asocie a gérmenes de menor virulencia tanto en los casos de ECN «verdadera» (causada por microorganismos con capacidad limitada de crecimiento en los hemocultivos convencionales) como en los casos de EI «decapitada» (por el empleo previo de antibióticos y donde el germen causal más probable es un estreptococo o un estafilococo coagulasa negativo) explican por qué actualmente la ECN no tiene peor pronóstico que la ECP.
Para estudiar la evolución temporal de la EI en nuestra serie y analizar el posible efecto del factor tiempo en el perfil microbiológico, realizamos un subanálisis en el que se dividió el periodo de estudio en tres intervalos de duración similar (Tabla 5). No hubo diferencias significativas en el perfil microbiológico con el paso del tiempo ni tampoco en el porcentaje de microorganismos resistentes a meticilina. Tan sólo se observaron diferencias en tres grupos de microorganismos: estafilococos coagulasa negativos, hongos y otros estreptococos distintos de viridans y bovis. En ninguno de los tres casos se observó una tendencia temporal y todos ellos constituyen grupos heterogéneos en los que se engloban muchos tipos de microorganismos con comportamientos y virulencias distintos. Salvo en el caso de estafilococos coagulasa negativos, en los otros dos grupos en que se objetivaron diferencias, el número de casos es demasiado pequeño para extraer conclusiones.
Haciendo mención especial de S. aureus, por ser un microorganismo de conocida importancia pronóstica, no hubo diferencias en el número de casos ocasionados por este microorganismo entre los tres periodos. Por lo tanto, y basándonos en los resultados mencionados, en nuestra serie se observó que el factor tiempo no tiene un papel importante en cuanto al comportamiento y el pronóstico de la enfermedad.
Dentro del grupo de ECN se observó que no hubo diferencias en las variables epidemiológicas y los factores predisponentes a la EI, con la salvedad de una mayor presencia de fiebre previa al ingreso en el grupo que había recibido tratamiento antibiótico previo a la extracción de los hemocultivos. Este hallazgo es esperable si se tiene en cuenta que la aparición de fiebre suele ser motivo de prescripción de antibioterapia empírica sin extracción de hemocultivos en el ámbito extrahospitalario, así como de automedicación por parte de los pacientes. Con respecto al curso clínico dentro de este grupo, se observó mayor frecuencia de embolias en el SNC en el grupo que no recibió tratamiento antibiótico antes de extraer hemocultivos. Este dato podría explicarse por el efecto de los antibióticos en la reducción del riesgo de embolia, tal y como se recoge en estudios previos34.
Por otro lado y al contrario que en publicaciones anteriores35, no se observaron diferencias en la mortalidad ni en la necesidad de cirugía dentro del grupo de ECN, con independencia de haber recibido tratamiento antibiótico antes de la extracción de los hemocultivos.
LimitacionesAunque se recogió a los pacientes prospectiva y consecutivamente, el análisis de este estudio se ha realizado de forma retrospectiva, con todos los sesgos que ello conlleva. Nuestros hospitales son centros de referencia de cirugía y muchos pacientes han sido remitidos para intervención. Por lo tanto, pueden representar un grupo de pacientes seleccionado con EI más grave.
Desconocemos el número de días de tratamiento antibiótico recibido antes de la extracción de los hemocultivos en ambos grupos. Del mismo modo que en los casos de ECP no se recoge si el microoganismo causal era sensible al antibiótico administrado previamente. Es muy probable que estos aspectos influyan en el resultado de los hemocultivos.
Existen diferencias en el número de pacientes pertenecientes a uno y otro grupo. Es posible que este aspecto tenga influencia en los análisis estadísticos; no obstante, el tamaño muestral total es grande, por lo que la influencia en los resultados será escasa.
Las técnicas de amplificación molecular en sangre o en tejidos procedentes de cirugía se utilizaron sólo anecdóticamente en esta serie, pues no han estado disponibles hasta hace poco. De haberse utilizado sistemáticamente, quizá se podría haber identificado el agente causal en un mayor número de episodios de ECN. Tampoco se utilizaron técnicas de immunobloting, usando anticuerpos antibacterianos específicos ni otras técnicas más recientes que podrían haber aumentado nuestra capacidad de identificación etiológica. Sin embargo, los resultados de otros grupos que utilizaron sofisticados métodos de inmunohistoquímica del tejido valvular y métodos de detección de biología molecular revelan que no fueron muy sensibles36.
ConclusionesActualmente, la administración previa de antibióticos no es más frecuente en los pacientes con ECN. Esta entidad tampoco supone un retraso en el diagnóstico ni en el inicio del tratamiento adecuado con respecto a los casos de ECP. La evolución clínica intrahospitalaria, la necesidad de cirugía y el pronóstico de la ECN son similares a los de la EI con hemocultivos positivos.
Conflicto de interesesNinguno.
Recibido 3 Febrero 2012
Aceptado 10 Abril 2012
Autor para correspondencia: Instituto Cardiovascular, Hospital Clínico San Carlos, Prof. Martín Lagos s/n, 28040 Madrid, España. carlosferreraduran@gmail.com