Palabras clave
INTRODUCCIÓN
La implantación de un stent después de predilatar con balón convencional es el método estándar utilizado en el tratamiento de la mayoría de las estenosis coronarias. La implantación de un stent sin predilatación se ha ido generalizando debido a la mejoría en el anclaje de los stents al balón, a la reducción del perfil de paso y a la mayor flexibilidad de los stents. Esta técnica tiene las ventajas de reducir el tiempo del procedimiento, la exposición a la radiación y los costes1,2. Asimismo, se ha indicado que puede disminuir la isquemia miocárdica debida a la necesidad de un menor número de hinchados de balón. Diversos autores han demostrado que este procedimiento es factible, efectivo y seguro en pacientes seleccionados1-12. En estudios con seguimiento angiográfico se ha observado una tasa de reestenosis entre el 11% y el 16%13,14. La ecografía intravascular (IVUS) tras la implantación convencional de stent con predilatación ha mostrado que el mecanismo principal implicado en la reestenosis intra-stent es la proliferación de tejido neointimal15-17. El grado y el patrón de proliferación neointimal después de implantación del stent directo han sido poco estudiados. El presente estudio fue diseñado para analizar el grado y la distribución axial de la proliferación neointimal después de implantación de un stent directo mediante IVUS e identificar las variables potencialmente implicadas en la proliferación neointimal.
MATERIAL Y MÉTODO
Pacientes
Se seleccionó a 50 pacientes con anatomía coronaria y morfología de las lesiones favorables para la implantación directa de stent. Todos presentaban clínica de angina con signos objetivos de isquemia miocárdica. Se excluyeron las lesiones calcificadas, lesiones largas (> 20 mm), oclusiones totales, aquellas lesiones con tortuosidad severa en el segmento proximal a la lesión y aquellas con angulaciones severas del vaso en el segmento a tratar. La presencia de trombosis intraluminal y la presentación clínica de la enfermedad no se consideraron criterios de selección. La estenosis coronaria no se logró cruzar con el stent en 5 pacientes (10%), por lo que fueron excluidos del estudio. La subestimación de la presencia de calcio en la lesión y el intento de cruzar estenosis muy severas fueron las causas de la imposibilidad de implantar un stent directo en estos enfermos. En los 45 pacientes restantes, con implantación exitosa de stent directo, se realizó una coronariografía de control y un estudio mediante IVUS a los 7,85 ± 2,81 meses de seguimiento. En 23 pacientes potencialmente elegibles para stent directo se realizó una implantación convencional con predilatación. Ninguno de estos pacientes fue excluido debido a la imposibilidad de cruzar el stent a través de la lesión después de predilatar.
Angioplastia coronaria
Todos los pacientes recibieron doble antiagregación plaquetaria por vía oral y 10.000 U de heparina sódica por vía intravenosa previa a la realización de la angioplastia. Tras canalizar la arteria femoral mediante la técnica de Seldinger y colocar un catéter guía en ostium coronario se administraron 0,2-0,4 mg de nitroglicerina intracoronaria. Se obtuvieron angiografías en al menos dos proyecciones ortogonales. La técnica de implantación coronaria de stent estándar ya ha sido previamente descrita18,19. En la implantación sin predilatación, en la mayoría de los pacientes se empleó una guía de alto soporte. Después de cruzar la lesión con la guía se administró una nueva dosis de 0,2-0,4 mg de nitroglicerina intracoronaria para revertir una posible vasoconstricción asociada y alcanzar el máximo grado de dilatación del vaso. Se escogió una relación stent/diámetro de referencia de 1,1-1,0/1,0. Tras posicionar el stent en la lesión, se hinchó el balón ligeramente por encima de la presión nominal para conseguir un tamaño adecuado de expansión. Cuando la expansión fue incompleta se hinchó el mismo balón a mayor presión o se utilizó otro balón de mayor diámetro. Ello fue necesario en 4 pacientes con stent directo y en ninguno de los pacientes con predilatación (p = 0,35). En los casos en que no fue posible la implantación de stent directo, se usó el mismo stent previa predilatación de la lesión con un balón convencional. En los pacientes en que se implantó un stent sin predilatación se emplearon modelos Multi-Link (Guidant Corporation, Santa Clara, California) en 20 pacientes, modelos Jo-stent (Jomed International AB, Rangendingen, Alemania) en 20, modelos Tenax (Biotronik Gmbh & Co, Berlín, Alemania) y NIR (Boston Scientific, Maple Grove, Minnesota) en los 5 pacientes restantes. En la implantación de stent con predilatación se usaron stents Multi-Link en 17 pacientes y NIR o Jo-stent en los 6 pacientes restantes.
Después de la angioplastia se administró tratamiento con doble antiagregación plaquetaria durante mínimo un mes, nitratos y antagonistas de los canales del calcio al menos hasta los controles de seguimiento, y ácido acetilsalicílico de forma indefinida.
Evaluación angiográfica
Dos observadores analizaron las imágenes angiográficas. Al menos se obtuvieron dos proyecciones ortogonales para el análisis. Se realizó un análisis cuantitativo usando el sistema de análisis de bordes (Integris HM 3000, Philips Medical System, Leiden, Holanda). Las medidas angiográficas se realizaron en diástole después de la administración de nitroglicerina intracoronaria y utilizando el catéter guía para la calibración. El porcentaje de estenosis, el diámetro luminal mínimo (DLM) y la longitud de la lesión se midió en situación basal, inmediatamente después de la implantación del stent y en el seguimiento. Se calcularon las siguientes variables: 1) ganancia aguda, definida como el incremento del DLM de la arteria tratada después de la implantación del stent; 2) pérdida tardía, definida como la reducción en el diámetro luminal de la arteria tratada en el seguimiento angiográfico, y 3) la ganancia neta, definida como la diferencia entre la ganancia aguda y la pérdida tardía20.
Ecografía intracoronaria
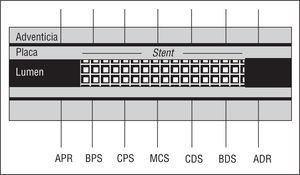
El equipo usado estaba formado por un transductor de 30-MHz dentro de una cúpula acústica en el extremo de un catéter de 3,2 F (CVIS Inc., Sunnyvale, California) conectado a una consola de ultrasonidos. Después de administrar 5.000 U de heparina y 0,2-0,4 mg de nitroglicerina intracoronaria, se pasó el sistema de imagen intravascular a través de una guía de 0,014 hasta el segmento distal de referencia, a 3-4 mm del borde distal del stent. Se realizó la IVUS retirando el sistema de imagen intravascular a una velocidad de 0,5 mm/s hasta alcanzar el diámetro de referencia proximal, 3-4 mm del borde proximal del stent. Las imágenes de ultrasonidos se almacenaron en vídeo para su posterior análisis. Se realizaron siete medidas cuantitativas. Cinco en el segmento dentro del stent: borde proximal del stent, cuerpo proximal del stent, cuerpo medio del stent, cuerpo distal y borde distal del stent, y 2 en el segmento proximal y distal sin stent (fig. 1).
Fig. 1. Esquema de los segmentos arteriales y de referencia evaluados mediante ecografía intravascular. APR: área proximal de referencia; BPS: borde proximal del stent; CPS: cuerpo proximal del stent; MCS: mitad del cuerpo del stent; CDS: cuerpo distal del stent; BDS: cuerpo distal del stent; ADR: área distal de referencia.
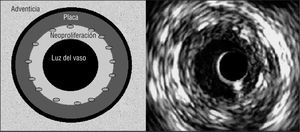
Las medidas del área transversal (AT) en el segmento coronario donde se implantó el stent fueron: 1) AT del vaso, obtenida trazando el borde entre la media y la adventicia (equivalente a la membrana elástica externa); 2) AT del stent, trazando la circunferencia del stent, y 3) AT de la luz del vaso, obtenida trazando el borde luminal de la zona de proliferación neointimal (fig. 2). El porcentaje de la placa excluida por el stent se calculó restando del AT del vaso del AT del stent. El resultado, el área de placa excluida (más la capa media) por el stent, se dividió por el AT del vaso y se multiplicó por 100. En la zona de la arteria coronaria donde no se implantó el stent se calculó el AT del vaso y de la luz. El grado de proliferación neointimal en cada una de las 5 secciones transversales del stent se calculó usando la siguiente fórmula: AT del stent menos AT de la luz, dividido por el AT del stent y el resultado multiplicado por 100.
Fig. 2. Izquierda: esquema de las áreas transversales evaluadas por ecografía intravascular en el segmento con stent. Se midieron el área del vaso (en el borde adventicial de la membrana elástica externa), y las áreas del stent y de la luz del vaso. Se calculó el porcentaje de placa excluida por el stent, incluida la capa media (representada como una circunferencia negra entre la placa y la adventicia) y la proliferación intimal. Derecha: imagen de ecografía intracoronaria. La circunferencia en el interior del lumen corresponde al catéter (no representado en el esquema de la izquierda).
Análisis estadístico
Se tabularon los resultados angiográficos basales, del procedimiento y post-stent, y los diámetros tardíos en el seguimiento. Los resultados del estudio mediante IVUS se analizaron en el seguimiento. Para detectar diferencias entre las variables continuas de los pacientes con y sin predilatación se utilizó la prueba de la t de Student y para las variables categóricas la prueba de la χ². El análisis de la varianza se utilizó para detectar diferencias entre las medidas de la AT a lo largo del eje axial de la arteria coronaria (con stent y vaso de referencia). La media de las 5 medidas del stent se usó para analizar la correlación entre variables continuas. El coeficiente de Pearson se usó para cuantificar el grado de relación lineal entre las variables continuas. Los resultados se expresaron en porcentajes y en el valor de la media ± 2 desviaciones estándar. Una p ≤ 0,05 se consideró estadísticamente significativa.
RESULTADOS
Resultados clínicos, de procedimiento y angiográficos
Todas las lesiones analizadas eran del tipo A y B con una longitud de 11,5 ± 4,5 mm. Las características clínicas y angiográficas basales eran superponibles en los 2 grupos estudiados (tabla 1). Asimismo, el DLM, el porcentaje de estenosis, la pérdida tardía y la ganancia neta, tanto basales como inmediatos posprocedimiento y tardíos, no difirieron entre los 2 grupos estudiados (tabla 2). No obstante, cuando se analizaron los resultados del procedimiento, se observó que en los pacientes en los que se realizó implantación directa del stent se usó una presión de hinchado mayor que en el grupo de angioplastia convencional con dilatación (13 ± 3 atm frente a 10 ± 2 atm, p = 0,005). El tiempo de hinchado, la longitud del stent, la relación entre la longitud de la lesión/longitud del stent y la relación stent/diámetro de referencia arterial no mostraron diferencias entre los dos grupos.
Resultados de la IVUS y seguimiento
Resultados globales
Se evaluaron un total de 340 cortes transversales del segmento coronario donde se implantó el stent en 68 pacientes. El AT del vaso, del stent y de la luz fueron 15,6 ± 3,6 mm², 8,5 ± 2,2 mm² y 5,9 ± 2,0 mm², respectivamente. El porcentaje de placa excluida fuera del stent fue de 44,8% ± 9,4% y el grado de proliferación neointimal de 30,1% ± 14,9%. Se analizaron un total de 136 cortes transversales en el segmento de referencia arterial. Las AT proximal y distal del vaso fueron de 16,7 ± 3,9 mm² y 14,9 ± 3,6 mm², respectivamente. El AT proximal y distal de la luz fueron de 9,7 ± 3,2 mm² y 8,5 ± 2,7 mm², respectivamente.
Comparación de los resultados de la IVUS entre los 2 grupos (tabla 3)
El análisis detallado del AT de las 5 secciones transversales en el stent y en el segmento de referencia arterial en los 2 grupos se muestra en la tabla 3. Las AT del vaso y del stent fueron significativamente mayores en la mayoría de las secciones transversales en el grupo sin predilatación comparado con el grupo de predilatación. No encontramos diferencias en el AT del vaso y de la luz en el segmento coronario de referencia proximal y distal entre los 2 grupos.
La proliferación neointimal fue levemente mayor en el grupo de implantación del stent sin predilatación comparado con el grupo con predilatación, aunque la diferencia no fue significativa (tabla 3). El porcentaje de la placa excluida por el stent fue levemente mayor en el grupo con predilatación, diferencia que alcanzó significación estadística en la zona media del cuerpo del stent entre los dos grupos (el 51,1% ± 7,2% frente al 46,4% ± 6,7%, p = 0,02).
Comparación de los resultados de la IVUS a lo largo del eje axial de la arteria coronaria (tabla 3 y fig. 3)
Fig. 3. Gráfica de las mediciones con ecografía intravascular de las áreas transversales del vaso, stent y luminales en pacientes con (izquierda) y sin (derecha) predilatación. Las áreas a lo largo del eje axial de la arteria con stent son similares en ambos grupos. La reducción del área transversal dentro del stent se explica por la proliferación neointimal. No se observa un incremento heterogéneo a lo largo del stent en los 2 grupos. ADR: área distal de referencia; APR: área proximal de referencia; AT: área transversal; BDS: cuerpo distal del stent; BPS: borde proximal del stent; CDS: cuerpo distal del stent; CPS: cuerpo proximal del stent; MCS: mitad del cuerpo del stent; NS: no significativo. *p < 0,05 entre el AT proximal o distal de referencia y el segmento coronario con stent.
El AT del vaso de la arteria en que se implantó el stent y la AT de referencia arterial distal fueron menores que el AT proximal de referencia arterial en los dos grupos (p < 0,05). El AT de la luz en la zona del stent en los dos grupos resultó menor que el AT de la luz de la zona arterial proximal y distal de referencia (p < 0,05). El factor determinante de esta estrechez de la zona fue la proliferación neointimal.
El AT del stent y el grado de proliferación neointimal en las 5 secciones predeterminadas del stent fueron similares a lo largo del eje axial en los dos grupos. Este hallazgo indica un crecimiento neointimal homogéneo a lo largo del stent en los 2 grupos.
Variables predictoras de proliferación neointimal
No encontramos correlación entre el DLM y el porcentaje de estenosis, tanto basales como inmediatamente posprocedimiento angiográfico, con el grado de proliferación neointimal. No obstante, encontramos una leve relación lineal entre la placa fuera del stent y la proliferación neointimal en el grupo con predilatación (r = 0,37; p = 0,005) y también en el grupo sin predilatación (r = 0,33; p = 0,005) (fig. 4). Este porcentaje de proliferación neointimal no se correlacionaba con la presión de hinchado ni con el AT del stent evaluado mediante IVUS.
Fig. 4. Correlación entre la placa excluida por el stent y la proliferación neointimal en el grupo con (arriba) y sin (abajo) predilatación. Se describe la ecuación predictiva en cada grupo.
DISCUSIÓN
Diversos estudios clínicos han demostrado que la implantación de stent coronario reduce la reestenosis angiográfica y la necesidad de reintervención en comparación con la angioplastia convencional con balón18,19. Mediante IVUS se ha demostrado que después de la implantación de stent no se produce retroceso o estrechamiento de la prótesis en el seguimiento. De hecho, el diagnóstico de la estenosis tardía del stent representaría una expansión incompleta del stent que no se detectó en el momento de la implantación15. El IVUS ha permitido demostrar que la reducción de la luz tardía se debe a proliferación neointimal16,17. Este crecimiento neointimal se distribuye de forma uniforme a lo largo del stent implantado con predilatación17. En el stent Palma-Schatz se observó un diámetro luminal menor en la zona central de la articulación que une a los dos cuerpos del stent. Ello se debe a la combinación del prolapso de tejido intimal y a la sobreimposición de tejido neointimal en esta zona. En la presente serie, observamos que al igual que en la angioplastia convencional con stent, la proliferación neointimal después de la implantación directa de stent se distribuye homogéneamente a lo largo del eje axial del stent, y no se observan predilecciones focales de proliferación neointimal a lo largo de la prótesis. Cuando comparamos con estudios previos mediante IVUS en stents articulados15-17, nuestros resultados pueden explicarse por el uso de stents con diseño tubular. Estos stents proporcionan un andamiaje rígido a la pared arterial21,22, una cobertura uniforme de la lesión a lo largo de la longitud del stent y previenen el potencial prolapso de la placa a través de las celdas de la prótesis, que podría predisponer a un crecimiento neointimal anormal23. Aunque se ha sugerido que la implantación de stent directo puede reducir la denudación endotelial provocando una menor proliferación neointimal y una menor tasa de reestenosis24, los estudios de seguimiento angiográfico han mostrado una tasa similar de reestenosis con ambas técnicas13,14,25,26. En nuestra serie observamos una pérdida tardía por angiografía y una proliferación intimal por IVUS ligeramente similar en los pacientes con y sin predilatación.
En el presente estudio el análisis a lo largo del segmento coronario de las AT del stent fue similar en los dos grupos. Ello sugiere un desplegamiento uniforme del stent con ambas técnicas. Como la mayoría de los pacientes se presentaron con un síndrome coronario agudo, es muy probable que las placas fueran principalmente «blandas», más que «fibrosas» o «calcificadas». Esta característica facilitaría la redistribución espacial de la placa durante la implantación y una expansión uniforme del stent. Cabe recordar que la presencia de calcificación angiográfica, asociado a una expansión incompleta, fue un criterio de exclusión. Otro factor que puede contribuir a la expansión uniforme del stent fue que la implantación se realizó con presiones por encima de la presión nominal de hinchado. En la implantación de stent directo usamos una presión de hinchado mayor que en la angioplastia convencional con stent (13 ± 3 frente a 10 ± 2; p < 0,005). El AT del stent y el área luminal fueron mayores con el stent directo. Al ser el AT de la arteria de referencia y la relación diámetro arteria/referencia similar en los dos grupos, el parámetro determinante del aumento de estas áreas fue probablemente la mayor presión de hinchado usada durante la liberación del stent. Durante la implantación se facilitaría la rotura, la distribución y el aplastamiento de la placa. En este sentido observamos que el porcentaje de placa excluida por el stent era menor en el stent directo que con el stent con predilatación. Sin embargo, cabe la posibilidad de que la mayor área de stent observada con el stent directo fuera en parte también debida a una mayor incidencia de placa «blanda», comparado con el stent implantado con predilatación debido a que hubo una mayor incidencia de angina inestable con el stent directo (el 82,2% frente al 65,2%; p = 0,2). Esta última característica, mayor grado de inestabilidad y posible inflamación de la placa en el grupo de stent directo, junto con una menor presión de inflado en el grupo de stent con predilatación, son factores que podrían haber influido en la ulterior proliferación neointimal y en los resultados obtenidos (véase el grado de pérdida tardía en la tabla 2 y de proliferación intimal en la tabla 3).
El incremento del AT del stent puede causar un aumento proporcional de la superficie de la prótesis provocando un aumento paralelo del grado de proliferación neointimal. Ello podría explicar el ligero aumento de proliferación neointimal observado después de la implantación directa de stent sin predilatación en comparación con la implantación con predilatación (no significativo). Cabe mencionar que la presión de hinchado del balón usada para implantar el stent no fue preestablecida, alcanzándose la presión necesaria para obtener una completa expansión angiográfica del balón y un resultado inmediato óptimo. La predilatación con balón convencional causa fisuras, disecciones menores, rotura, compresión y redistribución de la placa. Esto conlleva una ampliación del AT luminal que facilita la implantación del stent. Por el contrario, la implantación directa de stent requiere de una mayor fuerza de expansión radial para romper y distribuir espacialmente la placa, así como para permitir un desplegamiento uniforme del stent. Es muy probable que esto se consiga mejor aumentando la presión de hinchado. Un estudio reciente mediante IVUS ha mostrado que los resultados angiográficos y de ultrasonografía después de stent directo son mejores cuando se usan mayores presiones de hinchado para la implantación27.
Se ha descrito que la cantidad de placa es un factor predictor de reestenosis después de la angioplastia convencional con balón y la aterotomía28. Nosotros, al igual que otros autores29, hemos observado una leve relación lineal entre el grado de proliferación neointimal y el porcentaje de placa fuera del stent. En el presente estudio, observamos que esta relación se mantiene con el stent directo.
Limitaciones del estudio
Los pacientes fueron seleccionados de acuerdo con una anatomía coronaria y morfología de las lesiones favorables. El diseño transversal del estudio no permite evaluar las variables preintervención relacionadas con la reestenosis. En otras series, mediante IVUS después de la implantación de stent con predilatación, se ha identificado que la carga basal de placa y el área luminal postintervención pueden ser predictores de reestenosis intra-stent30. En el presente estudio no evaluamos el retroceso del stent puesto que estudios previos han mostrado buenos resultados angiográficos y buena resistencia a la compresión radial con la nueva generación de stents21-23. Por otro lado, el diseño del estudio no fue aleatorio. Sin embargo, no se observaron diferencias significativas entre las características clínicas y angiográficas basales, lo que sugiere que ambos grupos eran homogéneos. Se debe considerar que el tamaño de la muestra pudo ser insuficiente para detectar diferencias entre ambos grupos, por lo que los resultados obtenidos al comparar ambos grupos deben de interpretarse con cautela. Estos resultados también pueden estar condicionados por el hecho de que las presiones de hinchado en el grupo de stent con predilatación fueron inferiores a las que se utilizaron durante la implantación de stent directo, así como inferiores a las que se utilizan habitualmente. Por otro lado, 5 pacientes del grupo de stent directo fueron excluidos del estudio por presentar estenosis coronaria muy severa y moderadamente calcificada. Ello podría explicar que observásemos más placa fuera de la zona media del cuerpo del stent en pacientes con predilatación comparado con el stent directo. No obstante, cuando la cantidad de placa fue analizada a lo largo del eje axial del stent no se encontraron diferencias significativas.
En conclusión, tal como ocurre en la angioplastia convencional, en la implantación del stent directo en pacientes seleccionados se produce una respuesta proliferativa neointimal homogénea a lo largo del eje longitudinal del stent que se correlacionó débilmente con la cantidad de la placa excluida por el stent.
Correspondencia: Dr. V. Martí.
Unidad de Hemodinámica. Hospital de la Santa Creu i de Sant Pau.
Sant Antoni M. Claret, 167. 08025 Barcelona. España.
Correo electrónico: vmc18461b@hotmail.com