Los pacientes con insuficiencia cardiaca (IC) y enfermedad renal crónica (ERC) han estado infrarrepresentados en los ensayos clínicos, y su prevalencia y su perfil clínico requieren evaluación constante. Este estudio tiene como objetivo analizar la prevalencia de ERC, el perfil clínico y los patrones de tratamiento médico en las distintas categorías de ERC en una cohorte contemporánea de pacientes con IC ambulatorios.
MétodosEl registro CardioRen incluyó a 1.107 pacientes con IC ambulatorios, procedentes de 13 unidades de IC de España, desde octubre de 2021 hasta febrero de 2022.
ResultadosLa mediana de edad fue 75 años, el 63% eran varones y el 48% tenía una fracción de eyección del ventrículo izquierdo reducida (FEr). Un total de 654 pacientes (59,1%) mostraron una tasa de filtrado glomerular estimada (TFGe) <60 ml/min/1,73 m2 y 122 (11%) con TFGe ≥ 60 ml/min/1,73 m2 evidenciaron una relación albúmina/creatinina en orina ≥ 30mg/g. Las variables más importantes asociadas con TFGe reducidas fueron la edad (R2=61%) y la dosis de furosemida (R2=21%). La proporción de pacientes que recibieron un inhibidor de la enzima de conversión de la angiotensina (IECA) o un antagonista del receptor de la angiotensina II (ARA-II), un inhibidor de la neprilisina y el receptor de la angiotensina (ARNI), un inhibidor del cotransportador de sodio-glucosa tipo 2 (iSGLT2) o un antagonista del receptor de mineralocorticoides (ARM) disminuyó progresivamente al pasar de categorías de TFGe más altas a más bajas. El 32% de los pacientes con IC-FEr y TFGe <30 ml/min/1,73 m2 recibieron la combinación de IECA/ARA−II/ARNI+bloqueadores beta+ARM+iSGLT2.
ConclusionesEn este registro contemporáneo de IC, la prevalencia de enfermedad renal fue del 70%. Aunque la proporción de tratamientos basados en la evidencia fue menor en esta población, estrategias de seguimiento estructurado y especializado dentro de programas de IC pueden facilitar la adopción de tratamientos con impacto pronóstico.
Palabras clave
La enfermedad renal crónica (ERC) es una comorbilidad frecuente e importante en los pacientes con insuficiencia cardiaca (IC)1–4. El envejecimiento de la población y la continua mejora de los métodos de diagnóstico y tratamiento están conduciendo a un aumento de la morbilidad en los pacientes con IC5. De hecho, los datos de la práctica clínica real han mostrado un aumento progresivo de la ERC a lo largo de las últimas décadas6. Por ejemplo, un análisis sistemático del estudio Global Burden of Disease Study 2017 calculó un aumento de la prevalencia mundial de la ERC en el conjunto de todas las edades de un 29% entre 1990 y 20176. Además, se prevé que la ERC pase a ser la quinta causa mundial de muerte al año 20407.
Hasta la fecha, la prevalencia descrita de la ERC en pacientes con IC ha oscilado entre el 26% y el 57%1–4. Sin embargo, la mayor parte de los estudios se han centrado en la IC aguda y en poblaciones seleccionadas, y rara vez se ha evaluado la albuminuria. Además, la mayor parte de la información procede de pacientes incluidos en estudios hace más de 5 años1–4, con lo que los datos actuales sobre la ERC en la IC crónica son escasos.
Además, los pacientes con una ERC avanzada han sido excluidos tradicionalmente de los ensayos clínicos en la IC, y las estrategias de tratamiento han sido en gran parte empíricas. De hecho, es frecuente que los pacientes con IC y una ERC concomitante estén infratratados por lo que respecta a la medicación recomendada en las guías que prolonga la supervivencia.8–10.
En consecuencia, este estudio tuvo los siguientes objetivos: a) evaluar la prevalencia de la enfermedad renal en una cohorte contemporánea de pacientes con IC crónica, b) definir el perfil clínico, y c) describir los patrones de uso de tratamientos médicos basados en la evidencia en la IC en los diversos estadios de la ERC.
MÉTODOSDiseño y población del estudioEvaluamos prospectivamente una cohorte de pacientes consecutivos que acudieron a una visita de seguimiento en unidades de IC de España de 13 hospitales de nivel terciario, con independencia de su filtración glomerular estimada (FGe) basal, entre octubre de 2021 y febrero de 2022. El diagnóstico de la IC se realizó según lo indicado en las guías europeas actuales11. El único criterio de exclusión fue la negativa a participar.
Se obtuvieron datos sobre las características demográficas de los pacientes, los antecedentes patológicos, el tratamiento médico o con implante de dispositivos, las constantes vitales y la exploración física. La congestión clínica se evaluó mediante la puntuación de congestión combinada (CCS por su sigla en inglés), que incluía la ortopnea (0-3), el edema en las miembros inferiores (0-3) y la ingurgitación yugular (0-3)12. Todas las variables se especificaron a priori y se comunicaron al equipo de investigación, que asistió a reuniones de formación antes del inicio del estudio. Los datos sobre tratamiento médico se obtuvieron directamente de la historia clínica del paciente y se verificaron con los datos de prescripción electrónica.
Este estudio se atuvo a lo establecido en la Declaración de Helsinki y fue aprobado por los comités de ética de los centros participantes. Se obtuvo el consentimiento informado de todos los pacientes.
Análisis de laboratorioSe realizaron análisis de sangre y orina en la situación inicial (dentro de una ventana temporal de 48 horas respecto al momento de la inclusión) que se llevaron a cabo en el laboratorio local de cada centro. La FGe se calculó a partir de los niveles de creatinina utilizando la ecuación Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) y se estratificó según la clasificación de KDIGO de 2012 en 4 estratos clínicos: <30 ml/min/1,73 m2 (G4-G5); 30-44 ml/min/1,73 m2 (G3b), 45-59 ml/min/1,73 m2 (G3a) o ≥ 60 ml/min/1,73 m2(G1-G2)13. En todos los pacientes se dispuso de una determinación previa de la FGe en su historia clínica para la confirmación de la FGe. Se determinó el cociente albúmina-creatinina en la muestra de orina de primera hora de la mañana, y se estratificó la albuminuria en las 3 categorías siguientes: A1 (normal o aumento leve): <30mg/g, A2 (aumento moderado): 30-300mg/g y A3 (aumento grave):> 300mg/g.
Análisis estadísticoLas variables continuas se presentan en forma de mediana [rango intercuartílico (RIC)]. Las variables discretas se expresan en forma de porcentajes. Las comparaciones entre las distintas categorías de FGe se realizaron mediante la prueba de χ2 para las variables cualitativas. Para las variables continuas se utilizó un análisis de la varianza (ANOVA) o la prueba de Kruskal-Wallis para las variables con una distribución normal o no normal, respectivamente. Las variables asociadas a la FGe se evaluaron mediante un análisis de regresión lineal multivariante. La contribución de la exposición a la proporción de la variación de la variable dependiente se evaluó mediante el R2. Realizamos simultáneamente análisis del supuesto de linealidad para todas las variables continuas, y las variables se transformaron en polinomios fraccionales cuando era apropiado. A continuación derivamos un modelo reducido y conciso con el empleo de una selección de descenso escalonado hacia atrás basado en el conocimiento previo y la plausibilidad biológica, independiente del valor de p. Establecimos un valor de p bilateral <0,05 como umbral para la significación estadística. Las covariables incluidas en el modelo final fueron las siguientes: edad, sexo, hipertensión, tabaquismo, enfermedad pulmonar obstructiva crónica (EPOC), ictus, demencia, presión arterial diastólica inicial, fracción de eyección del ventrículo izquierdo (FEVI), niveles de CA125, inhibidores del sistema renina-angiotensina (iSRA), inhibidores de cotransportador de sodio-glucosa iSGLT2), antagonistas de receptores de mineralcorticoides (ARM), bloqueadores beta y dosis inicial de furosemida. Se realizó un análisis de regresión logística multinominal para evaluar la asociación entre los tratamientos para la IC con fracción de eyección reducida (ICFEr) según el FGe. El modelo se ajustó para las siguientes variables: edad, sexo, consumo de tabaco, hipertensión, dislipidemia, diabetes mellitus, cardiopatía isquémica, valvulopatía, fibrilación auricular, EPOC, ictus, cáncer, ERC, demencia, frecuencia cardiaca y presión arterial sistólica y diastólica. Para todos los análisis se usó el programa Stata 15.1 (Stata Statistical Software, versión 15, 2017; StataCorp LP, Estados Unidos).
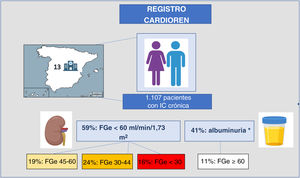
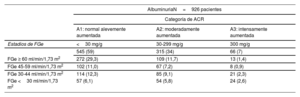
RESULTADOSSe incluyó a un total de 1.107 pacientes (figura 1). La mediana del número de pacientes de cada hospital fue de 100 por centro (figura 1 del material adicional). La mediana de edad de la cohorte total fue de 75 [RIC: 64-82] años, 694 (62,7%) eran varones, y 688 (62,1%) tenían una fracción de eyección ventricular izquierda reducida o levemente reducida (FEVI <50%) (tabla 1). La mediana (RIC] de creatinina y la del FGe fue de 1,23mg/dl [0,94-1,63] y 52,4 ml/min/1,73 m2 [36,1-75,2], respectivamente. La mediana del NT-proBNP y del CA125 fue de 1.405 pg/ml [578-3.277] y 15 U/ml [9-28], respectivamente. Un total de 654 pacientes (59,1%) tenían una filtración glomerular estimada (FGe) <60 ml/min/1,73 m2 (figura 1). De entre los pacientes en los que se determinó la presencia de albuminuria (926/1.107), 381 (41%) tenían una cociente albúmina/creatinina (ACR) ≥ 30 mg/g (tabla 2).
Características iniciales
| No disponibleValores (%) | Variables | Muestra total N=1.107 | FGe ≥ 60 ml/min n=453 (40,9%) | FGe=45-59 ml/min n=208 (18,8%) | FGe=30-44 ml/min n=267 (24,1%) | FGe <30 ml/minn=179(16,2%) | p |
|---|---|---|---|---|---|---|---|
| Características demográficas y antecedentes patológicos | |||||||
| 0 | Edad | 75,0 [64,0-82,0] | 66,0 [55,5-76,5] | 75,0 [67,0-81,7] | 80,0 [74,0-85,0] | 80,0 [74,0-85,0] | <0,001 |
| 0 | Sexo masculino | 694 (62,7) | 301 (66,4) | 142 (68,3) | 155 (58,1) | 96 (53,6) | 0,003 |
| 0 | Hipertensión | 785 (70,9) | 258 (57,0) | 149 (71,6) | 216 (80,9) | 162 (90,5) | <0,001 |
| 0 | Diabetes mellitus | 449 (40,6) | 135 (29,8) | 83 (39,9) | 119 (44,6) | 111 (62,0) | <0,001 |
| 0 | Dislipidemia | 673 (60,8) | 236 (52,1) | 139 (66,8) | 169 (63,3) | 129 (72,1) | <0,001 |
| 0 | Fumador actual | 96 (8,7) | 58 (12,8) | 11 (5,3) | 18 (6,7) | 9 (5,0) | 0,002 |
| 0 | Ex-fumador | 450 (40,6) | 170 (37,5) | 99 (47,6) | 108 (40,4) | 72 (40,2) | 0,001 |
| 0 | EPOC | 207 (18,7) | 72 (15,9) | 41 (19,7) | 59 (22,1) | 35 (19,6) | 0,204 |
| 0 | Índice de comorbilidad de Charlson | 5 (4-7) | 5 (3-6) | 5 (5-7) | 6 (5-7) | 7 (6-9) | <0,001 |
| 0 | Fibrilación auricular | 590 (53,3) | 194 (43) | 119 (57) | 167 (63) | 110 (62) | <0,001 |
| 0 | Etiología isquémica | 418 (37,8) | 161 (35,5) | 91 (43,8) | 101 (37,8) | 65 (36,3) | 0,237 |
| 0 | Valvulopatía | 216 (19,5) | 67 (14,8) | 47 (22,6) | 61 (22,8) | 41 (22,9) | 0,012 |
| 0 | DAI | 234 (21,1) | 111 (24,5) | 59 (28,4) | 39 (14,6) | 25 (14,0) | <0,001 |
| 0 | Resincronización | 132 (11,9) | 50 (11,0) | 27 (13,0) | 38 (14,2) | 17 (9,5) | 0,404 |
| 0 | Hospitalización por IC en el año anterior | 440 (39,7) | 170 (37,5) | 86 (41,3) | 104 (39,0) | 80 (44,7) | 0,384 |
| 0 | Tiempo tras el inicio de la IC, d | 738 [213-1.856] | 662 [150-1.792] | 778 [308-1.820] | 903 [239-1.884] | 808 [263-2.042] | 0,070 |
| Constantes vitales y evaluación inicial | |||||||
| 0 | Clase de NYHA, % | <0,001 | |||||
| I | 155 (14,0) | 99 (21,9) | 25 (12,0) | 25 (9,4) | 6 (3,4) | ||
| II | 737 (66,6) | 305 (67,3) | 138 (66,3) | 177 (66,3) | 117 (66,1) | ||
| III | 208 (18,8) | 48 (10,6) | 43 (20,7) | 63 (23,6) | 54 (30,5) | ||
| IV | 3 (0,3) | 0 (0,0) | 1 (0,5) | 2 (0,7) | 0 (0,0) | ||
| 2 | PAS, mmHg | 121 [109-137] | 120 [108-135] | 119 [106-132] | 122 [108-139] | 129 [112-141] | <0,001 |
| 2 | PAD, mmHg | 70 [61-78] | 71 [65-80] | 68 [60-75] | 67 [60-75] | 70 [60-76] | <0,001 |
| 5 | IMC, kg/m2 | 27 [25-31] | 28 [24-31] | 27 [24-31] | 28 [25-31] | 28 [25-32] | 0,036 |
| 3 | Frecuencia cardiaca, lpm | 70 [61-78] | 69 [60-76] | 68 [61-75] | 70 [62-79] | 72 [64-80] | 0,003 |
| 3 | Puntuación de congestión | 3 [3-5] | 3 [3-4] | 3 [3-5] | 4 [3-5] | 4 [3-5] | <0,001 |
| Ecocardiografía | |||||||
| 0 | FEVI, % | <0,001 | |||||
| ≥ 50 | 419 (37,9) | 135 (29,8) | 69 (33,2) | 118 (44,2) | 97 (54,2) | ||
| 40-50 | 162 (14,6) | 72 (15,9) | 30 (14,4) | 41 (15,4) | 19 (10,6) | ||
| ≤ 40 | 526 (47,5) | 246 (54,3) | 109 (52,4) | 108 (40,4) | 63 (35,2) | ||
| 0 | FEVI, % | 42 [31-56] | 39 [30-51] | 40 [30-53) | 46 (33-60] | 51 [35-62] | <0,001 |
| 2 | HVI | 550 (49,7) | 192 (42,4) | 98 (47,1) | 146 (54,7) | 114 (63,7) | <0,001 |
| 14 | DSPAT, mm | 19 [16-21] | 19 [16-22] | 19 [15-21] | 19 [15-21] | 19 [15-21] | 0,060 |
| 41 | PAPs, mmHg | 41 [32-53] | 36 [28-45] | 42 [32-52] | 46 [35-56] | 45 [35-55] | <0,001 |
| 24 | Vena cava inferior, mm | 16 [14-20] | 15 [13-18] | 16 [14-19] | 18 [15-21] | 18 [15-22] | <0,001 |
| 24 | Líneas B pulmonaresb | 289 (26,1) | 92 (29,3) | 63 (40,4) | 77 (36,0) | 57 (36,1) | 0,088 |
| Datos analíticos | |||||||
| 0 | Creatinina, mg/dl | 1,23 [0,94-1,63] | 0,88 [0,76-1,03] | 1,26 [1,13-1,40] | 1,57 [1,36-1,75] | 2,22 [1,93-2,76] | <0,001 |
| 0 | FGe, ml/min/1,73 m2 | 52,4 [36,1-75,2] | 80,3 [69,8-92,6] | 52,3 [48,6-55,7] | 37,9 [33,9-41,6] | 24,4 [19,9-27,5] | <0,001 |
| 1 | Urea, mg/dl | 60 [43-84] | 43 [35-52] | 60 [49-68] | 78 [63-95] | 119 [92-150] | <0,001 |
| 0 | Sodio, mEq/l | 140 [138-142] | 140 [138-142] | 141 [139-143] | 140 [138-142] | 140 [138-142] | 0,078 |
| 0 | Potasio, mEq/l | 4,5 [4,2-4,9] | 4,5 [4,2-4,8] | 4,6 [4,2-4,9] | 4,6 [4,2-4,9] | 4,5 [4,1-5,1] | 0,436 |
| 0 | Potasio ≥ 5 mEq/l | 212 (19) | 66 (15) | 37 (18) | 58 (22) | 51 (29) | <0,001 |
| 0 | Potasio ≥ 5,5 mEq/l | 51 (4,6) | 11 (2,4) | 8 (3,8) | 13 (4,9) | 19 (10,6) | <0,001 |
| 10 | Cloro, mEq/l | 103 [100-106] | 104 [101-106] | 103 [101-106] | 103 [100-106] | 103 [99-105] | 0,044 |
| 0 | Hemoglobina, g/dl | 13,6 [12,1-15,0] | 14,4 [13,1-15,7] | 13,9 [12,5-15,2] | 12,9 [11,6-14,4] | 12,1 [10,9-13,4] | <0,001 |
| 0 | Anemia | 358 (32,3) | 77 (17,0) | 65 (31,3) | 113 (42,3) | 103 (57,5) | <0,001 |
| 8 | Ferropeniaa | 431 (42,3) | 178 (39,3) | 79 (38,0) | 112 (41,9) | 62 (36,7) | 0,277 |
| 0 | NT-proBNP, pg/ml | 1.405 [578-3.277] | 675 [313-1.557] | 1.564 [820-2.876] | 2.620 [1.252-4.682] | 3.595 [1.410-8.619] | <0,001 |
| 5 | CA125, U/ml | 15 [9-28] | 12 [8-19] | 15 [10-28] | 17 [11-35] | 25 [13-62] | <0,001 |
| 7 | Ácido úrico, g/dl | 6,4 [5,0-8,0] | 5,4 [4,3-6,3] | 6,5 [5,2-8,1] | 7,1 [5,8-8,9] | 8 [6,3-9,7] | <0,001 |
| 14 | Hemoglobina glucosilada, % | 6,0 [5,5-6,5] | 5,8 [5,5-6,3] | 6,1 [5,6-6,6] | 6,1 [5,6-6,6] | 6,1 [5,5-7,1] | <0,001 |
| 4 | Proteínas totales, g/dl | 6,9 [6,6-7,3] | 6,9 [6,6-7,2] | 6,9 [6,6-7,2] | 7,0 [6,6-7,4] | 6,9 [6,4-7,2] | 0,551 |
| 8 | Albúmina, g/dl | 4,1 [3,8-4,4] | 4,2 [3,9-4,5] | 4,1 [3,8-4,4] | 4,0 [3,8-4,3] | 3,9 [3,6-4,2] | <0,001 |
| 3 | Colesterol total, mg/dl | 149 [124-181] | 151 [131-189] | 145 [115-174] | 150 [129-176] | 140 [116-177] | <0,001 |
| 10 | Fósforo, mg/dl | 3,5 [3,1-3,9] | 3,5 [3,1-3,8] | 3,5 [3,0-3,7] | 3,5 [3,1-3,9] | 3,8 [3,5-4,4] | <0,001 |
| 18 | iPTH, pg/ml | 78 [40-128] | 53 [28-87] | 79 [35-126] | 111 [66-166] | 129 [77-216] | <0,001 |
| 16 | Albuminuriab | 381 (41,1) | 122 (27,0) | 75 (36,1) | 106 (39,7) | 78 (43,6) | 0,003 |
| Tratamiento | |||||||
| 0 | IECA o ARA n (%) | 329 (29,7) | 149 (33,0) | 54 (26,0) | 76 (28,5) | 50 (27,9) | 0,258 |
| 0 | Sacubitrilo-valsartán | 514 (46,4) | 245 (54,1) | 115 (55,3) | 108 (40,4) | 46 (25,7) | <0,001 |
| 0 | Bloqueadores beta | 874 (79,0) | 386 (85,2) | 166 (79,8) | 189 (70,8) | 133 (74,3) | <0,001 |
| 0 | ARM | 626 (56,5) | 316 (69,8) | 132 (63,5) | 122 (45,7) | 56 (31,3) | <0,001 |
| 0 | iSGLT2 | 642 (58) | 287 (63) | 129 (62) | 141 (53) | 85 (48) | 0,001 |
| 0 | Furosemida | 808 (72,9) | 252 (55,6) | 153 (73,6) | 236 (88,4) | 167 (93,3) | <0,001 |
| 0 | Equivalente de dosis de furosemida, mg/d | 40 (0-80) | 20 (0-40) | 40 (0-80) | 60 (40-80) | 80 (40-120) | <0,001 |
| 0 | Tiazidas | 142 (13,0) | 19 (4,2) | 26 (12,5) | 45 (16,9) | 52 (29,1) | <0,001 |
| 1 | Tratamiento con hierro i.v.c | 241 (22) | 72 (16) | 47 (23) | 69 (26) | 53 (30) | <0,001 |
| 0 | FEE | 53 (4,8) | 3 (0,7) | 5 (2,4) | 12 (14,5) | 33 (18,4) | <0,001 |
| 1 | AVK | 232 (21,0) | 80 (17,7) | 35 (16,8) | 67 (25,1) | 50 (28,2) | 0,004 |
| 1 | ACOD | 437 (40) | 158 (35) | 89 (43) | 123 (46,1) | 67 (37) | 0,018 |
| 0 | Digoxina | 66 (6,0%) | 30 (6,6) | 14 (6,5) | 17 (6,4) | 5 (2,8) | 0,281 |
| 0 | Fijadores de potasio | 56 (5,1) | 10 (2,2) | 13 (6,3) | 21 (7,9) | 12 (6,7) | 0,003 |
ACOD, anticoagulantes orales directos; ARA, antagonistas de receptores de angiotensina II; ARM, antagonistas de receptores de mineralcorticoides; AVK, antagonistas de la vitamina K. DSPAT, desplazamiento sistólico del plano del anillo tricuspídeo; EPOC, enfermedad pulmonar obstructiva crónica; FEE, fármaco estimulador de la eritropoyesis; FEVI, fracción de eyección ventricular izquierda; FGe, filtración glomerular estimada; HVI, hipertrofia ventricular izquierda; i.v., vía intravenosa; IC, insuficiencia cardiaca; DAI, desfibrilador automático implantable; IECA, inhibidores de la enzima de conversión de la angiotensina; IMC, índice de masa corporal; CA125, antígeno carbohidrato125; iSLGT2, inhibidores de cotransportador de sodio-glucosa; NT-proBNP, propéptido natriurético cerebral aminoterminal; NYHA, New York Heart Association; PAD, presión arterial diastólica; PAPs, presión arterial pulmonar sistólica; PAS, presión arterial sistólica.
Los datos se expresan en forma de número (%), media±desviación estándar o mediana [rango intercuartílico].
Categorías de RACU junto con los estadios de FGe
| AlbuminuriaN=926 pacientes | |||
|---|---|---|---|
| Categoría de ACR | |||
| A1: normal alevemente aumentada | A2: moderadamente aumentada | A3: intensamente aumentada | |
| Estadios de FGe | <30 mg/g | 30-299 mg/g | 300 mg/g |
| FGe ≥ 60 ml/min/1,73 m2 | 545 (59) | 315 (34) | 66 (7) |
| 272 (29,3) | 109 (11,7) | 13 (1,4) | |
| FGe 45-59 ml/min/1,73 m2 | 102 (11,0) | 67 (7,2) | 8 (0,9) |
| FGe 30-44 ml/min/1,73 m2 | 114 (12,3) | 85 (9,1) | 21 (2,3) |
| FGe <30 ml/min/1,73 m2 | 57 (6,1) | 54 (5,8) | 24 (2,6) |
ACR, cociente albúmina-creatinina urinaria; FGe, filtración glomerular estimada.
Los datos se expresan en forma de número (%).
Los parámetros demográficos y las características clínicas iniciales, así como el tratamiento farmacológico, se presentan de manera estratificada según las categorías de FGe en la tabla 1. La distribución de la muestra en las diversas categorías de FGe fue la siguiente: 453 (40,9%) en las categorías G1 o G2, 208 (18,8%) en la categoría G3a, 267 (24,1%) en la categoría G3b y 179 (16,2%) en las categorías G4 o G5. Es de destacar que 122 (11% de los pacientes con una FGe ≥ 60 ml/min/1,73 m2 presentaron una ACR ≥ 30 mg/g (tabla 2). En términos generales, el perfil de riesgo en la situación inicial empeoraba al pasar de una FGe más alta a una más baja. De forma análoga, los pacientes con una reducción grave de la FGe (< 30 ml/min/1,73 m2) presentaron concentraciones plasmáticas superiores de NT-proBNP [3.595 (1.411-8.591) frente a 1.213 (508-2.776); p <0,001] y de CA125 [25 (13-63) frente a 14 (9-24), p <0,001)] y tuvieron una mayor probabilidad de presentar anemia (p <0,001) e hiperpotasemia (potasio sérico ≥ 5,5 mEq/l) (p <0,001). El fenotipo de IC fue también diferente en los distintos estratos de FGe. La FEVI mostró un aumento progresivo al pasar de las categorías de FGe superiores a las inferiores. De hecho, más de la mitad (54,2%) de los pacientes con una reducción grave de la FGe (categorías G4 o G5) tenían una FEVI conservada.
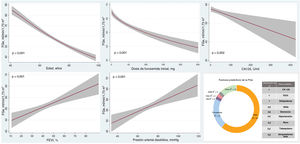
Factores asociados a una filtración glomerular estimada disminuidaEl análisis multivariante reveló que las variables independientes asociadas a una FGe disminuida (que explicaban hasta un 82% de la variabilidad del modelo) eran las siguientes, por orden de importancia: edad (efecto negativo, R2: 62%, p <0,001) y dosis de furosemida (efecto negativo, R2: 21%, p <0,001). Entre las demás covariables asociadas a unFGe inferior, el CA125 mostró una relación inversa y lineal con el FGe (R2: 1%, p=0,002), mientras que la asociación fue positiva y lineal para la presión arterial diastólica y la FEVI (R2: 2%, p <0,001 y R2: 1%, p <0,001, respectivamente) (figura 2). El valor de R2 del modelo fue del 47%.
Factores predictivos de la FGe tras el análisis multivariante. CA125, antígeno carbohidrato125; ERC, enfermedad renal crónica; PAD, presión arterial diastólica; DM, diabetes mellitus; FGe, filtración glomerular estimada; FEVI, fracción de eyección ventricular izquierda; ARM, antagonistas de receptores de mineralcorticoides; iSRA, inhibidores del sistema renina-angiotensina.
En la población total (con independencia de la FEVI), la prescripción de diuréticos del asa y tiazidas aumentó progresivamente al pasar de las categorías de FGe superiores a las inferiores. Casi un 30% de los pacientes con una FGe <30 ml/min/1,73 m2 estaban siendo tratados con furosemida junto con tiazidas en el momento de la inclusión en el registro. Se observó un patrón similar con los equivalentes de dosis de furosemida, con dosis más altas en los pacientes con una FGe más baja.
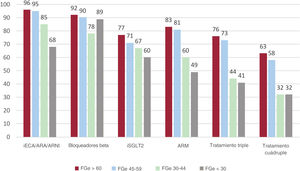
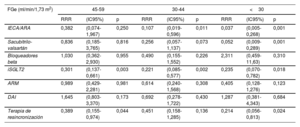
En el total de la muestra, 526 pacientes (48%) presentaban una ICFEr (FEVI ≤ 40%). Al analizar la prescripción del tratamiento según lo establecido en las guías en los distintos estratos de FGe en los pacientes con ICFEr, observamos que el porcentaje de pacientes a los que se prescribían inhibidores del sistema renina-angiotensina (iSRA), inhibidores del receptor angiotensina-neprilisina (ARNI), inhibidores de cotransportador de sodio-glucosa (iSGLT2) o antagonista de receptores de mineralcorticoides (ARM) disminuía progresivamente al pasar de las categorías de FGe superiores a las inferiores (figura 3). En los pacientes con una FGe ≥ 45 ml/min/1,73 m2, la implementación del tratamiento fue similar, con más de un 90% de los pacientes a los que se había prescrito un iSRA o un ARNI, un 80% con prescripción de un ARM y un 70% con prescripción de un iSGLT2. En los pacientes con una FGe <45 ml/min/1,73 m2, las proporciones de los tratados con estos tipos de fármacos fueron inferiores, aunque con valores que superaban el 50%. Al evaluar la proporción de pacientes que recibía un tratamiento triple o cuádruple, observamos una implementación elevada en los pacientes con un FGe ≥ 45 ml/min/1,73 m2 (más de un 70% y 60% respectivamente), y una implementación moderada (> 40% y > 30% respectivamente) en los que tenían unFGe <45 ml/min/1,73 m2. Estas diferencias persistieron tras un ajuste respecto a las comorbilidades y el uso de medicación en el análisis multivariante, en comparación con los pacientes con unFGe> 60 ml/min/1,73 m2 (categoría de referencia) (tabla 3).
Porcentaje de tratamientos según el estrato de la filtración glomerular estimada (FGe) en pacientes con insuficiencia cardiaca con fracción de eyección reducida (ICFEr). IECA, inhibidores de la enzima de conversión de la angiotensina; ARA, antagonistas de receptores de angiotensina II; ARNI, inhibidores de receptores de angiotensina y neprilisina; ARM, antagonistas de receptores de mineralcorticoides; iSLGT2, inhibidores de cotransportador de sodio-glucosa.
Tratamiento médico y con dispositivos en pacientes con ICFEr en las diversas categorías de FGe después de un ajuste multivariante
| FGe (ml/min/1,73 m2) | 45-59 | 30-44 | <30 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| RRR | (IC95%) | p | RRR | (IC95%) | p | RRR | (IC95%) | p | |
| IECA/ARA | 0,382 | (0,074-1,967) | 0,250 | 0,107 | (0,019-0,596) | 0,011 | 0,037 | (0,005-0,268) | 0,001 |
| Sacubitrilo-valsartán | 0,836 | (0,185-3,765) | 0,816 | 0,256 | (0,057-1,137) | 0,073 | 0,052 | (0,009-0,289) | 0,001 |
| Bloqueadores beta | 1,030 | (0,362-2,930) | 0,955 | 0,490 | (0,155-1,552) | 0,226 | 2,311 | (0,459-11,63) | 0,310 |
| iSGLT2 | 0,301 | (0,137-0,661) | 0,003 | 0,221 | (0,085-0,577) | 0,002 | 0,235 | (0,070-0,782) | 0,018 |
| ARM | 0,989 | (0,429-2,281) | 0,981 | 0,614 | (0,240-1,568) | 0,308 | 0,405 | (0,128-1,276) | 0,123 |
| DAI | 1,645 | (0,803-3,370) | 0,173 | 0,692 | (0,278-1,722) | 0,430 | 1,287 | (0,381-4,343) | 0,684 |
| Terapia de resincronización | 0,389 | (0,155-0,974) | 0,044 | 0,451 | (0,158-1,285) | 0,136 | 0,214 | (0,056-0,813) | 0,024 |
ARA, antagonistas de receptores de angiotensina II; ARM, antagonistas de receptores de mineralcorticoides; DAI, desfibrilador automático implantable; FGe, filtración glomerular estimada; IC, intervalo de confianza; ICFEr, insuficiencia cardiaca con fracción de eyección reducida; IECA, inhibidores de la enzima de conversión de la angiotensina; iSLGT2, inhibidores de cotransportador de sodio-glucosa; RRR, reducción del riesgo relativo.
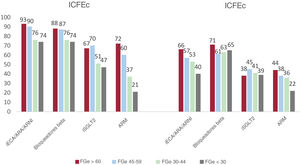
Por otro lado, un total de 419 (37,9%) y 162 pacientes (14,6%) presentaban una ICFEp y una IC con fracción de eyección levemente reducida, respectivamente. Los patrones de uso de los tratamientos médicos según lo establecido en las guías en los pacientes con ICFElr estuvieron más próximos a los de los pacientes con ICFEr, mientras que se observaron tasas inferiores en los pacientes con una ICFEp (figura 4).
Porcentaje de tratamientos según el estrato de la filtración glomerular estimada (FGe) en pacientes con insuficiencia cardiaca con fracción de eyección levemente reducida (ICFElr) o con fracción de eyección conservada (ICFEc). ARA, antagonistas de receptores de angiotensina II; ARM, antagonistas de receptores de mineralcorticoides; ARNI, inhibidores de receptores de angiotensina y neprilisina; IECA, inhibidores de la enzima de conversión de la angiotensina; iSLGT2, inhibidores de cotransportador de sodio-glucosa.
En esta cohorte multicéntrica, prospectiva y contemporánea en la que se evaluó a más de 1.000 pacientes con IC crónica de España, evidenciamos 3 hallazgos importantes. En primer lugar, hasta donde sabemos, la prevalencia de la enfermedad renal es la más alta descrita en una población con IC estable1–4, que incluye una de las series más amplias de albuminuria en pacientes con IC crónica. En segundo lugar, el diseño prospectivo nos permitió describir el perfil clínico actual y el tratamiento de una población amplia de pacientes con IC crónica que incluía todas las categorías de FGe. Por último, este es el primer estudio en el que se evalúa la implementación del tratamiento cuádruple en una población amplia de pacientes con ICFEr estable y enfermedad renal.
La IC y la ERC coexisten con frecuencia debido al solapamiento de su fisiopatología (es decir, el síndrome cardiorrenal) y a los factores de riesgo cardiometabólicos comunes que conducen de forma paralela a ambas enfermedades. Sin embargo, a pesar de la concienciación creciente respecto a la ERC como comorbilidad que multiplica el riesgo en la IC, los estudios contemporáneos de la práctica clínica real en los que se describe el perfil clínico de los pacientes con una IC crónica y una ERC combinada son escasos14. Además, hay pocas publicaciones que contengan información sobre la albuminuria, el estado de congestión y las comorbilidades específicas renales como la anemia, la ferropenia, las alteraciones del metabolismo del calcio y el fósforo y la hiperpotasemia.
En la presente cohorte, hasta un 70% de los pacientes con IC crónica presentaban un cierto grado de disfunción renal. Esta prevalencia notablemente elevada puede ser consecuencia de varios factores. En primer lugar, este estudio incluyó a pacientes contemporáneos de práctica clínica, caracterizados por una edad avanzada, un aumento de la prevalencia de ICFEp, y una carga elevada de factores de riesgo y comorbilidades. Además, las determinaciones de la albuminuria (de las que se dispuso en un 83% de los pacientes) identificaron un deterioro de la función renal en un 11% de los pacientes con una FGe ≥ 60 ml/min/1,73 m2. Por último, aunque la inclusión de pacientes con IC en programas de seguimiento específicos es actualmente una práctica muy difundida, es posible que un sesgo de selección pueda haber contribuido a causar esta elevada prevalencia.
Cabe destacar que, a pesar de la elevada prevalencia de la ERC en esta población, el perfil clínico de la IC difería en las diversas categorías de FGe. Los pacientes con unFGe más alta eran predominantemente varones, tenían una carga de comorbilidad más baja y presentaban una FEVI reducida. En cambio, el fenotipo clínico de los pacientes con una IC y una ERC avanzada combinadas se caracterizó principalmente por la edad avanzada, el sexo femenino y la FEVI conservada. Además, el desequilibrio de la homeostasis de volumen fue una manifestación prominente en la presentación clínica de este fenotipo cardiorrenal. Este estudio muestra que los pacientes con una ERC avanzada, y en especial los que tenían una FGe <45 ml/min/m2, mostraron más signos de sobrecarga de volumen según lo evaluado mediante la puntuación CCS, los biomarcadores (CA125) y los indicadores indirectos ecográficos de la congestión venosa. Tiene interés señalar que, tras un ajuste multivariable, el CA125 (y no en cambio el NT-proBNP) fue el único marcador indirecto de la congestión asociado a una FGe más baja. Una posible explicación de esta observación podría ser que los valores de CA125 no se ven influidos por la FEVI, la edad ni el FGe y que muestran una correlación alta con los indicadores indirectos de la IC de lado derecho (todos ellos observados con frecuencia en esta población)14,15. El CA125, que es un marcador de la sobrecarga de volumen, puede ser útil para identificar a los pacientes con un riesgo superior de nefropatía congestiva. De hecho, teniendo en cuenta la asociación demostrada entre el CA125 y la congestión renal16,17, es muy probable que la nefropatía congestiva sea, en parte, la culpable de la progresión de la ERC. Este aspecto podría explicar también la asociación inversa entre los equivalentes de dosis de furosemida y la de FGe (dosis más altas en los pacientes con un estado de congestión más grave).
Otro aspecto relevante que merece ser resaltado es la prevalencia elevada de comorbilidades de origen renal a medida que disminuía la FGe. Por ejemplo, observamos un aumento escalonado de la prevalencia de la anemia al pasar de las categorías de FGe altas a las bajas. Es de destacar que esta observación no estaba relacionada con el estado del hierro, puesto que no observamos diferencias de ferropenia entre las diversas categorías de la FGe. Así pues, se trataba probablemente de una anemia de causa renal, que es una comorbilidad frecuente y que a menudo no es tenida en cuenta en los pacientes con IC.
Tratamiento recomendado por las guías en los pacientes con insuficiencia cardiaca con fracción de eyección reducida y enfermedad renal crónicaSe ha demostrado que el tratamiento médico recomendado en guías reduce la morbilidad y la mortalidad en los pacientes con ICFEr, y su uso se recomienda como indicación de clase I en las guías de práctica clínica en pacientes con ICFEr11. Sin embargo, tradicionalmente, los pacientes con una ERC avanzada han sido excluidos de los ensayos clínicos cardiovasculares. Dado que estos fármacos pueden inducir una disminución inicial de el FGe, los clínicos dudan en iniciar o ajustar estos tratamientos, ya que cualquier deterioro de la función renal es percibido a menudo como nocivo18–20. De hecho la presencia de enfermedad renal es una de las principales razones de una implementación poco efectiva de la medicación en los pacientes con IC, incluso en aquellos que presentan una ERC leve a moderada8,10.
Esta tendencia se observó también en la presente cohorte, en la que la proporción de pacientes que recibieron un tratamiento médico según las guías (TMSG) se redujo en paralelo con el descenso de la FGe. No obstante, es importante resaltar que la implementación del TMSG en los diversos estratos de FGe es una de las más altas descritas en la literatura médica. Por ejemplo, el registro sueco de IC ha publicado recientemente la prescripción de los tratamientos recomendados en las guías en 31.668 pacientes con IC, según su FGe8. En ese registro, las proporciones de pacientes que recibieron un tratamiento triple (combinación de iSRA/ARNI+ARM+ bloqueadores beta) fue del 38%, 35%, 28% y 15% en los pacientes con valores de FGe ≥ 60, 45-59, 30-44 y <30 ml/min/1,73 m2, respectivamente. Aunque las características iniciales fueron ligeramente diferentes, estos porcentajes de implementación están lejos de las proporciones de TMSG alcanzadas en nuestro estudio, en el que el porcentaje de pacientes que recibió un tratamiento triple fue significativamente mayor, incluso en los que presentaban una ERC avanzada. Por último, la proporción de uso de dispositivos es mayor que la descrita en otros registros o ensayos contemporáneos en la ICFEr, como el ensayo DAPA HF, en el que el uso de un DAI fue del 26%21.
Por otro lado, la guía de la Sociedad Europea de Cardiología de 2021 incluyó recomendaciones de tratamiento para los pacientes con IC y una FEVI levemente reducida (recomendaciones de clase IIb)11, mientras que no se actualizó ningún tratamiento específico para la ICFEp. En este estudio describimos los patrones de prescripción tanto en la población con ICFElr como en la población con ICFEp. La implementación del tratamiento fue similar a la descrita en estudios previos sobre el uso de iSRA y bloqueadores beta22,23. Sin embargo, el uso de ARM fue superior. Además, alrededor de un 40% de nuestros pacientes con ICFEp recibían tratamiento con un iSGLT2, con independencia de la función renal. El uso de iSGLT2 en esta población se debió probablemente en parte a la prevalencia de la diabetes mellitus y la nueva evidencia relativa a los efectos beneficiosos de este tratamiento en la ICFEp24.
Otra explicación posible de todas estas diferencias podría ser la de que esta población procede de programas específicos de IC, lo cual puede constituir un sesgo, pero también resalta las posibles ventajas de estos modelos de asistencia estructurados y especializados.
Perspectivas futuras y consecuencias clínicasEl presente registro refuerza el mensaje de que la prevalencia de la enfermedad renal en los pacientes con IC de la práctica clínica real es notablemente elevada. La longevidad de la población, el aumento de la prevalencia de los factores de riesgo cardiovascular y las comorbilidades asociadas han contribuido probablemente al crecimiento de este fenotipo de enfermedad cardiorrenal, que se caracteriza por la edad avanzada, una carga elevada de comorbilidades y congestión, y una FEVI conservada. Así pues, los clínicos deben ser conscientes de esta entidad patológica emergente y de sus consecuencias clínicas. Un diagnóstico temprano y un trabajo en equipo multidisciplinarpodrán llevar a un inicio temprano de los tratamientos modificadores de la enfermedad y a un abordaje más personalizado y estructurado. Además, el desarrollo de programas específicos y coordinados de atención al paciente cardiorrenal, para mejorar el diagnóstico y ofrecer tratamientos adecuados basados en la evidencia, educación sanitaria y un seguimiento apropiado pueden mejorar los resultados en esta población cada vez más compleja25.
LimitacionesEste estudio tiene ciertas limitaciones. En primer lugar, aunque en todos los pacientes se dispuso de una determinación previa delFGe en la historia clínica, esta medición no se especificó a priori para un intervalo de tiempo específico. En consecuencia, es posible que la determinación en el momento de la inclusión haya clasificado erróneamente a algunos pacientes. No obstante, esta es la información que con frecuencia se dispone en la práctica clínica habitual. Además, la albuminuria no se determinó en un 17% de los pacientes, y ello podría haber modificado la clasificación de la ERC en algunos pacientes. En segundo lugar, la inclusión de los pacientes se realizó en consultas de IC especializadas. En consecuencia, la extrapolación a otros métodos de seguimiento, países o sistemas de asistencia sanitaria debe hacerse con precaución. En tercer lugar, a pesar de que el protocolo del registro exigía una inclusión consecutiva, no podemos garantizar que este requisito fuera respetado en todos los centros, y no se obtuvo información sobre las negativas a participar. En cuarto lugar, la información sobre las dispensaciones de farmacia puede no indicar necesariamente que los pacientes tomaran esa medicación.
CONCLUSIONESGlobalmente, el 70% de los pacientes con IC crónica presentaron algún grado de disfunción renal. La evaluación de la albuminuria mejoró la detección de la enfermedad renal. Los pacientes con una IC y un deterioro de la función renal concomitantes presentaron un perfil basal más desfavorable. Aunque la implementación de los tratamientos basados en la evidencia en esta población con ICFEr fue alta, los pacientes con una enfermedad renal concomitante tuvieron una menor probabilidad de que se les prescribieran tratamientos médicos basados en la evidencia.
- -
La enfermedad renal crónica es una comorbilidad frecuente e importante en los pacientes con insuficiencia cardiaca.
- -
El nexo cardiorrenal engloba una relación bidireccional, que agrava el pronóstico y puede complicar el tratamiento farmacológico en los pacientes con una enfermedad cardíaca y renal concomitantes.
- -
Los pacientes con una enfermedad renal crónica avanzada han sido excluidos tradicionalmente de los ensayos clínicos en la IC, y las estrategias de tratamiento han sido en gran parte empíricas.
- -
La prevalencia de la enfermedad renal, de un 70%, es la más alta descrita en una población con IC estable.
- -
Describimos el fenotipo cardiorrenal, caracterizado por edad avanzada, sexo femenino, deterioro de la homeostasis de volumen y una fracción de eyección ventricular izquierda preservada.
- -
Este es el primer estudio en el que se evalúa la implementación del tratamiento de la cuádruple terapia en una población amplia de pacientes con insuficiencia cardiaca estable con fracción de eyección reducida y una enfermedad renal.
- -
La implementación del tratamiento médico según las guías en los diversos estratos de filtrado glomerular estimado es una de las más altas descritas en la literatura, lo cual resalta las posibles ventajas de los modelos de asistencia estructurados y especializados.
Este trabajo contó con el apoyo de AstraZeneca España.
CONTRIBUCIÓN DE LOS AUTORESM. Cobo Marcos y J. Núñez participaron en la concepción y el diseño del estudio. M. Cobo Marcos y R. de la Espriella son primeros autores por igual. M. Cobo Marcos, J. Núñez, R. de la Espriella, J. Gayán Ordás, P Llàcer, A. Pomares, A. Fort, I. Ponz de Antonio, A. Méndez, Z. Blázquez-Bermejo, P. Caravaca Pérez, J. Rubio Gracia, A. Recio-Mayoral, I. Zegrí, JM. García Pinilla, E. Montero Hernández, A. Castro, M.J. Soler, J.L. Górriz, R. Bascompte Claret, P. Fluvià-Brugués y L. Manzano participaron en el análisis y la interpretación de los datos, la redacción de la propuesta inicial del manuscrito y la revisión crítica respecto a contenido intelectual importante, y aprobaron la versión final del manuscrito presentado para publicación.
CONFLICTO DE INTERESESTodos los autores declaran haber recibido subvenciones de AstraZeneca durante la realización del estudio. M. Cobo Marcos declara haber recibido pagos personales de AstraZeneca, Vifor Pharma, Novartis, Rovi, Boehringher-Ingelheim, Novonordisk, Esteve y Bayer. A. Pomares declara haber recibido pagos personales de Pfizer y apoyo para la asistencia a congresos de Novartis y Bayer. A. Méndez declara haber recibido pagos personales de AstraZeneca y Novartis, apoyo para la asistencia a congresos de Novartis, Boehringher-Ingelheim y AstraZeneca; J. Rubio Gracia declara haber recibido pagos personales de AstraZeneca, Novartis, Boehringher-Ingelheim, Esteve y Bayer. A. Recio-Mayoral declara haber recibido pagos personales de AstraZeneca, Novartis, Boehringher-Ingelheim, Janssen, Bayer, MSD y Vifor Pharma, y apoyo para la asistencia a congresos de Bayer, MSD y Novartis. J.M. García Pinilla declara haber recibido pagos personales de AstraZeneca, Vifor Pharma, Novartis, Boehringher-Ingelheim, Pfizer y Bayer. E. Montero Hernández declara haber recibido pagos por conferencias de AstraZeneca, Boehringher-Ingelheim y Lilly. M.J. Soler Romeo declara haber recibido pagos personales de NovoNordisk, Jansen, Boehringer-Ingelheim, Mundipharma, Esteve, Fresenius, Ingelheim Lilly, Vifor, ICU Medical, Travere Therapeutics, subvenciones de Boehringher-Ingelheim, Marató TV3 e Instituto Carlos III; Editor Jefe de CKJ; M.J. Soler Romeo tiene una patente 202131356. J.L. Górriz declara haber recibido subvenciones para investigación de AstraZeneca, CSL Vifor, pagos personales por conferencias de AstraZeneca, Boehringher-Ingelheim, Lilly, Novartis y Novonordisk. P. Fluvià-Brugués declara haber recibido honorarios por conferencias de Novartis, AstraZeneca, Boehringer-Ingelheim y Rovi y apoyo para la asistencia a congresos de Novartis, AstraZeneca y Boehringer-Ingelheim. L. Manzano declara haber recibido honorarios por conferencias de AstraZeneca, Novartis, Boehringher-Ingelheim, Rovi y Bayer y apoyo para la asistencia a congresos de AstraZeneca, Pfizer, Novartis, Boehringher-Ingelheim, y por la participación en consejos asesores de Bayer, Lilly, Novartis y Pfizer. J. Núñez declara haber recibido subvenciones de Vifor Pharma, pagos personales de Novartis, Rovi, Boehringher-Ingelheim, Novonordisk y Bayer. Los demás autores declaran no tener conflictos de intereses.