El derrame pericárdico tumoral presenta una elevada tasa de recurrencia tras la pericardiocentesis. Se busca confirmar la eficacia de la pericardiotomía percutánea con balón como tratamiento inicial de elección de estos derrames.
MétodosAnálisis retrospectivo de las características clínicas, ecocardiográficas y evolutivas de una serie monocéntrica y consecutiva de pericardiotomías percutáneas con balón en pacientes con enfermedad oncológica avanzada.
ResultadosSe han realizado 17 pericardiotomías percutáneas con balón en 16 pacientes (media de edad, 66,2 ± 15,2 años); 14 pacientes tenían confirmación anatomopatológica de enfermedad neoplásica metastásica; 3 habían requerido una pericardiocentesis previa, mientras que en los restantes la pericardiotomía percutánea con balón fue la primera intervención sobre el derrame. Todos los casos presentaban derrame circunferencial grave, y la mayoría tenían datos ecocardiográficos de compromiso hemodinámico. El éxito inicial se logró sin complicaciones agudas y con buena tolerancia en un primer intento. Durante el seguimiento (mediana, 44 [intervalo intercuartílico, 36-225] días) tampoco hubo complicaciones infecciosas. En 1 paciente se demostró la aparición de un derrame pleural significativo, que no precisó tratamiento. Fue necesario realizar una reintervención sobre el pericardio en 3 pacientes: dos ventanas pericárdicas quirúrgicas programadas y una segunda pericardiotomía percutánea con balón.
ConclusionesLa pericardiotomía percutánea con balón es un técnica sencilla y segura que puede resultar eficaz en un gran número de pacientes con derrame pericárdico tumoral grave para evitar que recurra. Por sus características, resultaría de especial utilidad en este grupo de pacientes para evitar abordajes más agresivos y peor tolerados.
Palabras clave
La aparición de derrame pericárdico tumoral (DPT) en la evolución de la enfermedad oncológica es una complicación que empeora significativamente su pronóstico1,2 y que además puede resultar potencialmente fatal. Se ha observado que en general la supervivencia media de estos pacientes no supera los 5 meses1–4, por lo que en la mayoría de los casos parecería razonable realizar un manejo del derrame centrado en el alivio de los síntomas y en la prevención de las recurrencias.
Durante décadas la pericardiocentesis ha constituido el tratamiento habitual del DPT5 y actualmente todavía se sigue practicando un 25-44% de las pericardiocentesis intrahospitalarias a pacientes con este tipo de derrame1,2. No obstante, es sabido que la etiología neoplásica del derrame es un factor independiente de recidiva tras la pericardiocentesis2,6, y se alcanzan unas tasas de recurrencia de un 36-62%7,8, lo que implica que los pacientes con DPT tengan una probabilidad 5 veces mayor de requerir nuevas pericardiocentesis que los pacientes con derrame no tumoral1.
En 1991, Palacios et al9 describieron una nueva técnica percutánea para evitar dichas recidivas, consistente en crear una ventana pericárdica inflando un balón. A lo largo de estos años se ha mostrado su eficacia y su seguridad10–19, y recientemente se ha propuesto que la pericardiotomía percutánea con balón (PPB) podría ser el tratamiento inicial de elección en estos pacientes con DPT sintomático19.
MÉTODOSSe han revisado retrospectivamente las historias clínicas y las imágenes ecocardiográficas y de escopia de los pacientes con sospecha o confirmación previa de DPT sometidos a PPB en nuestro centro. Se han recogido las variables clínicas cardiológicas y oncológicas, el resultado a corto y medio plazo del procedimiento y las complicaciones agudas derivadas, el índice de recurrencia del derrame y la necesidad de reintervención.
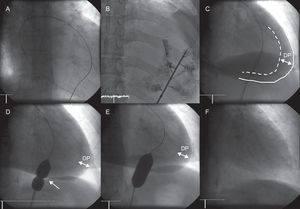
ProcedimientoCon sedoanalgesia superficial (midazolam 1-2 mg i.v. y morfina 2,5 mg i.v., repetidas ambas dosis antes del inflado del balón si es preciso), profilaxis antibiótica (cefazolina 1 g/8 h i.v, iniciada antes del procedimiento, con un total de tres dosis) y control por fluoroscopia, se accede al derrame pericárdico mediante abordaje percutáneo subxifoideo según la técnica convencional de pericardiocentesis. Inicialmente, tras extraer una mínima cantidad de derrame, se inyecta por el catéter de drenaje unos mililitros de contraste yodado para delimitar mejor el espacio pericárdico. A continuación, con el apoyo de una guía de intercambio de 0,035” y un introductor de 10-12 Fr, se coloca un balón de dilatación a través del pericardio parietal y se realizan varios inflados manuales hasta la desaparición total de la muesca creada por el pericardio en el balón. Se finaliza el procedimiento con la aspiración manual del líquido pericárdico, para lo cual se retira el balón de dilatación a través de la guía de intercambio y se vuelve a introducir el catéter de drenaje, sirviéndonos de las imágenes de fluoroscopia para dirigirlo hacia las zonas de derrame remanente. Antes de abandonar la sala de hemodinámica, se practica un ecocardiograma transtorácico para confirmar la ausencia de complicaciones y la desaparición del derrame pericárdico (fig. 1). En la gran mayoría de los casos, en ese momento se retira el drenaje, y se recomienda control radiológico a las 24-48 h y ecocardiográfico a las 48-72 h para descartar la aparición de derrame pleural significativo y la recurrencia del derrame pericárdico.
Pericardiotomía percutánea con balón. A: acceso percutáneo subxifoideo al espacio pericárdico. B: inyección de 10-15 ml de contraste yodado. C: visualización del derrame pericárdico, silueta cardiaca (línea discontinua) y pericardio parietal (línea continua). D y E: inflados repetidos del balón para lograr el borrado progresivo de la muesca creada por el pericardio en el balón (flecha) hasta su total desaparición. F: resultado final tras la pericardiotomía con balón y el drenaje completo del derrame pericárdico. DP: derrame pericárdico.
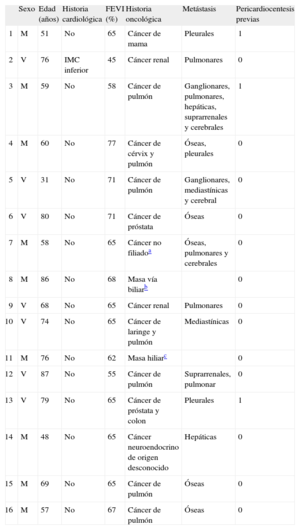
Desde abril de 2008 se han realizado en nuestro centro 17 PPB en 16 pacientes con sospecha o confirmación previa de DPT. En la tabla 1 se recogen los características demográficas y clínicas de estos pacientes. La media de edad del grupo era 66,2 ± 15,2 (31-87) años y había 9 mujeres; tan sólo 1 paciente tenía historia cardiológica conocida; 13 pacientes tenían confirmación anatomopatológica previa de enfermedad oncológica, en otro paciente se obtuvo del estudio del líquido pericárdico extraído durante la PPB y en otros 2 se desestimó realizar más estudios en presencia de masas biliar e hiliar no filiadas que radiológicamente apuntaban a neoplasia. Los 14 pacientes con diagnóstico anatomopatológico estaban en estadio oncológico avanzado, con metástasis en diversos órganos además del pericardio. Tres pacientes habían requerido con anterioridad una pericardiocentesis por taponamiento cardiaco, y en ellos la PPB se realizó en un segundo tiempo por recurrencia del derrame, mientras que en los restantes 13 pacientes la PPB se realizó como primer tratamiento de su derrame pericárdico.
Características demográficas y clínicas de los pacientes
| Sexo | Edad (años) | Historia cardiológica | FEVI (%) | Historia oncológica | Metástasis | Pericardiocentesis previas | |
| 1 | M | 51 | No | 65 | Cáncer de mama | Pleurales | 1 |
| 2 | V | 76 | IMC inferior | 45 | Cáncer renal | Pulmonares | 0 |
| 3 | M | 59 | No | 58 | Cáncer de pulmón | Ganglionares, pulmonares, hepáticas, suprarrenales y cerebrales | 1 |
| 4 | M | 60 | No | 77 | Cáncer de cérvix y pulmón | Óseas, pleurales | 0 |
| 5 | V | 31 | No | 71 | Cáncer de pulmón | Ganglionares, mediastínicas y cerebral | 0 |
| 6 | V | 80 | No | 71 | Cáncer de próstata | Óseas | 0 |
| 7 | M | 58 | No | 65 | Cáncer no filiadoa | Óseas, pulmonares y cerebrales | 0 |
| 8 | M | 86 | No | 68 | Masa vía biliarb | 0 | |
| 9 | V | 68 | No | 65 | Cáncer renal | Pulmonares | 0 |
| 10 | V | 74 | No | 65 | Cáncer de laringe y pulmón | Mediastínicas | 0 |
| 11 | M | 76 | No | 62 | Masa hiliarc | 0 | |
| 12 | V | 87 | No | 55 | Cáncer de pulmón | Suprarrenales, pulmonar | 0 |
| 13 | V | 79 | No | 65 | Cáncer de próstata y colon | Pleurales | 1 |
| 14 | M | 48 | No | 65 | Cáncer neuroendocrino de origen desconocido | Hepáticas | 0 |
| 15 | M | 69 | No | 65 | Cáncer de pulmón | Óseas | 0 |
| 16 | M | 57 | No | 67 | Cáncer de pulmón | Óseas | 0 |
FEVI: fracción de eyección del ventrículo izquierdo; IMC: infarto de miocardio crónico; M: mujer; V: varón.
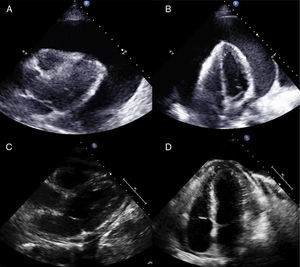
La indicación para la PPB fue en todos los casos un derrame pericárdico circunferencial grave (también denominado como severo) (≥ 20 mm) (fig. 2). La gran mayoría de los pacientes tenían además diversos datos ecocardiográficos de compromiso hemodinámico. Cinco de los ecocardiogramas de control disponibles realizados en las primeras 72 h mostraban recurrencia de un derrame pericárdico moderado o grave, aunque tan sólo en 2 de ellos se observaban datos de compromiso hemodinámico. En 2 de estos 5 pacientes, la recurrencia del derrame fue en forma de derrame localizado no circunferencial (tabla 2).
Ejemplo de derrame pericárdico tumoral circunferencial grave, tratado mediante pericardiotomía percutánea con balón (paciente 5) y su evolución a los 8 meses sin nuevas intervenciones. A y B: planos paraesternal y apical del derrame tumoral grave (40 mm) antes del tratamiento mediante pericardiotomía percutánea con balón. C y D: planos paraesternal y apical a los 8 meses, en los que se observa sólo un derrame pericárdico muy ligero.
Características ecocardiográficas de los derrames tumorales sometidos a pericardiotomía percutánea con balón
| Derrame pre-PPB (mm) | Datos ecocardiográficos de compromiso hemodinámico | Ecocardiograma < 72 h post-PPB | |
| 1 | 30 | Colapso AD y VD | Derrame moderado posterolateral, sin compromiso hemodinámico |
| 2 | 35 | Variaciones respiratorias patológicas transmitrales | Sin derrame |
| 3 | 35 | Colapso AD y VD y variaciones respiratorias patológicas transmitrales | Derrame mínimo |
| 4 | 25 | Colapso AD, VD y AI | Derrame mínimo |
| 5 | 40 | Colapso AD y VD y variaciones respiratorias patológicas transmitrales y transtricuspídeas | No disponiblea |
| 6 | 34 | Colapso AD y VD y variaciones respiratorias patológicas transmitrales y transaórticas | Sin derrame |
| 7 | 25 | Colapso AD, VD y AI | Derrame circunferencial ligero |
| 8 | 30 | No presentes | Derrame circunferencial grave sin compromiso hemodinámico |
| 9 | 35 | Colapso AD y variaciones respiratorias patológicas transmitrales | Derrame grave organizado, anterolateral, con colapso AD y variaciones respiratorias patológicas transmitrales menos acusadas |
| 10 | 27 | Variaciones respiratorias patológicas transmitrales y transtricuspídeas | Derrame circunferencial ligero |
| 11 | 24 | Colapso AD y VD y variaciones respiratorias patológicas transmitrales y transaórticas | No disponible |
| 12 | 25 | Colapso AD y VD | Derrame mínimo |
| 13 | 39 | Colapso AD y VD | No disponible |
| 14 | 50 | Colapso AD, VD y AI | Derrame circunferencial grave (30 mm) sin compromiso hemodinámico |
| 15 | 22 | Colapso AD y VD | Derrame circunferencial ligero |
| 16 | 20 | Colapso AD y VD | Derrame circunferencial moderado (17 mm) con colapso parcial de cavidades derechasb |
AD: aurícula derecha; AI: aurícula izquierda; PPB: pericardiocentesis percutánea con balón; VD: ventrículo derecho.
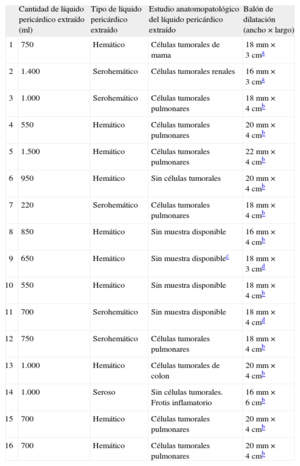
La PPB se llevo a cabo de forma programada en todos los casos, y en todos los pacientes se consiguió en un primer intento el éxito del procedimiento (definido como la desaparición total de la muesca en el inflado del balón y la ausencia de derrame pericárdico significativo al finalizar el caso). En la tabla 3 se muestra el tipo, la cantidad y el estudio anatomopatológico del derrame pericárdico evacuado, así como el tamaño de balón de dilatación usado en cada caso. No hubo ningún tipo de complicación aguda relacionada con la PPB dentro de la sala, y todos los pacientes presentaron buena tolerancia al procedimiento con la sedoanalgesia administrada.
Características del líquido pericárdico y los balones de dilatación utilizados
| Cantidad de líquido pericárdico extraído (ml) | Tipo de líquido pericárdico extraído | Estudio anatomopatológico del líquido pericárdico extraído | Balón de dilatación (ancho × largo) | |
| 1 | 750 | Hemático | Células tumorales de mama | 18 mm × 3 cma |
| 2 | 1.400 | Serohemático | Células tumorales renales | 16 mm × 3 cma |
| 3 | 1.000 | Serohemático | Células tumorales pulmonares | 18 mm × 4 cmb |
| 4 | 550 | Hemático | Células tumorales pulmonares | 20 mm × 4 cmb |
| 5 | 1.500 | Hemático | Células tumorales pulmonares | 22 mm × 4 cmb |
| 6 | 950 | Hemático | Sin células tumorales | 20 mm × 4 cmb |
| 7 | 220 | Serohemático | Células tumorales pulmonares | 18 mm × 4 cmb |
| 8 | 850 | Hemático | Sin muestra disponible | 16 mm × 4 cmb |
| 9 | 650 | Hemático | Sin muestra disponiblec | 18 mm × 3 cmd |
| 10 | 550 | Hemático | Sin muestra disponible | 18 mm × 4 cmb |
| 11 | 700 | Serohemático | Sin muestra disponible | 18 mm × 4 cmd |
| 12 | 750 | Serohemático | Células tumorales pulmonares | 18 mm × 4 cmb |
| 13 | 1.000 | Hemático | Células tumorales de colon | 20 mm × 4 cmb |
| 14 | 1.000 | Seroso | Sin células tumorales. Frotis inflamatorio | 16 mm × 6 cmb |
| 15 | 700 | Hemático | Células tumorales pulmonares | 20 mm × 4 cmb |
| 16 | 700 | Hemático | Células tumorales pulmonares | 20 mm × 4 cmb |
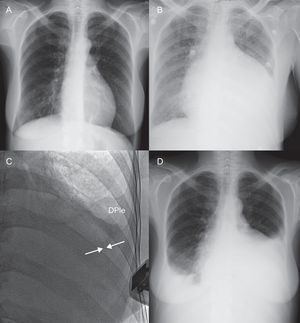
El seguimiento de los pacientes hasta agosto de 2012 o su fallecimiento fue una mediana de 44 [intervalo intercuartílico, 36-225] días. Durante la hospitalización que siguió a la PPB, no se documentó en ninguno de los casos fiebre u otro dato de infección atribuible al procedimiento. En un único caso (paciente 14), se demostró un agravamiento llamativo del derrame pleural izquierdo tras la PPB, aunque sin producir síntoma alguno, por lo que no fue necesario el drenaje (fig. 3). A pesar de que en el momento de realizarse la PPB tan sólo 1 paciente se encontraba en situación de taponamiento cardiaco franco, 12 pacientes refirieron mejoría de su estado general principalmente por la reducción de su disnea. En la evolución fue necesario realizar una nueva intervención sobre el pericardio en 3 pacientes. En 2 de ellos se realizó una ventana pericárdica quirúrgica de forma programada por recurrencia de un derrame pericárdico grave localizado. En el primero de ellos, la ventana quirúrgica se llevó a cabo pasados 79 días de la PPB por acumulación lentamente progresiva del derrame, mientras que en el segundo caso fue necesario realizarla a las 72 h de la PPB por rápida acumulación y datos ecocardiográficos de compromiso hemodinámico. Además, en un tercer caso (paciente 16), a pesar del éxito inicial del procedimiento y que la paciente refirió franca mejoría clínica las horas siguientes a la PPB, se nos solicitó la realización de una nueva PPB a las 48 h (balón de 22 mm × 4 cm; 350 ml de líquido hemático) por recurrencia de un derrame pericárdico circunferencial moderado (17 mm) y la clínica de disnea de reposo. Cabe destacar que al mes de esta segunda PPB no había derrame pericárdico en el ecocardiograma de control (tabla 4).
Evolución radiológica tras la realización de una pericardiotomía percutánea con balón (paciente 14). A: radiografía de tórax, realizada 2 meses antes, sin hallazgos patológicos significativos. B: 1 día antes de la pericardiotomía percutánea con balón, se observaba un incremento muy importante del índice cardiotorácico. C: tras el procedimiento se demuestra por escopia y ecocardiografía la persistencia de un mínimo derrame pericárdico (flechas), con una pequeña cantidad de derrame pleural ocupando el seno costofrénico izquierdo. D: a las 48 h, es llamativo el incremento del derrame pleural izquierdo y derecho, con un índice cardiotorácico todavía aumentado; en ese momento había derrame pericárdico grave, aunque de menor cuantía que antes de la intervención. DPIe: derrame pleural.
Evolución de los pacientes sometidos a pericardiotomía percutánea con balón
| Estado en agosto de 2012 | Seguimiento (días) | Reintervención sobre pericardio (tiempo tras PPB) | Motivo de reintervención sobre pericardio tras PPB | |
| 1 | Fallecido | 150 | Sí, ventana quirúrgica (79 días) | Recurrencia de derrame encapsulado grave localizado en cara anterolateral y ápex, con datos de compromiso hemodinámico |
| 2 | Fallecido | 340 | No | — |
| 3 | Fallecido | 28 | No | — |
| 4 | Fallecido | 208 | No | — |
| 5 | Fallecido | 286 | No | — |
| 6 | Vivo | 485 | No | — |
| 7 | Fallecido | 276 | No | — |
| 8 | Fallecido | 19 | No | — |
| 9 | Fallecido | 46 | Sí, ventana quirúrgica (72 h) | Recurrencia de derrame encapsulado grave localizado en cara anterolateral, con datos de compromiso hemodinámico |
| 10 | Fallecido | 74 | No | — |
| 11 | Fallecido | 5 | No | — |
| 12 | Fallecido | 40 | No | — |
| 13 | Fallecido | 39 | No | — |
| 14 | Vivo | 42 | No | |
| 15 | Fallecido | 9 | No | |
| 16 | Vivo | 40 | Sí, nueva PPB (48 h) | Recurrencia de derrame circunferencial moderado, con datos de compromiso hemodinámico incipiente |
PPB: pericardiotomía percutánea con balón.
En el presente estudio se ha demostrado que la PPB permite, en un único, sencillo y rápido procedimiento percutáneo, tanto el drenaje completo del derrame como evitar en la mayoría de los casos nuevas reintervenciones. Con base en ello y el buen perfil de seguridad y tolerancia encontrados, consideramos que puede ser el tratamiento inicial de elección de todos los pacientes con derrame pericárdico grave y deterioro clínico o hemodinámico que sufran enfermedad oncológica avanzada que limite su esperanza de vida.
La prevalencia real del DPT es desconocida y varía en función del tipo de cáncer y el método diagnóstico empleado. El cáncer de pulmón continúa siendo la causa de la mayoría de los DPT1,4,19, y 8 de nuestros casos. Además, es muy probable que en los próximos años aumente significativamente la detección de DPT, dadas la incidencia creciente de cáncer y la generalización de las pruebas de imagen cardiaca. Muestra de ello es que la etiología tumoral es ya la primera causa de derrame pericárdico1 y taponamiento cardiaco3,6 en muchos hospitales.
Se hace así necesario establecer un plan de tratamiento del DPT sintomático en esta población de enfermos que (como confirma nuestra serie) tiene un pronóstico vital limitado1–4. A nuestro modo de ver, el método ideal debería ser sencillo, aliviar los síntomas, producir mínimas morbilidad y mortalidad, requerir corta hospitalización, condicionar un bajo número de reintervenciones sobre el pericardio y facilitar el diagnóstico etiológico del derrame.
La pericardiocentesis es el procedimiento clásico y más sencillo, aunque presenta el problema de su alta tasa de recurrencia y la necesidad de reintervenciones1,7,8. El drenaje pericárdico continuo consigue disminuir las recurrencias, pero aumenta significativamente la hospitalización y el riesgo de infección6,7. Los agentes esclerosantes exigen igualmente mantener el catéter de drenaje y la hospitalización durante varios días, y muchos de ellos causan intenso dolor20, arritmias y pericarditis constrictiva o efusivo-constrictiva21. Por último, la ventana pericárdica quirúrgica es un procedimiento más complejo, peor tolerado y asociado a importantes morbilidad y mortalidad relacionadas con la anestesia, la cirugía y el postoperatorio4,7, sin que tampoco muestre de manera constante una mayor precisión en el diagnóstico etiológico del derrame respecto a la pericardiocentesis convencional22. Si se tiene en cuenta además que hasta un 10% de los derrames pericárdicos tratados mediante ventana quirúrgica pueden requerir nuevas intervenciones por recurrencia en el primer mes23, así como que la PPB sea económicamente menos costosa que la pericardiocentesis seguida de ventana pericárdica quirúrgica18, es razonable pensar que esta última técnica no resultaría la más adecuada para el tipo de paciente ante el que nos encontramos.
La creación de una ventana pericárdica percutánea como alternativa a la cirugía se describió inicialmente9 como una técnica complementaria al drenaje pericárdico continuo en caso de que persista un débito > 100 ml/24 h durante 3 días, aunque ya en la segunda serie publicada10 el 50% de los pacientes se sometieron a una PPB como terapia inicial de su derrame sin que se observaran diferencias en sus resultados (ni en los de series posteriores11,15) respecto a los tratados inicialmente con drenaje continuo seguido de PPB. En ambos casos, la PPB evitaría las recurrencias facilitando el drenaje pericárdico a la cavidad pleural (fig. 3) y/o peritoneal —donde habría mayor capacidad de reabsorción— y promoviendo una posible fusión entre las capas pericárdicas10.
Como hemos descrito, la PPB es un procedimiento breve, sencillo y bien tolerado que, utilizando un pequeño abordaje percutáneo, logra aliviar mucho de sus síntomas sin requerir unos cuidados posteriores que prolonguen innecesariamente la estancia hospitalaria. Dadas la gravedad y la circunferencialidad de los DPT tratados (tabla 2, fig. 2), tampoco debe extrañar que, al igual que en series previas11–13,15,19, no haya habido complicaciones durante la PPB y que con la antibioterapia profiláctica propuesta10 tampoco hayamos tenido infecciones relacionadas con la PPB. Además, a diferencia de algunos estudios previos en que la incidencia de derrame pleural que precisaba drenaje tras la PPB era considerable10,15,17, en nuestra serie sólo se detectó un derrame pleural significativo que no precisó drenaje en su evolución, lo que probablemente se deba a la aspiración manual completa del DPT realizada antes de dar por finalizados nuestros casos.
Finalmente, en relación con la eficacia de la PPB, podría parecer elevado el número de reintervenciones sobre el pericardio realizadas en nuestros pacientes, si bien 2 de las 3 son resultado de la formación de un derrame encapsulado que probablemente no indique el fallo de la técnica, sino una de limitación de esta y de la propia ventana pericárdica quirúrgica.
CONCLUSIONESEn vista de la seguridad, la sencillez, la tolerabilidad y la eficacia mostradas, y con el objetivo último de paliar síntomas y proveer la máxima calidad de vida posible, concluimos que la PPB puede ser el tratamiento inicial de elección del DPT grave sintomático en el grupo de pacientes con enfermedad oncológica avanzada.
FINANCIACIÓNEl Dr. Juan Ruiz-García agradece la ayuda económica recibida de la Sociedad Española de Cardiología a través de la Beca de la Sección de Hemodinámica y Cardiología Intervencionista para la Formación en Investigación Post Residencia del año 2011.
CONFLICTO DE INTERESESNinguno.