Palabras clave
INTRODUCCIÓN
La enfermedad cardiovascular es una causa importante de morbilidad y mortalidad en los países occidentales1. A pesar de los grandes avances que se han efectuado en el tratamiento y el diagnóstico de los pacientes con enfermedad coronaria, hoy día todavía hay un elevado número de personas aparentemente sanas que fallecen de forma súbita debido a esta enfermedad sin haber presentado sintomatología con anterioridad2,3. La mayor parte de estos episodios se debe a la rotura de una placa de ateroma, con la oclusión trombótica subsiguiente, en una zona de las arterias coronarias epicárdicas con lesiones ateroscleróticas no limitantes del flujo4,5. Además, la rotura silente de la placa y el proceso subsiguiente de curación aceleran el propio crecimiento de la placa y son procesos que se observan con mayor frecuencia en arterias con una estenosis luminal no severa6.
Según los datos obtenidos en estudios histológicos, la composición de la placa de ateroma desempeña un papel clave en la patogenia de la oclusión arterial, con independencia de la intensidad de la estenosis subyacente5.
OBJETIVO DE VISUALIZACIÓN: EL FIBROATEROMA CON CÁPSULA FINA
Recientemente, en estudios retrospectivos se han definido las características morfológicas y de composición de la placa que hacen que ésta muestre tendencia a la rotura7,8. Esta información ha dado lugar a una nueva clasificación de las lesiones coronarias en la que se recogen, de una manera más detallada, los aspectos referentes a la progresión de la placa8.
Las lesiones de fibroateroma de cápsula fina (FACF), que representan las lesiones de mayor prevalencia que anteceden a la rotura de la placa, están constituidas por una zona central ateromatosa rica en lípidos, una cubierta fibrosa fina (≤ 65 μm), infiltrada por macrófagos y linfocitos, y una cantidad escasa de células musculares lisas; además, presentan una remodelación expansiva8,9.
La detección de estas placas de ateroma no obstructivas, con abundantes lípidos y de riesgo alto, puede influir de manera importante en la prevención de los cuadros de infarto agudo de miocardio (IAM) y muerte súbita.
Aunque la coronariografía puede identificar las lesiones obstructivas y complejas10, ofrece únicamente una imagen de la luz coronaria, pero no permite visualizar la pared arterial. Así, no es posible valorar características importantes, como la remodelación del vaso o la composición de la placa. Recientemente, en un estudio necroscópico se han evaluado diversos aspectos geométricos de la pared vascular y se ha demostrado la presencia de una relación entre las alteraciones locales del tamaño del vaso y la estabilidad de la placa11.
En la actualidad se dispone de varias herramientas intravasculares que permiten evaluar localmente diversos determinantes de la vulnerabilidad de la placa, como el tamaño de la zona central lipídica, el grosor de la cubierta fibrosa, la infiltración inflamatoria de la cubierta y la remodelación positiva.
En un estudio reciente se ha propuesto un grosor crítico < 65 μm para la cubierta de la placa, según datos de histomorfometría post mórtem12. No obstante, el umbral in vivo para definir como fina una cubierta fibrosa posiblemente sea > 65 μm debido a varias razones. En primer lugar, se ha demostrado que durante la fijación histológica se produce una retracción general del tejido que es inevitable y que se debe a los procesos de deshidratación13,14. Además, el estrés circunferencial en el borde luminal de la placa aumenta de manera crítica cuando el grosor de su cubierta es inferior a aproximadamente 150 μm15.
En este artículo se resume la situación actual de las técnicas de imagen que pueden definir las características de las placas vulnerables in vivo (tabla 1) y que pueden ayudar en la estratificación del riesgo en los pacientes individuales, guiando en última instancia las estrategias preventivas sistémicas y locales9,16-20.
ECOGRAFÍA INTRAVASCULAR
La ecografía intravascular (EIV) en escala de grises es una herramienta diagnóstica de carácter invasivo que ofrece una visualización tomográfica de las arterias coronarias con alta resolución y en tiempo real. Por tanto, esta técnica permite evaluar la morfología, la severidad y la extensión de la placa coronaria.
La EIV es actualmente la única modalidad de imagen que puede ofrecer información in vivo respecto de las modificaciones cronológicas en el tamaño de la placa aterosclerótica21.
La caracterización cualitativa de la placa está basada en la ecogenicidad de la señal de ultrasonidos recibida, de manera que las zonas ecolúcidas corresponden a tejidos ricos en lípidos, mientras que las estructuras con una elevada capacidad de reflejar los ultrasonidos y con sombra acústica posterior corresponden a tejido calcificado. No obstante, la caracterización de la placa mediante la interpretación visual de la EIV en escala de grises es imprecisa, especialmente en el caso de las placas heterogéneas y ricas en lípidos22.
La resolución axial se limita a 100-200 μm, lo que reduce las posibilidades de detectar las placas con cubierta fibrosa fina. En cualquier caso, y por las razones ya mencionadas, consideramos que el umbral para definir como fina una cubierta fibrosa debe ser > 65 μm.
La detección de placas vulnerables mediante EIV está basada en una serie de casos aislados que han sido publicados en la bibliografía23-26. En estos estudios se describen las características morfológicas de placas que ya han presentado rotura, pero no se considera la detección prospectiva de las placas con tendencia a la rotura. De todas maneras, en un estudio prospectivo se demostró que las placas excéntricas grandes que presentan una zona ecolúcida en la EIV muestran un riesgo mayor de inestabilidad a pesar de la preservación del área luminal en el momento del estudio inicial27.
FUNCIÓN DEL REMODELADO VASCULAR
El remodelado vascular fue descrito por Glagov et al28 como un aumento de tamaño compensador de las arterias coronarias en respuesta al incremento en el área de la placa. En varios estudios se ha demostrado que los vasos con remodelado positivo se acompañan de un aumento en las concentraciones de los marcadores de la inflamación, muestran zonas centrales lipídicas de mayor tamaño y presentan un intenso adelgazamiento de la capa media11,29,30. Este concepto ha dado lugar a una teoría dinámica en la que los vasos también pueden presentar retracción en respuesta al crecimiento de la placa31. Esta modalidad de remodelado se ha correlacionado con un fenotipo y unas manifestaciones clínicas de carácter más estable11,29,32,33. Recientemente se ha evaluado mediante EIV la relación entre el remodelado vascular y la composición de la placa34-36. En estos estudios, el índice de remodelado en las lesiones blandas fue significativamente mayor que el de las lesiones fibrosas/mixtas y calcificadas34-36. No obstante, cabe destacar que en la mayor parte de los estudios en los que se ha evaluado este fenómeno se ha utilizado un diseño de tipo transversal. Debido a que la aterosclerosis es habitualmente una enfermedad difusa, no está garantizada la detección de una zona de referencia sin evidencia de aterosclerosis. Por tanto, no es posible descartar la presencia de un remodelado inicial en la zona de referencia.
VALORACIÓN CUANTITATIVA DE LA ECOGENICIDAD MEDIANTE ECOGRAFÍA INTRAVASCULAR
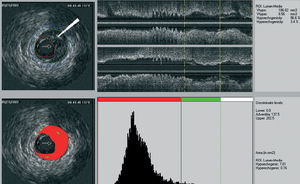
Nuestro grupo ha desarrollado recientemente un programa informático de análisis de los valores de la escala de grises para la caracterización de la placa37. Según el nivel medio de brillo de la adventicia, la placa se clasifica como más (hiperecogénica) o menos brillante (hipoecogénica) en relación con la adventicia (fig. 1). El porcentaje de placa hipoecogénica se calcula en toda la región de interés y en los cortes en los que aparece una placa significativa. En la circulación carotídea, la ecogenicidad de la placa determinada por medios no invasivos se ha relacionado con sus componentes histológicos38-41. Además, la ecotransparencia de la placa carotídea (ecogenicidad baja) se ha asociado con la aparición de complicaciones neurológicas futuras42-44. La caracterización de la placa mediante EIV en la circulación coronaria requiere una evaluación invasiva y se ha llevado a cabo con menos frecuencia. En un estudio reciente se ha demostrado que el tratamiento con atorvastatina da lugar a modificaciones cuantificables en la ecogenicidad de la placa coronaria, compatibles con cambios en la composición de la placa45. Estos hallazgos ofrecen una explicación potencial para la eficacia clínica de las estatinas a pesar de que su efecto sobre el volumen de la placa sea escaso21,46. Actualmente se están realizando estudios ex vivo y ensayos clínicos para validar los datos aportados por esta técnica.
Fig. 1. Ecogenicidad de la ecografía intravascular: la adventicia queda definida como el tejido que se sitúa fuera de la lámina elástica externa. Se calculan el valor medio y la desviación estándar en todos los píxeles no sombreados correspondientes a la adventicia. Para comprobar la idoneidad del estudio se crea una curva de distribución normal basada en el histograma de los mismos valores correspondientes a la media y la desviación estándar. Las zonas hipoecogénicas aparecen en color rojo, mientras que las hiperecogénicas aparecen en color verde.
Elastografía y palpografía por ecografía intravascular
Una característica morfopatológica importante de la placa vulnerable es la acumulación excéntrica de una zona necrótica con abundantes lípidos y que se localiza en el interior de la pared vascular, separada de la luz por una cubierta fibrosa fina. Esta observación ha dado lugar a la hipótesis de que las lesiones vulnerables podrían presentar propiedades mecánicas diferentes de las correspondientes a las lesiones estables crónicas. La elastografía y la palpografía intravascular son técnicas que permiten la evaluación de las propiedades tisulares mecánicas locales19,47.
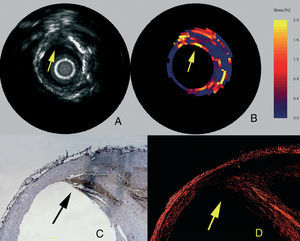
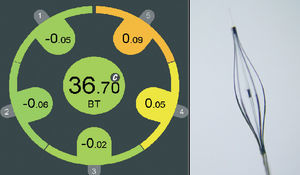
Para una presión definida, los componentes de un tejido blando (ricos en lípidos) muestran una deformación mayor que los componentes de un tejido duro (fibrosos-calcificados)48. En las arterias coronarias, el tejido de interés es la pared vascular, mientras que la presión arterial con sus cambios fisiológicos durante la sístole y la diástole se utiliza como fuerza de estimulación. Así, se comparan las imágenes obtenidas con diferentes grados de presión, con objeto de determinar la compresión tisular local. La presión radial sobre el tejido se calcula mediante técnicas de correlación cruzada en función de la señal de radiofrecuencia, y se puede mostrar como una imagen tras la codificación de los colores48. En recientes estudios necroscópicos efectuados con arterias coronarias humanas se han evaluado la sensibilidad y la especificidad de estas técnicas para detectar las placas vulnerables; los porcentajes de sensibilidad y especificidad observados han sido del 88 y el 89%, respectivamente (fig. 2)19. Además de los estudios ex vivo, también se han efectuado estudios in vivo para evaluar estas técnicas, con la demostración de que la palpografía detecta una alta incidencia de placas deformables en los pacientes con síndrome coronario agudo (SCA). Además, el número de lesiones altamente deformables se ha correlacionado con las manifestaciones clínicas y con las concentraciones de proteína C reactiva47.
Fig. 2. Placa vulnerable evaluada mediante ecografía intravascular (A), elastograma B), tinción de macrófagos (C) y tinción del colágeno (D). En el elastograma se muestra una placa vulnerable indicada por una zona altamente deformable en la superficie. En el estudio histológico correspondiente se observan una cantidad elevada de macrófagos (C), una cubierta fina (D) y una zona de acumulación de lípidos (LP). Tomada de Schaar et al19. Reproducida con autorización de Lippincott & Wilkins.
La limitación principal de la técnica es su dependencia de la calidad y la estabilidad de la señal de la presión coronaria. Por ello, sus resultados podrían ser poco valorables en situaciones con una frecuencia cardíaca elevada y alteraciones del ritmo cardíaco.
Histología virtual
La EIV en escala de grises tiene un valor limitado para la identificación de los componentes específicos de la placa49. Generalmente, los tejidos fibrosos densos y calcificados muestran una gran ecorrefringencia, de manera que las áreas calcificadas pueden ser sobrestimadas. Por otra parte, las placas con una ecogenicidad baja se consideran «blandas» o ricas en lípidos. No obstante, la precisión de la EIV en escala de grises para la discriminación entre los lípidos y el tejido fibroso es limitada debido a que, además de presentar grandes cantidades de lípidos extracelulares (áreas de baja ecogenicidad), la zona central lipídica contiene cristales de colesterol, restos necróticos y microcalcificaciones (áreas de elevada ecogenicidad)8.
Recientemente se ha introducido la técnica de la histología virtual (EIV-Virtual Histology® [EIV-VH], Volcano Therapeutics, Rancho Cordova, CA) que utiliza el sustrato (análisis de la región de frecuencia) de los datos de radiofrecuencia (RF) de la EIV, más que el análisis de la envolvente (amplitud) de la señal; con esta técnica ha sido posible realizar una evaluación objetiva y precisa de la composición de la placa coronaria en estudios sobre segmentos coronarios humanos explantados20.
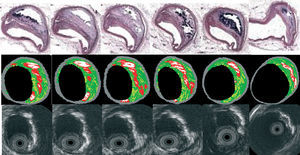
La EIV-VH realiza el análisis espectral de los datos de radiofrecuencia de la EIV para construir mapas tisulares que clasifican la placa en cuatro componentes principales. En estudios preliminares in vitro se ha demostrado que la placa presenta cuatro componentes histológicos (tejido fibroso, tejido fibrolipídico, zona central lipídica y calcio) que se correlacionan con un espectro específico de la señal de RF20,50. A estos distintos componentes de la placa se les asignan diferentes códigos de color. Las regiones calcificadas, fibrosas, fibrolipídicas y lipídicas aparecen en colores blanco, verde, verdoso-amarillento y rojo, respectivamente (fig. 3).
Fig. 3. Cortes histológicos seriados de un vaso coronario. Los paneles intermedio e inferior muestran la correlación cruzada entre el sistema Histología Virtual® y la ecografía intravascular en escala de grises, respectivamente. Las regiones calcificadas, fibrosas, fibrolipídica y lipídicas aparecen con los colores blanco, verde, verdoso-amarillo y rojo, respectivamente.
Los estudios realizados mediante EIV no han permitido demostrar de manera concluyente la regresión de la placa con el tiempo21,51,52. Sin embargo, la EIV-VH permite realizar un seguimiento de la progresión de la enfermedad no solamente en relación con su volumen, sino también con respecto a su composición53. Además, esta herramienta también podría ser útil para evaluar el efecto de las intervenciones terapéuticas, tanto convencionales como más novedosas.
En lo que se refiere a la detección de la placa vulnerable, la EIV-VH ofrece una evaluación precisa y cuantitativa de dos de las características principales de la lesión FACF: la zona central lipídica y el remodelado positivo.
La limitación principal de esta técnica es que no permite detectar la cápsula fibrosa fina. No obstante, tal como ya se ha mencionado, consideramos que el umbral para definir como fina una cubierta fibrosa debería ser > 65 μm.
Tomografía con coherencia óptica
La tomografía con coherencia óptica (TCO) es una técnica que ofrece imágenes de alta resolución (resolución axial de 15 μm) de los sistemas biológicos54. Así, la TCO tiene capacidad para visualizar la cubierta fibrosa fina in vivo y en tiempo real. La TCO está basada en la luz casi infrarroja de baja coherencia que es emitida por un diodo con superluminiscencia. En la parte central se utiliza una longitud de onda de aproximadamente 1.300 nm debido a que permite minimizar la absorción de energía del haz luminoso causada por las proteínas, el agua, la hemoglobina y los lípidos. Las ondas luminosas son reflejadas por las microestructuras internas que se encuentran en los tejidos biológicos a consecuencia de sus diferentes índices ópticos.
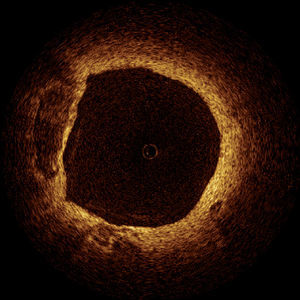
En estudios de experimentación animal y necroscópicos se ha demostrado la precisión de la TCO en comparación con la histología55-57. En estos estudios se ha observado que la TCO puede detectar estructuras arteriales, tanto normales como patológicas (fig. 4)57. Los datos más recientes obtenidos in vivo demuestran que la TCO puede diferenciar distintos tipos de placa, con la posibilidad de detectar la presencia de macrófagos en las placas ateroscleróticas58,59.
Fig. 4. Imagen de tomografía con coherencia óptica correspondiente a una lesión no significativa en la que se observa un vaso en «queso gruyer» que indica la presencia de un fibroateroma con cápsula fina.
En nuestra experiencia, en los pacientes programados para intervención coronaria percutánea (ICP) se pueden visualizar las lesiones FACF con zonas centrales necróticas de baja reflectividad revestidas por una cubierta fibrosa fina (media, 50 μm) altamente refringente60.
La elevada resolución de la TCO ofrece la posibilidad de detectar lesiones FACF en pacientes vivos59,60. Sin embargo, la TCO está limitada por su penetración relativamente superficial, que dificulta la visualización de toda la pared vascular en el caso de los vasos de calibres intermedio y grande, así como por la necesidad de eliminar la sangre de la arteria durante el estudio, con la aparición de una isquemia transitoria en la región evaluada.
Termografía intravascular
El fundamento para determinar la temperatura vascular es la observación de que la aterosclerosis se acompaña de inflamación. Las placas vulnerables se han asociado con un incremento de la actividad de los macrófagos, el metabolismo y la inflamación61. Según estos hallazgos se ha propuesto la hipótesis de que estos macrófagos «activados» producen energía térmica que podría ser detectada en la superficie de las lesiones ateroscleróticas. Los métodos invasivos más importantes para ello son la termografía por infrarrojos y la termografía con termistor (sensor de contacto) (fig. 5). Los métodos termográficos de contacto parecen ser los mejores en el momento presente, debido principalmente a las dificultades para que la radiación infrarroja atraviese el flujo sanguíneo y permita detectar la temperatura de la pared vascular. En un estudio de pequeña envergadura realizado en 19 pacientes con angina estable, angina inestable e IAM se demostró la heterogeneidad de la temperatura en las placas coronarias ateroscleróticas humanas62. La temperatura intracoronaria se evaluó mediante un catéter dedicado. En la mayor parte de los segmentos coronarios con placas ateroscleróticas se observó un aumento de la temperatura, en comparación con los segmentos coronarios en los que la pared vascular era normal. Las diferencias de temperatura entre la placa aterosclerótica y el vaso normal aumentaron progresivamente desde los pacientes con angina estable hasta los pacientes con IAM, con una diferencia de temperatura máxima respecto a la temperatura basal de 1,5 ± 0,7 °C. En cualquier caso, hay algunos estudios publicados y no publicados en los que se han obtenido resultados parcialmente contradictorios con otros dispositivos de termografía (cesta circular o brazos autoexpandibles) que demuestran una heterogeneidad mucho menor en la distribución de la temperatura. La explicación más probable para estas observaciones discrepantes referentes a los cambios de temperatura podría estar relacionada con la diferencia en el diseño de los catéteres y por la diferente alteración del flujo coronario.
Fig. 5. Catéter de termografía dedicado con cinco sensores térmicos en contacto con la pared vascular; se observa una heterogeneidad significativa en las mediciones compatible con el aumento en la actividad de los macrófagos, el metabolismo y la inflamación.
Estos hallazgos preliminares de las características térmicas de las placas ateroscleróticas parecen prometedores. No obstante, la evaluación precisa de la temperatura requiere el contacto directo de los sensores térmicos con la pared vascular, lo que conlleva un riesgo potencial de lesión endotelial. Además, el efecto de enfriamiento causado por el flujo sanguíneo podría dificultar la interpretación de los datos numéricos63.
Angioscopia
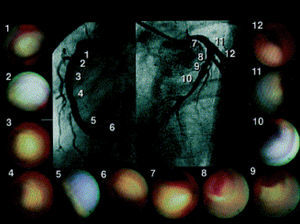
Esta técnica permite una visualización directa y en tiempo real de las placas coronarias (fig. 6). La validación ex vivo de la angioscopia ha sido realizada por Thieme et al64, que compararon las observaciones angioscópicas con las muestras histológicas obtenidas mediante aterectomía coronaria. En este estudio, las placas amarillas se relacionaron con las lesiones ateromatosas. Estos hallazgos fueron confirmados en estudios clínicos en los que las placas ricas en lípidos y con tendencia a la rotura fueron detectadas con mayor facilidad mediante la angioscopia en forma de placas amarillas, además de que fueron más frecuentes en los pacientes con síndrome coronario agudo65. Por otra parte, la angioscopia ha dado lugar a resultados sorprendentes en la predicción de los SCA65.
Fig. 6. Paciente con infarto miocárdico anterior. Imágenes angioscópicas de la lesión causante (8 y 9) y de todas las placas amarillas en segmentos arteriales distintos del que contiene la lesión causante. Se detectó un trombo sobre la placa amarilla en el segmento que contiene la lesión causante. Tomada de Asakura et al70. Reproducida con la autorización de ©2001 American College of Cardiology Foundation.
A pesar de estos resultados prometedores, la angioscopia solamente evalúa la superficie luminal de la capa íntima. Así, no aborda las características clave de las lesiones FACF, como el grosor de la cubierta, el contenido de la zona central lipídica y la remodelación. Además, para una adecuada visualización es preciso eliminar la sangre del interior del vaso, con la consiguiente isquemia transitoria en la región evaluada.
ESPECTROSCOPIA RAMAN
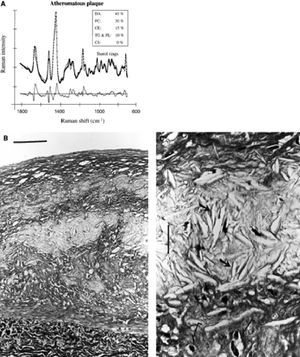
La espectroscopia Raman es una técnica que permite definir la composición química a través del efecto Raman66. Este efecto se genera cuando la luz incidente induce la excitación de diversas moléculas de la muestra tisular, causando una dispersión de la luz con longitudes de onda diferentes. Esta modificación de la longitud de onda, denominada «efecto Raman», depende de los componentes químicos de la muestra tisular. De esta manera, la espectroscopia Raman puede ofrecer información cuantitativa de la composición molecular de una muestra67. El espectro obtenido requiere un posprocesamiento para diferenciar los componentes de la placa (fig. 7). En estudios in vitro se ha demostrsificación del tejido arterial coronario en 3 categorías: no aterosclerótico, placas no calcificadas y placas calcificadas67.
Fig. 7. Espectro Raman de una placa ateromatosa y ajuste del modelo (A). En comparación con la fibroplasia intimal, el incremento de los pesos relativos de los componentes químicos FC y CE corresponde a la presencia de una zona central ateromatosa situada bajo una cubierta fibrosa (B, la barra indica 100 μm). En la zona central ateromatosa se puede observar la abundancia de células espumosas cargadas de lípidos (flechas blancas) y de hendiduras correspondientes a cristales de colesterol (flechas negras) (C, la barra indica 25 μm). Tomada de Romer et al67. Reproducida con autorización de Lippincott Williams & Wilkins.
Las limitaciones principales de esta técnica son la imposibilidad de conseguir información geométrica, la escasa profundidad de penetración (1,0 a 1,5 mm) y la absorbancia de la luz láser por parte de la sangre.
RESONANCIA MAGNÉTICA INTRAVASCULAR
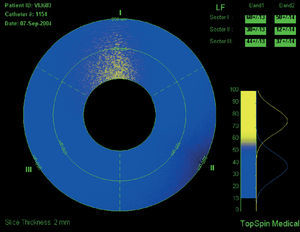
La resonancia magnética intravascular (RMI) es otro posible abordaje para determinar la composición de la placa según las propiedades de difusión del tejido analizado. La RM puede determinar la presencia de lípidos en el interior de la pared arterial. La tecnología actual de la RMI consiste en una sonda de RM que puede realizar la evaluación secuencial de diferentes sectores vasculares. Se determina el contenido lipídico en un sector y los datos aparecen codificados en colores (el color amarillo corresponde a un contenido lipídico elevado de la región de interés y el color azul a un contenido lipídico bajo; fig. 8).
Fig. 8. Resonancia magnética intravascular de un vaso coronario en el que la composición de la placa aparece codificada en colores: el amarillo corresponde a un contenido lipídico elevado en la región de interés, mientras que el azul corresponde a un contenido lipídico bajo (fibrosis).
El sistema RMI ha sido evaluado ex vivo en tejido carotídeo, tejido aórtico y arterias coronarias humanas para correlacionar los hallazgos en la RM con los hallazgos histológicos. En estudios efectuados ex vivo sobre tejido aórtico, la RMI determinó correctamente los resultados histológicos en 15 de 16 casos aórticos, mientras que en arterias coronarias evaluadas ex vivo pudo establecer correctamente las lesiones, incluido el diagnóstico de tres lesiones de FACF68,69. Actualmente se está realizando un ensayo clínico multicéntrico para determinar la idoneidad in vivo de esta técnica.
PERSPECTIVAS FUTURAS
Anteriormente se había demostrado que en los SCA hay un proceso de inestabilidad multifocal26,70. Rioufol et al26 observaron que en los pacientes con SCA se detecta una zona de rotura de placa alejada de la lesión causante en el 80% de los casos, diferente de la arteria que contiene la lesión causante en el 71% de los casos y con afección de dos arterias distintas de la que contiene lesión causante en el 12,5% de los casos.
El elevado número de lesiones de alto riesgo que se detecta en todo el árbol coronario mediante angiografía71, angioscopia70, EIV26 y palpografía47, además de la impredecibilidad de la evolución de estas lesiones y de la incertidumbre respecto de las características de la placa vulnerable que podrían dar lugar posteriormente a la aparición de complicaciones isquémicas mortales y no mortales, sugiere que las estrategias preventivas de carácter local podrían no ser económicamente rentables.
Sin embargo, las placas «amarillas» de riesgo alto identificadas mediante angioscopia en los pacientes estables predicen la aparición de complicaciones isquémicas65. Por tanto, la administración intensiva de estatinas podría ser un abordaje sistémico razonable para «enfriar» la «carga» inflamatoria.
Aunque enormemente prometedoras, las técnicas basadas en cateterismo requieren una validación más sólida, así como el desarrollo de un modelo apropiado de placa vulnerable. Además, estas técnicas abordan las arterias coronarias de manera localizada, mientras que la inflamación se distribuye de manera difusa en todo el árbol coronario72.
Estas nuevas modalidades tienen el potencial de ofrecer información fisiopatológica en los estudios sobre la evolución de la placa coronaria. Además, pueden proporcionar criterios de valoración alternativos. Por último, la combinación de las nuevas técnicas de imagen con la evaluación de los biomarcadores circulantes podría desempeñar un papel para refinar la estratificación del riesgo de los pacientes, ofreciendo finalmente la posibilidad de evaluar el efecto de las intervenciones farmacológicas convencionales o novedosas, así como de sus mecanismos de acción53.
Correspondencia: Dr. P.W Serruys.
Prof. of Interventional Cardiology.
Thoraxcenter, Bd 406. Erasmus MC.
Dr Molewaterplein 40. 3015 GD Rotterdam. Países Bajos.
Correo electrónico: p.w.j.c.serruys@erasmusmc.nl