El implante percutáneo de válvula aórtica se ha consolidado en los últimos años como tratamiento alternativo a la cirugía de sustitución valvular aórtica para pacientes de alto riesgo quirúrgico o inoperables1.
Recientemente ha salido al mercado la segunda generación de prótesis aórticas percutáneas2–4, diseñadas para minimizar las principales limitaciones como la insuficiencia aórtica paravalvular, la necesidad de marcapasos o el posicionamiento incorrecto que presentaban las dos primeras prótesis aórticas percutáneas: Edwards-SAPIEN y CoreValve (Medtronic; Minneapolis, Minnesotta, Estados Unidos)5,6. Desde septiembre de 2014, está disponible en nuestro país la nueva prótesis aórtica autoexpansible con el sistema Medtronic CoreValve EvolutTM R 23mm para anillos aórticos <20mm. El objetivo del estudio es analizar la experiencia inicial con los primeros pacientes tratados con EvolutTM R y comunicar las principales diferencias respecto a la primera generación de la prótesis CoreValve.
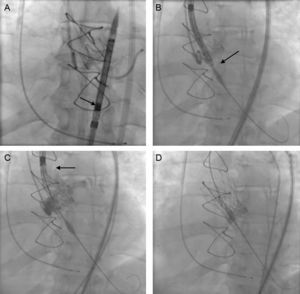
Los datos se expresan como mediana [intervalo intercuartílico] en el caso de variables continuas y como n (%) en caso de variables categóricas. Se ha tratado a un total de 12 pacientes entre septiembre de 2014 y enero de 2015. Las características basales de la población y del procedimiento se recogen en la tabla. Todos los procedimientos se realizaron con anestesia local y sedación profunda, excepto un paciente cuyo abordaje fue por arteria subclavia izquierda. Destaca que 5 pacientes eran portadores de prótesis aórticas biológicas disfuncionantes. El diámetro del anillo valvular aórtico estaba entre 18 y 20mm. Una novedad de esta válvula es que, tras el montaje de la prótesis en el sistema de liberación, es imperativo inspeccionarla con fluoroscopia, haciendo hincapié en que la cápsula que contiene la prótesis no presente ninguna deformidad ni curvatura y que tenga las coronas alineadas y las pestañas de anclaje perfectamente encajadas y simétricas (figura A).
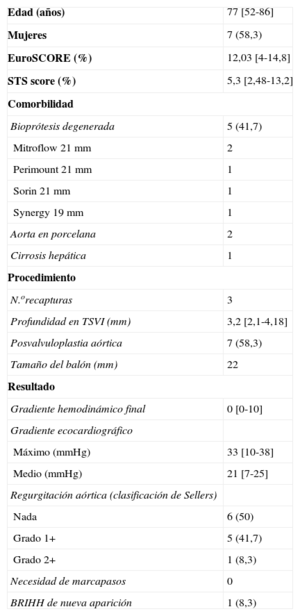
Características clínicas y del procedimiento con la utilización del sistema CoreValve EvolutTM R 23mm (n=12)
| Edad (años) | 77 [52-86] |
| Mujeres | 7 (58,3) |
| EuroSCORE (%) | 12,03 [4-14,8] |
| STS score (%) | 5,3 [2,48-13,2] |
| Comorbilidad | |
| Bioprótesis degenerada | 5 (41,7) |
| Mitroflow 21 mm | 2 |
| Perimount 21 mm | 1 |
| Sorin 21 mm | 1 |
| Synergy 19 mm | 1 |
| Aorta en porcelana | 2 |
| Cirrosis hepática | 1 |
| Procedimiento | |
| N.orecapturas | 3 |
| Profundidad en TSVI (mm) | 3,2 [2,1-4,18] |
| Posvalvuloplastia aórtica | 7 (58,3) |
| Tamaño del balón (mm) | 22 |
| Resultado | |
| Gradiente hemodinámico final | 0 [0-10] |
| Gradiente ecocardiográfico | |
| Máximo (mmHg) | 33 [10-38] |
| Medio (mmHg) | 21 [7-25] |
| Regurgitación aórtica (clasificación de Sellers) | |
| Nada | 6 (50) |
| Grado 1+ | 5 (41,7) |
| Grado 2+ | 1 (8,3) |
| Necesidad de marcapasos | 0 |
| BRIHH de nueva aparición | 1 (8,3) |
BRIHH: bloqueo completo de rama izquierda del haz de His; TSVI: tracto de salida del ventrículo izquierdo.
Salvo otra indicación, los valores expresan n (%) o mediana [intervalo intercuartílico].
Implante de una prótesis aórtica autoexpansible sobre bioprótesis Perimount disfuncionante, con el sistema Medtronic CoreValve EvolutTM R 23mm. A: valoración por fluoroscopia del montaje correcto de la prótesis. B: el objetivo de implante fue de 3±2mm. C: con la prótesis liberada al 80%, encontramos el punto táctil de recaptura. D: liberación completa de la prótesis.
El sistema de liberación permite avanzarlo a través de un introductor de 14 Fr de diámetro, lo que se realizó en 6 pacientes con diámetros femorales limítrofes; en el resto, se utilizó el habitual de 18 Fr.
Otra de las modificaciones que presenta es el objetivo de implante. Antes se recomendaba entre 4 y 6mm y ahora debe ser 3±2mm, respecto al anillo aórtico, dado que la configuración de la estructura y la prótesis ha cambiado (figura B). Tras alinear correctamente con el anillo valvular, se procede a la liberación mediante un botón de giro antihorario, cuya transmisión a la cápsula donde se encuentra alojada la prótesis es prácticamente 1:1. Al desplegar los primeros dos tercios, el nuevo sistema presenta lo que se conoce como punto táctil de recaptura (figura C). En ese momento se comprueba por fluoroscopia y aortografía la posición de la prótesis y la permeabilidad coronaria, que en 9 pacientes fue buena y se completó la liberación (figura D); sin embargo, en 3 pacientes, el implante fue bajo y se procedió a recapturar la prótesis y comenzar de nuevo el posicionamiento y la liberación, sin necesidad de extraer la prótesis, utilizando el botón en sentido horario. Esta maniobra es posible hasta 3 veces. El implante fue correcto en todos los pacientes y no hubo complicaciones derivadas del procedimiento. Se dio el alta a 11 pacientes y 1 paciente falleció por insuficiencia respiratoria secundaria a neumoconiosis.
El nuevo sistema presenta las siguientes modificaciones respecto a la primera generación: la principal es la posibilidad de recapturar la prótesis (enfundarla en el sistema de liberación) una vez liberado un 70-80% de la prótesis estando ya la válvula funcionante, lo que permite comprobar su posición con respecto al anillo nativo y el flujo de las arterias coronarias. Una vez recapturada, se puede recruzar el anillo y comenzar de nuevo la liberación. La segunda modificación es la reducción de 4 Fr del sistema de liberación, que permite ampliar el espectro de pacientes con acceso femoral limítrofe.
La posibilidad de recapturar y reposicionar la prótesis permite ser más exigentes y seguros a la hora del emplazamiento con respecto al anillo aórtico nativo y así evitar tanto el implante profundo, que está asociado con regurgitación aórtica paravalvular, y las alteraciones de la conducción auriculoventricular (factores relacionados con la mortalidad en el seguimiento), como el implante alto o la embolización a la aorta y la posibilidad de oclusión de las arterias coronarias. Otra ventaja potencial será la reducción drástica de la necesidad de una segunda válvula, que muchas series actuales sitúan alrededor del 5%.
Por lo tanto, estas áreas de mejora de la primera generación de la prótesis aórtica CoreValve permitirán minimizar algunas de las complicaciones y obtener mejores resultados.
CONFLICTO DE INTERESESJ.H. Alonso-Briales, C. Morís y J.M. Hernández García son proctors de Medtronic.