Las reacciones adversas a las vacunas son generalmente banales, pero se han descrito casos de miopericarditis tras su aplicación1. Por otro lado, se han publicado recientemente diferentes casos de miopericarditis relacionados con la infección por coronavirus del síndrome respiratorio agudo grave de tipo 2 (SARS-CoV-2)2,3.
Se describe el caso de un paciente varón de 39 años, médico de profesión, con antecedentes personales de asma bronquial, hipotiroidismo autoinmunitario, gastritis atrófica crónica, episodio aislado de fibrilación auricular y neumotórax espontáneos de repetición con segmentectomía apical izquierda. En los últimos meses, se había realizado varios cribados mediante PCR y serología para la infección por SARS-CoV-2, todos ellos negativos. El paciente ha dado su consentimiento informado para la redacción y publicación del caso clínico.
Siguiendo el programa de vacunación contra la COVID-19, se le administró la primera dosis de la vacuna BNT162b2, sin reacciones adversas relevantes. A las 6 h de la administración de la segunda dosis de la vacuna, 21 días después de la primera, comenzó con fiebre persistente de más de 38°C, que se trató con antitérmicos. Posteriormente manifestó dolor torácico e interescapular intermitente, que persistió varias horas sin que la analgesia convencional lo aliviara, por lo que decidió acudir a urgencias.
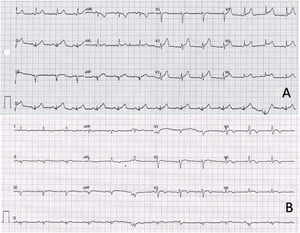
En el electrocardiograma a su llegada, se observó taquicardia sinusal a 130 lpm con QRS estrecho y elevación difusa del ST (figura 1A). La radiografía de tórax no mostró hallazgos relevantes. La analítica sanguínea evidenció elevación de marcadores de daño miocárdico, con una primera determinación de troponina T ultrasensible (TnTus) de 139 ng/l. Se realizó PCR para SARS-CoV-2 que resultó negativa. Dada la clínica, las alteraciones electrocardiográficas y los parámetros analíticos, se realizó un ecocardiograma transtorácico, que demostró buena función biventricular, sin alteraciones segmentarias de la contractilidad, valvulopatías significativas ni derrame pericárdico. Asimismo se descartó un síndrome aórtico agudo mediante una angiotomografía computarizada (angio-TC) de tórax; no se pudo realizar el estudio coronario mediante esta técnica por la imposibilidad de un control óptimo de frecuencia cardiaca.
A: electrocardiograma en ritmo sinusal con descenso del intervalo PR en I y V5-V6 y elevación del segmento ST con concavidad superior de forma difusa. B: electrocardiograma en ritmo sinusal con elevación < 1mm y convexidad superior en V3-V6 y negativización de ondas T en I, II, aVL y V3-V6.
Con la sospecha diagnóstica de miopericarditis aguda, se instauró tratamiento antiinflamatorio, y el paciente quedó asintomático. No obstante, se decidió su traslado a un hospital de tercer nivel de referencia para continuar el estudio.
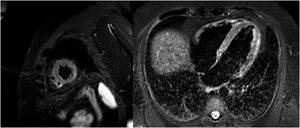
El paciente llegó en situación de estabilidad hemodinámica y asintomático, con episodios puntuales de dolor torácico. Los electrocardiogramas sucesivos mostraron una rectificación parcial de los cambios del ST, con negativización de las ondas T en derivaciones precordiales (figura 1B). El pico enzimático de TnTus fue de 854 ng/l. En las primeras 48 h se realizó una angio-TC coronaria, que descartó enfermedad coronaria, y una resonancia magnética cardiaca, que mostró edema en las secuencias T2-STIR y realce subepicárdico en la región lateral mediodistal compatibles con miocarditis aguda (figura 2). Se completó el estudio con serología vírica y cribado mediante reacción en cadena de la polimerasa (PCR) en plasma de los principales virus cardiotropos, también para SARS-CoV-2 en una nueva muestra orofaríngea, con resultado negativo. Se demostró en el estudio serológico IgM inespecífica positiva, IgG (spike) positiva e IgG (nucleocápside) negativa, patrón que indica inmunización tras la vacunación contra SARS-CoV-2, ya que la proteína spike es la codificada por el ARNm administrado con la vacuna4. Debido al perfil de bajo riesgo y evolución favorable, no se planteó la realización de biopsia endomiocárdica. Finalmente, el paciente presentó buena evolución clínica, con resolución de los síntomas, y se le dio el alta tras 6 días de ingreso.
Dada la evidente relación temporal entre el proceso de vacunación y el desarrollo del cuadro clínico, habiéndose excluido otras afecciones cardiológicas agudas, se propone este cuadro de miocarditis aguda como una reacción adversa a la vacuna BNT162b2.
Aunque no se establece causalidad, hay numerosos casos descritos de miopericarditis en relación con la administración de diferentes vacunas, como se recoge en el sistema de reportes de efectos adversos de vacunas estadounidense (VAERS)1; así, de 620.195 efectos adversos comunicados, 708 (0,1%) se describen como miopericarditis. Sin embargo, esta afección no se recoge en el estudio de seguridad de la vacuna BNT162b2, y las reacciones adversas descritas son de la esfera cardiovascular: casos aislados de síndrome coronario agudo, fibrilación auricular, extrasistolia ventricular y parada cardiaca (< 0,05%)5.
Diferentes autores describen una posible relación entre la infección por SARS-CoV-2 y el desarrollo de afecciones autoinmunitarias a través de un mecanismo de mimetismo molecular y reacción cruzada. Se propone que estas reacciones se podrían desencadenar también después de la vacunación, sobre todo en individuos genéticamente predispuestos4. En este caso, en un paciente con antecedentes personales de asma bronquial, hipotiroidismo autoinmunitario y gastritis crónica atrófica, se plantea la hipótesis de que la vacuna haya podido ser el desencadenante de una reacción autoinmunitaria manifestada como miocarditis aguda.
Por otra parte, se han publicado múltiples casos de miocarditis causada por COVID-192,3. En los diferentes análisis mediante estudio con biopsia endomiocárdica, si bien se ha evidenciado inflamación miocárdica, no se ha aislado SARS-CoV-2 en los cardiomiocitos humanos2. En el caso que se describe, se descartó infección aguda por este microorganismo en 2 determinaciones de PCR, pero se observó un patrón serológico compatible con inmunidad tras la vacunación4.
En este caso que se presenta, el diagnóstico etiológico definitivo, al igual que en numerosos cuadros de miocarditis aguda, es difícil de establecer2. Dados la evidente relación temporal y el patrón serológico compatible con inmunización tras la vacuna habiéndose descartado una infección aguda, parece razonable relacionar el cuadro clínico desarrollado por este paciente con una reacción adversa a la vacuna BNT162b2 contra la COVID-19.
En conclusión, se presenta un caso de miocarditis aguda tras vacunación contra SARS-CoV-2 en el que destaca que es el primer caso publicado como reacción adversa a esta vacuna.
FINANCIACIÓNNo ha habido ninguna fuente de financiación.
CONTRIBUCIÓN DE LOS AUTORESJ. Bautista García, P. Peña Ortega y J.A. Bonilla Fernández fueron los redactores del texto. A. Cárdenes León fue el corrector principal. L. Ramírez Burgos fue el cardiólogo responsable durante la hospitalización del paciente. E. Caballero Dorta es el jefe de servicio.
CONFLICTO DE INTERESESTodos los autores declaran que no existen conflictos de intereses.