En la especie humana, las arritmias cardiacas son muy prevalentes en todos los grupos de edad y pueden darse tanto en el contexto de una cardiopatía subyacente como en corazones estructuralmente normales. Aunque las formas de presentación clínica de las arritmias son muy diversas, en las células comparten propiedades electrofisiológicas comunes. Los 3 mecanismos principales de las arritmias cardiacas son las alteraciones en el automatismo, la actividad desencadenada y la reentrada. Aunque la identificación del mecanismo específico a veces pueda resultar difícil para el clínico y requerir un estudio electrofisiológico invasivo, diferenciar y comprender el mecanismo subyacente puede ser crucial para desarrollar una correcta estrategia diagnóstica y terapéutica.
Palabras clave
Comprender los mecanismos arrítmicos resulta útil para el manejo y el tratamiento apropiado de todo tipo de arritmias. Dado que es frecuente que los mecanismos que conducen a las arritmias clínicas se deban a anomalías que van más allá de los tejidos, es esencial comprender lo que sucede en las células.
Electrofisiología celular cardiaca normalLas células cardiacas o miocitos son células altamente especializadas que se encargan tanto de la conducción de los impulsos eléctricos como de la contracción mecánica. Algunos miocitos muestran automaticidad, la cual se define como la capacidad de las células cardiacas de sufrir una despolarización diastólica espontánea e iniciar un impulso eléctrico en ausencia de estímulos externos1.
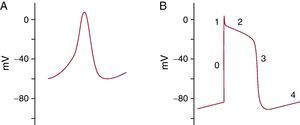
Los potenciales de acción (PA) originados espontáneamente se propagan a través de los miocitos, que son células «excitables», es decir, capaces de responder a un estímulo con un PA regenerativo2. La correcta propagación del impulso cardiaco es posible gracias a las uniones gap o de hendidura, que son estructuras de membrana especializadas formadas por múltiples canales iónicos intercelulares que facilitan la comunicación eléctrica y química entre las células. Los PA cardiacos presentan diferencias regionales (Figura 1) debido a que cada tipo de célula expresa diferentes tipos de canales iónicos y en diferente número3.
Figura 1. El potencial de acción cardiaco. A: potencial de acción del nódulo sinusal. B: potencial de acción de la célula muscular.
En condiciones normales, el nódulo sinoauricular es el marcapasos principal del corazón, con un potencial de membrana en reposo de aproximadamente –60mV. Estudios previos han demostrado que la corriente If(funny) desempeña un papel fundamental en la iniciación de la despolarización diastólica4. La actividad conjunta de diversas corrientes da lugar a un flujo de entrada neto de sodio (Na+) y, por lo tanto, a un aumento del potencial de membrana. Cuando este alcanza –40mV, se activan las corrientes de calcio (Ca2+) (tipo T ICa,T- y tipo L ICa,L), que son los transportadores iónicos predominantes durante la fase de ascenso del PA de las células marcapasos4 (dependientes de Ca2+). Posteriormente, se activan las corrientes de salida de potasio (K+) y se inactivan las corrientes de Ca2+. El potencial de membrana se reduce a causa del flujo de salida de K+, el principal ion repolarizante del corazón. Al alcanzar el potencial de membrana en reposo, el ciclo se repite continuamente una y otra vez.
El potencial de membrana de reposo de las células musculares es de –90mV. La entrada de cargas eléctricas positivas (Ca2+ y Na+) a través de las uniones gap hace que el voltaje aumente y se aproxime al umbral (aproximadamente –65mV)3, y se inicie un PA. En este punto se abren los canales de Na+, lo que origina una gran corriente de entrada de Na+, pero transitoria (fase 0). La corriente de Na+ se inactiva rápidamente, tras lo cual se produce una corriente de salida de K+ que inicia la repolarización (fase 1). Durante la fase de meseta del PA (fase 2), la ICa,L desempeña un papel importante, al oponerse a la corriente de K+. La ICa,L es la principal vía de entrada de Ca2+ y desencadena la liberación de Ca2+ del retículo sarcoplásmico, con lo que se inicia la contracción del miocito. La activación de los canales de K+ rectificadores tardíos y la inactivación de los canales de Ca2+ dan lugar a la interrupción de la fase de meseta e inician la repolarización tardía (fase 3). Por último, los canales de salida de K+ completan la fase de repolarización final (fase 4).
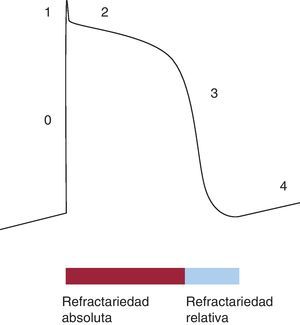
Tras la contracción, es necesario que las células cardiacas se relajen, lo que explica la importancia de la fase refractaria, durante la cual los miocitos no pueden ser despolarizados. El periodo refractario se define como el intervalo de tiempo posterior a la despolarización durante el cual la célula no es excitable. Esto se debe a la falta de disponibilidad de una corriente despolarizante (que es la de Na+ en las células musculares). Se clasifica como absoluto o relativo (Figura 2), en función de que no se pueda excitar la célula en absoluto o que requiera un estímulo superior a lo normal.
Figura 2. Periodos refractarios; periodo refractario absoluto y relativo durante el potencial de acción.
Principales mecanismos de las arritmias cardiacasLos mecanismos de las arritmias cardiacas pueden dividirse en trastornos de la formación del impulso, trastornos de la conducción del impulso o la combinación de ambos (Tabla 1).
Tabla 1. Mecanismos de las arritmias cardiacas
| Trastornos de la formación del impulso | Trastornos de la conducción del impulso |
| Automatismo | Reentrada |
| Automatismo normal alterado | Reentrada anatómica |
| Automatismo anormal | Reentrada funcional |
| Actividad desencadenada | |
| Pospotenciales tardíos | |
| Pospotenciales precoces |
Como se ha descrito previamente, algunas células cardiacas especializadas como las del nódulo sinoauricular, el nódulo auriculoventricular (AV) y el sistema de His-Purkinje, así como algunas células de ambas aurículas5, poseen la propiedad de automatismo o actividad de marcapasos. La supresión o potenciación de esta actividad puede derivar en arritmias clínicas.
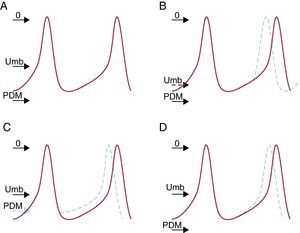
En condiciones normales, las células del nódulo sinoauricular poseen la frecuencia de descarga más rápida, y las células de los denominados marcapasos «subsidiarios» descargan a una frecuencia inferior manteniendo la jerarquía normal. La frecuencia de descarga está determinada por la interacción de tres factores: el potencial diastólico máximo, el potencial umbral al que se inicia el PA y la rapidez o pendiente de la despolarización de la fase 4. Un cambio en cualquiera de estos factores (Figura 3) puede modificar la frecuencia de generación de los impulsos6.
Figura 3. Mecanismos de aumento de automatismo normal. A: normal. B: aumento del umbral de voltaje. C: disminución del potencial diastólico de membrana (PDM). D: aumento de la pendiente de la despolarización de fase 4. PDM: potencial diastólico de membrana; Umb: umbral.
El sistema nervioso autónomo controla la actividad de marcapasos, que puede ser modulada por diversos factores sistémicos como anomalías metabólicas y sustancias endógenas o farmacológicas.
La actividad parasimpática reduce la frecuencia de descarga de las células marcapasos (Figura 4) al liberar acetilcolina (Ach) e hiperpolarizar las células mediante un aumento de la conductancia de los canales de K+. También puede reducir la actividad de ICa-L e If, lo que reduce aún más la frecuencia.
Figura 4. Efecto parasimpático en el potencial de acción (reducción de la frecuencia cardiaca).
El efecto supresor de la Ach se emplea frecuentemente en la práctica clínica, con fines tanto diagnósticos como terapéuticos. En las taquicardias debidas al aumento de automatismo normal, es esperable una reducción transitoria de la frecuencia en respuesta a las maniobras vagales (que fomentan la liberación de Ach), con una vuelta progresiva a la situación basal tras una transitoria aceleración al cesar la maniobra (fenómeno denominado «taquicardia posvagal»)7.
La actividad simpática, en cambio, aumenta la frecuencia sinusal. Las catecolaminas aumentan la permeabilidad de la ICa-L, incrementando la corriente de entrada de Ca2+. La actividad simpática también favorece la potenciación de la corriente If8, con lo que aumenta la pendiente de la repolarización de la fase 4.
Las anomalías metabólicas, como hipoxia e hipopotasemia, pueden potenciar la actividad automática normal, como consecuencia de la inhibición de la bomba de Na/K, reduciendo las corrientes repolarizantes y aumentando la pendiente de repolarización diastólica de la fase 47.
Los trastornos degenerativos que afectan al sistema de conducción cardiaco pueden causar supresión de las células marcapasos sinusales y dar lugar a bradicardia sinusal o incluso parada sinusal. Un marcapasos subsidiario puede manifestarse como consecuencia de la supresión del automatismo sinusal.
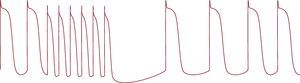
La característica distintiva del automatismo normal es la «supresión por sobreestimulación» (overdrive suppression). La sobreestimulación de una célula marcapasos a una frecuencia más rápida que su frecuencia intrínseca origina una disminución de la pendiente de la fase 4, que se produce principalmente por la potenciación de la actividad de la bomba de intercambio de Na/K. Una vez finalizada la sobreestimulación, se produce un retorno gradual a la frecuencia de descarga intrínseca, que se denomina periodo de «calentamiento» (Figura 5). El grado de supresión y el tiempo de recuperación son proporcionales a la frecuencia y la duración de la sobreestimulación aplicada7, 8.
Figura 5. Supresión por sobreestimulación en una fibra de Purkinje y periodo de calentamiento tras la supresión.
Este mecanismo desempeña un papel crucial en el mantenimiento del ritmo sinusal, al inhibir de forma continua la actividad de las células de marcapasos subsidiarios6. En pacientes portadores de marcapasos externos, este es el mecanismo por el que se inhibe su ritmo intrínseco9.
La ausencia de supresión por sobreestimulación puede indicar que la arritmia se debe a un mecanismo distinto del aumento de automatismo normal. Sin embargo, lo contrario no siempre es cierto, dado que un automatismo normal alterado puede no responder a la sobreestimulación a causa de un bloqueo de entrada3.
Ejemplos clínicos: taquicardia sinusal asociada a ejercicio, fiebre o tirotoxicosis; ritmos acelerados auriculares y ventriculares; taquicardia sinusal inapropiada y ritmos de la unión AV.
Automatismo anormalLas células miocárdicas no marcapasos de las aurículas y ventrículos, que en condiciones normales no muestran actividad espontánea, pueden presentar propiedades de automatismo. Esto puede ocurrir en situaciones en las que el potencial diastólico máximo se eleva hasta el potencial umbral, que se explica por la interacción de numerosas corrientes que, conjuntamente, dan lugar a una corriente despolarizante de entrada y una reducción de la conductancia del potasio.
La frecuencia intrínseca de un foco automático anormal depende del potencial de membrana; cuanto más positivo sea el potencial de membrana, más rápida será la frecuencia automática6. Se postula que el automatismo anormal puede aparecer en los casos de potasio extracelular elevado, pH intracelular bajo y exceso de catecolaminas.
Una distinción importante entre el automatismo normal alterado y el automatismo anormal es que este es menos sensible a la supresión por sobreestimulación10, aunque hay situaciones en las que sí puede observarse. En estas circunstancias, un foco automático ectópico puede mostrar características propias de otros mecanismos de arritmias11.Ejemplos clínicos: extrasístoles, taquicardia auricular, ritmo idioventricular acelerado, taquicardia ventricular (TV), especialmente en la fase aguda, asociada a isquemia y reperfusión.
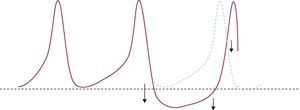
Actividad desencadenadaLa actividad desencadenada (AD) o triggered activity se define como la iniciación del impulso causado por pospotenciales (oscilaciones del potencial de membrana que se producen durante o inmediatamente después de un PA precedente)12. Los pospotenciales únicamente pueden producirse en presencia de un PA previo (el desencadenante). Cuando alcanzan el potencial umbral, se genera un nuevo PA, que genera una nueva respuesta desencadenada, que puede originar una nueva respuesta desencadenada y así perpetuar el mecanismo.
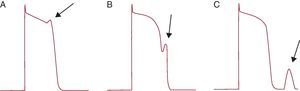
En función de su relación temporal, se describen dos tipos de pospotenciales: los pospotenciales precoces (PPP) se producen durante las fases 2 o 3 del PA, y los pospotenciales tardíos (PPT) se producen después de completar la fase de repolarización (Figura 6).
Figura 6. Representación de la actividad desencadenada. A: pospotencial precoz en fase 2. B: pospotencial precoz en fase 3. C: pospotencial tardío.
Actividad desencadenada por pospotenciales tardíosUn PPT es una oscilación del voltaje de membrana que se produce tras haberse completado la repolarización (durante la fase 4). Estas oscilaciones las causan diversas alteraciones que elevan la concentración del Ca2+ intracelular diastólico, lo que da lugar a oscilaciones causadas por el Ca2+ capaces de desencadenar un nuevo PA si alcanzan el umbral de estimulación13.
A medida que se reduce la duración del ciclo cardiaco, la amplitud y la frecuencia de los PPT aumenta, por lo que es de prever que la iniciación de arritmias desencadenadas por PPT ocurra cuando aumenta la frecuencia cardiaca (ya sea de forma espontánea o mediante maniobras de estimulación). De hecho, la amplitud y el número de respuestas desencadenadas guarda relación directa tanto con la frecuencia como con la duración de la sobreestimulación (por lo tanto, son más fáciles de inducir mediante estimulación continua). Con la sobreestimulación, la AD puede enlentecerse hasta que se termina, pero cuando no es lo suficientemente rápida para interrumpir el ritmo desencadenado, puede causar una aceleración por sobreestimulación, a diferencia de la supresión por sobreestimulación que se observa en los ritmos automáticos6.
La concentración tóxica de los digitálicos fue la primera causa objetivada capaz de producir PPT14. Estos se deben a la inhibición de la bomba de Na/K, que fomenta la liberación de Ca2+ por el retículo sarcoplásmico. Clínicamente, se considera que la taquicardia fascicular bidireccional secundaria a la toxicidad de la digoxina es un ejemplo de AD15.
Las catecolaminas pueden causar PPT al producir una sobrecarga de Ca2+ intracelular a través de un aumento de la ICa-L y la corriente de intercambio de Na+-Ca2+, entre otros mecanismos. En cuanto a los PPT inducidos por isquemia, se cree que se producen a través de la acumulación de lisofosfoglicéridos en el tejido isquémico16, lo cual causa elevación del Na+ y el Ca2+. Asimismo, la función anormal del retículo sarcoplásmico (p. ej., debido a mutaciones en el receptor de rianodina) puede conducir también a una sobrecarga de Ca2+ intracelular, lo cual facilita arritmias clínicas como la TV polimórfica catecolaminérgica17.
Un factor crucial para el desarrollo de los PPT es la duración del PA. Un PA más prolongado se asocia a una mayor sobrecarga de Ca2+ y facilita los PPT. Así pues, los fármacos que prolongan el PA (como los antiarrítmicos de clase IA) pueden aumentar ocasionalmente la amplitud de los PPT.
Las AD inducidas por los PPT pueden interrumpirse por extraestímulos únicos, por lo que son necesarias otras características electrofisiológicas para diferenciarlas de las taquicardias por reentrada. La frecuencia del intervalo de acoplamiento puede ser útil, puesto que en la mayoría de los casos de arritmias inducidas por PPT, cuanto más corto es el ciclo de estimulación, más breve es el intervalo de acoplamiento de la arritmia inducida. Esto contrasta con la relación inversa observada en las arritmias por reentrada, en las que, cuanto más cortos son los intervalos de acoplamiento de los extraestímulos, más largo es el intervalo de acoplamiento del primer latido de la arritmia3. Dado que esto no es una regla fija, es preciso tener en cuenta otras propiedades electrofisiológicas de las arritmias.
La adenosina se ha utilizado como maniobra para establecer el diagnóstico de los PPT. La adenosina reduce la corriente de entrada de Ca2+ de forma indirecta, al inhibir los efectos de la adenilato ciclasa y el adenosinmonofosfato cíclico. Por consiguiente, puede abolir los PPT inducidos por catecolaminas, pero no altera los PPT secundarios a la inhibición de la bomba de Na+/K+. La interrupción de una TV por adenosina apunta a PPT inducidos por catecolaminas como mecanismo subyacente18.Ejemplos clínicos: taquicardia auricular, taquicardia inducida por toxicidad digitálica, ritmos ventriculares acelerados en el contexto del infarto agudo de miocardio, algunas formas de TV monomórfica repetitiva, arritmias inducidas por reperfusión, TV del tracto de salida ventricular derecho, TV inducida por ejercicio (p. ej., TV polimórfica catecolaminérgica).
Actividad desencadenada por pospotenciales precocesLos PPP son oscilaciones de membrana que se producen durante la fase de meseta del PA (PPP de fase 2) o durante la repolarización tardía (PPP de fase 3). Ambos tipos pueden acontecer en condiciones experimentales similares, pero difieren tanto morfológicamente como en su mecanismo iónico subyacente. Los PPP de fase 2 parecen estar relacionadas con la corriente ICa-L19, mientras que los PPP de fase 3 parecen ser consecuencia de una corriente electrónica durante la repolarización o de una IK1 baja20.
La fase de meseta del PA es un periodo de alta resistencia de membrana3 y bajo flujo de corriente. Como consecuencia, pequeños cambios de las corrientes de repolarización o despolarización pueden acarrear profundos cambios en la duración y el perfil del PA. Existe una amplia variedad de agentes y situaciones que pueden conducir a una disminución de la corriente de salida o un aumento de la corriente de entrada (lo que modifica la corriente de salida normal) y, por lo tanto, facilitar las condiciones necesarias para que se produzcan PPP (Tabla 2).
Tabla 2. Agentes y manipulaciones que pueden conducir a pospotenciales precoces
| • Frecuencia lenta (bradicardia, bloqueo cardiaco completo, etc.) |
| • Distensión mecánica |
| • Hipopotasemia |
| • Hipoxia |
| • Acidosis |
| • Concentración de K+ extracelular baja |
| • Concentración de Ca2+ extracelular baja |
| • Concentración de magnesio (Mg2+) extracelular baja |
| • Fármacos antiarrítmicos de clase IA (quinidina, disopiramida, procainamida) |
| • Fármacos antiarrítmicos de clase IB (flecainida, encainida, indecainida) |
| • Fármacos antiarrítmicos de clase III (amiodarona, sotalol, bretilio) |
| • Fenotiacinas |
| • Antidepresivos tricíclicos y tetracíclicos |
| • Eritromicina |
| • Antihistamínicos |
| • Cesio |
| • Amilorida |
| • Bario |
Una condición fundamental que subyace al desarrollo de los PPP es la prolongación del PA, que se manifiesta en el electrocardiograma (ECG) de superficie como prolongación del intervalo QT. Algunos fármacos antiarrítmicos, sobre todo los de clases IA y III, pueden presentar efectos proarrítmicos, debido a su efecto en la prolongación del PA. Hay otros muchos fármacos (Tabla 2) que pueden predisponer a la formación de PPP, especialmente cuando se asocian a hipopotasemia y/o bradicardia, que son factores adicionales que causan una prolongación del PA7. Las catecolaminas pueden potenciar la aparición de PPP al elevar la corriente de Ca2+; sin embargo, su efecto en el incremento de la frecuencia cardiaca, junto con el aumento de la corriente de K+ que producen, reduce de manera efectiva la duración del PA y, por lo tanto, los PPP7.
La AD inducida por PPP parece ser la causa subyacente de las arritmias que acontecen en el contexto del síndrome de QT largo. Aunque continúa habiendo controversia respecto al mecanismo exacto por el que se producen estas arritmias, se acepta que la dispersión de la repolarización observada en pacientes con este síndrome puede crear un sustrato proarrítmico21 en el que un PPP puede iniciar la taquicardia.
Las arritmias inducidas por PPP dependen de la frecuencia y, en general, la amplitud de los PPP aumenta a frecuencias lentas. En consecuencia, no se espera que este tipo de AD se produzca mediante extraestímulos (que se asocian a una aceleración de la repolarización que reduce la amplitud del PPP). Una excepción es la presencia de una pausa compensatoria prolongada tras un estímulo prematuro, que puede ser más importante aún que la bradicardia para iniciar una taquicardia en torsades de pointes22.Ejemplos clínicos: torsades de pointes («torsión de puntas»), la TV polimórfica característica que se observa en pacientes con síndrome de QT largo.
Trastornos de la conducción del impulsoBloqueoLos retrasos y bloqueos en la conducción se producen cuando falla la propagación del impulso eléctrico. Existen diversos factores que determinan la velocidad de conducción de un impulso y que se produzca o no de forma satisfactoria, tales como las propiedades tanto activas como pasivas de la membrana, la eficacia estimuladora del impulso y la excitabilidad del tejido al que se transmite el impulso13. Las uniones gap o de hendidura desempeñan un papel crucial en la velocidad y la seguridad de la propagación del impulso23.
Lo más frecuente es que los impulsos se bloqueen a frecuencias rápidas como resultado de una recuperación incompleta de su periodo refractario. Cuando un impulso llega a un tejido que todavía se encuentra refractario, la conducción no se produce o se transmite como un latido aberrado. Este es el mecanismo habitual que explica varios fenómenos como el bloqueo o la conducción funcional sólo por una de las ramas del haz de His de un latido prematuro, el fenómeno de Ashman durante fibrilación auricular (FA) o la conducción aberrante dependiente de la aceleración.
Se ha propuesto que el bloqueo dependiente de la desaceleración o bradicardia dependiente está causado por la reducción de la excitabilidad que ocurre en los intervalos diastólicos largos, que resultan en una reducción de la amplitud del PA.
Muchos factores pueden alterar la conducción de un impulso, como por ejemplo la frecuencia cardiaca, el tono del sistema autónomo, los fármacos (p. ej., antagonistas del calcio, bloqueadores beta, digital, adenosina/adenosintrifosfato) o procesos degenerativos (porque alteran la fisiología del tejido y la capacidad de conducción de los impulsos).
ReentradaDurante la actividad eléctrica normal, el ciclo cardiaco se inicia en el nódulo sinoauricular y continúa propagándose hasta activar todo el corazón. Cuando todas las fibras se han despolarizado y se encuentran en una fase completamente refractaria, el impulso se extingue. Sin embargo, si un grupo aislado de fibras no se ha activado durante la onda inicial de despolarización, estas fibras pueden excitarse antes de que se extinga el impulso, porque aún están a tiempo de despolarizarse. En este contexto, pueden actuar como vínculo para volver a excitar zonas previamente despolarizadas pero que se han recuperado de la despolarización inicial6. Este tipo de proceso se denomina con diversos nombres, como reentrada, excitación reentrante, movimiento circular, latidos recíprocos o ecos o taquicardia reciprocante (TR), que indican una propagación repetitiva de la onda de activación que vuelve a su lugar de origen para volver a activar la zona ya activada12.
La reentrada se ha dividido en dos grupos principales (Tabla 3): reentrada anatómica o clásica, en la que el circuito está determinado por estructuras anatómicas, y reentrada funcional, que incluye a su vez diferentes mecanismos. La reentrada funcional se caracteriza por carecer de límites anatómicos. Ambas formas pueden coexistir en el mismo contexto y comparten mecanismos biofísicos comunes24. La reentrada es el mecanismo arrítmico que se observa con mayor frecuencia en las arritmias clínicas, tanto en su forma clásica como en forma de variantes funcionales.
Tabla 3. Tipos de reentrada
| Reentrada anatómica |
| Reentrada funcional |
| Circuito guía o leading circuit |
| Reentrada anisotrópica |
| Reentrada «en ocho» |
| Reflejo |
| Reentrada de onda espiral (rotor) |
Existe una serie de requisitos para que se produzca la reentrada:
• Un sustrato: la presencia de un tejido miocárdico con diferentes características electrofisiológicas y propiedades de conducción y refractariedad.
• Una zona de bloqueo (anatómico, funcional o de ambos tipos): una zona de tejido inexcitable alrededor del cual pueda circular el frente de onda.
• Un bloqueo de conducción unidireccional.
• Un trayecto de conducción lenta que permita que se cree un retraso suficiente en la conducción del frente de onda circulante para permitir la recuperación del tejido refractario proximal a la localización del bloqueo unidireccional.
• Una masa crítica de tejido que pueda sostener los frentes de onda de reentrada circulantes.
• Un desencadenante que la inicie.
El mecanismo de reentrada clásico se basa en un obstáculo anatómico no excitable rodeado por una vía circular en la que el frente de onda puede «reentrar» y crea circuitos de reentrada fijos y estables. El obstáculo anatómico determina la presencia de dos vías (Figura 7). Cuando el frente de onda encuentra el obstáculo, avanza por una de las vías (bloqueo unidireccional) y se propaga hasta el punto del bloqueo, con lo que se inicia el circuito de reentrada.
Figura 7. Reentrada anatómica: el obstáculo central establece dos vías; cuando el impulso llega al circuito, se produce un bloqueo unidireccional, y la conducción lenta a través de la otra vía permite que se inicie la reentrada.
El inicio y el mantenimiento de la reentrada dependen de la velocidad de conducción y del periodo refractario de cada vía, los cuales determinan la longitud de onda (longitud de onda = velocidad de conducción × periodo refractario). Para que se produzca la reentrada, la longitud de onda debe ser más corta que la longitud de la vía. Las condiciones que reduzcan la velocidad de conducción o que acorten el periodo refractario permitirán la creación de circuitos más pequeños, de modo que facilitan el inicio y el mantenimiento de la reentrada.
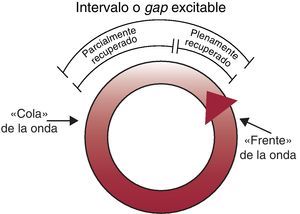
El intervalo o gap excitable es un concepto clave esencial para comprender el mecanismo de reentrada (Figura 8). Se denomina intervalo o gap excitable al miocardio excitable que existe entre el frente de la onda de reentrada y la cola de la onda precedente24. Este intervalo permite que la onda reentrante continúe propagándose por el circuito. Su presencia posibilita además que podamos entrar en el circuito de reentrada mediante maniobras de estimulación externas y explica los fenómenos de reciclaje (resetting), encarrilamiento (entrainment), e interrupción de la taquicardia mediante la estimulación eléctrica.Ejemplos clínicos: taquicardia de reentrada AV asociada a una vía accesoria, taquicardia de reentrada del nódulo AV, flutter auricular, TV de reentrada de rama del haz, TV postinfarto.
Figura 8. Representación esquemática del intervalo o gap excitable.
Reentrada funcionalEn la reentrada funcional, el circuito no está determinado por obstáculos anatómicos, sino que lo definen las heterogeneidades dinámicas de las propiedades electrofisiológicas del tejido involucrado2.
La localización y el tamaño de los circuitos de reentrada funcionales puede variar, pero generalmente son pequeños e inestables.
Como se ha indicado previamente, los circuitos de reentrada funcionales pueden deberse a diferentes mecanismos:
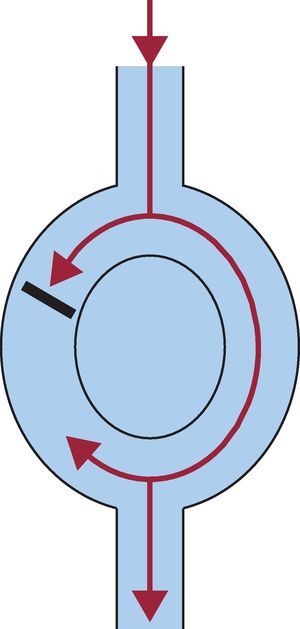
• Reentrada de «circuito guía» (leading circle) (Figura 9). En 1976, Allesie et al describieron un mecanismo de reentrada en el que no había ningún límite anatómico. Esos autores propusieron que el impulso circulaba alrededor de un núcleo central que se mantenía en un estado refractario al ser bombardeado constantemente por impulsos, y que se desplazaba por un tejido parcialmente refractario25. El circuito guía se definió como «el circuito más pequeño posible en que el impulso puede continuar circulando»26. Este tipo de reentrada es menos vulnerable a reciclaje, encarrilamiento e interrupción mediante maniobras de estimulación, puesto que no existe un intervalo plenamente excitable.
Figura 9. Representación esquemática de un «circuito guía».
• Reentrada anisotrópica. La conducción anisotrópica hace referencia a la dependencia de la velocidad de propagación del impulso con la dirección en que lo hace en el músculo cardiaco27 y depende de la estructura y la organización de los miocitos. Esto incluye la orientación de las fibras y la distribución no uniforme de las uniones gap, con un mayor número de canales capaces de propagar el impulso longitudinalmente que para propagarlo transversalmente4. La heterogeneidad de la velocidad de conducción y repolarización del tejido anisotrópico puede dar lugar a un bloqueo de los impulsos y una conducción lenta que permite la reentrada incluso en circuitos anatómicos pequeños24. Ejemplos clínicos: reentrada anisotrópica en el músculo auricular y ventricular, que puede ser causa de algunas TV originadas en el tejido que sobrevive a un infarto de miocardio28.
• Reentrada «en ocho». Este tipo de reentrada consiste en dos frentes de onda concomitantes que circulan en sentido contrario (horario y antihorario) alrededor de dos arcos funcionales o fijos de bloqueo que se fusionan en una vía común central. Ejemplo clínico: este tipo de reentrada puede observarse en el contexto de la TV relacionada con el infarto.
• Reflejo (Figura 10). El reflejo es una subclase particular de reentrada que se produce en un segmento de tejido lineal, en el que el impulso se desplaza en ambas direcciones por la misma vía, en situaciones en que la conducción está muy alterada29.
Figura 10. Representación esquemática de un mecanismo de reflejo.
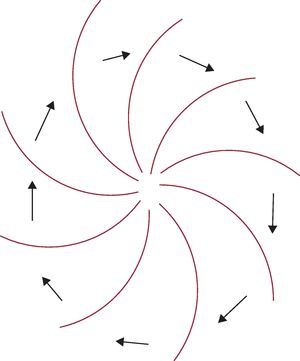
• Reentrada de onda espiral (rotor) (Figura 11). Las ondas espirales se pueden producir en una amplia variedad de entornos en los que existe tejido excitable30. Representan la forma bidimensional de propagación rotatoria de una onda, que puede producirse también de forma tridimensional. Cuando la actividad de onda espiral se produce en tres dimensiones, este fenómeno se denomina «scroll waves». Inicialmente, el término «rotor» hacía referencia al origen de la rotación y la «onda espiral» definía la forma de la onda emergente6. En la literatura se han mezclado los términos, y también se utilizan otros como «vórtices» o «reverberadores» para describir este fenómeno. La activación de la onda espiral se organiza alrededor de un núcleo que se mantiene sin estimular debido a la pronunciada curvatura de la espiral. Esta curvatura, a su vez, es la que limita la velocidad de propagación de la espiral y causa conducción lenta y bloqueo25. A diferencia del modelo de circuito guía, en este tipo de reentrada sí que existe un intervalo plenamente excitable. La punta de la onda se desplaza a lo largo de una trayectoria compleja y puede irradiar ondas hacia el medio circundante (lo que se denomina «rotura» —break-up— de la onda madre). Las espirales pueden tener una dinámica completamente diferente y circular con diferentes patrones, pasar de uno a otro, hacerse estacionarias o desplazarse o migrar continuamente6. Estas características dan lugar a que puedan derivar en patrones tanto monomórficos como polimórficos.
Figura 11. Representación esquemática de una onda espiral.
Ejemplos clínicos: FA y ventricular, TV polimórfica.
Reciclaje (resetting) y encarrilamiento (entrainment) de arritmias por reentradaReciclaje (resetting)El reciclaje es el acto de adelantar un impulso de la taquicardia como consecuencia de estímulos eléctricos aplicados prematuramente. El primer complejo de la taquicardia tras el extraestímulo debe tener las mismas características morfológicas y la misma duración del ciclo que antes del extraestímulo, y la pausa hasta este primer complejo de taquicardia debe sufrir «reciclaje» y, por lo tanto, debe ser menos del doble de la duración del ciclo de la taquicardia6.
Para que se produzca el reciclaje de una taquicardia, el frente de onda estimulado debe llegar del lugar desde donde se ha aplicado al circuito de la taquicardia (cuanto más próximo se encuentre el punto de estimulación, menos prematuridad es necesaria) y entrar en el intervalo excitable. Una vez penetrado en el circuito, se propagará en ambos sentidos, y colisionará en sentido retrógrado con el impulso de taquicardia previo (antidrómicamente), mientras que en sentido anterógrado se propagará y saldrá del circuito antes de lo esperado31.
Tras ello, la taquicardia continuará inalterada. El grado de adelanto depende de la prematuridad del extraestímulo y de su conducción en el interior del circuito (es decir, el estímulo se propagará de manera más lenta si el intervalo es tan sólo parcialmente excitable).
Si el estímulo entra en el circuito durante el periodo refractario, puede bloquearse en dirección anterógrada (debido a que se encuentra en periodo de refractariedad absoluta) y colisionar antidrómicamente con el latido previo, con lo que termina la taquicardia32.
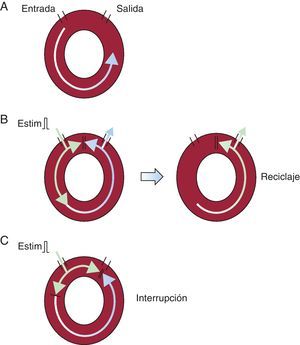
Encarrilamiento (entrainment)
El encarrilamiento es el reciclaje continuo de un circuito de taquicardia (Figura 12). Durante la sobreestimulación externa, todo el tejido miocárdico mantendrá la frecuencia de estimulación aplicada. Con el cese de la estimulación eléctrica o la reducción de su frecuencia por debajo de la frecuencia intrínseca33, se reanudarán la morfología y la frecuencia intrínsecas previas a la sobreestimulación.
Figura 12. A: circuito de reentrada. B: un estímulo prematuro puede entrar en el circuito; retrógradamente colisiona contra el impulso previo y en sentido anterógrado sale antes de lo esperado. C: la interrupción se produce cuando el estímulo entra en el circuito durante al periodo refractario relativo (colisiona retrógradamente y se bloquea de forma anterógrada). Estim: estímulo.
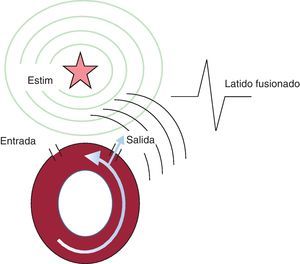
Fusión
Un latido de fusión posee una morfología intermedia entre un complejo plenamente estimulado y el complejo de taquicardia. Puede observarse en el ECG de superficie (si se despolariza una cantidad significativa de miocardio34) o en registros intracardiacos. Para que la fusión se produzca, el frente de onda de taquicardia debe salir del circuito y colisionar con el estímulo eléctrico aplicado antes de que haya despolarizado el miocardio circundante (Figura 13). Esto requiere que el circuito reentrante posea zonas de entrada y salida bien diferenciadas. El reciclaje y el encarrilamiento con fusión son específicos de las arritmias de reentrada pero, dado que a veces su identificación puede resultar difícil, que no se detecten no invalida la reentrada como mecanismo de la arritmia.
Figura 13. Representación esquemática de un latido de fusión. Estim: estímulo.
Características de los mecanismos de las arritmiasA continuación presentamos una forma de abordaje para el diagnóstico diferencial de los mecanismos de las arritmias. En la Tabla 4 se muestran de forma esquemática maniobras útiles (explicadas en apartados previos) que podemos utilizar para diferenciar los distintos mecanismos de las arritmias.
Tabla 4. Maniobras para diferenciar los distintos mecanismos de las arritmias
| Automatismo | Actividad desencadenada | Reentrada | |
| Iniciación mediante EEP | No | Sí (estimulación continua) | Sí |
| Interrupción mediante EEP | No | A veces | Sí |
| Primer intervalo al inicio | Largo, calentamiento | Corto (igual o más corto que el resto) | Largo (más largo que los siguientes) |
| Morfología del primer latido | Idéntico a siguientes | Diferente de los siguientes | Diferente de los siguientes |
| Adenosina | Enlentecimiento transitorio o sin respuesta | Interrupción | Ausencia de respuesta o bloqueo AV |
| Catecolaminas | Aumento | Aumento (si PPT) | Aumento/disminución |
| Respuesta a EEP durante la taquicardia | Reciclaje o pausa compensatoria | Reciclaje o interrupción | Reciclaje o interrupción |
| Reciclaje con fusión | No | No | Sí |
| Respuesta a la estimulación continua durante la taquicardia | Supresión por sobreestimulación (si automatismo normal aumentado) | Aceleración o interrupción | Encarrilamiento o interrupción |
| Encarrilamiento con fusión | No | No | Sí |
AV: auriculoventricular; EEP: estimulación eléctrica programada; PPT: pospotencial tardío.
Es importante señalar que a veces puede resultar muy difícil identificar el mecanismo exacto que sustenta una arritmia, más aún si tenemos en cuenta que una arritmia puede iniciarse por un mecanismo pero perpetuarse luego por otros (p. ej., la FA).
Tal como se muestra en la Tabla 4, las arritmias automáticas no pueden ser iniciadas o interrumpidas de una manera reproducible por estimulación eléctrica programada. Pueden ser reciclados, y la sobreestimulación externa puede dar lugar a supresión por sobreestimulación o no producir efecto alguno. La iniciación puede facilitarse con isoproterenol; la arritmia se inicia habitualmente tras un periodo de calentamiento y el primer latido de taquicardia es idéntico a los siguientes. La adenosina puede hacer que la taquicardia sea más lenta, pero generalmente no la interrumpe.
Aunque la AD puede iniciarse mediante estimulación programada, es frecuente que requiera isoproterenol. En las arritmias debidas a AD, puede observarse reciclaje y generalmente la estimulación eléctrica externa puede interrumpirlas. El primer latido suele ser el extraestímulo o latido prematuro, así que es diferente de los siguientes. Estas arritmias se suelen interrumpir en respuesta a la adenosina.
Las taquicardias por reentrada responden a la estimulación externa y muestran la característica distintiva de reciclaje y encarrilamiento con fusión. La adenosina puede interrumpir una taquicardia de reentrada en la que participe el nódulo AV, pero no influirá en las células dependientes del sodio de las aurículas y los ventrículos.
Además, siempre debemos considerar otros instrumentos no invasivos como el ECG de superficie. El ECG de superficie puede no confirmar un determinado mecanismo, pero nos aporta pistas importantes35. El ECG en ritmo sinusal puede revelar procesos patológicos de los que se sabe que se asocian a tipos específicos de arritmias: a) las ondas Q compatibles con un infarto de miocardio previo indican el sustrato para la reentrada; b) un intervalo QT prolongado hace sospechar de pospotenciales; c) una «onda delta» hace que la reentrada por una vía accesoria sea un mecanismo plausible, y d) las ondas épsilon o el patrón de Brugada en el ECG indican mecanismos de reentrada.
Relación con las arritmias clínicasEn este apartado se comentan los mecanismos que subyacen a las arritmias más frecuentes de la práctica clínica.
BradiarritmiasLas bradiarritmias pueden explicarse por dos mecanismos (Figura 14):
• Fallo en la generación del impulso. El fallo en la generación del impulso ocurre cuando las células marcapasos no son capaces de generar los impulsos eléctricos apropiados. Esta forma de bradiarritmia se observa con frecuencia en el contexto de procesos degenerativos. Aunque cualquier foco automático normal puede estar afectado, es posible que su fallo sólo se aprecie cuando se produzca la supresión de la función de las células marcapasos superiores. Por lo tanto, el fallo del nódulo sinusal causará pausas de mayor o menor importancia dependiendo de la función de las células marcapasos subsidiarias.
• Fallo en la propagación del impulso. El fallo en la propagación del impulso se refiere a la falta de conducción normal de los impulsos eléctricos generados por las células marcapasos a través del sistema de conducción. Este mecanismo implica una anomalía de la velocidad de conducción y/o un estado refractario en el sistema de conducción, y puede causar bloqueo cardiaco a diversos niveles.
Figura 14. A: conducción normal. B: supresión del automatismo. C: bloqueo de conducción.
TaquiarritmiasTaquicardia sinusal• La taquicardia sinusal fisiológica corresponde a una potenciación de descarga del nódulo sinusal en respuesta al estrés fisiológico, y se caracteriza por un aumento de la pendiente de la despolarización de la fase 4 en las células del nódulo sinusal.
• La taquicardia sinusal inapropiada es un trastorno en el que la frecuencia sinusal está aumentada de forma continua o en un modo desproporcionado para el grado de estrés fisiológico36 y se debe a un aumento del automatismo normal. Ante la sospecha, se debe descartar una taquicardia automática originada en las proximidades del nódulo sinusal y el circuito de reentrada sinoauricular.
Las taquicardias auriculares pueden deberse a automatismo, AD o mecanismos de reentrada, pero la mayor parte de ellas corresponden a alteraciones del automatismo o a mecanismos de reentrada. Pueden diferenciarse según su comportamiento en respuesta a diversas maniobras. Aunque fenómenos como la fusión pueden ser más difíciles de determinar en la onda P, el registro intracardiaco puede ser útil para identificar este fenómeno.
Recientemente se ha descrito una taquicardia auricular sensible a la lidocaína, lo cual indica un mecanismo subyacente diferente37.
Flutter auricularEl flutter auricular puede clasificarse, a su vez, en típico o atípico.
Flutter auricular típico
En el flutter típico, el frente de onda circula por la aurícula derecha alrededor del anillo de la válvula tricúspide en sentido antihorario u horario. El flutter auricular típico es el ejemplo más frecuente de circuito de macrorreentrada, en el que obstáculos anatómicos y funcionales crean el sustrato.
Flutter auricular atípico
En este tipo de flutter, el obstáculo suele estar relacionado con intervenciones realizadas anteriormente que crean barreras anatómicas grandes (cicatriz de atriotomía, líneas de sutura o ablación por radiofrecuencia) o facilitan una zona de conducción lenta que posibilita la reentrada (p. ej., flutter auricular izquierdo relacionado con una ablación de FA previa). A diferencia de la forma típica, el flutter auricular atípico muestra ocasionalmente características de un mecanismo focal y se solapa con las taquicardias auriculares.
Fibrilación auricularLa FA es la arritmia sostenida más frecuente en la práctica clínica. A pesar de que su mecanismo subyacente continúa siendo objeto de controversia entre los electrofisiólogos, la FA probablemente corresponda a una compleja interacción entre estímulos que causan su iniciación y el sustrato anatómico auricular necesario para su perpetuación38.
El origen de los impulsos se encuentra predominantemente en las venas pulmonares y puede corresponder a formas variables de automatismo focal anormal o de AD en la vena o a circuitos de microrreentrada alrededor de las desembocaduras de las venas bajo una intensa influencia del sistema autónomo39. Las venas pulmonares no sólo contribuyen a la iniciación de la FA, sino que también participan en el mantenimiento de la arritmia40. Se han descrito también otros focos desencadenantes no pulmonares, como los del seno coronario, la vena cava superior41 o el ligamento de Marshall42.
El mantenimiento de la arritmia es consecuencia de una combinación de factores electrofisiológicos y estructurales que crean el sustrato para perpetuar la FA. Se han propuesto diversos mecanismos, como la presencia de múltiples pequeñas ondas de reentrada o un circuito rotor madre, así como una actividad de alta frecuencia en las aurículas42. Además, el remodelado estructural y eléctrico de las aurículas con el paso del tiempo contribuye a producir el sustrato arritmogénico.
Complejos prematuros de la uniónLos complejos prematuros de la unión son muy poco frecuentes. Se atribuyen a una probable potenciación del automatismo normal.
Taquicardia de reentrada del nódulo auriculoventricularEsta frecuente taquicardia supraventricular paroxística se produce por el mecanismo de reentrada clásico. La presencia de dos vías en el nódulo AV que presentan diferentes propiedades electrofisiológicas hace posible esta arritmia.
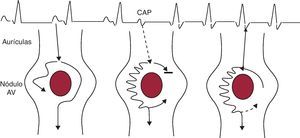
En condiciones normales, un impulso sinusal se desplazará por ambas vías. En respuesta a un estímulo prematuro, el estímulo puede bloquearse en la vía rápida a causa de un periodo refractario más largo y propagarse por la vía lenta. Si la conducción es lo suficientemente lenta, la vía rápida previamente bloqueada puede tener tiempo para recuperarse, lo que hace posible que se cree un circuito de reentrada, que se traduce en una taquicardia del nódulo AV cuando se perpetúa (Figura 15).
Figura 15. Iniciación de una taquicardia del nódulo auriculoventricular con un complejo auricular prematuro que se bloquea en la vía rápida y se propaga por la vía lenta para establecer la reentrada. AV: auriculoventricular; CAP: complejo auricular prematuro.
Se habla de la forma atípica de taquicardia del nódulo AV cuando la activación del circuito se produce en el sentido inverso.
Taquicardia de la unión auriculoventricularLas taquicardias de la unión AV se producen de forma característica en el contexto de un aumento del tono adrenérgico o efecto de un fármaco en pacientes con disfunción del nódulo sinusal a los que previamente se ha practicado una intervención o que presentan toxicidad digitálica. Pueden estar relacionadas con aumento del automatismo normal, automatismo anormal o AD43.
Taquicardia de reentrada auriculoventricular a través de una vía accesoriaLa vía accesoria típica posee una conducción rápida y un periodo refractario más largo que el del nódulo AV, lo cual crea el sustrato para la reentrada. El circuito en el que interviene una vía accesoria suele ser un circuito de macrorreentrada grande, formado por el sistema de conducción específico, la vía accesoria y el tejido auricular y ventricular situado entre ellos. En el tipo ortodrómico, que es la arritmia relacionada con vías accesorias más frecuente, el nódulo AV actúa como brazo anterógrado y la vía accesoria como vía retrógrada. La taquicardia antidrómica se produce cuando la activación ocurre en el sentido contrario (anterógrado por la vía accesoria y retrógrado por el nódulo AV), con lo que se crea un complejo de QRS ancho. La TRAV antidrómica es menos frecuente, y puede desencadenarse por alteraciones que hacen que la conducción anterógrada por el nódulo AV sea más lenta, mientras que la conducción retrógrada rápida por el nódulo AV está preservada.
En los pacientes con síndrome de Wolff-Parkinson-White y FA, puede producirse una conducción rápida por la vía accesoria con preexcitación ventricular. La FA preexcitada puede derivar en FA y parada cardiaca. La prevalencia de FA en los pacientes con síndrome de Wolff-Parkinson-White es más alta que lo habitual en ausencia de una cardiopatía orgánica. Aunque todavía se desconoce el mecanismo exacto, se ha propuesto que la presencia de la vía accesoria en sí y la activación retrógrada de las aurículas durante la taquicardia supraventricular ortodrómica desempeñan un papel importante en la iniciación de la FA44.
Ritmo idioventricular aceleradoSe cree que el ritmo idioventricular acelerado se debe a automatismo anormal relacionado con la fase aguda del infarto de miocardio, así como con la intoxicación por cocaína, la miocarditis aguda, la intoxicación por digoxina y el postoperatorio de la cirugía cardiaca45.
Taquicardia ventricularEste tipo de arritmia puede presentar multitud de características y comportamientos diferentes. Los mecanismos subyacentes predominantes de la mayoría de las TV son el automatismo anormal, la AD y la reentrada. Esta es el mecanismo más frecuente como causa de TV45.
Taquicardia ventricular monomórficaSe cree que, en ausencia de cardiopatía estructural, la mayor parte de las TV corresponden a mecanismos de AD o un mecanismo automático35 (que se diferencian con las maniobras ya explicadas). Sin embargo, la mayor parte de las TV monomórficas se producen en presencia de cardiopatía estructural, y el mecanismo predominante es la reentrada. La mayoría de los pacientes de este grupo muestran una TV en relación con miocardiopatía isquémica. El proceso postinfarto da lugar a una cicatriz asociada a islotes de miocitos supervivientes. Esto favorece una conducción lenta y discontinua y/o a un bloqueo de la conducción a través del tejido viable, que se atribuye a la alteración de la distribución y la función de las uniones gap y a un mal acoplamiento intercelular46. Todas estas alteraciones crean el sustrato electrofisiológico y anatómico ideal para el desarrollo de arritmias por reentrada (conducción lenta y bloqueo unidireccional).
La segunda causa más frecuente de TV debida a reentrada es la miocardiopatía no isquémica. En estos pacientes es frecuente que el circuito de reentrada afecte a una región de una cicatriz próxima a orificios valvulares o situada en el subepicardio. A veces, las TV observadas en este contexto parecen producirse a través de un mecanismo automático o por AD35.
La reentrada es también el principal mecanismo de la TV que se objetiva en la displasia/miocardiopatía arritmogénica de ventrículo derecho. En este trastorno, se forma un circuito de reentrada alrededor del tejido fibroadiposo característico que sustituye el miocardio del ventrículo derecho. Se produce un mecanismo de TV similar en el contexto de la miocardiopatía hipertrófica (especialmente en presencia de un aneurisma apical), valvulopatías cardiacas, cardiopatías congénitas reparadas quirúrgicamente (dado que son necesarias resecciones amplias que crean obstáculos anatómicos grandes), miocardiopatía infiltrativa (p. ej., sarcoidosis cardiaca) y trastornos neuromusculares.
Formas específicas de TV monomórficas:
• TV de reentrada rama a rama. En presencia de una enfermedad subyacente del sistema His-Purkinje (observada a menudo en la miocardiopatía valvular e idiopática no isquémica) puede crearse un circuito de macrorreentrada que engloba el sistema His-Purkinje. La conducción lenta a través de una red de His-Purkinje patológica permite la iniciación del circuito de reentrada32, en el que el haz derecho actúa habitualmente como brazo anterógrado (lo que explica la morfología de bloqueo de rama izquierda de la taquicardia) y el fascículo izquierdo como rama retrógrada. Con frecuencia puede invertirse el circuito mediante la estimulación del ventrículo izquierdo y crear un patrón de TV de bloqueo de rama derecha del haz de His.
• TV idiopática. La TV idiopática se da en corazones estructuralmente normales y puede dividirse en dos grupos principales:
– Taquicardia del tracto de salida. Las taquicardias del tracto de salida son las TV idiopáticas más frecuentes. Aunque la patogenia no se conoce por completo, su comportamiento indica que muchas de ellas se deben a AD como resultado de pospotenciales.
– Taquicardia ventricular fascicular. La TV fascicular yace en el sistema His-Purkinje del ventrículo izquierdo y, aunque se acepta que su mecanismo es un circuito de macrorreentrada en que participan fibras de respuesta lentas dependientes del calcio que pertenecen a la red de Purkinje ventricular47 (por lo característicamente se interrumpen con verapamilo), también se han descrito algunas formas automáticas de este tipo de taquicardia.
La forma de iniciación y mantenimiento de estas taquiarritmias continúa siendo desconocida; sin embargo, trabajos previos respaldan un mecanismo similar al que se sospecha en la FA. El desencadenante iniciador podría actuar a través de un mecanismo de AD, automatismo o mecanismo de reentrada, mientras que el mantenimiento puede deberse a diferentes formas de reentradas funcionales, como rotores, ondas migratorias o la reentrada en la red de Purkinje o intramural. Lo cierto es que la determinación del mecanismo subyacente se encuentra aún en fase experimental. También es posible que la FV pueda ser el resultado final común de un grupo heterogéneo de alteraciones eléctricas, y que no sea posible identificar un único mecanismo que explique adecuadamente todas ellas48.
Existen anomalías genéticamente determinadas que predisponen a la TV polimórfica:
• Síndrome de QT largo. Trastornos tanto congénitos como adquiridos (sobre todo a través de determinados fármacos49) pueden causar un intervalo QT largo a causa de una prolongación de la fase de meseta del PA. El inicio de la arritmia se produce a causa de PPP potenciados por la acumulación de calcio intracelular durante una meseta del PA prolongada38.
• Síndrome de Brugada. Las mutaciones genéticas que causan una reducción de la corriente de entrada de sodio en el epicardio del tracto de salida ventricular derecho son la causa de este síndrome. Como consecuencia de la alteración iónica, la corriente de salida de potasio no tiene oposición en algunas localizaciones epicárdicas, y ello da origen a la dispersión epicárdica de la repolarización que crea una ventana de vulnerabilidad durante la cual un impulso prematuro puede desarrollar una arritmia de reentrada de fase 229.
• Síndrome de QT corto. Las anomalías genéticas que causan este síndrome dan lugar a una disminución del tiempo de repolarización y reducen la refractariedad de los miocitos, lo que fomenta las arritmias por reentrada50.
• Taquicardia ventricular polimórfica catecolaminérgica. La TV polimórfica catecolaminérgica se debe a trastornos genéticos de los canales y proteínas (rianodina y calquestrina) que regulan el calcio intracelular17. Estos defectos causan una acumulación de calcio intracelular que puede facilitar la AD que se produce a través de los PPT. Los desencadenantes son el ejercicio o el estrés emocional, que causan un aumento de la concentración de calcio intracelular.
Ninguno.
Autor para correspondencia: Hospital of the University of Pennsylvania, 9th Floor, Founders Pavilion, 3400 Spruce Street, Philadelphia, Pensilvania 19104, Estados Unidos. Larraitz.gaztanaga@uphs.upenn.edu