La interleucina 5 (IL-5) es una citocina antiinflamatoria que se ha involucrado en las enfermedades cardiovasculares, incluidos los aneurismas aórticos y la insuficiencia cardiaca. El objetivo de este estudio es investigar el papel de la IL-5 en la enfermedad coronaria (EC) y sus posibles mecanismos.
MétodosSe analizó la expresión de la IL-5 en muestras de arterias coronarias humanas de 17 pacientes con EC y donantes fallecidos. Además, se determinaron las concentraciones plasmáticas de IL-5, IL-17 e interferón gamma en pacientes con EC usando kits ELISA con muestras de pacientes con dolor torácico (sin EC) como controles. Se separaron las células murinas CD4+T helper (Th), y el efecto de la IL-5 en la diferenciación de Th1, célula T reguladora y Th17 y la cantidad de ARNm de sus citocinas características se determinaron mediante citometría de flujo y reacción en cadena de la polimerasa tras transcripción inversa respectivamente.
ResultadosLa IL-5 disminuyó significativamente en las placas coronarias de los pacientes con EC comparados con el grupo de donantes fallecidos, y la IL-5 derivó fundamentalmente de los macrófagos de las placas de las arterias coronarias. Además, comparados con el grupo sin EC, las concentraciones plasmáticas de IL-5 en el grupo de EC fueron significativamente menores, y la secuencia de mayor a menor fue angina estable, angina inestable e infarto de miocardio. El análisis de regresión linear binaria mostró que la IL-5 se correlacionó independientemente con la aparición de la EC. Además, el tratamiento con IL-5 recombinante de ratón disminuyó los valores de Th1 y Th17 y la expresión del ARNm de sus citocinas características en lipoproteínas oxidadas de baja densidad tratadas con CD4+Th.
ConclusionesLos valores de IL-5 disminuyeron en los pacientes con EC e inhiben la diferenciación in vitro de Th1 y Th17 inducida por lipoproteínas oxidadas de baja densidad.
Palabras clave
La enfermedad coronaria (EC) es una enfermedad cardiovascular frecuente, aunque grave, y la primera causa de morbilidad y mortalidad en el mundo. La EC sucede después de la ateroesclerosis, y su principal proceso patológico es la activación de reacciones inflamatorias y del sistema de coagulación1. Varias células inflamatorias y citocinas contribuyen al adelgazamiento de la capa fibrosa y al agrandamiento del núcleo lipídico, lo que favorece la formación y la rotura de placas vulnerables2.
Las interleucinas (IL) están relacionadas con la inflamación y hacen un papel crucial en la formación de ateroesclerosis/EC. La IL-1 tiene efectos inflamatorios en los macrófagos, las células endoteliales y las células vasculares del músculo liso, mientras que la deleción genética de IL-1β o IL-1R disminuye el desarrollo de la lesión ateroesclerótica3. Por otra parte, la IL-6 se relaciona de manera independiente con la prevalencia y la gravedad de la ateroesclerosis coronaria4. Además, la IL-18 puede aumentar el desarrollo de lesión al incrementar una respuesta inflamatoria en la que interviene el mecanismo dependiente del interferón (IFN) gamma5, mientras que la IL-10 se define como un factor protector tanto de la formación de lesión ateroesclerótica como de su estabilización6.
La IL-5 es una citocina antiinflamatoria secretada principalmente por células inflamatorias: linfocitos T, mastocitos, macrófagos y eosinófilos7,8. La IL-5 es muy conocida como uno de los principales factores de crecimiento de eosinófilos, así como de su maduración y liberación desde la médula ósea. Se ha observado que el número de eosinófilos era significativamente mayor en pacientes con angina de pecho vasoespástica o con EC y que el número absoluto volvía a la normalidad tras el tratamiento9,10. La IL-5 podría prolongar la supervivencia de los eosinófilos y es crucial en la organización e intensificación de la respuesta alérgica en el asma y el síndrome hipereosinofílico11. Por otra parte, Zhang et al.12 observaron que la producción excesiva de IL-5 puede aumentar el riesgo de sufrir infecciones respiratorias graves en niños con antecedentes familiares de atopia. Frente a los ratones inmunocompetentes, los ratones deficientes en IL-5 mostraban una menor activación de los eosinófilos en los pulmones tras infección por parásitos13. Los estudios han demostrado que la concentración de IL-5 está elevada en pacientes con cáncer de pulmón no microcítico14 y la IL-5 también está involucrada en el tratamiento antirretroviral del sida15.
También se demostró la participación de la IL-5 en las enfermedades cardiovasculares. Liu et al.16 observaron que, en la inflamación pulmonar alérgica, las concentraciones plasmáticas de IL-5, IL-13 y factor de crecimiento transformador beta disminuían, mientras que aumentaba la acumulación de eosinófilos y de células inflamatorias; estos autores también vieron que la concentración de IL-5 y de factor de crecimiento transformador beta era inferior en ratones con aneurisma aórtico abdominal preestablecido. La IL-5 también había disminuido en los pacientes con insuficiencia cardiaca crónica17. Curiosamente, se ha informado que los pacientes asmáticos corren menor riesgo de ateroesclerosis, mientras que la IL-5 plasmática está aumentada en pacientes con asma18.
Se carece de datos sobre la expresión de IL-5 en pacientes con EC. En consecuencia, el objetivo de este estudio es evaluar prospectivamente la expresión de IL-5 en pacientes con EC y explorar los posibles mecanismos.
MÉTODOSRecogida de muestras coronarias humanasEl tejido arterial coronario (n=10) se obtuvo de las arterias coronarias de pacientes con EC que se sometieron a cirugía de trasplante cardiaco. Las muestras de control (n=7) se obtuvieron de donantes fallecidos que habían sufrido un accidente de tráfico o un ictus y muerte cerebral certificada. Los donantes carecían de antecedentes de enfermedad cardiovascular, y las muestras no mostraban signos de patología. Los cirujanos obtuvieron todo el tejido coronario durante intervenciones de trasplante cardiaco realizadas en el Hospital Popular de la Región Autónoma Zhuang de Guangxi (China). Se obtuvo el consentimiento informado por escrito de las familias y el Comité Ético del Hospital Popular de la Región Autónoma Zhuang de Guangxi aprobó el protocolo del estudio.
InmunotransferenciaSe lisaron las muestras coronarias y se obtuvo la proteína total. Tras cuantificar con el kit de análisis de proteínas con ácido bicinconínico (BCA), se añadieron 20 μg de proteína a la electroforesis en gel de poliacrilamida con dodecilsulfato sódico al 12% (SDS-PAGE). Se separaron las proteínas por medio de electroforesis y a continuación se transfirieron a las membranas de transferencia PVDF FL Immobilon. Las membranas se bloquearon con leche descremada al 5% y se incubaron con anticuerpo anti-IL-5 (Santa Cruz Biotechnology) y con anticuerpo contra la gliceraldehído-3-fosfato deshidrogenasa (GAPDH, tecnología para señalización celular) a 4°C durante toda la noche antes de la incubación con anticuerpo secundario a temperatura ambiente durante 1 h. Las proteínas se visualizaron y cuantificaron utilizando un sistema de imagen infrarroja en 2 colores (Odyssey; LI-COR Biosciences). Los niveles de expresión de proteínas se normalizaron al control de GAPDH.
Reacción en cadena de la polimerasa con transcriptasa inversaTras el lisado de las células y el tejido coronario con el reactivo TRIzol, se obtuvo el ARN mensajero (ARNm) total. Después, se sintetizó el ADN complementario (ADNc) a partir de 2 μg del ARNm total con cebadores oligo (dT) y con un kit de transcriptasa inversa de acuerdo con las instrucciones del fabricante. Las amplificaciones de la reacción en cadena de la polimerasa (PCR) se realizaron utilizando una mezcla maestra LightCycler 480 SYBR Green (todo de Roche). Las secuencias del cebador aparecen en la tabla 1. Se determinaron los niveles de expresión relativa del ARNm y se normalizaron a la GAPDH en la muestra correspondiente.
Cebadores utilizados en la reacción en cadena de la polimerasa cuantitativa tras transcriptasa inversa
| Gen | Cebador directo (5′-3′) | Cebador inverso (5′-3′) |
|---|---|---|
| IL-5 (humana) | CCCACAAGTGCATTGGTGAA | CCTCAGAGTCTCATTGGCTATCAG |
| IL-17 (humana) | CTCTGTGATCTGGGAGGCAAA | CTCTTGCTGGATGGGGACA |
| IFNγ (humano) | GCAGGTCATTCAGATGTAGCGG | TGTCTTCCTTGATGGTCTCCACAC |
| GAPDH (humana) | TTGTCAAGCTCATTTCCTGGT | TTACTCCTTGGAGGCCATGTA |
| IL-17 (murina) | TCCAGAAGGCCCTCAGACTA | AGCATCTTCTCGACCCTGAA |
| IFNγ (murino) | ACTGGCAAAAGGATGGTGAC | TGAGCTCATTGAATGCTTGG |
| TBX21 (murino) | ATTGGTTGGAGAGGAAGCGG | TGTGCACCCTTCAAACCCTT |
| IL-18 (murina) | ATGCTTTCTGGACTCCTGCC | GTCTGGTCTGGGGTTCACTG |
| RORγT (murino) | CTGTCCTGGGCTACCCTACT | CCACTTGTTCCTGTTGCTGC |
| IL-23 (murina) | AATAATGTGCCCCGTATCCA | CATGGGGCTATCAGGGAGTA |
| GAPDH (murina) | AACTTTGGCATTGTGGAAGG | CACATTGGGGGTAGGAACAC |
GAPDH: gliceraldehído-3-fosfato deshidrogenasa; IFNγ: interferón gamma; IL: interleucina; RORy: receptor huérfano gamma relacionado con el receptor de ácido retinoico; TBX21: factor de transcripción caja T.
Todas las muestras coronarias se fijaron con paraformaldehído neutro al 4%; a continuación se incluyeron en parafina, se cortaron en secciones de 5 μm y se montaron en portaobjetos. Se recurrió a la tinción por inmunofluorescencia para detectar la expresión de IL-5 en cada muestra. Para determinar la fuente de IL-5, se realizó una tinción doble por inmunofluorescencia con los anticuerpos anti-CD4, anti-CD68 y anti-IL-5.
Obtención de muestras de sangre humanaEntre junio de 2016 y diciembre de 2017, se llevó a cabo en el mismo hospital una nueva selección de pacientes consecutivos con dolor torácico en quienes se sospechaba EC. Todos los pacientes se sometieron a angiografía coronaria. En función de los síntomas clínicos y los resultados del angiograma coronario y el electrocardiograma, se dividió a los pacientes en 4 grupos: a) grupo sin EC (n=36; criterios de inclusión: el dolor torácico no se acompañaba de cambios en el electrocardiograma ni de estenosis coronaria o espasmo coronario tras la inyección intracoronaria de acetilcolina administrada en la angiografía coronaria); b) grupo con angina estable (n=51; criterios de inclusión: malestar torácico característico inducido por esfuerzo asociado con desviación descendente o depresión horizontal del segmento ST> 1mm en una prueba de esfuerzo; c) grupo con angina inestable (n=44; criterios de inclusión: dolor torácico en reposo con cambios electrocardiográficos de isquemia confirmados —cambios en el segmento ST o inversiones de la onda T—), y d) grupo con infarto agudo de miocardio (IAM) (n=29; criterios de inclusión: infarto de miocardio confirmado por un aumento significativo de la concentración sanguínea de troponina I y creatincinasa).
El criterio de agrupación se basó en un estudio previo de Lin et al.19. Se excluyó a los pacientes que habían sufrido IAM en los 3 meses previos o angina inestable durante el mes anterior20. También se excluyó a los pacientes con indicios de enfermedad concomitante significativa, en particular cardiopatía valvular hemodinámica, miocardiopatía, enfermedades malignas conocidas y fiebre21. Médicos con una amplia experiencia clínica establecieron el diagnóstico. Se utilizó la puntuación de Gensini para evaluar la estenosis en las arterias coronarias. El algoritmo detallado de las puntuaciones de Gensini ya fue explicado con anterioridad por Ye et al.22.
Los propios pacientes proporcionaron el consentimiento informado por escrito y el Comité Ético del Hospital Popular de la Región Autónoma Zhuang de Guangxi aprobó el protocolo del estudio.
Determinación plasmática de IL-5, IL-17 e IFNγLas muestras de sangre se obtuvieron a la llegada del paciente a urgencias. Estas se recogieron antes de realizar la angiografía coronaria y de proporcionar cualquier tipo de tratamiento. El tiempo de inicio fue <6 h en todos los pacientes. Las muestras se centrifugaron a 4.000g durante 20min y a continuación se recogió el sobrenadante y se conservó a−80°C hasta el comienzo de los experimentos. Se retiraron las muestras del medio a−80°C y a continuación se descongelaron a temperatura ambiente. Las concentraciones plasmáticas de IL-5 (R&D Systems), IL-17 e IFNγ (ambos de eBioscience) se determinaron con un kit de análisis de inmunoadsorción enzimática (ELISA) siguiendo las instrucciones del fabricante.
Cultivo celularSe anestesió a machos adultos de ratón C57BL/6 con isoflurano al 2% y se les separó el bazo. La suspensión esplénica de una sola célula se preparó y cultivó en medio de cultivo completo RPMI 1640 (Gibco). El grupo de diferenciación de células Th4 (CD4+) se obtuvo mediante selección positiva utilizando perlas magnéticas CD4 (Miltenyi Biotech) y un separador de células activadas por magnetismo23. Tras la activación por medio de anti-CD3 y anti-CD28 (ambos de eBioscience), las células CD4+Th se trataron con lipoproteína oxidada de baja densidad (50 μg/ml, Servicebio) o con IL-5 recombinante de ratón (rIL-5, Genetex). A continuación se cultivaron las células en una incubadora humidificada de CO2 con CO2 al 5%, a 37°C durante 24 h24,25.
Determinación de Th1 y Th17Se obtuvieron las células CD4+Th cultivadas previamente y se tiñeron con isotiocianato de fluoresceína (FITC) anti-CD4 (FITC-CD4). Tras tratamiento con concentrado de fijación/permeabilización, se tiñeron las células con ficoeritrina (PE) marcada con anti-IFNγ (PE-IFNγ) y PE marcada con anti-IL-17 (PE-IL-17). Se incluyeron los controles de isotipo para compensar y confirmar la especificidad de los anticuerpos. Las células Th1 se definieron como CD4+/IFNγ+ y las Th17, como CD4+/IL-17+. Las mezclas de estimulación celular y todos los anticuerpos de citometría de flujo se adquirieron en eBioscience y se utilizaron siguiendo las instrucciones del fabricante.
Análisis estadísticoLas concentraciones plasmáticas de citocinas y las características clínicas se expresan en mediana [intervalo intercuartílico] y se compararon con la prueba de la U de Mann-Whitney. Las correlaciones entre la IL-17, el IFNγ, las características clínicas y la IL-5 se analizaron utilizando el coeficiente de correlación de Spearman. El análisis de regresión lineal simple y el posterior análisis de regresión lineal binario se utilizaron para determinar si la IL-5 es un biomarcador independiente de la EC. Los valores del cultivo celular expresan media±desviación estándar y se compararon con las pruebas de la t de Student. Todos los datos se analizaron con el software SPSS 23.0, y se consideró estadísticamente significativo un valor de p <0,5.
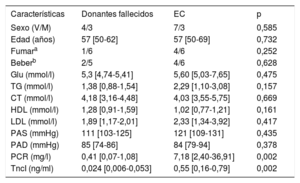
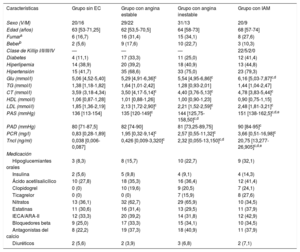
RESULTADOSCaracterísticas clínicas de los pacientes que proporcionaron las muestras de tejido coronarioEntre los pacientes que proporcionaron tejido coronario, los valores de troponina cardiaca I (TncI) y proteína C reactiva eran considerablemente más altos en los grupos con EC que en el grupo de donantes fallecidos. No se observaron diferencias entre los grupos en lo que respecta a otras características clínicas, tales como edad, sexo, fumar, beber, presión arterial sistólica (PAS), glucosa (Glu) en ayunas, colesterol total (CT), triglicéridos (TG), lipoproteínas de baja densidad (LDL), lipoproteínas de alta densidad (HDL) y presión arterial diastólica (PAD). Los datos clínicos se enumeran en la tabla 2.
Características clínicas de los donantes de muestras de tejido coronario
| Características | Donantes fallecidos | EC | p |
|---|---|---|---|
| Sexo (V/M) | 4/3 | 7/3 | 0,585 |
| Edad (años) | 57 [50-62] | 57 [50-69] | 0,732 |
| Fumara | 1/6 | 4/6 | 0,252 |
| Beberb | 2/5 | 4/6 | 0,628 |
| Glu (mmol/l) | 5,3 [4,74-5,41] | 5,60 [5,03-7,65] | 0,475 |
| TG (mmol/l) | 1,38 [0,88-1,54] | 2,29 [1,10-3,08] | 0,157 |
| CT (mmol/l) | 4,18 [3,16-4,48] | 4,03 [3,55-5,75] | 0,669 |
| HDL (mmol/l) | 1,28 [0,91-1,59] | 1,02 [0,77-1,21] | 0,161 |
| LDL (mmol/l) | 1,89 [1,17-2,01] | 2,33 [1,34-3,92] | 0,417 |
| PAS (mmHg) | 111 [103-125] | 121 [109-131] | 0,435 |
| PAD (mmHg) | 85 [74-86] | 84 [79-94] | 0,378 |
| PCR (mg/l) | 0,41 [0,07-1,08] | 7,18 [2,40-36,91] | 0,002 |
| TncI (ng/ml) | 0,024 [0,006-0,053] | 0,55 [0,16-0,79] | 0,002 |
CT: colesterol total; EC: enfermedad coronaria; Glu: glucosa en ayunas; HD: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad; M: mujeres; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PCR: proteína C reactiva; TG: triglicéridos totales; TncI: troponina cardiaca I; V: varones.
Los valores expresan proporciones o mediana [intervalo intercuartílico].
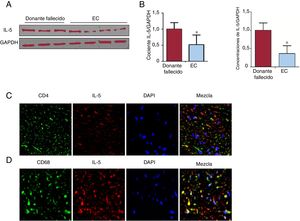
Había significativamente menos IL-5 en la placa coronaria de los pacientes con EC que en la de los donantes fallecidos (figura 1A y B). La IL-5 procedía tanto de las células CD4+Th como de los macrófagos, si bien estos constituían la fuente principal (figura 1C y D).
Expresión y fuente de IL-5 en tejido coronario humano. A: la concentración de IL-5 en la placa coronaria de los pacientes con EC y en los donantes fallecidos se determinó mediante inmunotransferencia. B: la concentración de ARNm de la IL-5 en estos 2 grupos se determinó mediante RT-qPCR. C y D: la fuente de IL-5 se analizó mediante tinción doble por inmunofluorescencia en tejido coronario (×400). CD: antígeno CD o de diferenciación; EC: enfermedad coronaria; GAPDH: gliceraldehído-3-fosfato deshidrogenasa; IL: interleucina; RT-qPCR: reacción en cadena de la polimerasa cuantitativa tras transcriptasa inversa. *p <0,05.
Los valores de Glu, CT, PAS, LDL, PCR y TncI eran considerablemente inferiores en el grupo sin EC que en los otros 3 grupos. Otras características clínicas, tales como la edad, el sexo, fumar y beber, los TG, las HDL y la PAD, no mostraban diferencias evidentes. Ninguna de las características clínicas era claramente distinta entre los grupos con angina estable, con angina inestable y con IAM, excepto la PAS y la TncI. La PAS y los valores de TncI más altos eran los del grupo con IAM, más altos que en el grupo con angina inestable, y los más bajos eran los del grupo con angina estable. Los datos clínicos se enumeran en la tabla 3.
Características clínicas de los pacientes que proporcionaron las muestras de sangre
| Características | Grupo sin EC | Grupo con angina estable | Grupo con angina inestable | Grupo con IAM |
|---|---|---|---|---|
| Sexo (V/M) | 20/16 | 29/22 | 31/13 | 20/9 |
| Edad (años) | 63 [53-71,25] | 62 [53,5-70,5] | 64 [58-73] | 68 [57-74] |
| Fumara | 6 (16,7) | 16 (31,4) | 15 (34,1) | 8 (27,6) |
| Beberb | 2 (5,6) | 9 (17,6) | 10 (22,7) | 3 (10,3) |
| Clase de Killip I/II/III/IV | — | — | — | 22/5/2/0 |
| Diabetes | 4 (11,1) | 17 (33,3) | 11 (25,0) | 12 (41,4) |
| Hiperlipemia | 14 (38,9) | 20 (39,2) | 18 (40,9) | 13 (44,8) |
| Hipertensión | 15 (41,7) | 35 (68,6) | 33 (75,0) | 23 (79,3) |
| Glu (mmol/l) | 5,06 [4,52-5,40] | 5,29 [4,91-6,36]c | 5,54 [4,95-6,86]c | 6,16 [5,03-7,87]c,d |
| TG (mmol/l) | 1,38 [1,18-1,82] | 1,64 [1,01-2,42] | 1,28 [0,93-2,01] | 1,44 [1,04-2,47] |
| CT (mmol/l) | 3,59 (3,18-4,34) | 3,50 [4,17-5,14]c | 4,40 [3,76-5,13]c | 4,78 [3,83-5,44]c |
| HDL (mmol/l) | 1,06 [0,87-1,28] | 1,01 [0,88-1,26] | 1,00 [0,90-1,23] | 0,90 [0,75-1,15] |
| LDL (mmol/l) | 1,85 [1,36-2,19] | 2,13 [1,72-2,90]c | 2,21 [1,52-2,59]c | 2,48 [1,81-3,21]c |
| PAS (mmHg) | 136 [113-154] | 135 [120-149]c | 144 [125,75-158,50]c,d | 151 [138-162,5]c,d,e |
| PAD (mmHg) | 80 [71-87,5] | 82 [74-90] | 81 [73,25-89,75] | 90 [84-95]c |
| PCR (mg/l) | 0,83 [0,28-1,89] | 1,95 [0,32-9,14]c | 2,57 [0,55-11,32]c | 3,66 [0,51-16,98]c |
| TncI (ng/ml) | 0,038 [0,006-0,087] | 0,426 [0,009-3,320]c | 2,32 [0,055-13,150]c,d | 20,75 [13,277-26,905]c,d,e |
| Medicación | ||||
| Hipoglucemiantes orales | 3 (8,3) | 8 (15,7) | 10 (22,7) | 9 (32,1) |
| Insulina | 2 (5,6) | 5 (9,8) | 4 (9,1) | 4 (14,3) |
| Ácido acetilsalicílico | 10 (27,8) | 18 (35,3) | 16 (36,4) | 12 (41,4) |
| Clopidogrel | 0 (0) | 10 (19,6) | 9 (20,5) | 7 (24,1) |
| Ticagrelor | 0 (0) | 0 (0) | 7 (15,9) | 8 (27,6) |
| Nitratos | 13 (36,1) | 32 (62,7) | 29 (65,9) | 10 (34,5) |
| Estatinas | 11 (30,6) | 16 (31,4) | 13 (29,5) | 11 (37,9) |
| IECA/ARA-II | 12 (33,3) | 20 (39,2) | 14 (31,8) | 12 (42,9) |
| Bloquedores beta | 9 (25,0) | 17 (33,3) | 15 (34,1) | 10 (34,5) |
| Antagonistas del calcio | 8 (22,2) | 19 (37,3) | 18 (40,9) | 11 (37,9) |
| Diuréticos | 2 (5,6) | 2 (3,9) | 3 (6,8) | 2 (7,1) |
ARA-II: antagonistas del receptor de la angiotensina II; CT: colesterol total; EC: enfermedad coronaria; Glu: glucosa en ayunas; HDL: lipoproteínas de alta densidad; IAM: infarto agudo de miocardio; IECA: inhibidores de la enzima de conversión de la angiotensina; LDL: lipoproteínas de baja densidad; M: mujeres; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PCR: proteína C reactiva; TG: triglicéridos totales; TncI: troponina cardiaca I; V: varones.
Los valores expresan proporciones, n (%) o mediana [intervalo intercuartílico].
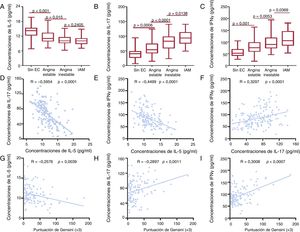
Los resultados del ensayo ELISA mostraban que las concentraciones de IL-5 disminuían de manera gradual en los grupos sin EC, con angina estable y con angina inestable, mientras que no se observaban diferencias entre los grupos de angina inestable y de IAM (figura 2A). Las concentraciones de IL-17 y de IFNγ aumentaron gradualmente en los grupos sin EC, con angina estable, con angina inestable y con IAM (figura 2B y C). El coeficiente de correlación de Spearman mostró que las concentraciones de IL-5 se correlacionaban negativamente con las de IL-17 e IFNγ en los pacientes con EC (figura 2D y E). Además, las concentraciones de IL-17 se correlacionaban de forma positiva con las de IFNγ (figura 2F).
Citocinas en pacientes con enfermedad coronaria. Concentraciones plasmáticas de IL-5 (A), IL-17 (B) e IFNγ (C) en los grupos sin EC y con EC. Correlaciones entre las concentraciones de IL-5 (D), IL-17 (E) e IFNγ (F). Correlaciones entre la puntuación de Gensini y las concentraciones plasmáticas de IL-5 (G), IL-17 (H) e IFNγ (I). EC: enfermedad coronaria; IAM: infarto de miocardio; IFNγ: interferón gamma; IL: interleucina.
Se detectó que la correlación entre las concentraciones de IL-5, IL-17 e IFNγ y las puntuaciones de Gensini también determinaba si las 3 citocinas se relacionaban con la gravedad de la EC. Los resultados mostraron que la puntuación de Gensini tenía una correlación positiva con las concentraciones de IL-17 e IFNγ, pero negativa con las de IL-5 (figura 2G-I).
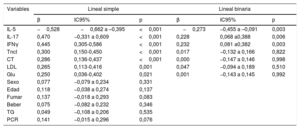
Análisis de regresión lineal simple y binarioLos resultados del análisis de regresión lineal simple mostraban que la IL-5, la IL-17, el IFNγ, la TncI, el CT, las LDL y la Glu tendían a establecer correlación con la prevalencia de EC (p <0,05). Luego se analizaron las 3 citocinas y las 4 características clínicas mediante análisis de regresión lineal binario, y los resultados mostraron que la IL-5 (β=−0,273; intervalo de confianza del 95% [IC95%], −0,455 a −0,091; p=0,003), la IL-17 (β=0,228; IC95%, 0,068-0,388; p=0,006) y el IFNγ (β=0,232; IC95%, 0,081-0,382; p=0,003) se asociaban con la presencia de EC (tal como se muestra en la tabla 4).
Variables asociadas con la presencia de enfermedad coronaria
| Variables | Lineal simple | Lineal binaria | ||||
|---|---|---|---|---|---|---|
| β | IC95% | p | β | IC95% | p | |
| IL-5 | −0,528 | −0,662 a –0,395 | <0,001 | −0,273 | −0,455 a –0,091 | 0,003 |
| IL-17 | 0,470 | −0,331 a 0,609 | <0,001 | 0,228 | 0,068 a0,388 | 0,006 |
| IFNγ | 0,445 | 0,305-0,586 | <0,001 | 0,232 | 0,081 a0,382 | 0,003 |
| TncI | 0,300 | 0,150-0,450 | <0,001 | 0,017 | −0,132 a 0,166 | 0,822 |
| CT | 0,286 | 0,136-0,437 | <0,001 | 0,000 | −0,147 a 0,146 | 0,998 |
| LDL | 0,265 | 0,113-0,416 | 0,001 | 0,047 | −0,094 a 0,189 | 0,510 |
| Glu | 0,250 | 0,036-0,402 | 0,021 | 0,001 | −0,143 a 0,145 | 0,992 |
| Sexo | 0,077 | −0,079 a 0,234 | 0,331 | |||
| Edad | 0,118 | −0,038 a 0,274 | 0,137 | |||
| Fumar | 0,137 | −0,018 a 0,293 | 0,083 | |||
| Beber | 0,075 | −0,082 a 0,232 | 0,346 | |||
| TG | 0,049 | −0,108 a 0,206 | 0,535 | |||
| PCR | 0,141 | −0,015 a 0,296 | 0,076 | |||
CT: colesterol total; Glu: glucosa en ayunas; IC95%: intervalo de confianza del 95%; IFNγ: interferón gamma; IL: interleucina; LDL: lipoproteínas de baja densidad; PCR: proteína C reactiva; TG: triglicéridos totales; TncI: troponina cardiaca I.
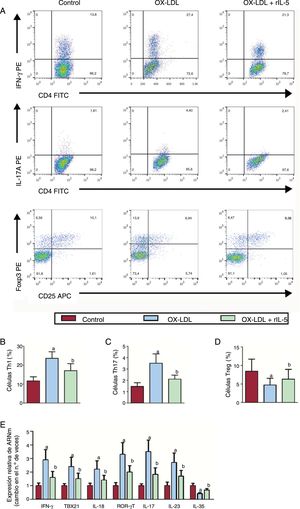
Los resultados del análisis de citometría de flujo mostraron que el tratamiento con lipoproteínas de baja densidad oxidadas aumentaba considerablemente los porcentajes de Th1 y Th17, mientras disminuía el número de células T reguladoras (Treg) (figura 3A-D). Estos efectos podrían invertirse con rIL-5. El ARNm de las citocinas Th1 y Th17 características, como el IFNγ, el TBX21, la IL-18, el RORγT, la IL-17 y la IL-23, mostraba tendencias similares a las de las células Th1 y Th17 respectivamente (figura 3E).
Efecto de la IL-5 en la diferenciación in vitro de Th1, Th17 y Treg. A: se identificaron células Th1 y Th17 entre las CD4+Th en función de su expresión de CD4+IFNγ+ y CD4+IL-17+ respectivamente. Valores de Th1 (B), Th17 (C) y Treg (D) en los grupos de control, OX-LDL y OX-LDL+rIL-5. E: las concentraciones de ARNm de IFNγ, TBX21, IL-18, RORγT, IL-17, IL-23 e IL-35 en los 3 grupos se determinaron mediante RT-qPCR. CD: antígeno CD o de diferenciación; IFNγ: interferón gamma; IL: interleucina; OX-LDL: lipoproteínas de baja densidad oxidadas; PE: ficoeritrina; rIL-5: IL-5 recombinante de ratón; RoRγ: receptor huérfano gamma relacionado con el receptor de ácido retinoico; RT-qPCR: reacción en cadena de la polimerasa cuantitativa tras transcriptasa inversa; TBX: factor de transcripción caja T; Th: células T helper; Treg: célula T reguladora. ap < 0,05 frente a grupo control. bp < 0,05 frente a grupo OX-LDL.
En el presente estudio, se observó por primera vez que la IL-5 había disminuido en la placa coronaria de los pacientes con EC y que los macrófagos eran la fuente principal de IL-5. Además, las concentraciones plasmáticas de IL-5 tenían correlación negativa con la presencia y la gravedad de la EC, y el tratamiento con rIL-5 inhibía considerablemente la diferenciación in vitro de Th1 y Th17.
Estudios previos hallaron una correlación negativa entre la IL-5 y la presencia de enfermedades cardiovasculares. Ishigami et al.7 informaron de que los anticuerpos anti-IL-5 se relacionaban de manera positiva con la aparición de ateroesclerosis. La IL-5 también había disminuido en los pacientes con insuficiencia cardiaca crónica, y las concentraciones reducidas de IL-5 se relacionaban con el avance de la enfermedad17. En la enfermedad de Kawasaki, las concentraciones de IL-5 se relacionaban negativamente con la aparición de lesiones en las arterias coronarias26. No obstante, la expresión de IL-5 en la EC sigue siendo una incógnita; así que se determinó la expresión de IL-5 en plasma y en las placas coronarias de pacientes con EC y los resultados mostraron que la concentración de IL-5 se había reducido considerablemente. Por otra parte, los resultados de la puntuación de Gensini mostraban que la concentración de IL-5 se relacionaba de forma negativa con el grado de estenosis coronaria.
Los macrófagos desempeñan un papel crucial en el inicio y la propagación de varias enfermedades cardiovasculares, como la ateroesclerosis27, la cardiopatía hipertensiva28 y la insuficiencia cardiaca29,30. Los macrófagos se hallan estrechamente relacionados con la EC; las pruebas objetivas son que se observaron abundantes macrófagos de la rotura de placa31. También se ha observado que las células espumosas derivadas de monocitos/macrófagos adoptan formas modificadas de LDL, y así contribuyen a la aterogénesis32. Las células Th se asociaron con ateroesclerosis, y también se ha informado de que la IL-5 procede de células Th27,33. Así pues, también se investigó la fuente de IL-5 en tejido de lesión coronaria humana mediante tinción doble por inmunofluorescencia con anticuerpos anti-CD68, anti-CD4 y anti-IL-5. Los resultados mostraron que tanto los macrófagos como las células Th eran la fuente de IL-5 en las placas coronarias humanas y que la IL-5 se expresaba principalmente en macrófagos.
La IL-17 y el IFNγ, las citocinas funcionales de Th1 y Th17 respectivamente, son los factores clave de la inflamación vascular crónica característica de la ateroesclerosis5,34,35. La sobreexpresión determinada por macrófagos de IL-5 también puede atenuar la ateroesclerosis inducida por la comida rica en grasas en los ratones deficientes en el receptor de las LDL36,37, y se ha observado una asociación inversa entre la concentración plasmática de IL-5 y el grosor intimomedial carotídeo38. Teniendo en cuenta la función antiinflamatoria de la IL-5 y el papel crucial de Th1/IFNγ y Th17/IL-17 en la progresión de la ateroesclerosis/EC, también se determinaron las concentraciones plasmáticas de IL-17 e IFNγ, y los resultados mostraron que ambos habían aumentado en los pacientes con EC y se correlacionaban positivamente con la puntuación de Gensini. No obstante, el coeficiente de correlación de Spearman mostró que la concentración de IL-5 se relacionaba de forma negativa con la IL-17 y el IFNγ. Por otro lado, la regresión lineal binaria mostró que la IL-5 establecía una correlación negativa con la EC. Estos datos indican que la IL-5 puede participar en la EC regulando la secreción de citocinas inflamatorias como IFNγ e IL-17.
La rotura de la placa ateroesclerótica constituye la base patológica de la mayor parte de las complicaciones vasculares como infarto cerebral e infarto de miocardio. La estabilización de la placa está determinada principalmente por su composición39. Las placas estables están mayormente calcificadas y son más susceptibles de romperse y desprenderse, mientras que las placas inestables no suelen estar calcificadas. Células inflamatorias, como CD3+T y los macrófagos CD68+, van acumulándose en las placas e inducen la apoptosis de las células vasculares del músculo liso, lo que aumenta el volumen de la placa y la incidencia de remodelación positiva, lo que al final provoca la formación de placas vulnerables40,41. Se ha demostrado que la IL-5 desempeña una función protectora en la ateroesclerosis, al estimular la diferenciación de células B-1 secretoras de anticuerpo T15/EO6, el cual bloquea la recaptación de lipoproteínas de baja densidad oxidadas por los macrófagos y reduce la formación de células espumosas42. En este estudio, se ha observado que la concentración plasmática de IL-5 era inferior en los pacientes con síndrome coronario agudo que en aquellos con angina estable. Esto indica que la IL-5 también se relaciona con la estabilización de las placas de la lesión coronaria.
Estudios previos mostraron que una proporción modificada de los linfocitos Th1/Th2 se relaciona con aparición de ateroesclerosis/EC43,44. Los factores de transcripción FOXP3+Treg son fundamentales para mantener la homeostasis inmunitaria, ya que responden a los estímulos del entorno permitiendo o inhibiendo la inflamación45. Por otro lado, los valores tanto de Th1/Treg como de Th17/Treg son altos en los pacientes con EC y en modelos animales de ateroesclerosis45,46. Estas pruebas demostraron que el desequilibrio entre Th1/Th2 y Th17/Treg es crucial en la aparición de ateroesclerosis/EC.
Teniendo en cuenta la función principal de Th1, Th17 y Treg, y para investigar los mecanismos de la IL-5 que intervienen en la ateroesclerosis/EC, se estudió el efecto de la IL-5 en la diferenciación in vitro de Th1, Th17 y Treg. Los resultados mostraron que el tratamiento con rIL-5 inhibe la diferenciación de Th1 y Th17 y la concentración de ARNm de la citocina relacionada. Estos datos indican que la IL-5 tiene una función protectora en el entorno de la ateroesclerosis.
Limitaciones del estudioPrimero, se requiere un modelo experimental de enfermedad cardiaca isquémica o infarto en animales para mostrar el efecto deletéreo de la IL-5KO o el efecto positivo de la estimulación in vivo de IL-5. Segundo, el tamaño de la muestra del estudio es insuficiente y se requieren más pacientes para validar los resultados. Tercero, los pacientes hospitalarios que participaron en el estudio pueden haber causado sesgo de selección, ya que en general se considera que su enfermedad es más grave. Por último, se constató una falta de visitas de seguimiento en los pacientes con EC.
CONCLUSIONESEste estudio es el primero que demuestra una fuerte relación negativa entre la EC y la concentración plasmática de IL-5. El posible mecanismo es que la IL-5 atenúa la ateroesclerosis/EC inhibiendo la inflamación. En resumen, se observó que la IL-5 se relaciona de forma negativa con la presencia de EC y que inhibe la diferenciación in vitro de Th1 y Th17.
CONFLICTO DE INTERESESNinguno.
- –
Aunque hay muchos métodos que sirven para diagnosticar EC, siguen siendo necesarios marcadores plasmáticos específicos para los pacientes con bajo riesgo y conveniencia, en especial para aquellos que no pueden someterse a una angiografía coronaria. La relación entre la concentración de IL-5 y la EC sigue sin estar clara.
- –
En pacientes con un diagnóstico establecido de EC, se halló que la concentración plasmática de IL-5 había disminuido y que la IL-5 se relacionaba negativamente con citocinas proinflamatorias.
- –
La IL-5 recombinante inhibe la diferenciación in vitro de Th1 y Th17 inducida por lipoproteínas de baja densidad oxidadas.
- –
La inflamación se relaciona con aparición de ateroesclerosis/EC, y se ha probado que Th1 y Th17 son dos células inmunitarias importantes que favorecen la aparición de ateroesclerosis/EC. En este estudio, la IL-5 inhibió la diferenciación de Th1 y Th17 inducida por lipoproteínas de baja densidad oxidadas. Esto indica que la aparición de ateroesclerosis/EC puede estar relacionada con una incapacidad de inhibir con eficacia la diferenciación de Th1 y Th17 causada por deficiencia de IL-5, lo que intensifica la inflamación. La IL-5 será definitivamente útil para la prevención y el tratamiento de la ateroesclerosis/EC en la práctica clínica.