Los inhibidores del cotransportador 2 de sodio-glucosa (iSGLT2) inducen cambios a corto plazo en la función renal y la hemoglobina y su fisiopatología se comprende de manera incompleta. Nuestro objetivo es evaluar la relación entre los cambios de la tasa de filtrago glomerular estimado (TFGre) y la hemoglobina tras el inicio de dapagliflozina en pacientes estables con insuficiencia cardiaca y fracción de eyección reducida (IC-FEr).
MétodosEste análisis post hoc de un ensayo clínico aleatorizado evaluó el efecto de la dapagliflozina sobre el consumo máximo de oxígeno a 1 y 3 meses en pacientes ambulatorios con IC-FEr estable (ensayo DAPA-VO2, NCT04197635). Se utilizó un análisis de regresión lineal mixta para evaluar la relación entre los cambios en la TFGe y la hemoglobina a 1 y 3 meses.
ResultadosSe evaluó a 87 pacientes. La media de edad era 67,0±10,5 años, y 21 pacientes (24,1%) eran mujeres. Las medias basales de TFGe y hemoglobina fueron de 66,9±20,7ml/min/1,73 m2 y 14,3±1,7g/dl respectivamente. En comparación con el placebo, la TFGe no cambió significativamente en el grupo de dapagliflozina, pero la hemoglobina aumentó significativamente a 1 y 3 meses. A 1 mes, el aumento de la hemoglobina se relacionó con la disminución de la TFGe solo en el grupo de dapagliflozina (p <0,001). A los 3 meses no había asociación significativa (p=0,123). Los cambios de la TFGe a 1 y 3 meses no se asociaron con cambios en el consumo pico de oxígeno, la calidad de vida o los péptidos natriuréticos.
ConclusionesEn pacientes con IC-FEr estable, los cambios en la TFGe a 1 mes inducidos por la dapagliflozina están en relación inversa con cambios en la hemoglobina. Esta asociación no se observa a los 3 meses.
Palabras clave
La evidencia previa muestra que los inhibidores del cotransportador de sodio-glucosa tipo 2 (iSGLT2) originan una reducción a corto plazo de la tasa de filtrado glomerular estimada (TFGe) en algunos pacientes1. Aunque la mayoría de estos cambios fueron leves y transitorios y no comportaron peores resultados1,2, generaron incertidumbre y, a veces, fueron el motivo de retirada del tratamiento3.
El aumento a corto plazo de la hemoglobina y el hematocrito es una manifestación común tras el inicio de los iSGLT24 y se ha relacionado con respuestas clínicas favorables, que reflejan el beneficio atribuible a los iSGLT2 en la diabetes mellitus tipo 2 y la insuficiencia cardiaca (IC)5. Un aumento a corto plazo de la hemoglobina es un indicador bien conocido de hemoconcentración en pacientes con IC tratados con diuréticos6. Gracias a las propiedades acuaréticas de los iSGLT2, el aumento de hemoglobina tras el inicio de los iSGLT2 también se ha propuesto como un marcador de hemoconcentración, especialmente a corto plazo7,8. Del mismo modo, existe evidencia acumulada de pacientes con IC tratados con una estrategia diurética intensiva que respalda el papel de los aumentos de creatinina/descensos de la TFGe como marcadores de hemoconcentración más que de un verdadero deterioro de la función renal, sobre todo cuando los cambios son leves y transitorios1,2. Por lo tanto, proponemos que un deterioro de la función renal tras el inicio de los iSGLT2 puede estar relacionado con el aumento de hemoglobina como marcador de hemoconcentración.
En este estudio, el objetivo es evaluar la asociación entre los cambios en la TFGe (ΔTFGe) y la hemoglobina (ΔHb) 1 mes y 3 meses tras el inicio de dapagliflozina en pacientes con IC estable y fracción de eyección reducida (IC-FEr).
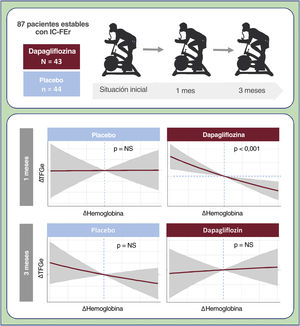
MÉTODOSPoblación del estudioEste es un análisis a posteriori del ensayo DAPA-VO29, un ensayo clínico aleatorizado, multicéntrico, con doble enmascaramiento, a iniciativa del investigador y diseñado para estudiar el efecto de la dapagliflozina en la capacidad funcional máxima evaluada mediante el consumo máximo de oxígeno (VO2máx) en pacientes ambulatorios con IC-FEr estable. Se aleatorizó a los pacientes 1:1 para que recibieran dapagliflozina o placebo. El VO2máx se calculó al inicio del estudio y tras 1 y 3 meses. Este estudio fue aprobado por la Agencia Española del Medicamento y Productos Sanitarios (AEMPS) y por el Comité Ético de Investigación Clínica (CEIC) de nuestro centro. Este estudio se registró en ClinicalTrials.gov (NCT04197635). Todos los pacientes firmaron el consentimiento informado. Formaron la población del estudio pacientes con IC crónica estable (clase funcional de la New York Heart Association [NYHA] II-III/IV) y fracción de eyección del ventrículo izquierdo ≤ 40%. Los criterios de selección, las técnicas del estudio y las principales conclusiones ya se publicaron antes9. Se excluyó de este análisis a los pacientes con enfermedades o tratamientos que puedan afectar a las concentraciones de hemoglobina (2 pacientes con hemorragia gastrointestinal y 1 que recibía metotrexato).
TécnicasLos pacientes aleatorizados realizaron una ergoespirometría inicial y otras 2 al mes y a los 3 meses, con pruebas de esfuerzo cardiopulmonar progresivo y limitado por los síntomas en una bicicleta ergométrica. La capacidad funcional máxima se definió como el punto en que el paciente dejaba de pedalear debido a los síntomas y el cociente respiratorio (CR) era ≥ 1,05. El VO2máx se definió como el valor más alto de VO2 durante los últimos 20s de ejercicio. Durante las visitas del estudio, se realizaron una prueba de 6 min de marcha, una ecocardiografía y una evaluación de la calidad de vida con el Minnesota Living with Heart Failure Questionnaire (MLHFQ), y se tomaron muestras de sangre. La TFGe se calculó con la ecuación de la Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI)10. Se analizó la fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP) mediante enzimoinmunoanálisis comercial estándar (Elecsys NT-proBNP assay, Roche Diagnostics, Suiza). Ninguno de los pacientes recibió hierro por vía intravenosa o agentes estimuladores de la eritropoyetina durante el periodo de estudio.
ObjetivosLos objetivos de este estudio fueron: a) la relación entre los ΔTFGe y los cambios de Hb a 1 y 3 meses tras la aleatorización del tratamiento, y b) la relación entre los ΔTFGe y los cambios en VO2máx, MLHFQ y NT-proBNP después del tratamiento con dapagliflozina en ambos momentos.
Análisis estadísticosLas variables continuas se expresan como media (±1 desviación estándar) o mediana [intervalo intercuartílico] y las variables discretas, como porcentajes. Al inicio del estudio, las medias, medianas y frecuencias se compararon entre los grupos de tratamiento mediante la prueba de la t de Student, la prueba de Wilcoxon y la prueba de la χ2 respectivamente.
Con un diseño de ANCOVA, los principales objetivos de este estudio incluyeron cambios absolutos (ΔTFGe) y porcentuales (ΔTFGe%) de la TFGe desde el inicio. Las variables de exposición, cuya asociación con los 2 objetivos se probó, también se modelaron como cambios desde el inicio e incluyeron ΔHb, ΔVO2máx, ΔMLHFQ y ΔNT-proBNP. Por consiguiente, todos los análisis incluyeron el valor basal del objetivo y el valor basal de la exposición como covariables. El análisis principal modeló ΔTFGe y el logaritmo de ΔHb a 1 mes y a 3 meses utilizando modelos de regresión lineal mixtos. En la figura 1, los valores del logaritmo de ΔHb se transformaron de nuevo a los valores brutos al obtener predicciones no lineales usando el comando predictnl en Stata. Los análisis secundarios incluyeron el modelado de ΔTFGe, independientemente con ΔVO2máx, ΔMLHFQ y ΔNT-proBNP. Cada modelo incluyó la identificación del paciente y el centro de estudio como intersecciones aleatorias y las visitas (1 y 3 meses), como coeficientes aleatorios. La estructura de varianza-covarianza elegida para los efectos aleatorios fue «no estructurada». El efecto del periodo se incluyó al modelar la interacción entre el tratamiento y el periodo. Las covariables incluidas en cada modelo se eligieron en función de la verosimilitud biológica e independientemente del valor de p. La lista de covariables en cada modelo se presenta en la leyenda de la figura correspondiente e incluye el valor basal de la TFGe. Los resultados se presentan como medias de mínimos cuadrados con intervalos de confianza del 95% (IC95%) y valores de p. La estabilidad estadística de los resultados se probó con una técnica de remuestreo con reposición. Se empleó a partir de 300 muestras bootstrap (remuestreo con reposición). Todos los análisis se realizaron con STATA 16.1 (Stata Statistical Software, versión 16 [2019]; StataCorp, Estados Unidos).
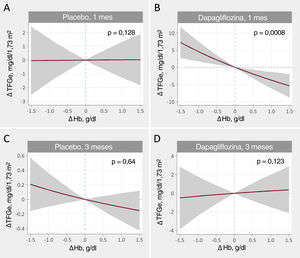
Relación entre los cambios en la tasa de filtrado glomerular estimada (TFGe) y la hemoglobina al mes y a los 3 meses. A: cambios a 1 mes, placebo. B: cambios a 1 mes, dapagliflozina. C: cambios a los 3 meses, placebo. D: cambios a los 3 meses, dapagliflozina. Estimaciones ajustadas a los valores basales de TFGe, hemoglobina, presión arterial sistólica, fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP), dosis equivalentes de furosemida, tratamiento con inhibidores de la enzima de conversión de la angiotensina (IECA)/antagonistas del receptor de la angiotensina II (ARA-II)/sacubitrilo-valsartán y tratamiento con antagonistas de la aldosterona. ΔTFGe: cambios en la tasa de filtrado glomerular estimada; ΔHb: cambios en la hemoglobina.
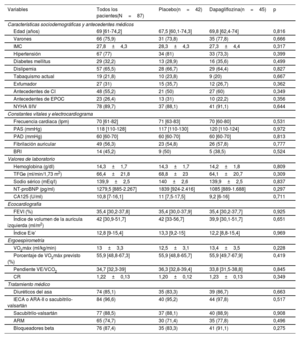
En este análisis se evaluó a 87 pacientes. La media de edad fue 67,0±10,5 años, 21 pacientes (24,1%) eran mujeres y 72 (82,8%) permanecían estables en NYHA II. Los valores medios de VO2máx, fracción de eyección del ventrículo izquierdo, TFGe y Hb fueron 13,0 ± 3,3 ml/kg/min, 33,7 ± 5,3%, 66,9 ± 20,7 ml/min/1,73 m2 y 14,3 ± 1,7 g/dl respectivamente. Al inicio del estudio, 30 pacientes (34,5%) mostraron TFGe ≤ 60 y 16 (18,4%), ≤ 45 ml/min/1,73 m2. No se encontraron diferencias significativas en las características basales entre tratamientos (tabla 1), incluidas la TFGe y la hemoglobina.
Características basales de los pacientes estratificados por grupo de aleatorización
| Variables | Todos los pacientes(N=87) | Placebo(n=42) | Dapagliflozina(n=45) | p |
|---|---|---|---|---|
| Características sociodemográficas y antecedentes médicos | ||||
| Edad (años) | 69 [61-74,2] | 67,5 [60,1-74,3] | 69,8 [62,4-74] | 0,816 |
| Varones | 66 (75,9) | 31 (73,8) | 35 (77,8) | 0,666 |
| IMC | 27,8±4,3 | 28,3±4,3 | 27,3±4,4 | 0,317 |
| Hipertensión | 67 (77) | 34 (81) | 33 (73,3) | 0,399 |
| Diabetes mellitus | 29 (32,2) | 13 (28,9) | 16 (35,6) | 0,499 |
| Dislipemia | 57 (65,5) | 28 (66,7) | 29 (64,4) | 0,827 |
| Tabaquismo actual | 19 (21,8) | 10 (23,8) | 9 (20) | 0,667 |
| Exfumador | 27 (31) | 15 (35,7) | 12 (26,7) | 0,362 |
| Antecedentes de CI | 48 (55,2) | 21 (50) | 27 (60) | 0,349 |
| Antecedentes de EPOC | 23 (26,4) | 13 (31) | 10 (22,2) | 0,356 |
| NYHA II/IV | 78 (89,7) | 37 (88,1) | 41 (91,1) | 0,644 |
| Constantes vitales y electrocardiograma | ||||
| Frecuencia cardiaca (lpm) | 70 [61-82] | 71 [63-83] | 70 [60-80] | 0,531 |
| PAS (mmHg) | 118 [110-128] | 117 [110-130] | 120 [110-124] | 0,972 |
| PAD (mmHg) | 60 [60-70] | 60 [60-70] | 60 [60-70] | 0,813 |
| Fibrilación auricular | 49 (56,3) | 23 (54,8) | 26 (57,8) | 0,777 |
| BRI | 14 (45,2) | 9 (50) | 5 (38,5) | 0,524 |
| Valores de laboratorio | ||||
| Hemoglobina (g/dl) | 14,3±1,7 | 14,3±1,7 | 14,2±1,8 | 0,809 |
| TFGe (ml/min/1,73 m2) | 66,4±21,8 | 68,8±23 | 64,1±20,7 | 0,309 |
| Sodio sérico (mEq/l) | 139,9±2,5 | 140±2,6 | 139,9±2,5 | 0,837 |
| NT-proBNP (pg/ml) | 1279,5 [885-2.267] | 1839 [924-2.416] | 1085 [889-1.688] | 0,297 |
| CA125 (U/ml) | 10,8 [7-16,1] | 11 [7,5-17,5] | 9,2 [6-16] | 0,711 |
| Ecocardiografía | ||||
| FEVI (%) | 35,4 [30,2-37,8] | 35,4 [30,0-37,9] | 35,4 [30,2-37,7] | 0,925 |
| Índice de volumen de la aurícula izquierda (ml/m2) | 42 [30,9-51,7] | 42 [33-56,7] | 39,9 [30,1-51,7] | 0,651 |
| Índice E/e’ | 12,8 [9-15,4] | 13,3 [9,2-15] | 12,2 [8,8-15,4] | 0,969 |
| Ergoespirometría | ||||
| VO2máx (ml/kg/min) | 13±3,3 | 12,5±3,1 | 13,4±3,5 | 0,228 |
| Porcentaje de VO2máx previsto (%) | 55,9 [48,8-67,3] | 55,9 [48,8-65,7] | 55,9 [49,7-67,9] | 0,419 |
| Pendiente VE/VCO2 | 34,7 [32,3-39] | 36,3 [32,8-39,4] | 33,8 [31,5-38,8] | 0,845 |
| CR | 1,22±0,13 | 1,20±0,12 | 1,23±0,13 | 0,349 |
| Tratamiento médico | ||||
| Diuréticos del asa | 74 (85,1) | 35 (83,3) | 39 (86,7) | 0,663 |
| IECA o ARA-II o sacubitrilo-valsartán | 84 (96,6) | 40 (95,2) | 44 (97,8) | 0,517 |
| Sacubitrilo-valsartán | 77 (88,5) | 37 (88,1) | 40 (88,9) | 0,908 |
| ARM | 65 (74,7) | 30 (71,4) | 35 (77,8) | 0,496 |
| Bloqueadores beta | 76 (87,4) | 35 (83,3) | 41 (91,1) | 0,275 |
ARA-II: antagonistas del receptores de la angiotensina II; ARM: antagonistas del receptor de mineralocorticoides; BRI: bloqueo de rama izquierda; CA125: antígeno carbohidrato 125; CI: cardiopatía isquémica; CR: cociente respiratorio; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo evaluada por el método de Simpson; IECA: inhibidores de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: clase funcional de la New York Heart Association; PAD: presión arterial diastólica; PAS: presión arterial sistólica; TFGe: tasa de filtrado glomerular estimada; VO2máx: consumo máximo de oxígeno; pendiente VE/VCO2: eficiencia ventilatoria.
Salvo otra indicación, las variables continuas se presentan como mediana [intervalo intercuartílico] y las cualitativas, como n (%).
En comparación con el placebo, la TFGe no cambió significativamente tras 1 o 3 meses (figura 2). Al mes, los pacientes asignados a dapagliflozina mostraron una reducción no significativa de la TFGe (Δ, –2,6 ml/min/1,73 m2 [IC95%, –6,8 a 1,6; p=0,163]). A los 3 meses, las diferencias continuaron siendo no significativas (Δ +1,9 ml/min/1,73 m2 [IC95%, –2,4 a 6,2; p=0,331]), como se presenta en la figura 1. Asimismo, el ΔTFGe% no cambió en los distintos grupos de tratamiento a 1 mes (Δ, –2,1% [IC95%, –6,4 a 2,3; p=0,495]) o a 3 meses (Δ, +2,5% [IC95%, –1,9 a 6,9; p=0,373]). La proporción de eventos de disminución de la TFGe por encima del 10% desde el inicio (en los cambios) fue mayor en el grupo de dapagliflozina al mes (el 22,2 frente al 4,8%; p=0,018), pero no hubo diferencias a los 3 meses (el 13,3 frente al 16,7%; p=0,663). Para la mayoría de los pacientes que mostraron una disminución de la TFGe por encima del 10% (cambios transitorios), fue solo en un momento determinado (17 de 21: 80,9%). Solo 4 pacientes mostraron una disminución constante de la TFGe por encima del 10% a 1 y 3 meses (cambios constantes).
Cambios en la hemoglobinaEn comparación con el placebo, la Hb aumentó significativamente en los pacientes tratados con dapagliflozina (al mes: Δ, +0,45 g/dl [IC95%, 0,03-0,88; p=0,037]; a los 3 meses: Δ, +0,55 g/dl [IC95%, 0,12-0,98; p=0,012]).
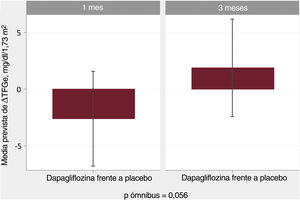
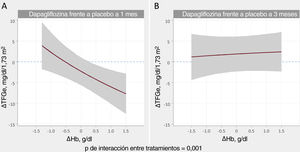
Relación entre los cambios en la tasa de filtrado glomerular estimada y los cambios en la hemoglobinaEn el análisis multivariante, el tratamiento con dapagliflozina afectó de manera diferencial a la asociación entre ΔHb y ΔTFGe entre visitas (p de la interacción=0,001). Las trayectorias ajustadas por covariables de ΔHb y ΔTFGe se muestran en la figura 1. A 1 mes, la pendiente de ΔHb no estaba relacionada con la de ΔTFGe en el grupo de placebo (figura 1A, p=0,128). En cambio, en los pacientes que recibieron dapagliflozina, la pendiente de ΔHb se asoció inversamente con la de ΔTFG (p <0,001) (figura 1B). A los 3 meses, no se encontró asociación significativa (figura 1C y D). Los gráficos de diferencias entre tratamientos (dapagliflozina frente a placebo) mostraron que los aumentos de Hb > 0,3g/dl se asociaron significativamente con una disminución significativa y casi lineal de la TFGe al mes (IC95% por debajo del eje de ordenadas de 0) (figura 3A). A los 3 meses no se encontró ningún efecto entre tratamientos (figura 3B).
Relación entre los cambios en la tasa de filtrado glomerular estimada (TFGe) y la hemoglobina. Comparación entre tratamientos (dapagliflozina frente a placebo). A: cambios al mes. B: cambios a los 3 meses. Estimaciones ajustadas a los valores basales de TFGe, hemoglobina, presión arterial sistólica, fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP), dosis equivalentes de furosemida, tratamiento con inhibidores de la enzima de conversión de la angiotensina (IECA)/antagonistas del receptor de la angiotensina II (ARA-II)/sacubitrilo-valsartán y tratamiento con antagonistas de la aldosterona. ΔHb: cambios en la hemoglobina; ΔTFGe: cambios en la tasa de filtrado glomerular estimada.
Se obtuvieron resultados similares cuando el ΔHb se modeló respecto al ΔTFGe%. Un ΔHb positivo predijo una disminución del ΔTFGe% al mes en el grupo de dapagliflozina, pero no en el de placebo. En comparación con el placebo, un aumento de la Hb se asoció con una disminución de la TFGe en el grupo de dapagliflozina (figura 1 del material adicional). A los 3 meses no hubo relación entre ΔHb y ΔTFGe% con ninguno de los tratamientos, sin evidencia de una diferencia significativa de los efectos entre tratamientos (figura 2 del material adicional).
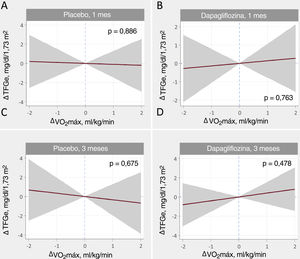
Relación entre los cambios en la tasa de filtrado glomerular estimada y los objetivos de eficaciaCambios en el VO2 máximoNo se encontró evidencia de una relación significativa entre ΔTFGe y ΔVO2máx ni en los grupos de tratamiento ni en momentos determinados (figura 4). Del mismo modo, la comparación entre tratamientos no mostró diferencias significativas (figura 3 del material adicional).
Relación entre los cambios en el consumo máximo de oxígeno (VO2máx) y los cambios en la tasa de filtrado glomerular estimada (TFGe) al mes y a los 3 meses. A: cambios al mes, placebo. B: cambios al mes, dapagliflozina. C: cambios a los 3 meses, placebo. D: cambios a los 3 meses, dapagliflozina. Estimaciones ajustadas a los valores basales de TFGe, hemoglobina, presión arterial sistólica, fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP), dosis equivalentes de furosemida, tratamiento con inhibidores de la enzima de conversión de la angiotensina (IECA)/antagonistas del receptor de la angiotensina II (ARA-II)/sacubitrilo-valsartán y tratamiento con antagonistas de la aldosterona. ΔTFGe: cambios en la tasa de filtrado glomerular estimada; ΔVO2máx: cambios en el consumo máximo de oxígeno.
La dapagliflozina y el ΔTFGe asociados a placebo no estuvieron relacionados con ΔMLHFQ ni con ΔNT-proBNP en ningún momento (figura 4 del material adicional). Además, las gráficas entre tratamientos no mostraron diferencias significativas (figuras 5 y 6 del material adicional).
DISCUSIÓNEn este análisis a posteriori del ensayo DAPA-VO2, se encontró que los cambios en la TFGe al mes estaban en relación inversa con los cambios en la Hb tras el inicio de dapagliflozina en pacientes con IC-FEr ambulatoria estable. En otras palabras, la disminución inicial de la TFGe se relacionó con el aumento de la Hb, un parámetro reconocido que indica una respuesta clínica favorable. Esta asociación no fue significativa a los 3 meses (figura 5). Los resultados actuales apunta a una conexión fisiológica a corto plazo entre la cinética de ambos marcadores, lo que indica que la hemoconcentración puede explicarla en parte. Esto también puede explicar la ausencia de una relación significativa entre los cambios a corto plazo en la TFGe y los cambios en la capacidad funcional, la calidad de vida y los péptidos natriuréticos. En un seguimiento más prolongado (3 meses), los cambios en la TFGe no parecían relacionados con los cambios en la Hb.
Ilustración central. Relación entre la tasa de filtrado glomerular a corto plazo y los cambios en la hemoglobina tras el inicio de dapagliflozina en la insuficiencia cardiaca con fracción de eyección reducida. TFGe: tasa de filtrado glomerular estimada; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; NS: no significativo.
Se ha descrito un aumento significativo de la Hb y el hematocrito tras el inicio de los iSGLT211. Curiosamente, los cambios en el hematocrito fueron el predictor individual más fiable en la reducción del riesgo de muerte cardiovascular en el ensayo EMPA-REG OUTCOME12. Más recientemente, Fitchett et al.13 comunicaron que la Hb y el hematocrito representaron más de la mitad de la reducción del riesgo de mortalidad y hospitalización atribuida a empagliflozina en pacientes con diabetes tipo 2 y enfermedad cardiovascular establecida. En pacientes con IC descompensada, el aumento relativo de los elementos celulares en la sangre se utiliza comúnmente para comprobar la respuesta diurética y se asocia con mejores resultados. Entre ellos, la Hb y el hematocrito son los parámetros más utilizados14 y se incluyen en las fórmulas más utilizadas para estimar el volumen plasmático15. El mecanismo exacto que subyace a los resultados beneficiosos de la IC continúa siendo incierto, específicamente respecto al hecho de si los beneficios observados se atribuyen a un aumento directo del hematocrito o intervienen factores asociados con el aumento del hematocrito, aunque parece que esta última es la explicación más probable7.
Existe evidencia que respalda el efecto diurético, predominantemente acuarético, de los iSGLT216,17. Algunos estudios sostienen que el aumento de las cifras de hematocrito y Hb puede explicarse por la contracción del volumen circulante, especialmente a corto plazo18. Por lo tanto, imaginamos que la hemoconcentración puede desempeñar un papel en la explicación del aumento de la hemoglobina, al menos los primeros días o semanas tras el inicio de los iSGLT27. Sin embargo, a medio y largo plazo otros factores, como el aumento de la producción de eritropoyetina y los cambios en el metabolismo del hierro19,20, pueden explicar la mayoría de los cambios en masa de los glóbulos rojos.
Fisiopatología de los cambios en la función renal tras el inicio de los inhibidores del cotransportador de sodio-glucosa tipo 2Estudios previos con iSGLT2 en pacientes con IC crónica estable21,22, diabetes tipo 223,24 e insuficiencia renal crónica25 mostraron de manera sistemática una ligera disminución a corto plazo de la TFGe, seguida de una disminución más lenta con el tiempo y una reducción de los eventos adversos renales, al contrario de lo que ocurrió en pacientes con placebo21–25. Asimismo, en un subestudio del ensayo EMPULSE, Voors et al.26 comunicaron que los pacientes hospitalizados por IC aguda tratados con empagliflozina mostraron un deterioro de la función renal a los 15 días, sin cambios a los 90 días. En un subestudio del EMPEROR-Reduced Trial, Zannad et al.27 describieron que se observó una disminución modesta de la TFGe con más frecuencia en pacientes que recibieron empagliflozina que en aquellos que recibieron placebo. A diferencia de los pacientes tratados con placebo, estos cambios no se asociaron con un peor pronóstico. La mayor parte de la evidencia de los estudios controlados muestra que la caída inicial de la TFGe tras el inicio de los iSGLT2 es pequeña y transitoria y no tiene implicaciones clínicas adversas. Este mismo mensaje también se ha repetido en grandes estudios de la vida real en consumidores de iSGLT228. Los resultados del presente estudio coinciden con estos mensajes al no mostrar ninguna relación entre los cambios en la TFGe y los cambios en la capacidad funcional máxima, la calidad de vida y los péptidos natriuréticos.
Los mecanismos de esta disminución inicial de la TFGe tras el inicio de los iSGLT2 no se comprenden totalmente. En los estudios de diabetes tipo 2, la mayoría de estos cambios se han atribuido a cambios hemodinámicos intraglomerulares (un aumento de la excreción tubular de sodio y cloruro es detectado por la mácula densa, lo que provoca la vasoconstricción aferente, que da lugar a una reducción de la circulación sanguínea renal y, por lo tanto, del filtrado glomerular)29. Sin embargo, quizá no sea el único mecanismo que explique los cambios de la TFGe en todo el espectro de pacientes con IC, ya que en la mayoría de ellos no hay evidencia de hiperfiltración30.
En la IC aguda, algunos datos muestran que la importancia clínica del aumento de la creatinina/disminución de la TFGe depende en gran medida de los marcadores indirectos de decongestión y respuesta diurética31,32. Por ejemplo, en 2 grandes cohortes de pacientes con IC aguda, el empeoramiento de la función renal durante los primeros 4 días no se asoció con peores resultados cuando los pacientes tuvieron una buena respuesta diurética31. Curiosamente, en un subestudio del ensayo EVEREST, McCallum et al.32 comunicaron un efecto heterogéneo de la disminución de la TFGe en los marcadores indirectos de descongestión y hemoconcentración. De manera específica, la disminución de la TFGe no se asoció con resultados adversos en pacientes con un mayor aumento en el hematocrito y una disminución en NT-proBNP. En cambio, una disminución de la TFGe se asoció con peores resultados en pacientes sin evidencia de decongestión/hemoconcentración32. Curiosamente, en el mismo estudio, los pacientes con una mayor disminución de la función renal fueron aquellos con un mayor aumento del hematocrito32. Por lo tanto, en pacientes con IC, en concreto en el contexto agudo, los cambios de la TFGe deben interpretarse teniendo en cuenta su estado clínico y de decongestión. Los cambios pequeños y transitorios en pacientes con una respuesta diurética adecuada pueden deberse a la hemoconcentración en lugar de a un verdadero empeoramiento de la función renal33.
La importancia clínica de la conexión entre el aumento de hemoglobina y la disminución de la TFGe tras el inicio de los iSGLT2En el contexto de la IC y según los resultados del presente estudio, se propuso que la caída inicial de la TFGe tras el inicio de los iSGLT2 puede reflejar hemoconcentración en lugar de otros mecanismos. Los siguientes puntos respaldan esta hipótesis.
• En pacientes con IC tratados con diuréticos, los aumentos a corto plazo de la Hb y una disminución de la TFGe son indicadores reconocidos de hemoconcentración. En el caso de la TFGe, esto es especialmente cierto cuando la disminución se produce paralelamente a la evidencia de otros parámetros de hemoconcentración y una respuesta clínica y diurética adecuada32,33. En esta línea, un subestudio del EMPA-RESPONSE mostró que la empagliflozina aumentó la osmolalidad plasmática y se asoció con una disminución temporal de la TFGe8. En el presente estudio, se encontró una fuerte asociación entre el aumento de Hb al mes y la disminución de la TFGe, como se encontró previamente con el uso de otros hidruréticos como el tolvaptán32. Por lo tanto y dado el importante papel de la hipervolemia en pacientes con IC34, especulamos que a corto plazo la mayoría de los efectos beneficiosos a corto plazo de la dapagliflozina pueden deberse a la descongestión. Con un seguimiento más prolongado, parece que la cinética de ambos biomarcadores no está relacionada, lo que indica que mecanismos distintos de la decongestión/hemoconcentración pueden desempeñar un papel predominante.
• La disminución inicial de la TFGe tras el inicio de los iSGLT2 es pequeña y transitoria y generalmente no tiene consecuencias clínicas. Las conclusiones del presente estudio ofrecen evidencia adicional al respecto y muestran que los pacientes con una caída inicial al mes no presentaron disminución de la TFGe a los 3 meses. Además, estos cambios fueron pequeños en magnitud y, lo que es más importante, no estaban relacionados con el estado funcional o el deterioro de la calidad de vida.
Se justifica la realización de nuevos estudios para confirmar estas conclusiones en la IC y otras situaciones clínicas como la insuficiencia renal crónica, en la que los iSGLT2 también han demostrado su utilidad clínica35,36.
LIMITACIONESHasta donde sabemos, este es el primer estudio que correlaciona el aumento de la Hb tras la administración de iSGLT2 con cambios en la función renal. Con todo, nuestro estudio tiene algunas limitaciones. En primer lugar, se trata de un análisis a posteriori de un ensayo clínico aleatorizado. Dado que nuestros hallazgos no se corrigieron por numerosas pruebas, existe un mayor riesgo de error de tipo I37. En segundo lugar, este estudio tiene las limitaciones inherentes a un ensayo con escasa potencia estadística. En tercer lugar, la mayoría de los cambios en la función renal fueron leves y transitorios; por ello, estas conclusiones no pueden extrapolarse a formas más graves de insuficiencia renal. En cuarto lugar, no se pueden explorar los cambios a medio y largo plazo de la función renal y la Hb o deducir su importancia biológica o clínica con los datos actuales. En quinto lugar, el hematocrito no se registró de manera uniforme durante el ensayo, lo que impide la evaluación de su relación con los cambios en la TFGe. En sexto lugar, no se pueden extrapolar estas conclusiones a otras situaciones clínicas distintas de la IC en que con frecuencia se utilizan los iSGLT2. Por último, no se midieron el volumen plasmático, la osmolaridad u otros parámetros que pudieran contribuir a respaldar la fisiopatología de esta interacción.
CONCLUSIONESEn pacientes con IC-FEr estable, los cambios en la TFGe inducidos por dapagliflozina al mes estaban en relación inversa con los cambios en la Hb. Sin embargo, a los 3 meses no había asociación en los cambios de la TFGe y la Hb. Se requieren más estudios para confirmar estas conclusiones y descifrar el significado biológico de esta asociación.
FINANCIACIÓNEste trabajo ha sido financiado en parte por una subvención ilimitada de AstraZeneca (ESR-17-13447), Unidad de Investigación Clínica y Ensayos Clínicos INCLIVA, Health Research Institute, Spanish Clinical Research Network (SCReN); números de subvención: PT17/0017/0003 y PT20/00100, y CIBERCV; números de subvención: 16/11/00420, 16/11/00403 y 16/11/00486.
CONTRIBUCIÓN DE LOS AUTORESG. Miñana y R. de la Espriella: conceptualización, conservación de los datos, investigación, metodología, administración del proyecto, validación, visualización, redacción-borrador original; redacción, revisión y edición. P. Palau, M. Amiguet y J. Seller: conservación de los datos, investigación, metodología, validación, visualización, redacción, revisión y edición. J.M. García Pinilla: investigación, metodología, validación, visualización, redacción, revisión y edición. E. Núñez: análisis formal, investigación, metodología, administración del proyecto, recursos, software, supervisión, validación, redacción, revisión y edición. J.L. Górriz, A. Valle, J. Sanchis y A. Bayés-Genís: investigación, metodología, validación, visualización, redacción, revisión y edición. J. Núñez: conceptualización, análisis formal, adquisición de fondos, investigación, metodología, administración del proyecto, recursos, software, supervisión, validación, visualización, redacción-borrador original; redacción, revisión y edición.
CONFLICTO DE INTERESESG. Miñana ha recibido honorarios como conferenciante de Abbott Vascular; R. de la Espriella informa de honorarios personales de AstraZeneca, Novartis, Boehringer-Ingelheim y NovoNordisk; P. Palau ha recibido honorarios por participar en actividades formativas de Servier; M. Amiguet informa de honorarios personales de AstraZeneca, Novartis, Boehringer-Ingelheim, Lilly y Pfizer; J. Seller informa de honorarios como conferenciante de AstraZeneca y Boehringer-Ingelheim; J.M. García Pinilla informa de honorarios personales de AstraZeneca y Esteve; J.L. Górriz ha recibido honorarios por participar en consejos asesores y actividades formativas de AstraZeneca, Boehringer-Ingelheim, NovoNordisk, Bayer y Novartis; A. Valle informa de honorarios como conferenciante de AstraZeneca; J. Sanchis ha recibido honorarios como conferenciante de Abbott Vascular y Prosmédica; A. Bayés-Genís ha impartido conferencias y/o participado en consejos asesores de Abbott, AstraZeneca, Boehringer-Ingelheim, Novartis, Roche Diagnostics y Vifor; J. Núñez informa de honorarios personales de AstraZeneca, Novartis, Boehringer-Ingelheim, Eli Lilly, Rovi, NovoNordisk y Vifor Pharma. J. Sanchis es editor jefe de Rev Esp Cardiol. Se ha seguido el procedimiento editorial de la revista para garantizar un tratamiento imparcial del original. Los demás autores no tienen nada que declarar.
- -
El uso de iSGLT2 se ha asociado con una reducción a corto plazo de la TFGe.
- -
Estos cambios en la TFGe generalmente son leves y transitorios y no están asociados con un pronóstico adverso.
- -
Otro hallazgo común tras el inicio de los iSGLT2 es un aumento a corto plazo de la hemoglobina y el hematocrito. La magnitud de este aumento se ha asociado con respuestas clínicas favorables que reflejan el beneficio atribuible a los iSGLT2 en pacientes con diabetes tipo 2 e IC.
- -
En este subanálisis del ensayo DAPA-VO2, se halló relación inversa entre los cambios en la TFGe al mes y los cambios en la hemoglobina tras el inicio de dapagliflozina en pacientes estables con IC-FEr.
- -
La asociación entre los cambios en la TFGe y la hemoglobina ya no se observó a los 3 meses.
- -
Nuestras conclusiones apuntan a una conexión fisiológica a corto plazo entre la cinética de los 2 marcadores, lo que indica que la hemoconcentración puede ser una explicación parcial.