La identificación de biomarcadores de fibrilación auricular (FA) subclínica en los pacientes con ictus criptogénico (ICr) es de gran interés. Con dicho objetivo, se evaluó el perfil de microARN circulante de los pacientes con ICr y FA frente a aquellos en ritmo sinusal.
MétodosSe incluyó a 64 pacientes con ICr consecutivos monitorizados mediante Holter subcutáneo. Se seleccionó a 18 pacientes (9 con FA y 9 en ritmo sinusal persistente) para determinación de 754 microARN mediante tecnología de alto rendimiento. Se incluyó a 9 pacientes adicionales con ictus y FA concomitante para guiar la selección de microARN. Los microARN de interés se replicaron en una cohorte independiente (n=46). La asociación de biomarcadores con FA a los 6 y 12 meses se analizó mediante regresión logística.
ResultadosOcho microARN mostraron expresión diferencial entre los pacientes con y sin FA. El miR-1-3p, un regulador génico involucrado en la arritmogénesis cardiaca, fue el único que permaneció significativamente más elevado en pacientes con ICr y FA de la cohorte de repetición, y además mostró una discreta asociación con la carga arrítmica. Los valores de miR-1-3p por encima de la mediana y la fracción de eyección de la aurícula izquierda se asociaron de forma independiente con la presencia de FA a los 6 y 12 meses.
ConclusionesEn nuestra cohorte, los valores plasmáticos de miR-1-3p fueron más altos en los pacientes con ICr y FA en el seguimiento. Nuestros resultados indican que el miR-1-3p podría ser un nuevo biomarcador de FA oculta en los pacientes con ICr.
Palabras clave
Alrededor del 30% de los ictus isquémicos son de etiología indeterminada y, por tanto, se clasifican como criptogénicos (ICr)1,2. Trabajos previos han señalado que una proporción considerable de los ICr podrían ser secundarios a una fibrilación auricular (FA) paroxística oculta, la cual puede confirmarse en el seguimiento posterior1,3. Sin embargo, no está bien establecida la mejor estrategia para la detección de FA en pacientes con ICr3. Los monitores cardiacos insertables por vía subcutánea, que permiten la supervisión continua del ritmo cardiaco, son la alternativa más atractiva3–6, pero aún no se ha establecido su coste-efectividad. Más importante aún, su rendimiento diagnóstico se basa en la identificación de un episodio de FA que puede ocurrir semanas o meses después del accidente cerebrovascular inicial, lo que deja a los pacientes en riesgo con tratamiento insuficiente hasta que se demuestre la FA.
Por lo tanto, un enfoque más deseable sería identificar marcadores indirectos de la FA subclínica que pudieran detectarse en el momento del primer ingreso. La FA responde a una fisiopatología compleja, en la cual la actividad ectópica sobre un particular remodelado auricular predisponente convergen para desencadenar y mantener la arritmia7. Es razonable especular que en los pacientes con ICr y FA oculta preexistente existiría un entorno predisponente que facilitaría dichos mecanismos y podría detectarse mediante marcadores biológicos. En los últimos años se ha implicado directamente a los microARN, pequeñas secuencias de ARN que regulan la expresión génica, en la fisiopatología de la FA8. Además, puesto que se ha descrito una buena correlación entre las concentraciones tisulares y las circulantes, se ha propuesto a estas moléculas como potenciales marcadores biológicos de la arritmia9,10. Se han publicado datos preliminares sobre los perfiles diferenciales de microARN presentes en la sangre de personas con una futura FA incidente e individuos con algunas formas particulares de FA persistente y prolongada11–14. Hay menos información disponible sobre el perfil de microARN circulante de pacientes con FA paroxística, que en su mayoría proviene de informes centrados en microARN específicos y no de cribados de alto rendimiento15.
Hasta la fecha, no hay información sobre el perfil de microARN circulantes en pacientes con ICr y FA oculta. Por lo tanto, en este estudio se intenta describir la expresión diferencial de microARN en pacientes con ICr y FA subclínica en comparación con aquellos en ritmo sinusal (RS) continuo, con la hipótesis de que los primeros presentarían un perfil específico de microARN circulante que los predispondría a la arritmia.
MÉTODOSPoblación de estudio y procedimiento diagnóstico habitualSe seleccionó a los individuos consecutivos de una cohorte prospectiva de pacientes con ICr ingresados en la Unidad de Ictus del Hospital del Mar (Barcelona, España) entre octubre de 2013 y septiembre de 2016 que cumplieran los siguientes criterios6: a) ictus isquémico o accidente isquémico transitorio; b) edad entre 50 y 89 años; c) causa indeterminada según los criterios SSS-TOAST2. Se excluyó a los pacientes con antecedentes de ictus hemorrágico, FA o aleteo auricular previos, contraindicación permanente para la anticoagulación oral, cirugía mayor o eventos cardiacos recientes (< 1 mes), enfermedad cardiovascular grave o comorbilidades, esperanza de vida corta (< 1 año) o ictus grave (escala de Rankin modificada >4)6. El estudio siguió los principios nacionales e internacionales (Declaración de Helsinki) y fue aprobado por el comité de ética local (2013/5055/I). Todos los pacientes o familiares más próximos tuvieron que firmar el formulario de consentimiento informado específico.
Se extrajo sangre de una vía periférica en el momento del ingreso. Se trató de inmediato a los pacientes con antiagregantes plaquetarios y se los trasladó a la unidad de ictus con monitorización electrocardiográfica continua. Se les realizó un ecocardiograma transtorácico bidimensional en las primeras 48 h con un equipo General Electric Vivid E9 (GE Healthcare, Estados Unidos) para evaluar las dimensiones y la funcionalidad del ventrículo izquierdo y la aurícula izquierda. Véase más detalles en el material adicional.
De acuerdo con el protocolo, a todos los pacientes sin causa del ictus establecida se les implantó un monitor cardiaco insertable cuando se los trasladó a planta. Los monitores cardiacos insertables (Biomonitor y Biomonitor-2, Biotronik, Alemania) se programaron con el algoritmo específico para la detección de FA, definido por una variabilidad del intervalo RR> 12,5% con una duración> 1min, como se ha descrito anteriormente6. Los registros detectados automáticamente como posibles episodios de FA fueron revisados por un cardiólogo especializado. La carga de FA se evaluó por el porcentaje de tiempo de seguimiento que un individuo estuvo en FA y, en segundo lugar, por el número de episodios de FA, como se propuso anteriormente16. Un tiempo de FA <0,05% definió a los participantes con una carga de FA baja, mientras que con tiempo de FA ≥ 0,05% la carga de FA fue alta17. Si en algún momento se confirmaba la FA, se iniciaba anticoagulación oral.
Grupos de estudio y diseñoEste es un estudio de casos y controles que incluyó a los pacientes prospectivamente y los asignó a casos (pacientes con FA, ICr-FA) o controles (pacientes en RS continuo, ICr-RS) después de 6 meses de seguimiento, el punto temporal final del análisis primario. Se realizó un análisis secundario a los 12 meses de seguimiento.
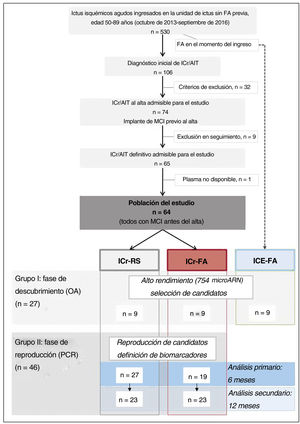
Como es habitual en los estudios de expresión génica18, el diseño del estudio siguió un enfoque de 2 pasos, es decir, una fase de descubrimiento utilizando datos de micromatrices de alto rendimiento, con selección de biomarcadores candidatos potenciales, seguida de una fase de reproducción (y confirmación) de microARN candidatos en una cohorte independiente (figura 1). En la fase de descubrimiento, se seleccionó a 18 pacientes emparejados por edad y sexo (conjunto I): 9 ICr-FA y 9 ICr-RS. Se realizó un seguimiento de los 9 pacientes de cada grupo durante 12 meses para garantizar que permanecieran clasificados por igual a los 6 o 12 meses (es decir, no ocurrieron episodios de FA en el ICr-RS más allá de los 6 meses), lo que corroboraba su idoneidad para el estudio a 6 y 12 meses. Paralelamente, en esta fase se realizó el cribado de un grupo adicional de 9 pacientes (sin antecedentes de FA) que presentaban FA en el momento del ingreso (ictus cardioembólico [ICE], ICE-FA), también emparejados con los grupos anteriores, con el objetivo de orientar aún más la selección de microARN. En la fase de reproducción, se utilizó una cohorte independiente de 46 pacientes no emparejados (grupo II), 19 de los cuales presentaron FA a los 6 meses. Se analizó a la misma cohorte a los 12 meses de seguimiento, cuando 23 habían presentado FA (figura 1).
Extracción e identificación de mARNLos microARN se aislaron del plasma utilizando el equipo miRNeasy Serum/Plasma (Qiagen Hilden, Alemania). En la fase de descubrimiento se utilizó el perfil de microARN humano avanzado TaqMan OpenArray (ThermoFisher, Estados Unidos), que analizó 754 microARN humanos, y los niveles de expresión de todos los microARN se analizaron con el software Cloud (ThermoFisher). Los microARN con una expresión diferencial importante entre grupos (p <0,05 y factor multiplicador> 2 o <0,5) se seleccionaron para la reproducción, que se realizó mediante reacción en cadena de la polimerasa cuantitativa (qPCR). Los resultados se analizaron con el software Expression Suite (Life Technologies). Véase más detalles en el material adicional.
Análisis estadísticosLos datos clínicos se comunican como media±desviación estándar o frecuencia (%). Los resultados de la expresión de microARN se exponen en factor multiplicador frente a los controles, donde 1 es igual a la media de expresión de todos los controles y, por tanto, representa el valor de referencia19. El análisis OpenArray de la expresión diferencial se evaluó con el software Cloud específico (Life Technologies) utilizando el método de normalización global. Para otras comparaciones se aplicaron la prueba de la t de Student, el análisis de la varianza de una vía (ANOVA) o la prueba de la χ2, en su caso. Dado el diseño del estudio de casos y controles, la asociación entre las variables y la FA se evaluó mediante modelos de regresión logística binaria. Puesto que no existen valores de referencia establecidos de microARN, la expresión de los microARN de interés se estratificó en cuartiles o por encima/por debajo de la mediana de todos los valores obtenidos en nuestra cohorte. Las variables que mostraron asociación con p <0,1 en el modelo univariante se incluyeron en el análisis multivariante. La capacidad discriminatoria del modelo se evaluó por el área bajo la curva de características operativas del receptor. Las probabilidades pronosticadas se calcularon a los 6 meses mediante modelos lineales generalizados utilizando las variables de interés del modelo multivariante, y se graficaron de acuerdo con ellas. La significación se fijó en p <0,05. Los análisis estadísticos se realizaron con SPSS versión 26.0 para Windows (SPSS Inc., Estados Unidos).
RESULTADOSPoblación del estudioDurante el periodo de estudio, 530 pacientes de 50 a 89 años ingresaron con ictus isquémico. Después de un estudio diagnóstico completo, se consideró aptos para el estudio a 74 pacientes con ICr, de los que después se excluyó a 10. Por lo tanto, la población del estudio estuvo compuesta por 64 pacientes con diagnóstico definitivo de ICr en seguimiento continuo con un monitor cardiaco insertable implantado antes del alta.
Las características clínicas de la población final del estudio se resumen en la tabla 1. La media de edad fue 75±11 años, y 29 pacientes (45%) eran mujeres. La prevalencia de factores de riesgo cardiovascular fue alta; 11 pacientes (17%) ya habían tenido un ictus o accidente isquémico transitorio. La evaluación cardiaca durante el ingreso mostró dimensiones y función normales del ventrículo izquierdo y la aurícula izquierda en la población total. Las características, el tratamiento y la gravedad del ictus se presentan en la tabla 1.
Características de la población de estudio
| Total(n=64) | ICr-RS(n=36) | ICr-FA(n=28) | p | |
|---|---|---|---|---|
| Características basales y antecedentes médicos | ||||
| Edad (años) | 74,6 (10,8) | 73,0 (11,8) | 76,7 (9,2) | 0,180 |
| Mujeres | 29 (45,3) | 18 (50,0) | 11 (39,3) | 0,454 |
| IMC | 27,5 (4,5) | 27,4 (3,8) | 27,6 (5,4) | 0,904 |
| Hipertensión | 45 (70,3) | 28 (77,8) | 17 (60,7) | 0,173 |
| Diabetes mellitus | 13 (20,3) | 9 (25,0) | 4 (14,3) | 0,359 |
| Hiperlipemia | 35 (54,7) | 21 (58,3) | 14 (50,0) | 0,615 |
| Consumo actual de tabaco | 8 (12,5) | 5 (13,9) | 3 (10,7) | 1,000 |
| Vasculopatía periférica | 11 (17,2) | 4 (11,1) | 7 (25,0) | 0,188 |
| Enfermedad coronaria | 3 (4,7) | 1 (2,8) | 2 (7,1) | 0,577 |
| Ictus/accidente isquémico transitorio previos | 11 (17,2) | 5 (13,9) | 6 (21,4) | 0,513 |
| CHA2DS2-VASc | 3,2 (1,8) | 3,2 (1,7) | 3,2 (1,9) | 0,979 |
| Parámetros cardiacos | ||||
| Diámetro telediastólico del VI (mm) | 45,3 (4,0) | 44,4 (3,2) | 46,5 (4,6) | 0,054 |
| Diámetro telesistólico del VI (mm) | 26,8 (3,8) | 26,0 (3,2) | 27,9 (4,3) | 0,061 |
| FEVI (%) | 63,5 (3,2) | 63,9 (3,3) | 63,0 (3,1) | 311 |
| DAI (mm) | 36,5 (4,5) | 35,3 (4,5) | 37,9 (4,2) | 0,029 |
| Área biplanar de la AI (cm2) | 18,1 (3,2) | 17,1 (2,6) | 19,3 (3,6) | 0,010 |
| FEAI (%) | 54,2 (11,2) | 58,5 (10,0) | 48,9 (10,3) | 0,001 |
| Características del ictus | ||||
| AIT | 11 (17,2) | 6 (16,7) | 5 (17,9) | 1,000 |
| Escala de Oxford, disponible para 60 pacientes | ||||
| TACI | 19 | 12 | 7 | 0,886 |
| PACI | 28 | 14 | 14 | |
| LACI | 2 | 1 | 1 | |
| POCI | 11 | 7 | 4 | |
| NIHSS (ingreso) | 5 [1,75-12,25] | 3 [1-13] | 5,5 [2-11,25] | 0,193 |
| Fibrinolisis | 20 (31,3) | 11 (30,6) | 9 (32,1) | 1,000 |
| NIHSS (alta) | 1 [0-2] | 1 [0-2] | 1 [0-2,25] | 0,864 |
AI: aurícula izquierda; AIT: accidente isquémico transitorio; DAI: diámetro de la aurícula izquierda; FA: fibrilación auricular; FEAI: fracción de eyección de la aurícula izquierda; FEVI: fracción de eyección del ventrículo izquierdo; ICr: ictus criptogénico; IMC: índice de masa corporal; NIHSS: National Institute of Health Stroke Scale; RS: ritmo sinusal; TACI, PACI, POCI y LACI: infarto de circulación anterior total, anterior parcial, posterior y lacunar; VI: ventrículo izquierdo.
Los valores expresan n, n (%) o mediana [intervalo intercuartílico].
De los 64 pacientes, 28 presentaron FA (25 paroxística y 3 crónica) en los primeros 6 meses y constituyeron el grupo de ICr-FA. Todos los pacientes iniciaron anticoagulación oral. Los pacientes con FA presentaron una mediana de 4,3 [0,6-2] episodios de FA al mes, con una mediana de tiempo total de FA de 183,9 [23,7-775,6] min, lo que representa el 0,071% [0,009-0,30] del tiempo de seguimiento. Los 36 pacientes restantes mostraron RS continuo (grupo de ICr-RS). Las características de los pacientes con FA y en RS se resumen en la tabla 1. Los pacientes del grupo de ICr-FA tendían a presentar mayores dimensiones ventriculares y auriculares junto con menor fracción de eyección de la aurícula izquierda que los pacientes del grupo ICr-RS.
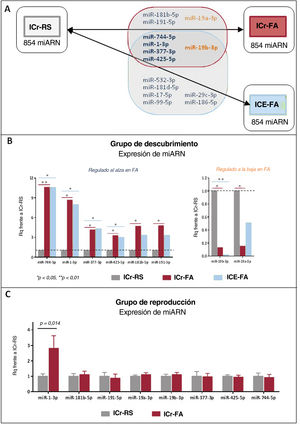
Estudio del microARNLas características de los pacientes incluidos en la fase de descubrimiento (9 pacientes en ICr-FA, 9 en ICr-RS y 9 en ICE-FA) se resumen en la tabla 1 del material adicional. Todos los grupos se emparejaron por sexo y edad, con 4 mujeres y una media de edad de 75 años. Dieciséis microARN se expresaron de manera diferenciada en ICr-FA frente a ICr-RS (consulte la lista completa en la tabla 2 del material adicional), de los cuales 8 surgieron como candidatos potenciales en función de su estabilidad plasmática. Estos se representan en la figura 2A (área sombreada). Los 8 candidatos mostraron una expresión relativamente constante entre ICr-FA y ICE-FA en comparación con los controles y 5 de ellos (miR-744-5p, miR-1-3p, miR-377-3p, miR-425-5p y miR-19b-3p) también fueron considerablemente diferentes entre los pacientes con ICE-FA e ICr-RS, de modo que estos podrían ser indicadores potenciales de la presencia de un entorno favorable a la FA, independientemente de si la arritmia se hubiera confirmado o continuaba siendo subclínica. Los valores de expresión de los 8 microARN candidatos en el ensayo Open Array se muestran en la figura 2B.
A: resultados del estudio Open Array. De los 854 microARN evaluados en los 3 grupos de estudio (ICr-RS, ICr-FA e ICE-FA), 8 se expresaron de manera diferencial entre ICr-FA e ICr-RS (área sombreada en gris), de los cuales 5 también se expresaron de manera diferente entre ICE-FA e ICr-RS (en negrita); los microARN sobrexpresados se presentan en azul, mientras que los microARN regulados a la baja aparecen en naranja. B: resultados de los 8 microARN seleccionados para la reproducción; los datos se expresan en Rq (FM) frente al grupo ICr-RS (control), que se normalizó a 1; los valores de p específicos se presentan en la tabla 2 del material adicional. C: resultados de la expresión de microARN plasmático en la cohorte de reproducción; microARN-1-3p fue el único candidato del que se confirmó que estaba considerablemente aumentado en pacientes con ICr-FA frente a ICr-RS. FA: fibrilación auricular; FM: factor multiplicador; ICE: ictus cardioembólico; ICr: ictus criptogénico; RS: ritmo sinusal. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Los 8 microARN candidatos se reprodujeron en una cohorte independiente definida por la presencia o ausencia de FA a los 6 meses (conjunto 2, tabla 1 del material adicional). Los resultados se muestran en la figura 2C. Solo las concentraciones plasmáticas de miR-1-3p permanecieron considerablemente aumentadas en los pacientes con ICr-FA frente a ICr-RS (aumento de 2,81 veces, p=0,014).
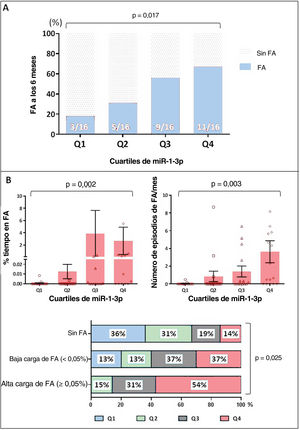
Asociación entre miR-1-3p y fibrilación auricular a los 6 mesesEn la cohorte total (n=64), se investigó más a fondo la asociación potencial entre miR-1-3p y FA. Puesto que no se ha establecido el «intervalo normal» de las concentraciones plasmáticas de miR-1-3p y los valores del factor multiplicador no proporcionan concentraciones plasmáticas reales, sino un valor que es proporcional a su concentración, los resultados de miR-1-3p se estratificaron en cuartiles (Q1-Q4). Como se muestra en la figura 3A, los valores de miR-1-3p mostraron una asociación positiva con el riesgo de FA, donde los pacientes en Q4 y Q3 tenían más probabilidades de presentar FA a los 6 meses de seguimiento (el 69 y el 56% respectivamente) en comparación con los de los cuartiles inferiores (el 31% en Q2 y el 19% en Q1, p=0,017).
A: aparición de FA según cuartiles de miR-1-3p en la población total. B: asociación entre valores de miR-1-3p y carga de FA. El porcentaje de tiempo en FA (superior derecha) y el número de episodios de FA por mes (superior izquierda) se presentan según los cuartiles de miR-1-3p. En el panel inferior, se representa la distribución de los cuartiles de miR-1-3p entre pacientes sin FA, carga de FA baja y carga de FA alta. FA: fibrilación auricular.
Además, las concentraciones de miR-1-3p aparecieron moderadamente asociadas con la carga de FA en nuestra cohorte. La figura 3B muestra el porcentaje de tiempo en FA (superior derecha) y la cantidad de episodios de FA por mes (superior izquierda) que se registraron entre los pacientes en los 4 cuartiles de miR-1-3p durante los 6 meses de seguimiento. La carga de FA medida por ambos parámetros parecía mayor entre los pacientes en los cuartiles más altos de miR-1-3p. El grupo inferior de la figura 3B representa la distribución de los cuartiles de miR-1-3p entre pacientes sin FA, carga baja de FA y carga alta de FA. Concretamente, más de la mitad de los pacientes con carga alta de FA tenían valores de miR-1-3p en Q4, mientras que ninguno tenía valores de miR-1-3p en Q1.
Indicadores de fibrilación auricular subclínica a los 6 mesesA continuación se evaluó si miR-1-3p, junto con datos clínicos, podría proporcionar una orientación temprana en la identificación de pacientes con ICr y FA subclínica. Para una mejor aplicabilidad, se agruparon todos los valores de miR-1-3p por encima (Q3 + Q4) o por debajo (Q1 + Q2) de la mediana.
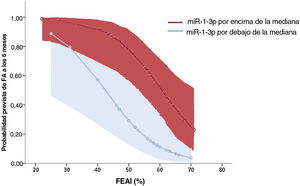
La tabla 2 resume los resultados de los análisis de regresión logística. Solo 2 parámetros permanecieron asociados de manera independiente con la FA en el análisis multivariante: a) la fracción de eyección de la aurícula izquierda, asociada con una reducción relativa del 11% del riesgo de FA por unidad de aumento, y b) concentración plasmática de miR-1-3p elevada, donde valores por encima de la mediana se asociaron con un aumento de 8,5 veces del riesgo de FA a los 6 meses. El modelo que incluye ambas variables mostró una capacidad discriminatoria, evaluada por el área bajo la curva de características operativas del receptor, de 0,860 (0,760-0,960; p <0,001). La figura 4 muestra las probabilidades previstas estimadas de FA documentada a los 6 meses del ictus según estas variables.
Variables clínicas y biológicas relacionadas con la fibrilación auricular a los 6 meses
| Análisis univariante | Análisis multivariante | |||||
|---|---|---|---|---|---|---|
| OR | IC95% | p | OR | IC95% | p | |
| Edad (años) | 1,04 | 0,98-1,09 | 0,183 | — | — | — |
| Varones | 0,65 | 0,24-1,76 | 0,394 | — | — | — |
| Diámetro telediastólico del VI (mm) | 1,15 | 1,00-1,32 | 0,050 | 1,12 | 0,96-1,30 | 0,169 |
| Diámetro telesistólico del VI (mm) | 1,14 | 0,99-1,32 | 0,066 | 0,96 | 0,72-1,28 | 0,788 |
| Área biplanar de la aurícula izquierda (cm2) | 1,25 | 1,05-1,50 | 0,014 | 0,92 | 0,68-1,24 | 0,568 |
| FEAI (%) | 0,91 | 0,85-0,97 | 0,003 | 0,89 | 0,82-0,96 | 0,003 |
| miR-1-3p> mediana | 4,55 | 1,54-13,42 | 0,006 | 8,51 | 2,05-35,25 | 0,003 |
FEAI: fracción de eyección de la aurícula izquierda; IC95%: intervalo de confianza del 95%; OR: odds ratio; VI: ventrículo izquierdo.
Probabilidades previstas de riesgo de FA a los 6 meses en la cohorte total según los valores de FEAI y miR-1-3p, expresadas por encima (rojo) o por debajo (azul) de la mediana de todos los valores. Las áreas sombreadas representan intervalos de confianza del 95%. FA: fibrilación auricular; FEAI: fracción de eyección de la aurícula izquierda. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
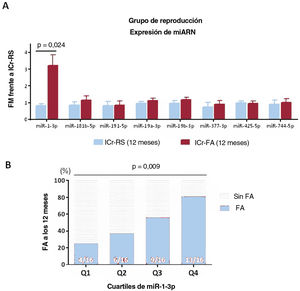
Para analizar más a fondo el impacto clínico potencial del miR-1-3p plasmático en la evaluación de la FA subclínica en pacientes con ICr, se investigó la asociación entre el miR-1-3p y la presencia de FA a los 12 meses. Otros 4 pacientes presentaron FA entre los 6 y los 12 meses de seguimiento (figura 1). Los valores de miR-1-3p fueron significativamente más altos en los pacientes que presentaron FA a los 12 meses que en aquellos con RS continuo (figura 5A). Además, los cuartiles de miR-1-3p se asociaron positivamente con la presencia de FA (figura 5B). Por último, mediante análisis de regresión logística, tanto el miR-1-3p por encima de la mediana como la fracción de eyección de la aurícula izquierda permanecieron asociados de manera independiente con la presencia de FA a los 12 meses (tabla 3).
Asociación entre las concentraciones de miR-1-3p y la FA a los 12 meses. A: resultados de expresión de microARN plasmático en la cohorte de reproducción, con 23 pacientes en RS y 23 con al menos 1 episodio de FA. B: aparición de FA a los 12 meses según cuartiles de miR-1-3p en la población total. FA: fibrilación auricular; FM: factor multiplicador; ICr: ictus criptogénico; RS: ritmo sinusal.
Variables clínicas y biológicas relacionadas con la fibrilación auricular a los 12 meses
| Análisis univariante | Análisis multivariante | |||||
|---|---|---|---|---|---|---|
| OR | IC95% | p | OR | IC95% | p | |
| Edad (años) | 1,06 | 1,01-1,12 | 0,032 | 1,04 | 0,96-1,12 | 0,367 |
| Varones | 0,88 | 0,33-2,36 | 0,802 | — | — | — |
| Diámetro telesistólico del VI (mm) | 1,13 | 0,98-1,30 | 0,092 | 1,09 | 0,91-1,32 | 0,354 |
| Área biplanar de la aurícula izquierda (cm2) | 1,32 | 1,09-1,60 | 0,005 | 1,03 | 0,76-1,40 | 0,866 |
| FEAI (%) | 0,87 | 0,80-0,94 | 0,001 | 0,83 | 0,74-0,93 | 0,001 |
| miR-1-3p> mediana | 4,41 | 1,52-12,79 | 0,006 | 11,91 | 2,40-59,18 | 0,002 |
FEAI: fracción de eyección de la aurícula izquierda; IC95%: intervalo de confianza del 95%; OR: odds ratio; VI: ventrículo izquierdo.
Este estudio, realizado en una cohorte seleccionada, indica que los valores de miR-1-3p altos en el momento del ingreso se asocian con FA subclínica en pacientes con ICr. Un miR-1-3p elevado, así como el deterioro de la función auricular evaluada por una fracción de eyección de la aurícula izquierda baja en un ecocardiograma inicial, podrían indicar un sustrato auricular favorable a la FA, por lo que serían marcadores potenciales de FA oculta en pacientes con ICr.
La búsqueda de FA subclínica en pacientes con ICr continúa siendo un tema de gran interés, dadas las profundas implicaciones pronósticas y terapéuticas que conlleva la arritmia en este contexto1,3. Las tasas notificadas de detección de FA en ICr han aumentado en los últimos años en paralelo a las estrategias de seguimiento más intensivas3,4. Una estrategia de seguimiento ultraprecoz por medio del implante de un monitor cardiaco insertable antes del alta condujo a una tasa de FA del 58% a los 31 meses en una cohorte de pacientes con ICr evaluados minuciosamente6; destaca que la FA subclínica puede ser la base de más casos de ICr de lo que se pensaba1,3,4. Sin embargo, incluso en el mejor de los escenarios posibles, la identificación de la FA mediante estrategias de seguimiento tiene la limitación inherente de que la FA suele ser de naturaleza paroxística, de modo que su confirmación puede producirse meses después después del ictus, lo que retrasa el tratamiento con anticoagulantes orales de pacientes potencialmente en riesgo.
La identificación de marcadores biológicos o clínicos de FA subclínica que puedan estar presentes en el momento del ingreso se ha analizado en varios estudios los últimos años. Los factores clínicos han demostrado un valor pronóstico limitado20. Recientemente, se han introducido resultados más prometedores en un estudio exhaustivo de la aurícula izquierda mediante estudios de imagen21,22. Al mismo tiempo, se han investigado varios biomarcadores de FA subclínica. La fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP) y el BNP han proporcionado los resultados más consistentes23,24, con mejores resultados aparentemente para el primero25. Las moléculas relacionadas con la hipercoagulabilidad, como el dímero D y la antitrombina III, han mostrado menos sensibilidad y especificidad23. Un estudio piloto reciente en pacientes con ICr que evaluó 184 biomarcadores potenciales simultáneamente encontró la mayor asociación con FA en las proteínas relacionadas con la inflamación, lo que abre nuevas líneas para futuras investigaciones26.
Sin embargo, una limitación de estos estudios proviene de la estrategia utilizada para la confirmación de la FA, que fue intermitente (basada en ECG y Holter)22–24 o a corto plazo (seguimiento inferior a 1 mes)25,26. En el presente estudio, se intentó confirmar en todos los pacientes de nuestra cohorte que la arritmia de verdad estaba presente o ausente, por lo que se dio a todos ellos un seguimiento continuo a largo plazo implantándoles un monitor cardiaco insertable antes del alta. La FA se definió por una grabación compatible de duración> 1min. Se han utilizado diferentes umbrales para la definición de la FA en el contexto del ICr, que van desde los 30 s5 hasta los 2min27,28. El umbral de 1min se eligió con base en una publicación anterior que mostraba que el inicio de la anticoagulación oral según esta definición se asociaba con una reducción del riesgo de un nuevo ictus6. Nuestro criterio de valoración principal fue la aparición de FA durante los primeros 6 meses después del ictus. Este marco de tiempo se ha utilizado previamente en estudios fundamentales sobre ICr, como el estudio CRYSTAL5. Para un estudio de biomarcadores, un periodo de 6 meses parece adecuado para establecer mejor una asociación entre el biomarcador y la arritmia, con lo que se evitan factores de confusión incidentales. Con todo, en un intento de aportar mayor relevancia clínica, se realizó un análisis secundario a los 12 meses, que también confirmó la asociación entre miR-1-3p y FA.
Otro punto fuerte de nuestro estudio es que, a diferencia de estudios anteriores, se hizo una investigación de alto rendimiento. Se optó por evaluar el perfil de los microARN circulantes, dado que en los tejidos estas moléculas han estado muy implicadas en la promoción del remodelado auricular que favorece la FA8, y en plasma, algunas han mostrado una buena correlación con el tejido9,10. Es importante destacar que, dado que en la literatura se ha descrito cierta incoherencia respecto a los perfiles de microARN circulantes8, se incluyó además un grupo adicional de pacientes que presentaban ictus y FA concomitantes para ayudar en la selección de los microARN candidatos con mayor probabilidad de asociación con la FA, ya fuera clínica o subclínica.
Se halló que los pacientes con ICr y posterior FA tenían concentraciones plasmáticas de miR-1-3p más altas. miR-1-3p es miembro de la familia de miR-1 específica del músculo, implicada repetidamente en la enfermedad cardiaca y, en particular, en la arritmogénesis29. Los efectos proarrítmicos de miR-1 están bien avalados por publicaciones anteriores que muestran que miR-1 puede promover actividad desencadenada (al aumentar la corriente de entrada de Ca2+ y la frecuencia de las liberaciones espontáneas de Ca2+)30, pero también genera un sustrato favorable que facilita la reentrada anatómica y funcional (mediante la despolarización de la membrana citoplásmica y la desaceleración de la conducción con la represión de KCNJ2 y GJA1 respectivamente)31. Se sabe que todos estos mecanismos participan en la promoción y el mantenimiento de la FA7. Además, un trabajo previo en conejos informó que la estimulación auricular a frecuencias elevadas durante 1 semana aumentó la expresión de miR-1 y la inducibilidad de FA32. Sin embargo, estudios previos hacen referencia a la sobrexpresión cardiaca de miR-1. Existe poca información sobre el papel del miR-1-3p plasmático. Un estudio piloto reciente encontró concentraciones plasmáticas de miR-1-3p más elevadas en pacientes con FA e ictus cardioembólico que en aquellos con FA sin ictus33. Nuestros resultados indican que las concentraciones elevadas de miR-1-3p también podrían indicar FA subclínica en pacientes con ICr. Además, los valores de miR-1-3p mostraron una asociación potencial con la carga de FA en nuestra población. A la espera de confirmación en futuros estudios con poblaciones de pacientes más amplias, estos resultados respaldan aún más el papel de miR-1-3p como marcador de arritmogenicidad auricular y riesgo de FA en pacientes con ICr.
LimitacionesNuestro estudio tiene varias limitaciones. El tamaño de la muestra es pequeño, en especial en la cohorte de reproducción, pero incluye a una población muy valiosa de pacientes consecutivos evaluados minuciosamente mediante seguimiento continuo. Aun así, la población final no es considerablemente menor que la utilizada en estudios previos sobre microARN circulantes que utilizaron la metodología de alto rendimiento18. En nuestra población hay varones y mujeres con edades entre 50 y 89 años. Por lo tanto, estos resultados no deben extrapolarse a otros grupos de edad. Este estudio se realizó en un solo hospital terciario y carece de validación externa en otras cohortes, lo que sería muy deseable para establecer definitivamente el papel de miR-1-3p como biomarcador de FA subclínica en pacientes con ICr. Por último, no se pudo confirmar que las concentraciones elevadas de miR-1-3p circulante reflejen una alta expresión auricular de miR-1-3p o la presencia de un sustrato que favorece la FA. Sin embargo, nuestros resultados apuntan a miR-1-3p como biomarcador potencial de la FA subclínica independientemente de su expresión tisular o del sustrato auricular. Deberá evaluarse en estudios futuros si altas concentraciones plasmáticas de miR-1-3p pueden ser causa directa de la promoción de la FA en el contexto del ICr, lograr una verdadera aplicabilidad clínica e incluso ofrecer orientación para el inicio precoz de la anticoagulación oral.
CONCLUSIONESNuestros resultados indican que las concentraciones plasmáticas de miR-1-3p, un regulador génico claramente involucrado en la arritmogénesis cardiaca, podrían estar elevados en pacientes con ICr y posterior FA, sobre todo aquellos con una carga arrítmica alta. Nuestros resultados preliminares indican que miR-1-3p podría ser un biomarcador novedoso que, junto con parámetros clínicos como la alteración de la fracción de eyección de la aurícula izquierda, podría ayudar a identificar a los pacientes con ICr y alto riesgo de FA oculta.
- –
Es necesario identificar precozmente a los pacientes con FA subclínica entre los pacientes con ICr.
- –
Las estrategias de monitorización continua a largo plazo han mostrado mejor rendimiento diagnóstico que las estrategias convencionales, pero continúan siendo subóptimas.
- –
Se han propuesto varios biomarcadores seleccionados, pero con poca capacidad predictiva.
- –
A diferencia de las series anteriores, este estudio incluyó una cohorte que se evaluó minuciosamente con un monitor cardiaco insertable implantado antes del alta y una determinación de microARN de alto rendimiento.
- –
Las concentraciones plasmáticas de miR-1-3p, un regulador génico relacionado con la arritmogénesis, fueron más altas en pacientes con ICr y posterior FA que en aquellos con RS. Nuestro estudio indica por primera vez la utilidad potencial de un regulador implicado en la fisiopatología de la FA como biomarcador plasmático.
- –
Nuestros datos preliminares indican que, junto con una baja fracción de eyección de la aurícula izquierda, las altas concentraciones de miR-1-3p podrían ayudar a identificar, ya en el momento del ingreso y con buena capacidad predictiva, a los pacientes con ICr y alto riesgo de FA oculta.
Con el apoyo del Instituto de Salud Carlos III-FIS (Fondo de Investigación Sanitaria, PI13/01830) y la Societat Catalana de Cardiologia 2016 (ambos otorgados a BB); Ministerio de Sanidad de España (FEDER, RD16/0019/0002- INVICTUS-PLUS) otorgado al Servicio de Neurología, Hospital del Mar. E. Giralt-Steinhauer recibió financiación del Instituto de Salud Carlos III (JR18/00004).
CONTRIBUCIÓN DE LOS AUTORESTodos los autores enumerados en el artículo hicieron una contribución importante al planteamiento y diseño, obtención de datos o análisis e interpretación de los resultados del presente estudio. Además, todos tuvieron la oportunidad de redactar y/o revisar críticamente el contenido de este artículo y aprobaron la versión actual para su publicación. B. Benito y A. García-Elías contribuyeron por igual a este artículo.
CONFLICTO DE INTERESESBiotronik Inc. proporcionó amablemente 35 de los monitores cardiacos implantables (Biomonitor) necesarios para este estudio. Los autores no tienen ningún conflicto de intereses financiero o no financiero relevante que divulgar.