Palabras clave
INTRODUCCIÓN
La pérdida luminal que ocurre tras la implantación de los stents es proporcional al daño vascular1-4 y también tiene relación con numerosas variables clínicas y angiográficas, como la diabetes, el diámetro de la arteria y la longitud de la lesión5. Se ha sugerido que los valores bajos de tensión de cizallamiento (TC) podrían favorecer el proceso de reestenosis, aunque es difícil demostrarlo en el modelo humano. Teniendo en cuenta el papel de la TC en la composición y el comportamiento de las placas de aterosclerosis6-9, es razonable suponer que ésta también ejerce un papel en la respuesta proliferativa tras la angioplastia.
En la actualidad, el cálculo directo de la velocidad de flujo y la presión en la superficie luminal no es posible in vivo. Sin embargo, los avances tecnológicos y científicos en los modelos matemáticos y numéricos permiten la simulación matemática del flujo sanguíneo y la determinación precisa de los efectos hemodinámicos locales10. De esta manera, podemos estimar la TC in vivo y tenemos la posibilidad de analizar la influencia de las variables hemodinámicas en la reestenosis intra-stent. Las publicaciones previas con esta metodología muestran resultados contradictorios: en un estudio se sugiere una correlación negativa entre TC y proliferación neointimal tras el implante de Wallstents11, mientras que en otro no se observa una relación clara entre estas 2 variables9.
El presente trabajo tiene por objetivo evaluar la contribución de la TC en la formación neointimal tras el implante con éxito de stents balón-expandibles, utilizando una reconstrucción geométrica tridimensional real basada en la integración de la angiografía coronaria convencional con ecografía intravascular y una técnica de simulación numérica de las condiciones del fluido sanguíneo, conocida como dinámica de fluidos computacional (DFC).
PACIENTES Y MÉTODO
Grupo de estudio
El estudio fue aprobado por el comité de ética local y todos los pacientes firmaron un consentimiento informado. Los criterios de inclusión fueron: edad ≥ 18 años, presencia de lesiones de novo en las coronarias nativas con una longitud < 25 mm y que se consideraban susceptibles de angioplastia con stent. Se estudiaron solamente las arterias coronarias derechas en su segmento proximal y medio, para evitar las complejidades relacionadas con la presencia de grandes bifurcaciones, como la del tronco común izquierdo. Los motivos de exclusión fueron: intervención en la fase aguda del infarto de miocardio, tortuosidad importante proximal a la lesión diana, calcificación severa que pudiera evitar un análisis correcto de los bordes arteriales por ecografía, insuficiencia renal, anemia, enfermedad sistémica significativa que pudiera afectar a la expectativa de vida, y uso de dispositivos o fármacos en investigación para la reestenosis.
Procedimientos de angioplastia
El procedimiento de implantación de stents siguió una práctica estándar. Todos los pacientes fueron tratados previamente con aspirina y ticlopidina. Se administró heparina no fraccionada por el catéter-guía en una dosis de 100 U/kg. Antes de la introducción de la guía de angioplastia se tomaron dos proyecciones angiográficas de la lesión diana y se evaluó la arteria con ecografía intravascular (EIV). Se colocó el stent de manera directa en todos los casos, excepto en uno (paciente 2). Los stents implantados fueron: Multilink Ultra (2 casos) o Tetra (2 casos) (Guidant, Santa Clara, CA, Estados Unidos); Jostent Flexmaster en 1 caso (Jomed, Ragendingen, NL) y NIR en 2 casos (Boston Scimed, Natick, MA, Estados Unidos).
Estudio coronario con imágenes
En todos los casos se obtuvo una angiografía convencional y una EIV en situación basal (tras la implantación del stent) y a los 6 meses de seguimiento. Las imágenes se adquirieron con catéteres-guía de 6 Fr tras administar 200 µg de nitroglicerina intracoronaria. Una vez considerado satisfactorio el resultado, tras el implante del stent, se tomaron 2 proyecciones ortogonales, grabadas en formato DICOM a 25 imágenes/s, con el catéter de EIV posicionado justo distal al borde distal del stent. Durante la grabación de estas angiografías se inyectaba una solución de contraste diluido con salino 1:1 con objeto de no ocultar la visualización del catéter de EIV que, no obstante, permitía identificar los bordes de la íntima y, así, se podían identificar en un mismo fotograma la línea del catéter y los marcadores anatómicos, como las ramas laterales. Las imágenes en telediástole fueron las utilizadas para la reconstrucción geométrica. La línea del catéter de EIV se utilizó como línea central o «columna vertebral» para orientar el montaje de las secciones transversales obtenidas con EIV y, de esta forma, obtener una reconstrucción tridimensional real.
Los datos de angiografía cuantitativa automática se obtuvieron con el programa disponible en el equipo de General Electric Advantx (GE Medical Systems, París, Francia).
Para la EIV se utilizaron catéteres convencionales (Atlantis 40 MHZ, Boston Scimed, San Jose, CA, Estados Unidos). Las imágenes ecográficas se adquirieron en formato digital durante la retirada automática sincronizada con el electrocardiograma mediante un dispositivo informático específicamente diseñado (TomTec Imaging Systems, GMBH, Unterschleissheim, Alemania). Este sistema permite corregir el desplazamiento del catéter de EIV que ocurre durante el ciclo cardíaco y la respiración, lo que posibilita la adquisición de imágenes telediastólicas precisas para una reconstrucción longitudinal.
Reconstrucción tridimensional y generación de la malla
La técnica de reconstrucción utilizada en este estudio es similar a la empleada por Slager et al12, que describimos aquí de forma breve. Ésta se basa en la superposición de unas secciones ecográficas sobre el trayecto 3D que sigue la arteria coronaria, o en este caso el catéter de EIV que va en su interior. Las secciones ecográficas usadas son imágenes obtenidas a intervalos de 2 mm, utilizando como primera sección la situada a 4 mm del borde distal del stent (la sección más distal) y como última sección (la más proximal) la que corresponde a la unión aortoostial. Para cada sección, los contornos luminal y externo eran identificados y marcados manualmente. Tras emparejar la línea del catéter de EIV obtenida con la angiografía con el centro de estos cortes ecográficos, los contornos luminal y externo eran montados perpendicularmente a intervalos de 2 mm y la geometría global interpolada. La orientación axial de las secciones ecográficas se realizaba mediante la localización de 2 ramas laterales separadas que se identificaban tanto con angiografía como con EIV.
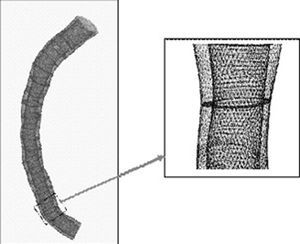
La reconstrucción tridimensional permite la generación de una malla virtual (mesh) que se utiliza en la simulación matemática de las condiciones fluidodinámicas. La reconstrucción espacial, su segmentación (malla tridimensional) y las variables fluidodinámicas derivadas se obtuvieron mediante un programa informático específico (Fluent, v. 6.0, Fluent Inc. Lebanon NH, Estados Unidos). En la figura 1 se expone un ejemplo de este tipo de reconstrucción tridimensional.
Fig. 1. Ejemplo de una reconstrucción 3D real utilizada en los estudios de fluidodinámica.
Fluidodinámica computacional
Para el cálculo de las condiciones del flujo sanguíneo se utilizó una técnica conocida como método de volúmenes finitos. Dicho método se basa en la división del volumen en el interior de la coronaria en elementos diminutos (volúmenes finitos) (fig. 1)13. A continuación se resuelven las ecuaciones de Navier-Stokes, lo que permite calcular las variables fluido-mecánicas en cada uno de dichos elementos. La aplicación de esta técnica matemática necesita la construcción de una malla a partir de la imagen reconstruida de la coronaria. Este proceso de mallado permite la subdivisión de la estructura vascular en dichos volúmenes finitos, en los cuales se puede calcular el valor de la velocidad de flujo y de la tensión de cizallamiento. En este trabajo, estos elementos de volumen fueron hexaedros, con una resolución media de 0,2 mm, de tal manera que por cada coronaria se obtuvieron varios puntos, de número variable para cada caso según la longitud y las dimensiones del vaso estudiado, en los que se calcularon las variables fluidodinámicas.
Para dichos cálculos de dinámica de fluidos se asumió que la sangre se comporta como un fluido newtoniano, con una densidad de 1.050 kg/m³ y una viscosidad de 3 cP8,14. Se asumió un flujo laminar, tomando en consideración el número de Reynolds para un vaso de diámetro entre 3 y 4 mm. Se descartaron variaciones en el área transversal del vaso durante el ciclo cardíaco, ya que las variaciones son mínimas en arterias con enfermedad aterosclerótica y, por lo tanto, más rígidas, y nulas en los segmentos cubiertos con stents. Como consecuencia, los cálculos fueron realizados con una geometría fija para la superficie luminal. El perfil parabólico de la velocidad de entrada en la coronaria se consideró de 25 cm/s en todos los casos. Esta velocidad se eligió para simular una situación en reposo en todos los casos y es similar a la utilizada en otros estudios8. La DFC se calculó en los segmentos con stent en la situación basal (después del último inflado tras el stent) y a los 6 meses de seguimiento.
Correlaciones y estadística
Las variables continuas se presentan como media ± desviación estándar. La comparación entre medias se realizó con el test de la t de Student para muestras independientes. Para valorar la relación entre la dinámica de fluidos y la proliferación neointimal se elaboró un algoritmo especial que permitía la correlación precisa y robusta entre la TC obtenida a través de los cálculos de DFC con el grosor local de la pared en cada punto.
En el segmento estudiado, la malla interna se obtuvo a partir del contorno luminal del EIV obtenido en el estudio de seguimiento a los 6 meses. Para calcular el grosor de neoíntima se utilizó la diferencia entre este contorno luminal y el contorno del stent. Para obtener el grosor de pared en los bordes del stent se utilizó la diferencia entre el contorno luminal obtenido en el seguimiento a los 6 meses y el trazado en situación basal tras el implante del stent. En este cálculo se incluyeron como bordes los 4 mm distales y los 4 mm proximales al stent. Dado el enorme número de puntos con datos de DFC, para poder correlacionarlos con el espesor de la pared se diseñó un algoritmo específico que permitía reducir el número de puntos y que, al mismo tiempo, regularizaba los datos eliminando algún artefacto local indeseable. Para ello se construyó una nueva malla de interpolación. De esta manera disponíamos de un conjunto de datos promedio por coronaria de 2.432 puntos (955-5.002) para poder correlacionar la DFC y el espesor neointimal.
La relación entre la TC y la proliferación neointimal se estudió mediante un análisis de regresión lineal. El análisis de correlación se hizo con la TC obtenida en el estudio basal. Para un análisis más exacto de la influencia de las condiciones fluidodinámicas en la reestenosis se dividió la TC en cuartiles. De esta forma, el grosor de neoíntima (GN) pudo ser comparado en diferentes grupos de acuerdo con los valores post-stent de TC.
Se utilizó el programa SPSS versión 10.0 para los cálculos estadísticos. Los valores de p < 0,05 se consideraron estadísticamente significativos.
RESULTADOS
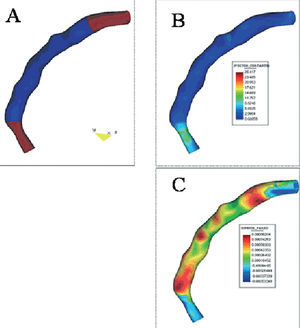
Las características clínicas y angiográficas de los 7 pacientes incluidos se resumen en las tablas 1 y 2. En todos los casos se pudo realizar la reconstrucción geométrica 3D, tanto en situación basal como en el seguimiento. Uno de los pacientes requirió stents adicionales para cubrir una disección proximal a la lesión inicial que se extendía hasta el ostium de la coronaria. Por este motivo no se pudo obtener el borde proximal sin stent en este caso. En la figura 2 se ilustra un ejemplo de reconstrucción 3D con la estimación de la TC y del GN representada en color. Dos pacientes presentaron reestenosis angiográfica (estenosis > 50%) en el seguimiento y uno de ellos requirió nueva angioplastia de la lesión diana. En este caso, la EIV se realizó antes de la dilatación.
Fig. 2. Ejemplo de una reconstrucción geométrica del segmento cubierto por stent (representado en azul en el panel A) y los bordes proximal y distal (en marrón en el panel A). La tensión de cizallamiento y el grosor neointimal están representados en una escala de color en los paneles B y C, respectivamente.
Grosor neointimal y tensión de cizallamiento
El GN y la TC en los segmentos tratados, incluidos los bordes sin stent, eran de 0,29 ± 0,21 mm y 1,93 Pa, respectivamente. De manera general, el GN tenía un valor superior en los segmentos cubiertos por stent que los bordes (0,29 ± 0,20 frente a 0,14 ± 0,31 mm; p < 0,001). Por otro lado, la TC era significativamente inferior en los segmentos con stent que en los bordes (1,82 ± 1,10 frente a 2,40 ± 2,10 Pa; p < 0,001).
Relación entre proliferación neointimal y tensión de cizallamiento
Considerando todos los casos, se observó una correlación negativa débil entre GN y TC (r = -0,15; p < 0,001). La relación entre estas 2 variables era similar en los segmentos con stent y los bordes, excepto en un caso (tablas 3 y 4). En 5 casos se encontró una correlación negativa significativa entre GN y TC. El GN medio era significativamente menor en los cuartiles inferiores de TC en todos, con excepción de uno de los casos (tabla 5). Sin embargo, en este paciente se registraron valores anormalmente bajos de TC (tabla 5). Agrupando todos los casos, el GN era de 0,34 ± 0,21 mm en el cuartil 1 y de 0,27 ± 0,24 mm en el cuartil 4 de TC (p < 0,0001). El GN en los 4 grupos de TC está representado en la figura 3.
TABLA 4.Correlaciones entre el grosor neointimal y la tensión de cizallamiento. Los datos obtenidos de los segmentos intra-stent y los bordes proximal y distal están analizados por separado
Fig. 3. Distribución del grosor neointimal (eje de las y) según la división en 4 grupos de tensión de cizallamiento (cuartiles) (eje de las x).
Evolución de la tensión de cizallamiento en los segmentos con stent
La TC basal en los segmentos con stent pasó de 2,40 ± 2,06 a 3,43 ± 3,26 Pa. Este cambio en la TC se correlacionó de forma positiva con el GN medido (r = 0,33; p < 0,0001). En la figura 4 se ilustra la relación entre el cambio evolutivo de la TC y el GN dividido en cuartiles. El incremento medio en la TC para el cuartil inferior y superior de GN fue de 0,22 ± 1,80 y 2,14 ± 2,24 Pa, respectivamente (p < 0,001).
Fig. 4. Cambios en la tensión de cizallamiento (calculado como [valor en el seguimiento] [valor basal tras stent]; eje de las y) en diferentes grupos (cuartiles) de grosor neointimal (eje de las x).
DISCUSIÓN
En este estudio se evaluó de forma longitudinal la influencia de la TC en la proliferación neointimal tras el implante de stents intracoronarios en un modelo humano in vivo. El principal hallazgo fue una correlación negativa entre TC y GN en 5 de los 7 casos estudiados. Los valores más bajos de TC se asociaron con un mayor grado de proliferación a los 6 meses. No obstante, la correlación encontrada es escasa y en la formación de la neoíntima contribuyen, seguramente, otros factores más potentes.
Proliferación neointimal tras la implantación de stents: papel de los factores fluidodinámicos
La proliferación de tejido cicatrizal es prácticamente el único mecanismo de pérdida luminal tras la colocación de stents1. El principal disparador de esta respuesta proliferativa es la expansión mecánica de la pared vascular, con la exposición de las estructuras subendoteliales al torrente circulatorio y la activación de una gran respuesta trombótica e inflamatoria4,5. La cantidad de tejido neointimal es proporcional al grado de daño inducido y los factores locales tienen una gran implicación en la respuesta reparadora tras angioplastia2,3. De hecho, la presencia de una estructura metálica en la superficie luminal contribuye al aumento en la respuesta neointimal4,15 e incluso el diseño del stent ejerce una influencia en esta respuesta16-18. Las variables sistémicas, como la resistencia a la insulina y la diabetes19, pueden promover la reestenosis. También se ha indicado una relación entre la reestenosis y determinados polimorfismos genéticos20-22.
En comparación con otros factores locales, la participación de los factores fluidodinámicos en la proliferación neointimal está poco estudiada. La relación entre la TC baja y la progresión de la aterosclerosis puede inferirse por la distribución excéntrica de las placas ateroscleróticas, en general de mayor volumen en la superficie interna de la curva arterial y en el lado opuesto a la divisoria de flujo en las bifurcaciones23,24. La simulación numérica del flujo sanguíneo ha indicado en estudios previos una correlación negativa entre la TC y la progresión de la placa8, aunque esta relación es compleja y está limitada a patrones específicos de remodelado vascular25. Más recientemente, en un modelo experimental de angioplastia, Carlier et al26 demostraron de modo elegante que el implante de múltiples divisores de flujo en el interior de un stent sobredimensionado colocado en arterias ilíacas de conejos puede atenuar el crecimiento neointimal y la respuesta inflamatoria. Estos hallazgos indican que las condiciones hemodinámicas ejercen alguna influencia en la reestenosis intra-stent, aunque no se puede extrapolar directamente estas conclusiones al modelo humano, ya que tiene condiciones de flujo, geometría vascular y grado de respuesta a la lesión muy diferentes.
Wentzel et al11, utilizando un modelo de reconstrucción 3D similar al de este estudio, evaluaron a 14 pacientes con Wallstents implantados en las coronarias nativas. Se demostró una correlación negativa entre TC y GN en 9 casos. Los valores de R variaron entre 0,04 y 0,65 y el coeficiente beta era de 0,08 ± 0,10 mm. Aunque nuestros hallazgos son concordantes con los de Wentzel et al, el impacto de la TC en la proliferación neointimal parece ser menor en el presente estudio. No obstante, es importante considerar algunas diferencias metodológicas entre estos 2 estudios. Los resultados obtenidos con stents autoexpandibles, como el Wallstent, son difícilmente extensibles a los stents expandidos con balón, más utilizados en la práctica. Los stents autoexpandibles producen un grado de respuesta neointimal más intenso, en parte mediado por la expansión tardía continua16,17. La expansión tardía no se tuvo en cuenta en el estudio de Wentzel et al, y los investigadores utilizaron el contorno del stent obtenido en el seguimiento (que en general es considerablemente más grande que el medido justo después del implante), lo que probablemente llevó a subestimar la TC real en la superficie luminal.
De manera más reciente, Stone et al9 estudiaron 6 segmentos coronarios tratados con stents convencionales, también mediante simulación numérica de las condiciones fluidodinámicas y reconstrucción 3D. Las regiones con baja TC eran más propensas a la acumulación de placa y al remodelado excéntrico en los segmentos sin stent, pero no había correlación significativa entre la formación neointimal intra-stent y la TC. De nuevo, hay algunas diferencias metodológicas que pueden explicar las aparentes discrepancias entre el presente estudio y el de Stone et al, como la inclusión de las ramas de la coronaria izquierda, los métodos de estimación del flujo sanguíneo y la segmentación del grosor de placa para el análisis de correlación.
Nuestros hallazgos concuerdan con la hipótesis previa que correlaciona las condiciones de flujo y el crecimiento neointimal tras el implante del stent. Esta relación no parece estar presente con valores fisiológicos o altos de TC. Parece ser exclusiva para las condiciones de baja TC y el patrón observado indica la presencia de un «efecto umbral» de la TC sobre la respuesta proliferativa. Los mecanismos celulares potenciales podrían involucrar la activación de receptores de membrana que fueran sensibles a las condiciones de bajo flujo y que enviarían una señal de activación a mediadores intracelulares para favorecer la creación de tejido neointimal. El efecto último sería la normalización de las condiciones de flujo en la pared vascular a través del crecimiento hacia el interior de la luz arterial. De hecho, en este estudio, la estimación de los valores de TC a lo largo del tiempo muestra un aumento exponencial en aquellas zonas con mayor crecimiento neointimal (fig. 4). Es importante reseñar que en los
2 casos en los que no se encontró correlación alguna entre las condiciones fluidodinámicas basales y la proliferación neointimal se registraron los valores absolutos más altos y más bajos, con pequeñas variaciones a lo largo del stent (casos 1 y 6, respectivamente; tabla 5), lo que a indicar la presencia de un umbral de TC a partir del cual empieza el estímulo a la proliferación de tejido.
Por último, en el presente estudio se pudo analizar el comportamiento de los bordes del stent, zonas en las que con frecuencia aparece una mayor pérdida tras angioplastia. Los resultados indican un papel similar de las variables fluidodinámicas en esta localización, con una correlación negativa débil entre la TC y la pérdida luminal.
Implicaciones
Estos hallazgos refuerzan la recomendación general de obtener una expansión correcta y uniforme de los segmentos tratados con stent. No obstante, las implicaciones de este estudio en cuanto a la reestenosis con los stents farmacoactivos disponibles en la actualidad son inciertas, ya que producen una respuesta neointimal prácticamente despreciable.
Limitaciones
La principal limitación de este estudio tiene relación con el pequeño número de casos incluidos, que está justificado por la gran complejidad del procedimiento global. Sin embargo, el gran número de puntos y el amplio abanico de TC analizados por cada coronaria atemperan esta limitación. Las coronarias estudiadas no tenían una tortuosidad importante o bifurcaciones y, además, el resultado de la angioplastia en cuanto a expansión de los stents se puede considerar adecuado, sin zonas de clara infraexpansión, lo que impide evaluar estas situaciones específicas. Sin embargo, la simulación matemática de la fluidodinámica en un vaso tortuoso es difícil con esta metodología porque la reconstrucción geométrica está basada en la línea central obtenida con el catéter de EIV y la presencia del dispositivo estira la arteria, neutralizando las curvas naturales observadas en la angiografía.
Finalmente, en el presente estudio no se realizó una valoración directa de la velocidad de flujo, lo que impide la estimación de los valores absolutos de TC. No obstante, los cálculos están basados en valores de velocidad comúnmente encontrados en la coronaria derecha y permiten estudiar los cambios de TC ocurridos con el tiempo en la misma arteria.
CONCLUSIONES
El presente estudio indica que la TC y la proliferación neointimal están negativamente correlacionadas. No obstante, la influencia de esta variable fluidodinámica parece ser pequeña y, además, limitada a las condiciones de bajo flujo. Las implicaciones de estos hallazgos en el contexto actual, con la utilización de stents farmacoactivos, son inciertas.
Este trabajo fue financiado en parte por una beca especial de la Sociedad Española de Cardiología.
Correspondencia: Dr. M. Sanmartín Fernández.
Unidad de Cardiología Intervencionista. Medtec. Hospital Meixoeiro.
Meixoeiro, s/n. 36200 Vigo. Pontevedra. España.
Correo electrónico: marcelo.sanmartin.fernandez@sergas.es
Recibido el 12 de julio de 2004.
Aceptado para su publicación el 18 de octubre de 2005.