INTRODUCCIÓN Y OBJETIVOS: La angina preinfarto puede reducir el tamaño de la necrosis miocitaria y mejorar el pronóstico tras el infarto agudo de miocardio. El objetivo de este estudio es analizar la mortalidad total 6 meses después del infarto agudo de miocardio según la presencia o no de angina preinfarto.
MÉTODOS: Se incluyeron prospectivamente 175 pacientes consecutivos con infarto agudo de miocardio, 72 (41,1%) con angina preinfarto. Se realizó el seguimiento durante 6 meses. En el grupo sin angina preinfarto fallecieron en el seguimiento 16 pacientes (15,5%) frente a siete (9,7%) en el grupo con angina preinfarto (log-rank: 1,03; p = 0,311). Las funciones de riesgo de los dos grupos muestran un mayor riesgo de mortalidad a lo largo de todo el seguimiento en el grupo sin angina preinfarto. En el modelo de regresión logística múltiple, la presencia de angina preinfarto no contribuye significativamente a reducir la mortalidad (OR = 0,43; IC del 95% = 0,09-2,22; p = 0,303). Se detecta una interacción significativa entre el consumo de sulfonilureas previo al infarto y la angina preinfarto (p = 0,017).
CONCLUSIÓN: En este estudio no hemos encontrado diferencias significativas en la mortalidad total tras 6 meses de seguimiento después de infarto agudo de miocardio según la presencia o no de angina preinfarto. El riesgo de muerte, sin embargo, parece estar incrementado en los pacientes sin angina preinfarto en todo el período de seguimiento. Existe una interacción significativa entre el consumo de sulfonilureas previo al infarto y la angina preinfarto.
Palabras clave
Angina inestable
Infarto de miocardio
Pronóstico
INTRODUCCIÓN
Diversos estudios han analizado el impacto sobre la mortalidad de la presencia de angina preinfarto (AP) con resultados discordantes. Así, existen estudios publicados que no encuentran diferencias en la mortalidad hospitalaria cuando los pacientes son agrupados según la presencia o no de AP 1, otros que hallan una reducción de la mortalidad hospitalaria en los pacientes con AP 2-5, al menos en los pacientes más jóvenes 6 y otros que encuentran un incremento en la mortalidad hospitalaria si el paciente presenta AP 7. Los trabajos que analizan la mortalidad a medio/largo plazo son más concordantes, observando un incremento acumulado de la mortalidad en los pacientes con AP que iguala 3,8 o supera la de los pacientes sin AP 1,2,7,9.
Este trabajo pretende analizar prospectivamente la mortalidad a medio plazo (6 meses) tras un infarto agudo de miocardio (IAM) en una cohorte de pacientes divididos según la presencia o no de AP. Los resultados del estudio complementan los ya publicados por nuestro grupo sobre el efecto de la AP en el tamaño de la necrosis miocitaria 10. MÉTODOS
La metodología del estudio ya ha sido descrita con anterioridad 10. Brevemente, se diagnosticó IAM cuando el paciente cumplió los siguientes tres requisitos: dolor, molestia u opresión torácica atribuible a isquemia miocárdica de al menos 30 min de duración; cambios en el electrocardiograma sugestivos de isquemia miocárdica aguda (tanto elevación como depresión del segmento ST); elevación en las cifras de creatinfosfocinasa (CK) y de CK-MB al menos dos veces por encima del valor considerado por nuestro laboratorio como normal (195 U/l para la CK y mayor de 20 U/l para la CK-MB). Todos los pacientes fueron interrogados en el momento del ingreso para determinar si presentaron angina inestable antes del infarto. Se definió angina preinfarto como la presencia de dolor, opresión o molestia torácica en reposo en los 7 días previos al infarto. Se analizaron la edad, categorizada en dos grupos ya que no seguía una distribución normal y esta división tiene interés teórico 6, la presencia de factores de riesgo cardiovascular (hipertensión arterial, diabetes mellitus, hipercolesterolemia y consumo de tabaco), la presencia de IAM previo y las intervenciones coronarias previas (angioplastia y cirugía de revascularización), el tratamiento farmacológico que el paciente consumió en los 7 días previos al infarto, el retraso en acudir al hospital, la localización del IAM y el tratamiento administrado, el tamaño del IAM mediante el área bajo la curva de CK-MB en las primeras 24 h según el método de Kloner 4, el mayor grado de Killip alcanzado, las complicaciones mecánicas (comunicación interventricular, rotura de pared libre o regurgitación mitral aguda) y eléctricas (taquiarritmias supraventriculares y ventriculares de al menos 3 latidos y bloqueos auriculoventriculares de segundo o tercer grado). Se categorizó la fracción de eyección (FE) calculada antes del alta en dos categorías: disfunción sistólica significativa (FE ² 0,40) y disfunción ligera o función normal (FE > 0,40). Se contactó con los pacientes dados de alta del hospital a los 3 y 6 meses del infarto, bien mediante entrevista personal o mediante contacto telefónico. El único objetivo final fue determinar la muerte de cualquier causa en un seguimiento de 6 meses, aunque también se analizaron las variables reinfarto, revascularización y reingreso por angina inestable. El grupo total de pacientes fue dividido a posteriori en dos grupos, según hubieran fallecido o no en el período de seguimiento.
Análisis estadístico
Las variables cuantitativas con distribución normal se exponen con la media y entre paréntesis la desviación estándar. Si la distribución no fue normal se presentan con la mediana y entre paréntesis los intercuartiles 25 y 75. Para la comparación de variables cuantitativas continuas se utilizaron tests paramétricos (t de Student), salvo que la variable no siguiera una distribución normal, en cuyo caso se utilizaron tests no paramétricos (U de Mann-Whitney) y para variables cualitativas el test de la c<+f$>2 con la corrección de Welch. Se aplicó el test exacto de Fisher cuando fue necesario. Las curvas de mortalidad se analizaron mediante la curva actuarial y su función de riesgo (dividiendo el período de seguimiento en intervalos de un mes) o mediante las curvas de Kaplan-Meier. La comparación entre curvas se realizó mediante el test de Mantel-Haenszel (tests de log-rank). Se construyó un modelo de regresión logística con la variable «muerte» como dependiente y con la variable «angina preinfarto» como independiente (no se utilizó el modelo de riesgos proporcionales de Cox porque el riesgo de muerte no es constante a lo largo de todo el seguimiento) (fig. 1). Si alguna de las variables no seguía una distribución normal se realizó una transformación logarítmica y se comprobó de nuevo que su distribución se ajustaba a una curva normal. Se creó un modelo máximo con las variables de confusión e interacción, evaluando primero estas últimas según si su contribución al modelo era o no significativa, y posteriormente las variables de confusión. Las variables de interacción analizadas fueron las ya descritas en la bibliografía: AP con edad 6, tratamiento fibrinolítico 2,11 y consumo de sulfonilureas 10,12-14. Se aplicó el principio jerárquico de Bishop 15 y se evitó la colinealidad entre variables independientes. Se consideró que existía significación estadística cuando la p era menor de 0,05. Se utilizó el paquete estadístico SPSS 9.0 16.
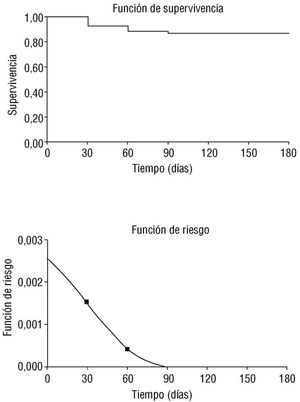
Fig. 1. Curva actuarial de supervivencia y función de riesgo del grupo total.
RESULTADOS
Se incluyeron prospectivamente 179 pacientes, 104 sin AP (58,1%) y 75 (41,9%) en el grupo con AP. Se perdió el seguimiento de 4 pacientes (2,2%), con lo que se analizaron finalmente 175. Durante los 6 meses de seguimiento, 23 pacientes (13,1%) fallecieron, 16 en el grupo sin AP (15,5%) y siete (9,7%) en el grupo con AP. En la figura 1 se exponen la curva actuarial de supervivencia y la curva de función de riesgo para el grupo total. Obsérvese cómo el riesgo de muerte decrece a medida que el tiempo transcurre desde el IAM, para hacerse prácticamente nulo a partir del tercer mes.
Los pacientes que fallecen en el seguimiento son de mayor edad, con más prevalencia de IAM previo y en una mayor proporción, aunque no significativa, del sexo femenino (tabla 1). El hecho de tener un mayor número de infartos previos podría explicar el mayor consumo de antiagregantes y anticoagulantes antes del IAM (tabla 2). En la tabla 3 se exponen las características del IAM. Aunque el porcentaje de pacientes con IAM anterior no difiere entre los dos grupos, sí son diferentes el tamaño del IAM y la concentración de fibrinógeno en el momento del ingreso, que son mayores en el grupo de fallecidos. También se encontraron diferencias en el tratamiento administrado desde el ingreso hasta las 24 h posteriores (tabla 4), con un significativo menor uso de β-bloqueantes en el grupo de fallecidos y un uso significativamente superior de digoxina, inhibidores de la enzima conversiva de la angiotensina II, amiodarona, diuréticos y aminas simpaticomiméticas. Tanto la incidencia de complicaciones mecánicas (el 2,0 frente al 17,4%; p = 0,006) como eléctricas (el 15,1 frente al 65,2%; p = 0,000) es significativamente superior en los pacientes que mueren en el seguimiento, así como la presencia de un grado de Killip > 1 (el 23,0 frente al 60,9%; p = 0,001) o la presencia de disfunción ventricular izquierda (el 18,8 frente al 63,2%; p = 0,0001).
Durante el seguimiento se encontró una incidencia superior de reinfarto en el grupo de pacientes que fallecieron, aunque no llegó a ser significativa (el 1,3 frente al 8,7%; p = 0,084). No se hallaron diferencias en la tasa de hospitalización por angina inestable (el 9,2 frente al 4,3%; p = 0,696) o en la realización de cualquier procedimiento de revascularización (el 19,7 frente al 17,4%; p = 1,000).
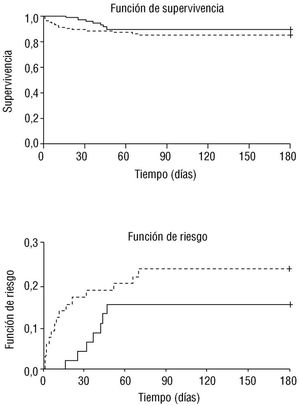
En la figura 2 se observan las curvas de supervivencia y funciones de riesgo, según la presencia o no de AP. No se encuentran diferencias significativas (log-rank: 1,03; p = 0,311). Sin embargo, obsérvese que el riesgo de fallecer es superior en los pacientes sin AP, especialmente en los primeros 45 días postinfarto, para después estabilizarse.
Fig. 2. Curvas de supervivencia y funciones de riesgo de los pacientes según la presencia (línea continua) o no (línea discontinua) de angina preinfarto. Log-rank = 1,03; p = 0,311.
Dado que muchas de las variables en las que difieren los dos grupos están relacionadas entre sí, se realizó un análisis de regresión logística multivariante con la variable dependiente «muerte» (véase el apartado «Métodos»). Los resultados se exponen en la tabla 5. Aunque la presencia de AP parece que tiende a reducir el riesgo de mortalidad, no es significativa. El consumo de tabaco reduce significativamente el riesgo de muerte en el seguimiento. Sin embargo, un mayor tamaño del IAM, un mayor grado de Killip, la existencia de arritmias en la fase aguda y la presencia de reinfarto en el seguimiento incrementan de forma significativa el riesgo de muerte. Se ha encontrado una significativa interacción entre el consumo de sulfonilureas antes del IAM y la AP (p = 0,017).
DISCUSIÓN
Los resultados de este estudio están, globalmente, en concordancia con otros publicados, en los que se demuestra que la presencia de AP induce una menor mortalidad precoz 2-6, sin modificar de manera significativa la mortalidad a medio/largo plazo 1,2,3,7-9. Analizar la influencia de la AP en la mortalidad no es tarea fácil. Una de las limitaciones más importantes es la propia definición y el tiempo en que la angina previa se considera como preinfarto. En los trabajos publicados que analizan mortalidad, este tiempo varía desde más de 7 días 3, en los 7 días previos al comienzo del IAM 2,6 o tan precoz como 24 h 17. Esto puede influir en la evaluación del pronóstico, pues se ha descrito que solamente los episodios anginosos cercanos al inicio del IAM pueden tener un efecto beneficioso 18. A esto hay que añadir que es posible que el efecto de la AP sea gradual, es decir, sean necesarios varios episodios isquémicos para que se manifieste el beneficio 19. También episodios de isquemia silente previos al comienzo del IAM podrían tener un efecto beneficioso al preacondicionar el miocardio. En el momento actual, detectar a posteriori qué enfermos con IAM han tenido episodios de isquemia silente previos es imposible. Por tanto, bien pudiera ocurrir que pacientes que han tenido episodios de isquemia sin angina fueran clasificados en el grupo de pacientes sin AP. Al contrario, pacientes con dolor torácico no coronario antes del IAM podrían ser clasificados en el grupo de AP. Esto conduce a un evidente sesgo en el análisis de la mortalidad, especialmente en el grupo de pacientes ancianos, en el que las características del dolor pueden ser muy atípicas 20.
La isquemia transitoria preinfarto puede, en teoría, inducir una mejoría en la función ventricular al retrasar la muerte celular en episodios isquémicos posteriores más prolongados, lo cual podría inducir una mejoría en el pronóstico. Sin embargo, esta secuencia lógica de acontecimientos puede verse truncada por muchos factores intermedios que pueden influir de manera directa en la necrosis miocitaria, la función ventricular y el pronóstico (entre otros, la tasa de reperfusión/recolusión conseguida, el daño mediado por la reperfusión, la cantidad de miocardio viable existente, etc.). El conjunto de estos factores puede explicar el porqué, según cómo sea analizada, la AP puede no influir en el curso del IAM, aun cuando en determinados grupos de pacientes pudiera inducir un retraso en la necrosis celular. Evidentemente, este estudio no está diseñado para analizar todos y cada uno de estos factores que pueden limitar o incrementar la necrosis celular e influir de manera indirecta en el pronóstico. Es posible incluso, que la angina que antecede al infarto puede tener un efecto deletéreo, como sugiere un reciente estudio publicado en un modelo animal 21.
A pesar de que en un período de seguimiento de 6 meses no hemos encontrado diferencias en la mortalidad total según la presencia de AP, sí parece deducirse de las gráficas de riesgo que el riesgo de muerte es mayor en el grupo sin AP, sea cual sea el momento en que se analice, y que este riesgo va incrementándose hasta alcanzar un nivel estable. Sin embargo, el análisis multivariante pone de manifiesto que esta diferencia no puede explicarse por la presencia o no de AP. No debemos olvidar que las dos poblaciones (pacientes con y sin AP) no son equivalentes. Los pacientes con AP tienen un perfil de factores de riesgo cardiovascular distinto, con mayor prevalencia de infarto previo 3,4,6, diabetes mellitus 3,4,7,8,22, hipercolesterolemia 3,17, hipertensión arterial 7,8,17,22, tienen una edad más avanzada 1,7,8, existe un mayor número de consumidores de tabaco 8,22 y la «localización» del infarto es diferente 1,7,8. Además, se ha descrito una mayor prevalencia de enfermedad multivaso en el grupo de pacientes con AP 3,4,8. En el grupo analizado en este estudio, y estudiando las características basales 10, encontramos que los pacientes con AP tendían a ser más jóvenes, con una proporción significativamente mayor de varones y una mayor prevalencia de ex fumadores. No se encontraron diferencias significativas en el resto de factores de riesgo cardiovascular. Ninguna de estas variables aparece en el análisis multivariante contribuyendo significativamente a la mortalidad a los 6 meses. No se realizó coronariografía de rutina a los pacientes incluidos en este estudio, por lo que se desconoce el porcentaje real de afectación multivaso. Sin embargo, no se encontraron diferencias significativas en la incidencia de revascularización en el seguimiento 10.
Merece una mención especial la significativa interacción en el análisis multivariante de la mortalidad encontrada entre el consumo preinfarto de sulfonilureas y la AP. Las sulfonilureas, fármacos utilizados habitualmente para el control de la glucemia en pacientes diabéticos, actúan bloqueando los canales de K +-ATPasa dependientes que han sido propuestos como efectores finales en el proceso del preacondicionamiento isquémico 23. Se ha descrito que las sulfonilureas pueden impedir el preacondicionamiento isquémico 12,14,24, aunque pueden existir diferencias entre ellas 13. La molécula propuesta para activar estos canales sería la adenosina, aunque en fases iniciales de isquemia pudiera ser la bradicinina 19. En algunos estudios, sin embargo, la adenosina no parece preacondicionar el miocardio 25, lo que sugiere que hay otra moléculas implicadas en el proceso, que puede haber una interacción con otros canales iónicos 26 o que hay otros efectores finales 27. Sea cual fuere el mecanismo, este estudio y el previo publicado 10 son los primeros en encontrar en la práctica clínica ordinaria una interacción significativa entre el consumo de estos fármacos y la AP. De esta manera, el efecto de la AP depende de si el paciente consume sulfonilureas en el momento de los episodios isquémicos transitorios o en el momento del IAM. Los pacientes que han tenido una angina preinfarto y consumen sulfonilureas tienen una mayor probabilidad de muerte en el seguimiento. Son necesarios, sin embargo, más estudios para definir exactamente cuál es la magnitud de este fenómeno, pues sólo 14 pacientes consumían sulfonilureas, lo que da un amplísimo intervalo de confianza para la interacción. Por tanto, el hecho de que no sea un estudio controlado, junto con el reducido número de pacientes que consumen sulfonilureas antes del IAM, impide extraer una conclusión definitiva acerca de esta interesante interacción. CONCLUSIÓN
En este estudio no hemos encontrado diferencias significativas en la mortalidad total después de 6 meses de seguimiento tras IAM, según la presencia o no de AP. El riesgo de muerte, sin embargo, parece estar incrementado en los pacientes sin AP en todo el período de seguimiento. Existe una interacción significativa entre el consumo de sulfonilureas previo al IAM y la AP cuando se analiza la mortalidad a medio plazo.
Diversos estudios han analizado el impacto sobre la mortalidad de la presencia de angina preinfarto (AP) con resultados discordantes. Así, existen estudios publicados que no encuentran diferencias en la mortalidad hospitalaria cuando los pacientes son agrupados según la presencia o no de AP 1, otros que hallan una reducción de la mortalidad hospitalaria en los pacientes con AP 2-5, al menos en los pacientes más jóvenes 6 y otros que encuentran un incremento en la mortalidad hospitalaria si el paciente presenta AP 7. Los trabajos que analizan la mortalidad a medio/largo plazo son más concordantes, observando un incremento acumulado de la mortalidad en los pacientes con AP que iguala 3,8 o supera la de los pacientes sin AP 1,2,7,9.
Este trabajo pretende analizar prospectivamente la mortalidad a medio plazo (6 meses) tras un infarto agudo de miocardio (IAM) en una cohorte de pacientes divididos según la presencia o no de AP. Los resultados del estudio complementan los ya publicados por nuestro grupo sobre el efecto de la AP en el tamaño de la necrosis miocitaria 10. MÉTODOS
La metodología del estudio ya ha sido descrita con anterioridad 10. Brevemente, se diagnosticó IAM cuando el paciente cumplió los siguientes tres requisitos: dolor, molestia u opresión torácica atribuible a isquemia miocárdica de al menos 30 min de duración; cambios en el electrocardiograma sugestivos de isquemia miocárdica aguda (tanto elevación como depresión del segmento ST); elevación en las cifras de creatinfosfocinasa (CK) y de CK-MB al menos dos veces por encima del valor considerado por nuestro laboratorio como normal (195 U/l para la CK y mayor de 20 U/l para la CK-MB). Todos los pacientes fueron interrogados en el momento del ingreso para determinar si presentaron angina inestable antes del infarto. Se definió angina preinfarto como la presencia de dolor, opresión o molestia torácica en reposo en los 7 días previos al infarto. Se analizaron la edad, categorizada en dos grupos ya que no seguía una distribución normal y esta división tiene interés teórico 6, la presencia de factores de riesgo cardiovascular (hipertensión arterial, diabetes mellitus, hipercolesterolemia y consumo de tabaco), la presencia de IAM previo y las intervenciones coronarias previas (angioplastia y cirugía de revascularización), el tratamiento farmacológico que el paciente consumió en los 7 días previos al infarto, el retraso en acudir al hospital, la localización del IAM y el tratamiento administrado, el tamaño del IAM mediante el área bajo la curva de CK-MB en las primeras 24 h según el método de Kloner 4, el mayor grado de Killip alcanzado, las complicaciones mecánicas (comunicación interventricular, rotura de pared libre o regurgitación mitral aguda) y eléctricas (taquiarritmias supraventriculares y ventriculares de al menos 3 latidos y bloqueos auriculoventriculares de segundo o tercer grado). Se categorizó la fracción de eyección (FE) calculada antes del alta en dos categorías: disfunción sistólica significativa (FE ² 0,40) y disfunción ligera o función normal (FE > 0,40). Se contactó con los pacientes dados de alta del hospital a los 3 y 6 meses del infarto, bien mediante entrevista personal o mediante contacto telefónico. El único objetivo final fue determinar la muerte de cualquier causa en un seguimiento de 6 meses, aunque también se analizaron las variables reinfarto, revascularización y reingreso por angina inestable. El grupo total de pacientes fue dividido a posteriori en dos grupos, según hubieran fallecido o no en el período de seguimiento.
Análisis estadístico
Las variables cuantitativas con distribución normal se exponen con la media y entre paréntesis la desviación estándar. Si la distribución no fue normal se presentan con la mediana y entre paréntesis los intercuartiles 25 y 75. Para la comparación de variables cuantitativas continuas se utilizaron tests paramétricos (t de Student), salvo que la variable no siguiera una distribución normal, en cuyo caso se utilizaron tests no paramétricos (U de Mann-Whitney) y para variables cualitativas el test de la c<+f$>2 con la corrección de Welch. Se aplicó el test exacto de Fisher cuando fue necesario. Las curvas de mortalidad se analizaron mediante la curva actuarial y su función de riesgo (dividiendo el período de seguimiento en intervalos de un mes) o mediante las curvas de Kaplan-Meier. La comparación entre curvas se realizó mediante el test de Mantel-Haenszel (tests de log-rank). Se construyó un modelo de regresión logística con la variable «muerte» como dependiente y con la variable «angina preinfarto» como independiente (no se utilizó el modelo de riesgos proporcionales de Cox porque el riesgo de muerte no es constante a lo largo de todo el seguimiento) (fig. 1). Si alguna de las variables no seguía una distribución normal se realizó una transformación logarítmica y se comprobó de nuevo que su distribución se ajustaba a una curva normal. Se creó un modelo máximo con las variables de confusión e interacción, evaluando primero estas últimas según si su contribución al modelo era o no significativa, y posteriormente las variables de confusión. Las variables de interacción analizadas fueron las ya descritas en la bibliografía: AP con edad 6, tratamiento fibrinolítico 2,11 y consumo de sulfonilureas 10,12-14. Se aplicó el principio jerárquico de Bishop 15 y se evitó la colinealidad entre variables independientes. Se consideró que existía significación estadística cuando la p era menor de 0,05. Se utilizó el paquete estadístico SPSS 9.0 16.
Fig. 1. Curva actuarial de supervivencia y función de riesgo del grupo total.
RESULTADOS
Se incluyeron prospectivamente 179 pacientes, 104 sin AP (58,1%) y 75 (41,9%) en el grupo con AP. Se perdió el seguimiento de 4 pacientes (2,2%), con lo que se analizaron finalmente 175. Durante los 6 meses de seguimiento, 23 pacientes (13,1%) fallecieron, 16 en el grupo sin AP (15,5%) y siete (9,7%) en el grupo con AP. En la figura 1 se exponen la curva actuarial de supervivencia y la curva de función de riesgo para el grupo total. Obsérvese cómo el riesgo de muerte decrece a medida que el tiempo transcurre desde el IAM, para hacerse prácticamente nulo a partir del tercer mes.
Los pacientes que fallecen en el seguimiento son de mayor edad, con más prevalencia de IAM previo y en una mayor proporción, aunque no significativa, del sexo femenino (tabla 1). El hecho de tener un mayor número de infartos previos podría explicar el mayor consumo de antiagregantes y anticoagulantes antes del IAM (tabla 2). En la tabla 3 se exponen las características del IAM. Aunque el porcentaje de pacientes con IAM anterior no difiere entre los dos grupos, sí son diferentes el tamaño del IAM y la concentración de fibrinógeno en el momento del ingreso, que son mayores en el grupo de fallecidos. También se encontraron diferencias en el tratamiento administrado desde el ingreso hasta las 24 h posteriores (tabla 4), con un significativo menor uso de β-bloqueantes en el grupo de fallecidos y un uso significativamente superior de digoxina, inhibidores de la enzima conversiva de la angiotensina II, amiodarona, diuréticos y aminas simpaticomiméticas. Tanto la incidencia de complicaciones mecánicas (el 2,0 frente al 17,4%; p = 0,006) como eléctricas (el 15,1 frente al 65,2%; p = 0,000) es significativamente superior en los pacientes que mueren en el seguimiento, así como la presencia de un grado de Killip > 1 (el 23,0 frente al 60,9%; p = 0,001) o la presencia de disfunción ventricular izquierda (el 18,8 frente al 63,2%; p = 0,0001).
Durante el seguimiento se encontró una incidencia superior de reinfarto en el grupo de pacientes que fallecieron, aunque no llegó a ser significativa (el 1,3 frente al 8,7%; p = 0,084). No se hallaron diferencias en la tasa de hospitalización por angina inestable (el 9,2 frente al 4,3%; p = 0,696) o en la realización de cualquier procedimiento de revascularización (el 19,7 frente al 17,4%; p = 1,000).
En la figura 2 se observan las curvas de supervivencia y funciones de riesgo, según la presencia o no de AP. No se encuentran diferencias significativas (log-rank: 1,03; p = 0,311). Sin embargo, obsérvese que el riesgo de fallecer es superior en los pacientes sin AP, especialmente en los primeros 45 días postinfarto, para después estabilizarse.
Fig. 2. Curvas de supervivencia y funciones de riesgo de los pacientes según la presencia (línea continua) o no (línea discontinua) de angina preinfarto. Log-rank = 1,03; p = 0,311.
Dado que muchas de las variables en las que difieren los dos grupos están relacionadas entre sí, se realizó un análisis de regresión logística multivariante con la variable dependiente «muerte» (véase el apartado «Métodos»). Los resultados se exponen en la tabla 5. Aunque la presencia de AP parece que tiende a reducir el riesgo de mortalidad, no es significativa. El consumo de tabaco reduce significativamente el riesgo de muerte en el seguimiento. Sin embargo, un mayor tamaño del IAM, un mayor grado de Killip, la existencia de arritmias en la fase aguda y la presencia de reinfarto en el seguimiento incrementan de forma significativa el riesgo de muerte. Se ha encontrado una significativa interacción entre el consumo de sulfonilureas antes del IAM y la AP (p = 0,017).
DISCUSIÓN
Los resultados de este estudio están, globalmente, en concordancia con otros publicados, en los que se demuestra que la presencia de AP induce una menor mortalidad precoz 2-6, sin modificar de manera significativa la mortalidad a medio/largo plazo 1,2,3,7-9. Analizar la influencia de la AP en la mortalidad no es tarea fácil. Una de las limitaciones más importantes es la propia definición y el tiempo en que la angina previa se considera como preinfarto. En los trabajos publicados que analizan mortalidad, este tiempo varía desde más de 7 días 3, en los 7 días previos al comienzo del IAM 2,6 o tan precoz como 24 h 17. Esto puede influir en la evaluación del pronóstico, pues se ha descrito que solamente los episodios anginosos cercanos al inicio del IAM pueden tener un efecto beneficioso 18. A esto hay que añadir que es posible que el efecto de la AP sea gradual, es decir, sean necesarios varios episodios isquémicos para que se manifieste el beneficio 19. También episodios de isquemia silente previos al comienzo del IAM podrían tener un efecto beneficioso al preacondicionar el miocardio. En el momento actual, detectar a posteriori qué enfermos con IAM han tenido episodios de isquemia silente previos es imposible. Por tanto, bien pudiera ocurrir que pacientes que han tenido episodios de isquemia sin angina fueran clasificados en el grupo de pacientes sin AP. Al contrario, pacientes con dolor torácico no coronario antes del IAM podrían ser clasificados en el grupo de AP. Esto conduce a un evidente sesgo en el análisis de la mortalidad, especialmente en el grupo de pacientes ancianos, en el que las características del dolor pueden ser muy atípicas 20.
La isquemia transitoria preinfarto puede, en teoría, inducir una mejoría en la función ventricular al retrasar la muerte celular en episodios isquémicos posteriores más prolongados, lo cual podría inducir una mejoría en el pronóstico. Sin embargo, esta secuencia lógica de acontecimientos puede verse truncada por muchos factores intermedios que pueden influir de manera directa en la necrosis miocitaria, la función ventricular y el pronóstico (entre otros, la tasa de reperfusión/recolusión conseguida, el daño mediado por la reperfusión, la cantidad de miocardio viable existente, etc.). El conjunto de estos factores puede explicar el porqué, según cómo sea analizada, la AP puede no influir en el curso del IAM, aun cuando en determinados grupos de pacientes pudiera inducir un retraso en la necrosis celular. Evidentemente, este estudio no está diseñado para analizar todos y cada uno de estos factores que pueden limitar o incrementar la necrosis celular e influir de manera indirecta en el pronóstico. Es posible incluso, que la angina que antecede al infarto puede tener un efecto deletéreo, como sugiere un reciente estudio publicado en un modelo animal 21.
A pesar de que en un período de seguimiento de 6 meses no hemos encontrado diferencias en la mortalidad total según la presencia de AP, sí parece deducirse de las gráficas de riesgo que el riesgo de muerte es mayor en el grupo sin AP, sea cual sea el momento en que se analice, y que este riesgo va incrementándose hasta alcanzar un nivel estable. Sin embargo, el análisis multivariante pone de manifiesto que esta diferencia no puede explicarse por la presencia o no de AP. No debemos olvidar que las dos poblaciones (pacientes con y sin AP) no son equivalentes. Los pacientes con AP tienen un perfil de factores de riesgo cardiovascular distinto, con mayor prevalencia de infarto previo 3,4,6, diabetes mellitus 3,4,7,8,22, hipercolesterolemia 3,17, hipertensión arterial 7,8,17,22, tienen una edad más avanzada 1,7,8, existe un mayor número de consumidores de tabaco 8,22 y la «localización» del infarto es diferente 1,7,8. Además, se ha descrito una mayor prevalencia de enfermedad multivaso en el grupo de pacientes con AP 3,4,8. En el grupo analizado en este estudio, y estudiando las características basales 10, encontramos que los pacientes con AP tendían a ser más jóvenes, con una proporción significativamente mayor de varones y una mayor prevalencia de ex fumadores. No se encontraron diferencias significativas en el resto de factores de riesgo cardiovascular. Ninguna de estas variables aparece en el análisis multivariante contribuyendo significativamente a la mortalidad a los 6 meses. No se realizó coronariografía de rutina a los pacientes incluidos en este estudio, por lo que se desconoce el porcentaje real de afectación multivaso. Sin embargo, no se encontraron diferencias significativas en la incidencia de revascularización en el seguimiento 10.
Merece una mención especial la significativa interacción en el análisis multivariante de la mortalidad encontrada entre el consumo preinfarto de sulfonilureas y la AP. Las sulfonilureas, fármacos utilizados habitualmente para el control de la glucemia en pacientes diabéticos, actúan bloqueando los canales de K +-ATPasa dependientes que han sido propuestos como efectores finales en el proceso del preacondicionamiento isquémico 23. Se ha descrito que las sulfonilureas pueden impedir el preacondicionamiento isquémico 12,14,24, aunque pueden existir diferencias entre ellas 13. La molécula propuesta para activar estos canales sería la adenosina, aunque en fases iniciales de isquemia pudiera ser la bradicinina 19. En algunos estudios, sin embargo, la adenosina no parece preacondicionar el miocardio 25, lo que sugiere que hay otra moléculas implicadas en el proceso, que puede haber una interacción con otros canales iónicos 26 o que hay otros efectores finales 27. Sea cual fuere el mecanismo, este estudio y el previo publicado 10 son los primeros en encontrar en la práctica clínica ordinaria una interacción significativa entre el consumo de estos fármacos y la AP. De esta manera, el efecto de la AP depende de si el paciente consume sulfonilureas en el momento de los episodios isquémicos transitorios o en el momento del IAM. Los pacientes que han tenido una angina preinfarto y consumen sulfonilureas tienen una mayor probabilidad de muerte en el seguimiento. Son necesarios, sin embargo, más estudios para definir exactamente cuál es la magnitud de este fenómeno, pues sólo 14 pacientes consumían sulfonilureas, lo que da un amplísimo intervalo de confianza para la interacción. Por tanto, el hecho de que no sea un estudio controlado, junto con el reducido número de pacientes que consumen sulfonilureas antes del IAM, impide extraer una conclusión definitiva acerca de esta interesante interacción. CONCLUSIÓN
En este estudio no hemos encontrado diferencias significativas en la mortalidad total después de 6 meses de seguimiento tras IAM, según la presencia o no de AP. El riesgo de muerte, sin embargo, parece estar incrementado en los pacientes sin AP en todo el período de seguimiento. Existe una interacción significativa entre el consumo de sulfonilureas previo al IAM y la AP cuando se analiza la mortalidad a medio plazo.
Bibliografía
[1]
Prognostic significance of angina pectoris before first acute myocardial infarction. Am J Cardiol 1988; 61: 984-987.
[2]
Implications of prodromal angina pectoris in anterior wall acute myocardial infarction: acute angiographic findings and long-term prognosis. J Am Coll Cardiol 1997; 30: 970-975.
[3]
Relationship between antecedent angina pectoris and short-term prognosis after thrombolytic therapy for acute myocardial infarction. Am Heart J 1990; 119: 224-231.
[4]
Previous angina alters in-hospital outcome in TIMI 4. A clinical correlate to preconditioning? Circulation 1995; 91: 37-47.
[5]
Effect of short-term prognosis and left ventricular function of angina pectoris prior to first Q-wave anterior wall myocardial infarction. Am J Cardiol 1994; 74: 755-759.
[6]
Angina-induced protection against infarction in adult and elderly patients: a loss of preconditioning mechanism in the aging heart? J Am Coll Cardiol 1997; 30: 947-954.
[7]
The prognostic significance of angina pectoris preceding the occurrence of a first acute myocardial infarction in 4166 consecutive hospitalized patients. Am Heart J 1992; 123: 1481-1486.
[8]
Invasive versus conservative strategy after thrombolytic therapy for acute myocardial infarction in patients with antecedent angina. A report from the Thrombolysis in Myocardial Infarction Phase II (TIMI II). J Am Coll Cardiol 1992; 20: 1445-1451.
[9]
Preexisting cardiovascular conditions and long-term prognosis after initial myocardial infarction: the Framingham Study. Am Heart J 1993; 125: 863-872.
[10]
Efecto de la angina inestable preinfarto en el tamaño de la necrosis miocárdica. Rev Esp Cardiol 2000; 53: 43-48.
[11]
Preinfarction angina as a predictor of more rapid coronary thrombolysis in patients with acute myocardial infarction. N Engl J Med 1996; 334: 7-12.
[12]
Ischemic preconditioning during coronary angioplasty is prevented by glibenclamide, a selective ATP-sensitive K
[13]
Sulfonylureas and ischaemic preconditioning. A double-blind, placebo-controlled evaluation of glimepiride and glibenclamide. Eur Heart J 199; 20: 439-446.
[14]
Effects of K-ATP channel blockade by glibenclamide on the warm-up phenomenon. Eur Heart J 1999; 20: 196-202.
[15]
Discrete multivariate analysis: theory and practice. Cambridge, MA: MIT Press, 1975.
[16]
0. Applications guide. Chicago: SPSS Inc., 1999.
[17]
Prospective temporal analysis of the onset of preinfarction angina versus outcome. An ancillary study in TIMI 9B. Circulation 1998; 97: 1042-1045.
[18]
Ischemic preconditioning in unstable coronary syndromes: evidence for time dependence. J Am Coll Cardiol 1997; 30: 1461-1465.
[19]
Ischemic preconditioning in pigs: a graded phenomenon. Its relation to adenosine and bradykinin. Circulation 1998; 98: 1022-1029.
[20]
Changing presentation of myocardial infarction with increasing old age. J Am Geriatr Soc 1986; 34: 263-266.
[21]
Precondicionamiento isquémico. ¿Es siempre un fenómeno beneficioso? Rev Esp Cardiol 1999; 52: 429-436.
[22]
Antecedent angina pectoris predicts worse outcome after myocardial infarction in patients receiving thrombolytic therapy: experience gleaned from the International Tissue Plasminogen Activator/Streptokinase mortality trial. J Am Coll Cardiol 1992; 20: 36-41.
[23]
Intravenous nicorandil can preserve microvascular integrity and myocardial viability in patients with reperfused anterior wall myocardial infarction. J Am Coll Cardiol 1999; 33: 654-660.
[24]
Oral sulfonylurea hypoglycemic agents prevent ischemic preconditioning in human myocardium. Two paradoxes revisited. Circulation 1997; 96: 29-32.
[25]
Is the development of myocardial tolerance to repeated ischemia in humans due to preconditioning or to collateral recruitment? J Am Coll Cardiol 1999; 33: 1027-1035.
[26]
Coordinate interaction between ATP-sensitive K
[27]
Fostriecin, an inhibitor of protein phosphatase 2», limits myocardial infarct size even when administered after onset of ischemia. Circulation 1998; 98: 899-905.