Recientemente se ha publicado un brote internacional de infecciones por Mycobacterium chimaera tras cirugía cardiaca, en el que se ha documentado la transmisión de las bacterias a través de aerosol desde unidades de frío-calor (UFC) utilizadas durante la cirugía cardiopulmonar1. Se describe un caso de endocarditis por M. chimaera sobre válvula protésica aórtica.
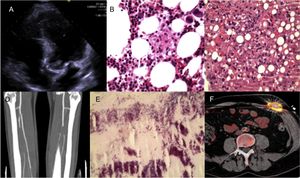
Varón de 51 años que ingresó en diciembre de 2011 por dolor abdominal, fiebre, hepatomegalia y pérdida ponderal en 3 meses. Se lo había tratado 6 meses antes con sustitución de válvula aórtica con prótesis biológica Mitroflow por estenosis grave e inserción de marcapasos DDD por bloqueo auriculoventricular tras la cirugía. La analítica inicial reveló pancitopenia leve y una alteración en las enzimas hepáticas (aspartato aminotransferasa, 412 U/l; alanina aminotransferasa, 389 U/l; fosfatasa alcalina, 779 U/l; gammaglutamil transferasa, 460 U/l; bilirrubina total, 2,5 mg/dl). Un ecocardiograma transesofágico mostró una vegetación de 17 × 10 mm anclada en la comisura sigmoidea no coronariana de la válvula aórtica (figura A). Se realizaron biopsias hepática y de médula ósea, en las que se observaron granulomas amorfos e imágenes que apuntaban a hemofagocitosis en la tinción de hematoxilina-eosina (figura B y C). En ambas muestras se identificó M. chimaera por reacción en cadena de polimerasa y posteriormente cultivo, por lo que se inició tratamiento antibiótico con rifampicina, etambultol, claritromicina y amikacina. El paciente necesitó tratamiento inmunosupresor (etopósido, ciclosporina y dexametasona) para controlar el síndrome hemofagocítico (SHF), que se resolvió semanas más tarde. Dos semanas después sufrió una oclusión de la arteria tibioperonea por embolia (figura D), en la que se identificó de nuevo M. chimaera (figura E). En febrero de 2012, se intervino al paciente de Bentall de Bono con sustitución de la bioprótesis por una prótesis Sorin ART 21 LFA y sustitución del marcapasos endocavitario por otro epicárdico ESPRIT DR. En enero de 2013 se tuvo que sustituir el tubo valvulado aórtico por un homoinjerto de 21 mm por dehiscencia secundaria a infección no controlada. En agosto de 2013 sufrió un ictus isquémico, y fue visible una nueva vegetación aórtica. En octubre de 2015, 2 años tras la última complicación, se retiró la medicación. En enero de 2017 se recambió el generador del marcapasos epicárdico por agotamiento de la batería. La herida quirúrgica del reimplante del generador presentó exudación y falta de cicatrización. Los cultivos convencionales fueron negativos, y finalmente se identificó M. chimaera a partir de crecimiento en medios específicos. Se reinició el tratamiento antibiótico con azitromicina, rifabutina y moxifloxacino. Una tomografía por emisión de positrones combinada con tomografía computarizada mostró actividad metabólica anómala únicamente en el marcapasos (figura F). La ausencia de otros focos metabólicos en la exploración apuntaba la posibilidad de curación completa de la infección tras el recambio del sistema infectado por otro endocavitario. El paciente aún sigue en tratamiento.
Endocarditis aórtica protésica por Mycobacterium chimaera complicada con síndrome hemofagocítico. A: vegetación aórtica en la comisura sigmoidea no coronariana. B: hemofagocitosis observada mediante tinción con hematoxilina-eosina de biopsia de médula ósea. C: granulomas hepáticos visibles mediante hematoxilina-eosina de biopsia hepática. D: oclusión de la arteria tibioperonea, visible por angiografía. E: bacilos resistentes a ácido-alcohol en hematoxilina-eosina de embolia tibioperonea. F: imagen de tomografía por emisión de positrones.
En 2015 se diagnosticó otro caso de endocarditis por M. chimaera en el centro donde se le intervino por primera vez. Se tomaron muestras de las UFC (LivaNova PLC, antiguamente grupo Sorin Group Deutschland GmbH) y muestras ambientales. El estudio realizado mediante hibridación inversa con Geno Type NTM-DR (Hain Lifescience Spain S.L.) identificó M. chimaera en las muestras de agua de las UFC y de un grifo situado fuera de los quirófanos. Estudios moleculares (RAPD-RFLP con IS986 y ERIC PCR) mostraron una relación filogenética entre las cepas de ambos casos.
Este caso es inusual por 3 motivos: el primero es la presentación atípica con SHF, ya que hasta la fecha se han descrito pocos casos en infecciones causadas por micobacterias de crecimiento lento2; en segundo lugar, el difícil tratamiento simultáneo de la infección y el SHF pues, aunque se trató según el antibiograma, esta técnica no está estandarizada para micobacterias atípicas y el tratamiento inmunosupresor tiene un efecto negativo en el control de la infección; finalmente, es el primer caso diagnosticado en España perteneciente al brote internacional de infecciones por M. chimaera tras cirugía cardiaca. En los últimos 2 años, se han descrito casos en muchos otros países, y se esperan nuevos diagnósticos1,3. Se ha considerado el uso de UFC contaminadas durante la cirugía de sustitución valvular como el posible foco de infección. La alta correlación del ADN de M. chimaera obtenido de pacientes, de las UFC de diferentes países y de muestras ambientales en el lugar de producción4 respalda la hipótesis de contaminación en origen de las UFC del grupo Sorin5. No se puede descartar el riesgo añadido de contaminación ambiental. La larga latencia de estas infecciones apunta a M. chimaera como motivo persistente de preocupación mundial.