Se estima que la insuficiencia tricuspídea (IT) de moderada a torrencial afecta a 1,6 millones de personas en Estados Unidos1. El tratamiento clásico para la IT es el tratamiento médico óptimo, principalmente con diuréticos, o la cirugía. Sin embargo, la mortalidad quirúrgica en las intervenciones solo de la válvula tricúspide es significativamente mayor que en las de cualquier otra válvula operada de forma aislada (∼9%)1. Dentro de la amplia gama de alternativas terapéuticas percutáneas para la IT, el implante de prótesis valvulares en cavas (CAVI) de tipo heterotópico, como los sistemas Tricento (NVT, Alemania) y el dispositivo TricValve (Products&Features, Austria)2,3, podría ser la opción preferida cuando la dilatación de las cámaras derechas está más avanzada o hay electrodos de marcapasos previos. La evaluación de la anatomía de las venas cavas es crucial. En consecuencia, se analizaron las imágenes de tomografía computarizada (TC) de pacientes candidatos a este tratamiento, así como de modelos cadavéricos, con objeto de: a) describir las principales variantes anatómicas del corazón derecho y las venas cavas en pacientes candidatos a CAVI, y b) desarrollar una evaluación estandarizada de la TC antes de la intervención de CAVI.
Se analizaron de manera centralizada las imágenes de TC de 32 pacientes con IT de grave a torrencial que eran aptos para una intervención de CAVI, tras descartarse otros tratamientos alternativos. Las imágenes se obtuvieron con un escáner de TC de 128 detectores (Revolution CT, GE Healthcare; Estados Unidos). El protocolo se individualizó mediante la inyección de 75ml de iodixanol (Visipaque 320mg/ml) a través de una vena antecubital. Una vez opacificada por completo la arteria pulmonar, se inició manualmente la adquisición. Además, se preparó una adquisición retardada que se iniciaría a los 70-90 s de la inyección del medio de contraste (fase portal) que debía llevarse a cabo si la vena cava inferior (VCI) y las venas suprahepáticas no se opacificaban bien en el primer examen. Por último, se usaron 3 modelos cadavéricos para un análisis estructural directo. Todos los pacientes dieron su consentimiento informado y el estudio recibió la aprobación del comité de ética local.
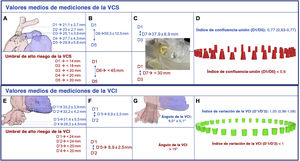
En la figura 1 se resumen las principales mediciones y los umbrales de riesgo para la vena cava superior (VCS) y la VCI. La media de la longitud craneocaudal de la VCS fue de 59,3±10,5 mm, lo cual conduciría a una media de protrusión en la aurícula derecha de 8 mm, pero de un máximo de 31,6mm con el dispositivo autoexpandible TricValve (véase la simulación en la figura 1C). Además, 7 pacientes (21,9%) mostraron una notable conificación craneocaudal (índice de confluencia-unión <0,6). Ambos factores podrían implicar mayor riesgo de fuga o de embolización valvular e indicarían la necesidad de un implante más alto del dispositivo. Sin embargo, esto podría asociarse con mayor riesgo de oclusión de la vena ácigos durante la intervención, según lo identificado en el modelo en cadáver (figura 2C,D). En la actualidad no se conoce la trascendencia clínica de esta complicación. Por último, en 11 pacientes (34,4%) había un electrodo de marcapasos.
Mediciones de la vena cava superior (A-D) e inferior (E-H) basadas en la tomografía computarizada y umbrales propuestos para el alto riesgo de complicaciones. A: confluencia entre la VII y la VCS (D1); VCS a la altura de la parte superior de la AP (D2); VCS a la altura de la parte media de la AP (D3); VCS a la altura de la parte inferior de la AP (D4); VCS a la altura de la unión con la AD (D5). B: longitud entre D1 y D5 (D6). C: longitud entre D1 y D3 (D7) y ejemplo del biomodelo impreso de una VCS corta y con marcada conificación craneocaudal. D: índice de confluencia y diferentes morfologías de VCS según este índice y D7. E: diámetro a la altura de la confluencia entre la VCI y la transición a la AD (D’1); VCI a la altura de la parte superior de las VSH (D’2); VCI a la altura de la parte inferior de las VSH (D’3); 5cm por debajo de la transición de VII-AD (D’4). F: longitud de D’1 a D’2 (D’5). G: simulación del ángulo determinado por los segmentos inferior y superior de la VCI en la posición final del dispositivo TricValve. H: índice de variación de la VCI y diferentes morfologías de la VCI según este índice. AD: aurícula derecha; AP: arteria pulmonar; VCI: vena cava inferior; VCS: vena cava superior. VII: vena innominada izquierda; VSH: venas suprahepáticas.
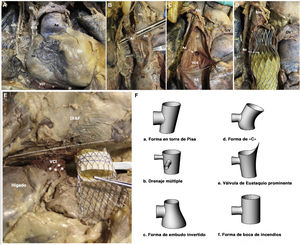
Modelo en cadáver de la VCS (A-D) y la VCI (E) y esquema de las posibles formas de la VCI (F). Fibras del plexo celiaco (asterisco). Ac: vena ácigos; AD: aurícula derecha; Ao: aorta; DIAF: diafragma; NFD: nervio frénico derecho; VCI: vena cava inferior; VCS: vena cava superior; VID: vena innominada derecha; VII: vena innominada izquierda.
La distancia media entre la VCI y la parte superior de las venas suprahepáticas fue de 8,9±2,5 mm, lo cual descartaría a 30 pacientes (93,75%) para implante de un dispositivo autoexpandible Tricento, cuyo límite es de 12mm. Sin embargo, en ninguno de estos casos fue prohibitiva esta distancia para el empleo del dispositivo TricValve. Además, el ángulo determinado por los segmentos de la VCI por encima y por debajo de las venas suprahepáticas (media, 9,5° ± 5,1°) mostró amplias variaciones (intervalo, 4,4°-18,4°) y podría influir en la zona de implante final y el riesgo de migración de la válvula y fuga residual (figura 1G). La presencia de fibras del plexo celiaco alrededor de la VCI se identificó en el modelo cadavérico (figura 2E) y podría explicar la frecuente presencia de un dolor transitorio irradiado al hombro que a menudo se detecta a las pocas horas tras el implante de una prótesis de VCI a causa de la sobreexpansión. Se identificaron varios patrones morfológicos de la VCI que se han representado esquemáticamente en la figura 1H y la figura 2. Hubo una amplia variabilidad en la longitud de la válvula de Eustaquio, que motivó un mal contraste de la VCI a pesar de la repetición de la TC en 3 pacientes (9,4%), lo cual apunta a una mayor utilidad de la ecocardiografía para determinar el tamaño de la prótesis de VCI si hay una válvula de Eustaquio larga.
Los hallazgos preliminares favorables obtenidos con dispositivos específicamente diseñados han creado grandes expectativas sobre los resultados del estudio TRICUS actualmente en curso (NCT04141137). Nuestra investigación resalta la importancia de las mediciones de TC (por encima de otras técnicas de imagen) para una planificación óptima de la intervención. Además, el éxito de las alternativas de CAVI no radica solo en el dispositivo elegido, sino también en la identificación correcta de los parámetros de interés de la anatomía y la fisiología para predecir el riesgo de complicaciones y la eficacia respectivamente.
En conclusión, según nuestro análisis de imágenes, el dispositivo TricValve podría ser preferible al Tricento en una gran parte de los casos debido a la corta distancia existente hasta las venas suprahepáticas (VSH), pero el Tricento podría ser una alternativa mejor en los pacientes con una excesiva conificación craneocaudal de la VCS o una angulación marcada de la VCI, ya que ambos factores aumentan el riesgo de fuga perivalvular o embolización de la prótesis.
FINANCIACIÓNNinguna que declarar.
CONFLICTO DE INTERESESI.J. Amat-Santos es proctor de Products & Features.